Газета «Новости медицины и фармации» Кардиология (406) 2012 (тематический номер)
Вернуться к номеру
Симпозиум 56: "Первичные системные васкулиты (часть 1): общие вопросы"
Авторы: А.И. Дядык, Н.Ф. Яровая, С.Р. Зборовский, Ю.В. Сулиман, Донецкий национальный медицинский университет им. М. Горького, кафедра внутренних болезней и общей практики — семейной медицины ФИПО
Версия для печати
Проводит: Донецкий национальный медицинский университет им. М. Горького.
Рекомендован: семейным врачам, терапевтам, ревматологам.
Определение
Первичные системные васкулиты (СВ) — это гетерогенная группа заболеваний (более 15), характеризующаяся воспалением и некрозом сосудистой стенки; при этом в патологический процесс могут вовлекаться сосуды всех калибров (от аорты до капилляров). Спектр клинических проявлений, течение и прогноз СВ определяются видом васкулита; типом, размером и локализацией вовлеченных в патологический процесс сосудов и особенностями их поражения.
Общепринято выделение первичных и вторичных васкулитов. Первичными васкулитами считаются заболевания, являющиеся самостоятельными. Васкулиты, ассоциируемые с другими заболеваниями, воздействием лекарственных препаратов или различных токсических агентов, рассматриваются как вторичные. К ним относятся васкулиты, вызываемые бактериальными и вирусными инфекционными агентами (гепатиты В и С, инфекционный эндокардит, сепсис, ВИЧ и др.); развивающиеся при системных заболеваниях соединительной ткани или злокачественных новообразованиях [3–5, 12, 19, 20].
СВ присущ ряд общих характеристик, включающих:
— неизвестную этиологию;
— сложный, неоднозначный и недостаточно изученный патогенез;
— полиорганность поражения;
— быстрое прогрессирование и неблагоприятный прогноз (без проведения адекватной терапии);
— высокую частоту обострений после достижения полной ремиссии с возможным поражением ранее интактных органов и систем;
— благоприятный эффект иммуносупрессивной терапии, включающей глюкокортикоиды и препараты цитотоксического действия (ПЦТД — цитостатики) [3–5, 12, 19, 20].
Эпидемиология
В недавних эпидемиологических исследованиях показано, что СВ не являются редкими заболеваниями, а их распространенность прогрессивно повышается. В целом их частота превышает 100 новых случаев на 1 млн населения (очевидно, истинная распространенность СВ существенно выше). СВ наблюдаются как у детей, так и у взрослых; как у женщин, так и у мужчин.
Распространенность отдельных представителей СВ существенно разнится в зависимости от национальной принадлежности, пола и возраста пациентов. Так, гигантоклеточный артериит (ГКА) обычно развивается в пожилом возрасте (старше 60 лет), чаще встречается у населения Скандинавии, чем в Африке и Японии. Артериит Такаясу (АТ), болезнь Buerger превалируют среди СВ в Японии. В Японии около 5000 больных АТ, среди которых 90 % составляют женщины. Микроскопический полиангиит (МПА) в Японии превалирует среди АНЦА-ассоциированных васкулитов (ААВ) и наблюдается чаще, чем в Европе, где выше удельный вес гранулематоза Вегенера (ГрВ), частота которого составляет в Великобритании 106 случаев на 1 млн населения. Частота узелкового полиартериита (УП) 4,6 в Великобритании, а на Аляске — 77 случаев на 1 млн.
Болезнь Кавасаки наблюдается преимущественно у детей в возрасте до 2 лет и значительно реже — после 5 лет. ААВ развиваются у лиц старше 40 лет, а пик развития ГКА приходится на возраст около 70 лет [1, 4, 19, 20].
Этиология и патогенез СВ
Этиология СВ остается неизвестной. Активно обсуждается возможная роль вирусной или бактериальной инфекции. Однако не представлено достаточно убедительных доказательств этиологической связи СВ с каким-либо вирусным или бактериальным агентом [3, 12–14].
Патогенез СВ представляется комплексным, включающим множество механизмов и остается недостаточно изученным. При различных СВ роль иммунного ответа в сосудистом поражении вариабельна.
В настоящее время в развитии СВ предполагаются следующие ведущие факторы:
— формирование патогенных иммунных комплексов (ИК) и их депозиция в сосудистую стенку и/или образование ИК in situ;
— образование аутоантител к АНЦА с активацией и адгезией нейтрофилов к эндотелиальным клеткам, индуцирующее повреждение последних;
— формирование аутоантител к антигенам стенок сосудов;
— иммунные реакции, опосредованные Т-лимфоцитами [3–5, 12–14, 20].
Наряду с перечисленными фундаментальными механизмами в возникновении, становлении и прогрессировании СВ важная роль отводится также:
— прямым воздействиям различных инфекционных агентов на сосудистую стенку;
— многообразным локальным и системным эффектам высвобождаемых воспалительных медиаторов и цитокинов;
— коагуляционным и вазоспастическим нарушениям;
— процессам взаимодействия эндотелиальных клеток и лейкоцитов с высвобождением широкого спектра переформированных и вновь синтезируемых адгезивных молекул [4, 13, 14, 20].
Многочисленные экспериментальные и клинические исследования демонстрируют, что названные выше механизмы ведут к активации эндотелиальных клеток, что может индуцировать такие осложнения, как ишемия и/или окклюзия, приводящие к нарушению перфузии и повреждению органов и тканей, вовлеченных в патологический процесс.
Удельный вес и характер комбинаций перечисленных патофизиологических процессов широко варьируют в зависимости от вида СВ, особенностей пораженных сосудистых бассейнов, активности и давности процесса.
В основе СВ, характеризующихся преимущественно иммунокомплексным генезом, лежит формирование в циркуляции с последующим депонированием в структурах стенки сосудов патологических ИК и/или локальное формирование ИК (in situ). Депонирование (и/или формирование in situ) ИК сопровождается активацией гуморальных воспалительных медиаторных систем (комплемента, коагуляционно-фибринолитической, кининовой), привлечением и активацией нейтрофилов и моноцитов с высвобождением токсических кислородных радикалов и протеолитических энзимов, что обусловливает развертывание локального и системного воспалительного процесса. Определенная роль в процессе депонирования ИК в стенке сосудов отводится нарушениям систем эритроцитарного и макрофагального транспорта и элиминации ИК из циркуляции; повышенной сосудистой проницаемости; воздействию таких цитокинов, как интерлейкин-1 (ИЛ-1), фактор некроза опухоли a (ФНО-a), интерферон-g (ИФН-g).
Преимущественно иммунокомплексный патогенетический механизм рассматривается как ведущий при таких СВ, как пурпура Шенлейн — Геноха, криоглобулинемический васкулит, узелковый периартериит.
В эксперименте было показано, что ИК индуцируют повреждение эндотелия со стороны просвета сосудов, а не из периваскулярных отделов.
Образование и циркуляция аутоантител, направленных против антигенов стенки сосудов (например, антиэндотелиальных аутоантител, аутоантител к базальным мембранам капилляров), ведет к локальному формированию ИК непосредственно в этих зонах (in situ). Сформированные in situ ИК обусловливают каскадную активацию перечисленных выше медиаторных вазоактивных и воспалительных систем, индуцирующих процессы лизиса и апоптоза клеток в структурах-мишенях, а также способствующих развитию и становлению некротизирующего воспалительного процесса.
Иммунным реакциям, опосредованным Т-лимфоцитами, отводится основная роль при СВ, характеризующемся формированием гранулематозного воспаления (например, при ГрВ). Клеточный состав гранулем при этом представлен в первую очередь Т-лимфоцитами (как CD4+, так и CD8+ клетками) и инфильтратами макрофагов. Точные механизмы возникновения Т-клеточно-опосредованного иммунного воспаления при этих видах СВ остаются недостаточно установленными; предполагается, что важную роль могут играть нарушения процессов распознавания антигенов Т-лимфоцитами (в частности, нарушения функции антиген-презентирующих клеток, дефекты антиген-презентирующих молекул класса HLA-DR) и, возможно, другие изменения.
Т-клеточные механизмы, индуцированные различными механизмами (более вероятно, инфекционными агентами), рассматриваются как ведущие при ГКА. При этом дендритические клетки, представленные в адвентиции и медии кровеносных сосудов, представляются потентными антиген-презентирующими клетками, способными активировать CD4+ Т-клетки, под влиянием которых развивается сосудистое повреждение вследствие привлечения макрофагов и моноцитов в сосудистую стенку. Эти клетки индуцируют системное воспаление посредством высвобождения таких цитокинов, как ИЛ-1 и ИЛ-6. Тканевые резидентные Т-клетки также высвобождают ИФН-g, являющийся ключевым провоспалительным цитокином, участвующим в патогенезе ГКА. Развившееся воспаление под влиянием Т-клеток, макрофагов и провоспалительных цитокинов, высвобождающихся из этих клеток, ведет к интенсивному утолщению интимы и окклюзии сосудов. Тромбоцитарный фактор роста и фактор роста сосудистого эндотелия играют ключевую роль в развитии в последующем сужения/окклюзии сосудов, что характерно для ГКА [5].
В патогенезе некротизирующих СВ, протекающих с поражением артерий малого калибра, артериол и капилляров, ведущее место отводится образованию антител к АНЦА с последующим развитием опосредованного нейтрофилами повреждения эндотелиальных клеток. Эти формы СВ обычно характеризуются отсутствием иммуноморфологических свидетельств депонирования циркулирующих ИК в структурах стенки сосудов или их локального образования in situ, а также отсутствием доказательств формирования лимфоцитарных и макрофагальных инфильтратов. На этом основании обсуждаемую группу СВ с патофизиологических позиций принято обозначать термином «скудноиммунные» (pauci-iттunе), значение которого определяется как отсутствие доказательств непосредственной повреждающей роли ИК и Т-лимфоцитов в реализации воспалительного процесса в стенке сосудов.
Понятием АНЦА объединяют аутоантитела, специфичные по отношению к протеинам, находящимся внутри цитоплазматических гранул нейтрофилов и лизосом моноцитов. В сыворотке крови больных СВ эти аутоантитела выявляются с помощью непрямой иммунофлюоресцентной микроскопии. При оценке результатов этого исследования выделяют два различных типа АНЦА: цитоплазматическое окрашивание (выявляющее Ц-АНЦА) и перинуклеарное окрашивание (характерное для П-АНЦА). Использование иммунохимических методов исследования (таких как ELISA — энзим-связанное иммуносорбентное или RIA — радиоиммунное) дает возможность определить Ц-АНЦА как специфичные по отношению к протеиназе 3 (Пр3) нейтрофилов и моноцитов, a П-АНЦА — как специфичные к миелопероксидазе (МПО).
В соответствии с одной из наиболее обоснованных гипотез развития ААВ в ходе взаимодействия АНЦА с цитоплазматическими антигенами Пр3 и МПО нейтрофилов индуцируется адгезия последних к стенке сосудов, а также их дегрануляция с высвобождением кислородных радикалов, токсических гранулярных продуктов и активацией каскадных воспалительных систем.
Таким образом, экспериментальные и клинические исследования подтверждают патогенетическую роль аутоиммунных ответов к Пр3 и МПО при ААВ. Эти ауто-Ат могут быть ответственны за развитие некротизирующего васкулита малых сосудов, а дисрегуляция Т-клеточного гомеостаза может обусловливать развитие гранулематозного воспаления [11].
Повреждающее воздействие на эндотелиальные клетки стенок сосудов инфекционных агентов может явиться важным фактором патогенеза различных СВ вследствие:
— облегчения депонирования ИК;
— усиления адгезии и локальной пролиферации лейкоцитов;
— увеличения экспрессии генов II класса главного комплекса гистосовместимости (МНС), что способствует улучшению презентации антигенов макрофагами;
— повышения высвобождения воспалительных цитокинов.
К числу инфекционных агентов с установленными прямыми и/или опосредованными повреждающими эффектами при СВ относят Streptococcus, Staphylococcus, Salmonella, Yersinia, Mycobacterium, Borrellia burgdorferi, Pseudomonas, Varicella zoster, Hepatitis А, В, С, Cytomegalovirus, Epstein-Barr virus, Parvovirus, Human Immunodeficiency virus.
Возникновение и прогрессирование воспалительного процесса в стенках сосудов сопровождается развитием комплекса коагуляционных нарушений, степень и выраженность которых при различных СВ значительно варьируют, создавая широкий спектр (от умеренных до тяжелых) нарушений, ассоциированных с развитием ишемической или окклюзирующей васкулопатии. Ведущим фактором, определяющим возникновение коагуляционных нарушений при СВ, считают активацию эндотелиальных клеток в процессе воспаления с увеличением их прокоагулянтной способности. Это проявляется увеличением экспрессии тканевого фактора, связывающего VIIa фактор свертывания; снижением экспрессии тромбомодулина; повышением синтеза и уменьшением высвобождения ингибитора тканевого активатора плазминогена типа I. Важную роль в развитии коагуляционных нарушений при некоторых СВ также играют гиперфибриногенемия, сниженная фибринолитическая активность плазмы, тромбоцитоз, увеличение сывороточных уровней, продуцируемых тромбоцитами b-тромбоглобулинов.
Воспаление стенки сосуда характеризуется активным синтезом и высвобождением в циркуляцию разнообразных вазоактивных медиаторов, оказывающих стимулирующее влияние на тромбогенез, усиливающих хемотаксис и пролиферацию лейкоцитов, способствующих активации комплемента и усилению протеолиза и в конечном итоге усугубляющих процессы тканевого повреждения. Наряду с секрецией вазоактивных медиаторов важную роль в становлении и персистенции воспалительного процесса при СВ отводят взаимодействию эндотелиальных клеток и лейкоцитов с высвобождением широкого спектра преформированных и вновь синтезируемых адгезивных молекул. Каскадные процессы взаимодействия комплексов адгезивных молекул (суперсемейств селектинов, интегринов и других), в свою очередь, дополнительно стимулируют активацию лейкоцитов и эндотелиальных клеток, способствуя развертыванию некротизирующего воспаления и окклюзии сосудов [2–4, 7, 11–14, 16, 20].
Классификационные критерии
В 1990 г. Американская коллегия ревматологов (АКР) предложила критерии для классификации семи первичных системных васкулитов, включающих ГКА, АТ, ГрВ, синдром Чарга — Стросса (СЧС), УП, пурпуру Шенлейна — Геноха и гиперчувствительный васкулит [1–3]. Эти критерии характеризуются довольно высокой чувствительностью и специфичностью для ГКА и СЧС. Однако диагностические возможности этих критериев в практической деятельности ревматологов и терапевтов оказались недостаточно валидными, но при большинстве СВ приемлемыми [1, 3, 12, 17].
Использование критериев АКР приемлемо при проведении эпидемиологических и клинических исследований, но не с диагностической целью в связи с тремя основными недостатками:
1) отсутствием среди используемых СВ МПА;
2) отсутствием АНЦА в качестве диагностических маркеров при ГВ, МПА и СЧС, а также при УП (отсутствие при последнем АНЦА);
3) некорректным использованием практическими врачами критериев АКР как золотого стандарта в диагностике СВ.
По мнению авторитетных ревматологов M. Gonzalez-Gay, C. Garcia-Porrua и многих других, эти классификационные критерии не должны рассматриваться как диагностические, но они могут быть использованы в эпидемиологических исследованиях [1, 3, 15].
В 1994 г. на согласительной конференции — Chapel Hill Consensus Conference (CHCC), посвященной номенклатуре СВ, были приняты определения различных васкулитов [3]. CHCC также предложила определение МПА, характеризующегося преимущественным поражением мелких сосудов (капилляров, венул или артериол). Напротив, классическому УП присуще вовлечение в патологический процесс артерий среднего или малого калибра без развития ГН или васкулитов, включающих капилляры, артериолы или венулы.
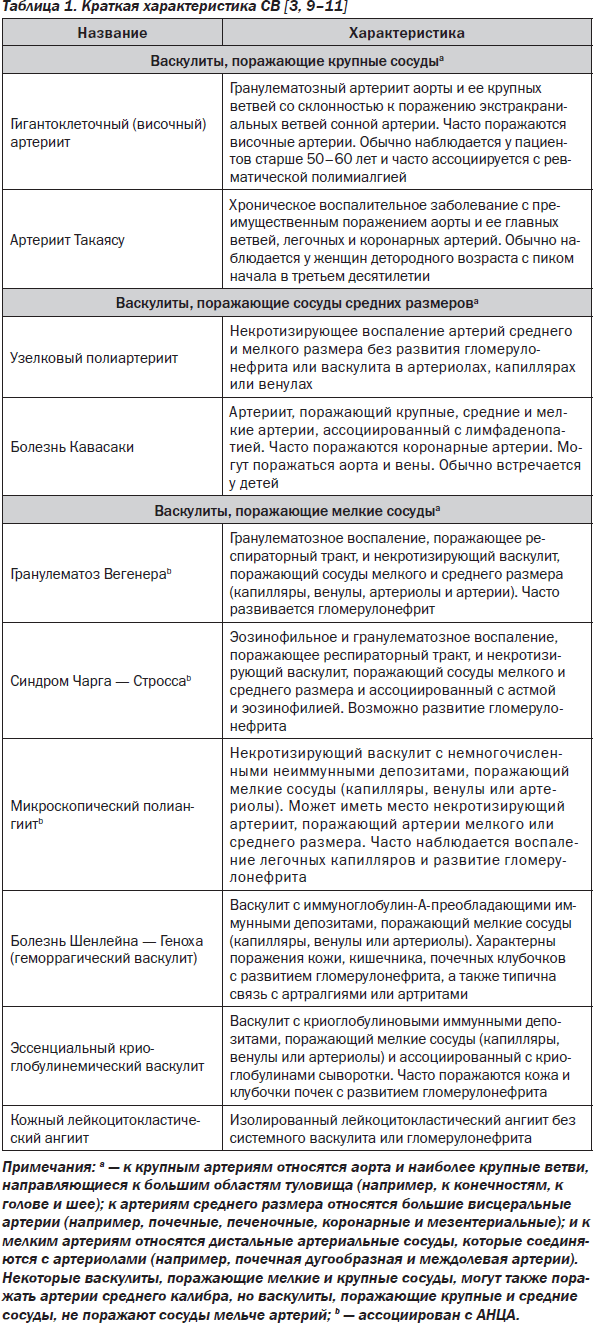
Первичные СВ согласно рекомендациям CHCC классифицируются в три подгруппы в соответствии с размером сосудов, вовлеченных в патологический процесс:
a) васкулиты с преимущественным поражением сосудов крупного калибра;
b) васкулиты с преимущественным поражением сосудов среднего или мелкого калибра;
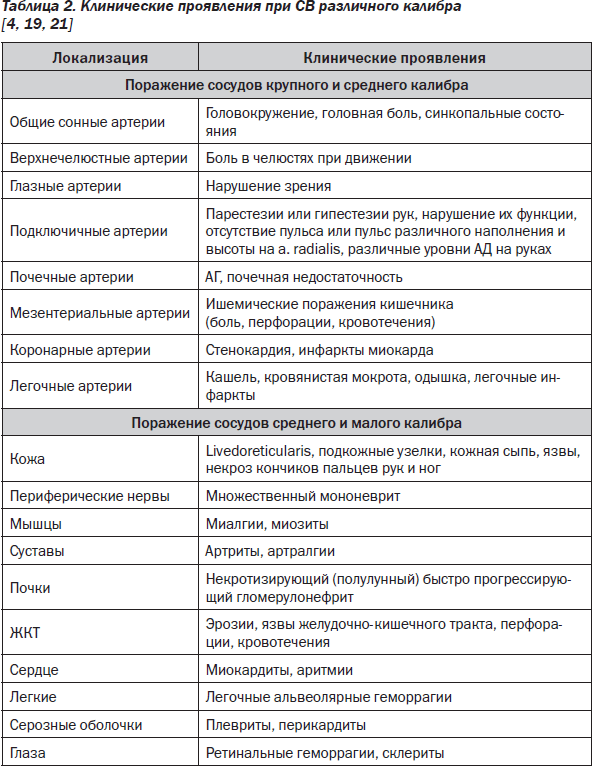
c) васкулиты, характеризующиеся преимущественным поражением сосудов мелкого калибра (табл. 1, рис. 1) [3].
В табл. 1 представлены классификация, названия и краткие характеристики васкулитов, принятые на CHCС, посвященной номенклатуре СВ.
В связи с отсутствием валидных диагностических критериев для СВ классификационные критерии АКР и определения (номенклатура) СНСС часто в практической деятельности используются в диагностических целях в качестве альтернативы [1, 15].
Таким образом, сегодня мы можем констатировать противоречивость взглядов на место критериев АКР и определений СНСС, а также отсутствие золотых стандартов в диагностике СВ. В связи с этим эксперты EULAR считают необходимым создание новых критериев диагностики СВ, характеризующихся высокой специфичностью и чувствительностью, способных с высокой достоверностью диагностировать СВ [1].
Как показано на рис. 1, при ГКА и АТ в патологический процесс (что наблюдается редко) могут вовлекаться почечные артерии, обусловливая нарушение их перфузии. При УП и болезни Кавасаки (васкулиты, поражающие сосуды среднего калибра) имеет место воспаление артерий без поражения артериол и гломерулярных капилляров. При УП почки поражаются чаще, чем при болезни Кавасаки. Васкулиты сосудов мелкого калибра (МПА, ГрВ, СЧС, болезнь Шенлейна — Геноха, эссенциальный криоглобулинемический васкулит), в отличие от васкулитов сосудов крупного и среднего калибра, характеризуются частым поражением гломерулярных капилляров с развитием ГН [8, 9, 18].
Клинико-лабораторная характеристика СВ
СВ присущи симптомы и клинические проявления, обусловленные «воспалением» кровеносных сосудов, приводящим к ишемии и геморрагическим поражениям различных органов и систем.
Системные проявления:
— часто высокая лихорадка (38– 39 °С);
— потеря массы тела;
— слабость и недомогание;
— полиорганность поражения;
— миалгии;
— артриты, артралгии.
Симптомы и клинические проявления обусловлены одновременным или последовательным поражением различных органов и систем в результате их ишемизации и геморрагических поражений в связи с сосудистыми поражениями. Причем клинические проявления определяются размером вовлеченных в патологический процесс сосудов и тяжестью их поражений, что представлено в табл. 2.
A. При поражении сосудов крупного и среднего размера:
— дефицит пульса;
— боль в челюстях при движениях, уменьшающаяся в покое;
— периферические артриты, артралгии;
— нарушение зрения;
— абдоминальные боли или катастрофы (перфорации, кровотечения);
— поражения почечных артерий крупного и среднего размера, ведущие к развитию тяжелой артериальной гипертензии (АГ), обусловливающие развитие почечной недостаточности.
B. При поражении сосудов малого размера:
— кожная сыпь (чаще на конечностях);
— множественный мононеврит, развивающийся при поражении сосудов малого и среднего калибра, кровоснабжающих различные отделы нервной системы, что проявляется гиперестезиями, прогрессирование которых ведет к различным нарушениям, результатом чего может быть нарушение функции конечностей (сенсорная и моторная недостаточность);
— развитие гломерулонефрита, часто характеризующегося быстрым прогрессированием и серьезным прогнозом.
Дифференциальная диагностика
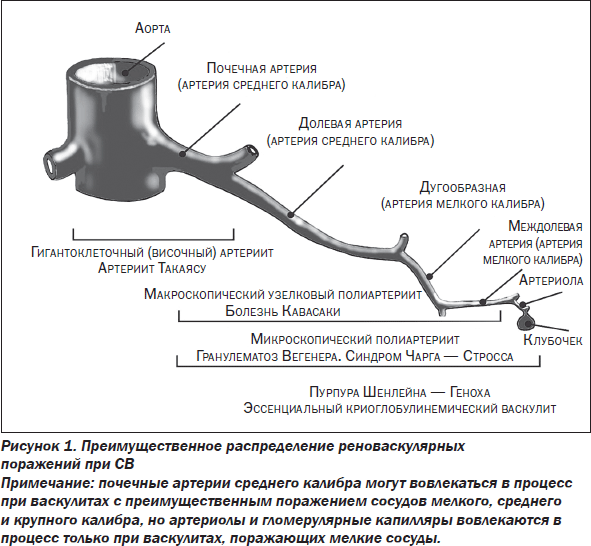
Дифференциальная диагностика СВ включает инфекции, опухоли, СЗСТ. Ее алгоритм показан на рис. 2.
Ангиография показательна при поражении сосудов крупного и среднего калибра. В дифференциальной диагностике васкулитов сосудов среднего и малого калибров важная роль отводится изучению наличия или отсутствия различных ИК. Диагностически важным является наличие IgA или криоглобулинов.
ИК отсутствуют у больных с АНЦА-ассоциированными васкулитами. Такие пациенты должны быть обследованы на наличие МПО-АНЦА и Пр3-АНЦА. У больных с васкулитами (за исключением АТ) важную диагностическую роль играет прижизненное морфологическое исследование сосудов.