Газета «Новости медицины и фармации» Неврология (405) 2012 (тематический номер)
Вернуться к номеру
Нарушение ауторегуляции мозгового кровотока как фактор развития мозговых дисциркуляций при сахарном диабете 2-го типа
Авторы: Е.Л. Товажнянская, О.И. Дубинская, И.О. Безуглая, М.Б. Наврузов Кафедра неврологии Харьковского национального медицинского университета Научно-практический медицинский центр ХНМУ
Версия для печати
Сосудистые заболевания головного мозга остаются одной их острейших и глобальных медико-социальных проблем, наносящих огромный экономический ущерб обществу. В Украине львиная доля (95 %) цереброваскулярных заболеваний (ЦВЗ) принадлежит хроническим нарушениям мозгового кровообращения, рост частоты встречаемости которых в основном и предопределяет увеличение распространенности ЦВЗ в нашей стране. Тенденция к постарению населения планеты и увеличение в популяции основных факторов риска развития сосудистых заболеваний головного мозга (артериальная гипертензия (АГ), болезни сердца, сахарный диабет (СД), гиперхолестеринемия, гиподинамия, курение и другие) обусловливают дальнейший рост ЦВЗ на ближайшие десятилетия [1–5].
Известно, что важнейшим независимым фактором риска развития всех форм ЦВЗ является сахарный диабет — одно из самых распространенных заболеваний среди людей среднего и пожилого возраста. СД поражает в среднем от 1,2 до 13,3 % населения планеты и является причиной около 4 млн смертей ежегодно во всем мире. Наиболее часто в структуре СД (90–95 %) встречается сахарный диабет 2-го типа. По оценкам Всемирной организации здравоохранения, число лиц, страдающих сахарным диабетом, в мире составляет более 190 млн, а к 2025 году эта цифра возрастет до 330 млн. В Украине на сегодняшний день зарегистрировано более 1 млн пациентов, страдающих сахарным диабетом. Однако данные эпидемиологических исследований показали, что истинное число больных в 2–2,5 раза выше [2–5].
На основании проведенных широкомасштабных исследований было установлено, что СД повышает риск развития мозгового инсульта в 2–6 раз, транзиторных ишемических атак — в 3 раза по сравнению с таковым риском в общей популяции. Кроме того, СД отводится важная роль в формировании хронической прогрессирующей недостаточности мозгового кровообращения — диабетической энцефалопатии (ДЭ) и сосудистой деменции. Риск развития сердечно-сосудистых катастроф значительно увеличивается при сочетании СД с другими факторами риска (АГ, дислипидемия, ожирение), что нередко наблюдается у данной когорты пациентов [3, 5–8].
Патогенетическую основу развития ЦВЗ у больных с диабетом обусловливает генерализованное поражение при СД мелких сосудов (микроангио-патия), сосудов среднего и крупного калибра (макроангиопатия). В результате развивается так называемая диабетическая ангиопатия, наличие и выраженность которой определяют течение и прогноз заболевания. Установлено, что изменения в мелких сосудах (артериолах, капиллярах, венулах) носят специфический для СД характер, а в крупных — расцениваются как ранний и распространенный атеросклероз [2–4, 9, 10].
Патогенез микроангиопатии (в том числе vasa nervorum) при диабете связан с образованием аутоантител к гликозилированным белкам сосудистых стенок, накоплением в сосудистой стенке липопротеидов низкой плотности, активизацией процессов перекисного окисления липидов и увеличением образования свободных радикалов, подавлением синтеза простациклина и дефицитом оксида азота, обладающих антиагрегантным и сосудорасширяющим действием.
Развитие дислипидемии на фоне повышения проницаемости сосудистой стенки за счет ее структурных нарушений, связанных с гликозилированием белковых молекул, усилением процессов пероксидации, дефицитом NO и др., приводит к формированию атеросклеротических бляшек, поражающих магистральные сосуды (макроангиопатия). При этом диабетическая макроангиопатия не имеет специфических отличий от атеросклеротических изменений сосудов у людей без СД. Однако установлено, что атеросклероз при СД развивается на 10–15 лет раньше, чем у лиц без него, и затрагивает большинство артерий, что объясняется метаболическими нарушениями, предрасполагающими к сосудистым поражениям [4, 5, 9, 10]. Кроме того, более широкой распространенности атеросклеротического процесса при СД способствует и развитие микроангиопатий.
В свою очередь, прогрессирование микро- и макроангиопатий приводит к снижению эндоневрального кровотока и тканевой гипоксии. Развивающаяся при этом дисгемическая гипоксия переключает энергетический метаболизм нервной ткани на малоэффективный анаэробный гликолиз. В результате в нейронах снижается концентрация фосфокреатина, возрастает содержание лактата (продукт анаэробного окисления глюкозы), развиваются энергетический дефицит и лактоацидоз, что приводит к структурно-функциональным нарушениям в нейронах, клиническим результатом чего является развитие диабетической энцефалопатии. Диабетическая энцефалопатия — стойкая церебральная патология, возникающая под воздействием хронической гипергликемии, метаболических и сосудистых нарушений, клинически проявляется неврологическими синдромами и психопатологическими расстройствами. Установлено, что важную роль в развитии хронических нарушений мозгового кровообращения при СД играют также эндотелиальная дисфункция, нарушение ауторегуляции мозгового кровотока, повышение вязкости и агрегационных свойств крови [5, 6, 10, 11].
Известно, что адекватное функционирование процессов ауторегуляции мозгового кровотока способно компенсировать гемодинамический дефицит, обусловленный различными причинами, за счет сочетанной работы анатомических и функциональных источников компенсации. По мнению ряда авторов, низкие показатели цереброваскулярной реактивности ассоциируются с повышенным риском развития острых и хронических нарушений мозгового кровообращения [12–15]. Ауторегуляция церебрального кровообращения обеспечивается комплексом миогенных, метаболических и нейрогенных механизмов. Миогенный механизм связан с реакцией мышечного слоя сосудов на уровень внутрисосудистого давления — так называемый эффект Остроумова — Бейлиса. При этом церебральный кровоток поддерживается на постоянном уровне при условии колебания среднего артериального давления (АД) в диапазоне от 60–70 до 170–180 мм рт.ст. за счет способности сосудов реагировать: на повышение системного АД — спазмом, на снижение — дилатацией. При снижении АД менее 60 мм рт.ст. или подъеме выше 180 мм рт.ст. появляется зависимость «АД — мозговой кровоток», за которой следует «срыв» ауторегуляции церебрального кровообращения. Метаболический механизм ауторегуляции опосредован тесной связью кровоснабжения головного мозга с его метаболизмом и функцией. Метаболическими факторами, обусловливающими интенсивность кровоснабжения мозга, являются уровни РаСО2, РаО2 и продуктов метаболизма в артериальной крови и ткани мозга. Снижение нейронального метаболизма приводит к снижению уровня мозгового кровотока. Таким образом, ауторегуляция мозгового кровотока — легкоуязвимый процесс, который может нарушаться при резком повышении или снижении АД, гипоксии, гиперкапнии, прямом токсическом действии экзо- и эндотоксинов на мозговую ткань, в том числе хронической гипергликемии и каскада патологических процессов, которые она инициирует. В этом случае срыв ауторегуляции является составной частью патологического процесса при СД, на основе которого формируются хронические нарушения церебральной гемодинамики и диабетическая энцефалопатия. А оценка состояния цереброваскулярного резерва имеет важное прогностически-диагностическое значение для форм ЦВЗ диабетического генеза [12–15].
Целью настоящего исследования явилось определение роли нарушения вазомоторной реактивности сосудов мозга в формировании диабетической энцефалопатии и разработка путей ее коррекции.
Материалы и методы
Было обследовано 67 больных с СД 2-го типа в стадии субкомпенсации и диабетической энцефалопатией в возрасте от 48 до 61 года и длительностью диабета от 4 до 11 лет, находившихся на лечении в неврологическом отделении Научно-практического медицинского центра ХНМУ. У 24 (35,8 %) больных была установлена легкая степень СД, у 32 (47,8 %) — средняя степень тяжести, у 11 (16,4 %) пациентов — тяжелая форма СД. 45,6 % обследованных пациентов в качестве гипогликемической терапии получали инсулинотерапию, 54,4 % больных — таблетированные сахароснижающие препараты.
Состояние церебральной гемодинамики и сосудистой реактивности артерий мозга изучалось по стандарт-ным методикам с использованием датчиков частотой 2, 4, 8 МГц на аппарате «Спектромед-300» (Россия). Алгоритм исследования состояния церебральной гемодинамики и вазомоторной реактивности включал:
— исследование магистральных артерий головы и интракраниальных артерий методами экстра- и интракраниальной допплерографии с определением скоростных характеристик кровотока, индексов пульсации и циркуляторного сопротивления;
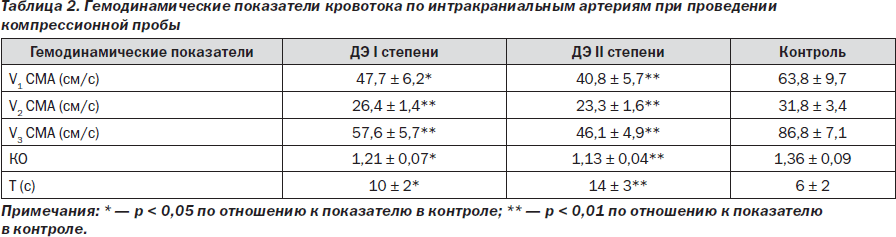
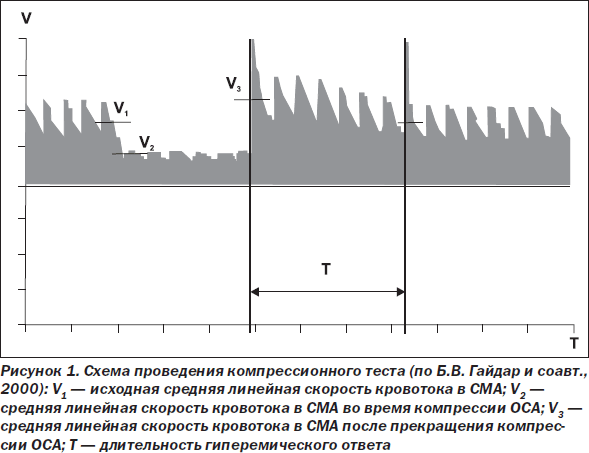
— исследование вазомоторной реактивности по результатам компрессионного теста. Известно, что кратковременная пальцевая компрессия общей сонной артерии (ОСА) на шее приводит к снижению перфузионного давления и развитию преходящего гиперемического ответа после прекращения компрессии, что позволяет рассчитать ряд показателей, характеризующих резервы ауторегуляции. Пациентам (с отсутствием стенозирующего поражения сонных артерий) проводили 5–6-секундную компрессию ОСА с прекращением компрессии в фазу диастолы. Регистрировали среднюю линейную скорость кровотока (ЛСК) в средней мозговой артерии (СМА) до компрессии ипсилатеральной ОСА — V1, во время компрессии — V2, после прекращения компрессии — V3, а также время восстановления исходной ЛСК — T (рис. 1). С помощью полученных данных рассчитывали коэффициент овершута (КО) по формуле: КО = V3/V1 [15].
Полученные данные были статистически обработаны с использованием пакета прикладных статистических программ Statistica 6.0. Рассчитывались средние значения показателей и ошибки средних. В качестве критерия значимости различия выборок использовались параметрические и непараметрические критерии Стьюдента и Уилкоксона. Различия принимались достоверными при р < 0,05.
Результаты исследования и их обсуждение
В ходе клинико-неврологического обследования больных с СД 2-го типа диабетическая энцефалопатия I степени была диагностирована у 29 пациентов (43,3 %), диабетическая энцефалопатия II степени — у 38 больных (56,7 %). Ведущими неврологическими синдромами у обследованных были: цефалгический синдром (96,5 % случаев); статико-координаторные нарушения (86,1 %); психоэмоциональные расстройства от эмоциональной лабильности до депрессивных синдромов (89,5 %); когнитивная дисфункция (89,5 %); внутричерепная гипертензия (84,2 %), пирамидная недостаточность по центральному типу (49,1 %), полиневропатический синдром (96,5 %), нарушение сна (66,7 %) и др. Цефалгический синдром в большинстве случаев (в 87,7 %) имел сосудистый генез (головные боли носили давящий характер, височную или лобно-височную локализацию, усиливались при смене метеоусловий и психоэмоциональном перенапряжении) или смешанный генез в комбинации с внутричерепной гипертензией (цефалгии распирающего характера с чувством давления изнутри на глазные яблоки и симптомами гиперестезии). Частым неврологическим синдромом при диабетической энцефалопатии были когнитивные нарушения легкой (27–26 баллов по шкале MMSE) и умеренной степени выраженности (25–24 балла по шкале MMSE). Следует отметить, что частота и выраженность объективной симптоматики у обследованных нарастали по мере прогрессирования тяжести диабетической энцефалопатии. Соматическое обследование больных с СД выявило сопутствующую артериальную гипертензию, преимущественно 2-й степени (86 % случаев), длительность которой составляла в среднем 12,3 ± 3,5 года; гиперхолестеринемию (82,5 %); избыточный вес (40,4 %).
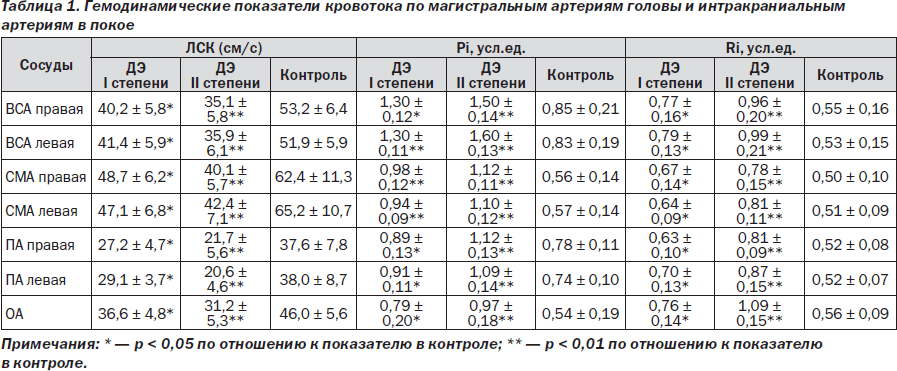
Нарушение церебральной гемодинамики у больных с СД 2-го типа по данным допплерографического исследования характеризовалось снижением скорости кровотока в ВСА на 24,5 и 33,9 %, в СМА — на 25,4 и 34,5 %, в ПА — на 24,3 и 44,7 %, в ОА — на 21,7 и 32,6 % (при ДЭ I и II степени соответственно) по отношению к показателям в контрольной группе. Также были выявлены признаки повышения сосудистого тонуса во всех исследованных сосудах по данным повышения индекса пульсации (Pi) и циркуляторного сопротивления (Ri) в среднем в 1,5 и 1,3 раза при ДЭ I степени и в 1,8 и 1,75 раза — при ДЭ II степени. Гемодинамических значимых стенозов магистральных артерий головы у обследованных больных не было выявлено ни в одном случае (их наличие было критерием исключения из исследования в силу опасности проведения компрессионных проб).
Снижение возможностей коллатерального кровотока (анатомического звена церебрального сосудистого резерва) у обследованных пациентов с диабетической энцефалопатией I и II степени подтверждалось депрессией относительно контрольных показателей остаточной скорости кровотока в СМА (V2) в момент компрессии ипсилатеральной ОСА на 19,3 и 28,1 % соответственно. Это отражало нарушение проходимости перфорирующих и соединительных артерий, возможно, в результате их вторичной облитерации как проявление атеросклеротической и диабетической ангиопатии. Снижение коэффициента овершута у больных с диабетической энцефалопатией I и II степени относительно контроля на 11,6 и 16,9 % соответственно свидетельствовало о напряжении функционального звена цереброваскулярной реактивности, в частности, ее миогенного компонента вследствие нарушения при СД структуры сосудистой стенки и ее тонуса. Выявленное увеличение в 1,7 и 2,3 раза времени восстановления скорости кровотока до исходной отражало нарушение метаболического контура сосудистой реактивности как проявление общих дисметаболических процессов, развивающихся в организме при СД, — нарушения полиолового пути окисления глюкозы, избыточного накопления сорбитола и про- оксидантов, развития гиперлипидемии, дефицита депрессорных факторов, необратимого гликозилирования белков, в том числе белков стенок сосудов [4, 6, 8, 11].
Следует отметить, что выявленное ухудшение гемодинамических показателей и показателей цереброваскулярной реактивности у больных с СД 2-го типа находилось в прямо пропорциональной зависимости от степени тяжести диабетической энцефалопатии, что свидетельствовало о патогенетической роли нарушения ауторегуляции мозгового кровотока в развитии мозговых дисциркуляций и формировании энцефалопатического синдрома при СД 2-го типа.
Таким образом, нарушение церебральной гемодинамики и снижение реактивности сосудов головного мозга у пациентов с СД 2-го типа являются патогенетической основой формирования диабетической энцефалопатии. Учитывая тесную связь гемодинамических и обменных нарушений при СД, а также их комплексную роль в патогенезе развития цереброваскулярных и неврологических осложнений сахарного диабета, в схемы терапии диабетической энцефалопатии необходимо включать препараты комплексного действия, способные улучшить состояние цереброваскулярной реактивности, уменьшить явления вазоспазма в церебральных сосудах и нормализовать метаболические процессы в организме, что позволит улучшить состояние пациентов с СД и качество их жизни.