Газета «Новости медицины и фармации» Неврология (405) 2012 (тематический номер)
Вернуться к номеру
Оптимизация нейрометаболических процессов при ишемии головного мозга
Авторы: С.Г. Бурчинский, к.м.н. ГУ «Институт геронтологии НАМН Украины», г. Киев
Версия для печати
 Острые и хронические нарушения мозгового кровообращения (ОНМК, ХНМК) занимают одно из ведущих мест в структуре заболеваемости, утрате трудоспособности и ментальных функций, смертности населения нашей страны.
Острые и хронические нарушения мозгового кровообращения (ОНМК, ХНМК) занимают одно из ведущих мест в структуре заболеваемости, утрате трудоспособности и ментальных функций, смертности населения нашей страны.
Ключевым патогенетическим фактором развития цереброваскулярной патологии (инсульт, дисциркуляторная энцефалопатия, сосудистая деменция и др.) является ишемия головного мозга.
Ишемия головного мозга в результате нарушений мозгового кровообращения — пусковой фактор развития комплекса патобиохимических реакций, связанных с гипоксией, ведет к фатальным процессам дегенерации и гибели нейронов. Поэтому фармакотерапевтическое воздействие при любой форме ишемического поражения мозга (как острой, так и хронической) должно быть максимально комплексным и направленным:
— на восстановление нормального кровотока в пораженном участке;
— устранение (или ослабление) ишемического каскада (комплекс нейрометаболических, нейромедиаторных, нейротрофических и других реакций, которые приводят к дегенеративно-деструктивным изменениям в нейронах и формированию неврологического дефицита) [1]. Как известно, основным биоэнергетическим субстратом в организме (в том числе в ЦНС) являются молекулы аденозинтрифосфорной кислоты (АТФ). Фундаментом биосинтеза АТФ служат реакции гликолиза. Процессы выработки энергии в тканях мозга зависят от катализируемых ферментами окислительных реакций, для которых абсолютно необходимым компонентом служит молекулярный кислород. Эти процессы происходят в митохондриях, играющих важнейшую роль в процессах тканевого дыхания и уязвимых даже при небольшой степени гипоксии в результате ишемии головного мозга. Это в первую очередь касается митохондриальных мембран.
Исключительно велика роль митохондрий в обеспечении тканевого дыхания и в образовании АТФ, в деятельности систем переноса электронов в дыхательной цепи. Выделение основного количества энергии в результате реализуется с помощью ведущего метаболического пути организма — цикла лимонной кислоты, или цикла Кребса.
Процессы транспорта кислорода в нейронах могут быть полноценными только в условиях сохранения ионного гомеостаза, т.е. нормального соотношения ионов К+, Nа+ и Са2+ вне и внутри клеток.
Что же происходит с рассмотренной системой в условиях ишемии?
Уже на ее начальных стадиях отмечаются выраженные сдвиги ионного гомеостаза — нарушения деятельности энергозависимого натриевого насоса и накопление внутриклеточного натрия и внеклеточного калия. Данный фактор в последующем может провоцировать отек и набухание астроглии, что усугубляет ишемическое повреждение мозга. Следующим важным звеном в развитии ишемических нарушений является повышение концентрации кальция внутри нейронов, вызванное высвобождением кальция из митохондрий в условиях высокой концентрации натрия и свободных жирных кислот и из эндоплазматического ретикулума при недостатке АТФ. Повышение концентрации внутриклеточного кальция способствует активации мембранных фосфолипаз, что приводит к разрушению фосфолипидных структур мембран и высвобождению свободных жирных кислот. Одна из них — арахидоновая кислота может метаболизироваться в простагландины, лейкотриены и тромбоксаны, обладающие разрушительным действием на ишемизированные ткани. Накопление простагландинов и тромбоксанов способствует также агрегации тромбоцитов и усугублению нарушений микроциркуляции. Разрушение мембран вызывает изменение деятельности рибосом и нарушения синтеза белка, значительно снижающие адаптационно-компенсаторные возможности нейронов, и усугубляет нейрометаболические нарушения. Еще одним важным последствием ишемии и связанным с ней ослаблением гликолиза является развитие лактат-ацидоза вследствие анаэробного метаболизма глюкозы в условиях недостатка кислорода. Развитие оксидативного стресса приводит к нарастанию перекис- ного окисления липидов, образованию свободных радикалов и дальнейшему нейротоксическому эффекту, прежде всего в отношении митохондриальных ферментов дыхательной цепи, вызывая необратимые дегенеративные изменения внутри нейронов. Наконец, деполяризация клеточных мембран приводит к высвобождению возбуждающих нейромедиаторов — глутамата и аспартата, что оказывает дополнительный нейротоксический эффект (феномен эксайтотоксичности). Глутамат активирует NMDA-рецепторы, что способствует дальнейшему входу ионов кальция в нейроны и выходу из них ионов калия, что вновь запускает описанный выше патобиохимический каскад [3, 11].
В зависимости от той или иной клинической формы (ОНМК или ХНМК) отмеченные нейрометаболические изменения развиваются либо в течение нескольких часов (при остром ишемическом инсульте), либо на протяжении месяцев и даже лет (при дисциркуляторной энцефалопатии), отдельные компоненты данного каскада могут быть более или менее выраженными, но в конечном итоге результатом ишемии является дегенерация и гибель нейронов.
Таким образом, необходимость комплексной патогенетической коррекции действия фактора ишемии на ЦНС не вызывает сомнения. С этой целью используются самые различные лекарственные препараты (антиагреганты, тромболитики, нейропротекторы, ноотропы, вазотропы, ангиопротекторы, нейротрофические факторы и др.) [2, 3, 8]. Важнейшая задача указанной терапии — максимально возможное ограничение полипрагмазии, т.е. желательно использование лекарственных средств с комплексным, многосторонним нейрометаболическим механизмом действия, способных эффективно влиять на разные звенья ишемического каскада. Такое средство должно обладать следующими эффектами:
— стимуляция транспорта кислорода как из крови в нейроны, так и на внутринейрональном уровне;
— активация дыхательной цепи митохондрий;
— стимуляция накопления АТФ в нейронах;
— активация транспорта и утилизации глюкозы;
— антиоксидантное действие.
Однако сегодня в клинической неврологии сформировалась ситуация, когда у практического врача есть достаточно широкий выбор разнообразных препаратов преимущественно нейромедиаторного и вазотропного типа действия, позволяющих успешно решать задачи коррекции нейромедиаторного дисбаланса и/или стабилизации мозгового кровотока. Однако при этом третий важнейший компонент фармакотерапевтической стратегии при лечении заболеваний ЦНС и, в частности, цереброваскулярной патологии — нейрометаболический — остается наиболее проблемным звеном клинической практики в силу следующих причин:
1) весьма ограниченный выбор лекарственных средств, обладающих комплексным политопным воздействием на метаболические процессы в нейронах, прежде всего в условиях гипоксии;
2) недостаточно серьезное в ряде случаев отношение практических врачей к необходимости проведения направленной нейрометаболической фармакотерапии, оценка данного направления лечебной стратегии как вспомогательного, фонового, вторичного и т.д.;
3) отсутствие в современной классификации нейротропных средств отдельной группы препаратов с преимущественно нейрометаболическим эффектом, что приводит к «размыванию» немногочисленных лекарственных средств такого рода по другим группам и среди ноотропных средств. Несмотря на наличие нейрометаболического компонента в действии ноотропов, эти препараты отнюдь не тождественны понятию «нейрометаболические средства». В связи с этим заслуживает особого внимания появление в Украине нового отечественного препарата Вазопро® (мелдония метонат), перспективного с точки зрения комплексной коррекции нейрометаболических процессов в ЦНС в условиях ишемии.
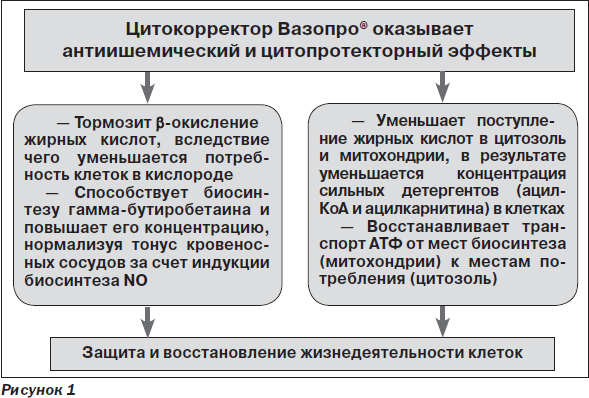
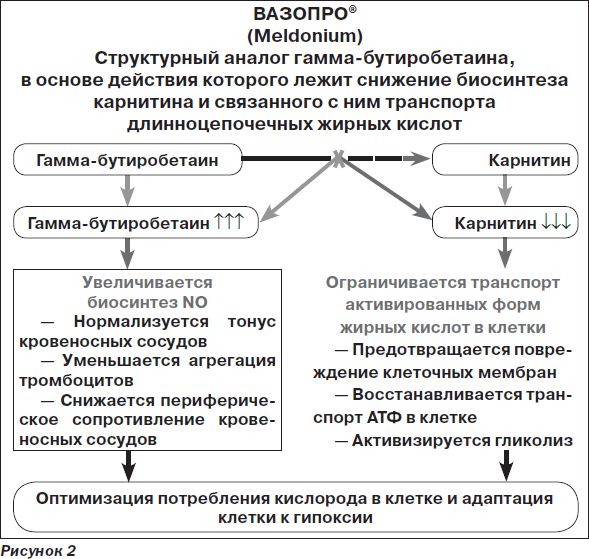
Вазопро® — препарат с уникальным механизмом действия, не присущим другим представителям ноотропов и вазотропов. Именно поэтому представляется целесообразным анализ его возможностей в клинической практике.
Вазопро® — структурный аналог гамма-бутиробетаина, является средством с уникальным комплексным механизмом действия на нейрометаболические процессы в нейронах, в первую очередь нарушающиеся в рамках ишемического каскада:
а) окисление жирных кислот;
б) биосинтез карнитина;
в) активность свободнорадикальных процессов;
г) регуляция сосудистого тонуса.
Гамма-бутиробетаин представляет собой физиологически активное вещество — предшественник карнитина в цепи метаболизма жирных кислот [4, 15]. Уже на основании этого можно сделать вывод, что Вазопро® не является препаратом-ксенобиотиком, т.е. чужеродным для организма химическим соединением, подобно большинству известных нейропротекторов, а его эффекты определяются физиологическими потребностями нейронов в условиях ишемии и гипоксии.
Как известно, при ишемии и гипоксии одним из ведущих компонентов повреждающего воздействия на клетку считается повышение транспорта жирных кислот через нейрональную мембрану, увеличение содержания свободного карнитина и активация карнитинзависимого окисления жирных кислот [7, 12, 16]. Результатом этого является активация свободнорадикального окисления, приводящего к повреждению клеточных мембран, прежде всего митохондриальных, их деструкции и дегенерации. Поэтому важная цель фармакологического воздействия — ограничение процессов окисления жирных кислот и перевод энергообеспечения клеток на окисление глюкозы, так как данный процесс требует меньшего количества кислорода и может рассматриваться как максимально физиологический в состоянии гипоксии [18].
Под влиянием Вазопро® происходит блокада биосинтеза карнитина, осуществляемого с помощью транспорта длинноцепочечных жирных кислот через мембраны митохондрий. При этом данный препарат не влияет на транспорт короткоцепочечных жирных кислот, необходимых для поддержания физиологического уровня тканевого дыхания [5, 12].
В результате реализации описанных эффектов происходит переключение энергетического метаболизма клеток на гликолитический путь, намного более экономный и эффективный в условиях гипоксии, что способствует существенному повышению адаптационно-компенсаторного потенциала нейронов и ЦНС в целом при ишемическом повреждении мозга. В конечном итоге именно данный механизм, направленный на активацию процессов гликолиза, является с физиологической точки зрения ведущим компонентом цитопротекторного действия Вазопро®.
В упомянутом действии Вазопро® можно выделить два принципиально важных компонента:
— блокада накопления карнитина в нейронах;
— активация ферментов — пируватдегидрогеназы, стимулирующей гликолиз, и гексокиназы, что позволяет обеспечить вовлечение наряду с глюкозой других гексоз в цикл Кребса как важный источник энергетического обеспечения клеток в условиях ишемии.
Так как именно гексокиназа в значительной степени определяет скорость процесса гликолиза, то активация и экспрессия данного фермента обеспечивают интенсификацию утилизации глюкозы для синтеза АТФ [5]. С другой стороны, наиболее полно гексокиназный механизм действия Вазопро® проявляется в условиях сниженного содержания карнитина в нейронах, т.е. оба описанных компонента его действия тесно взаимосвязаны и взаимодополняют друг друга. Результатом упомянутого действия служит уменьшение концентрации лактата в тканях (т.е. явлений лактат-ацидоза — одного из ведущих проявлений ишемического каскада) и соотношения ацетил-КоА/КоА, а также повышение концентрации АТФ.
Таким образом, с помощью Вазопро® возможно осуществление комплексной нейропротекции — оптимизации энергообеспечения нейронов в сочетании с фармакологической защитой митохондрий. Последнее является уникальным свойством, которое не присуще многим другим метаболическим препаратам.
Кроме того, важнейшей стороной действия Вазопро®, выгодно дополняющей и расширяющей его нейрометаболические эффекты, является его антиоксидантное действие.
В условиях нарушений энергообразующих реакций при ишемии и гипоксии и при неполном восстановлении кислорода происходит образование высокореактивных и потому токсичных свободных радикалов или продуктов, которые их генерируют. Патологическое воздействие свободных радикалов связано с их влиянием на структурно-функциональные характеристики биологических мембран, что приводит к нарушениям их естественной транспортно-защитной функции, повышению микровязкости, изменению проницаемости для различных ионов и, в результате, к изменениям в жизнедеятельности нейронов, а в дальнейшем — их деструкции и гибели [14].
Повышенная продукция свободных радикалов является одной из существенных причин длительного спазма церебральных сосудов, прогрессирования постишемического отека и дегенерации нейронов вследствие нарушения целостности мембран при различных формах нарушений мозгового кровообращения. Именно поэтому антиоксидантная фармакотерапия является одним из важных направлений развития стратегии нейропротекции, а разработка препаратов с направленным антиоксидантным действием входит в число ведущих направлений экспериментальной и клинической нейрофармакологии.
Следует сразу подчеркнуть, что спектр антиоксидантных эффектов Вазопро® существенно отличается от действия других подобных средств своей широтой и физиологичностью и включает:
1) активацию естественной антиоксидантной системы организма (ферменты супероксиддисмутаза, каталаза);
2) ингибирование свободнорадикального окисления липидов за счет снижения карнитинзависимого окисления жирных кислот;
3) стимулирование образования оксида азота — NO через повышение концентрации гамма-бутиробетаина и NO-зависимого связывания свободных радикалов [7, 12].
Вазопро® действует и как блокатор, и как «ловушка» свободных радикалов, что обеспечивает максимальную полноту реализации его антиоксидантного действия.
Наконец, благодаря своему активирующему воздействию на ацетилхолиновые рецепторы Вазопро® стимулирует индукцию биосинтеза NO, являющегося ацетилхолинзависимым процессом. Известно, что NO, помимо уже упоминавшихся антиоксидантных свойств, обладает мощным вазодилатирующим действием, способствуя ослаблению проявлений сосудистого спазма, в том числе и в сосудах головного мозга, и уменьшению ишемии, периваскулярного отека и т.д. [13, 17]. В результате Вазопро® оказывает селективное воздействие именно на ишемизированную зону мозга, практически не влияя на интакт-ные участки, что является важнейшей характеристикой препарата с точки зрения препятствования развитию феномена обкрадывания [7].
Вазопро® кроме комплексного действия обладает и другими ценными характеристиками:
— уменьшает периферическое сосудистое сопротивление;
— улучшает капиллярное кровообращение и микроциркуляцию;
— тормозит агрегацию тромбоцитов;
— повышает эластичность мембраны эритроцитов [5, 7], т.е. проявляет сочетанные вазотропные и реологические эффекты, весьма важные в плане воздействия на основные звенья патогенеза цереброваскулярной патологии и также не имеющие аналогов среди препаратов как нейрометаболического, так и вазотропного типа действия.
В итоге описанные фармакологические эффекты Вазопро® послужили основанием имеющегося положительного опыта его применения в ангионеврологии.
В клинической практике в результате проведенных обширных испытаний был выявлен комплексный поликомпонентный эффект мелдония (Вазопро®) в отношении патологических симптомов в рамках ОНМК (восстановительный период инсульта) и ХНМК (дисциркуляторная энцефалопатия): ослабление проявлений когнитивных нарушений (улучшение оперативной памяти, внимания, концентрации), цефалгического и астенического синдромов, нормализация психоэмоционального баланса, реологических свойств крови и гемодинамических параметров [6, 10, 13, 19]. Особо следует отметить уменьшение степени гемипареза и очаговой симптоматики [10] — эффекта, очень ценного в клиническом отношении и нечасто наблюдаемого при применении препаратов нейрометаболического типа действия. Также важно подчеркнуть, что эффекты мелдония (Вазопро®) не только проявлялись на уровне клинической симптоматики, но и были визуализированы путем КТ/МРТ-исследования, подтвердившего усиление перфузии как в коре, так и в белом веществе мозга обоих полушарий, причем наиболее выраженно — именно в зоне ишемического очага. Важно отметить, что отмеченные клинические эффекты четко коррелировали со степенью выраженности антиоксидантного действия препарата, выявляемого по серии показателей (снижение интенсивности перекисного окисления липидов, повышение активности супер-оксиддисмутазы и др.).
В конечном итоге клинические эффекты Вазопро® непосредственно способствуют улучшению качества жизни пациентов [12, 13].
При острых нарушениях мозгового кровообращения Вазопро® рекомендуется вводить в дозе 500 мг 1 раз в сутки внутривенно капельно на изотоническом растворе натрия хлорида в течение 10 дней, после чего желателен переход на прием пероральных форм до окончания курса лечения длительностью 4–6 недель. В то же время в ряде проведенных исследований показана целесообразность внутривенного введения мелдония при ишемическом инсульте в указанной дозе сроком до 3 недель [8, 10]. Имеются также сообщения как об успешном применении более высоких доз мелдония и более длительно при ишемическом инсульте (1000 мг/сутки в течение 20 дней с последующим переходом на пероральный прием также в дозе 1000 мг в течение 8 недель) [8], так и о возможности эффективного применения мелдония относительно коротким курсом при данной патологии (500 мг/сутки в течение 10 дней с последующим переходом на пероральный прием при общей длительности курса лечения 3 недели) [4]. При хронических формах цереброваскулярной патологии, как правило, рекомендуется прием пероральных лекарственных форм мелдония, однако получены данные об эффективности парентерального введения препарата в отношении коррекции субъективных симптомов и очаговых неврологических проявлений у пациентов с дисциркуляторной энцефалопатией и в реабилитационном периоде инсульта (500 мг внутривенно в течение 20 дней) [12]. Очевидно, что возможности парентерального пути введения Вазопро® превышают принятые на сегодняшний день рекомендации и заслуживают дальнейшего изучения с точки зрения как применения более длительного курса введения и более высоких доз в остром периоде ишемического инсульта, так и обоснования целесообразности использования парентеральных форм при других видах ангионеврологической патологии.
Лечение Вазопро® характеризуется благоприятными характеристиками безопасности и хорошей переносимостью. Серьезные побочные эффекты не описаны.
Таким образом, Вазопро® — нейрометаболический и вазотропный препарат с комплексным и вместе с тем точечным механизмом действия в отношении ведущих звеньев патогенеза цереброваскулярной патологии, что вполне соответствует современным критериям инструмента нейропротекторной терапии и способствует решению основных целей и задач клинической ангионеврологии.
Вазопро® выпускается в форме раствора для инъекций (ампулы по 5 мл; 1 мл = 100 мг мелдония метоната) в полном соответствии с европейскими критериями качества, является одним из наиболее доступных препаратов мелдония в Украине, что существенно расширяет возможности и перспективы его применения в клинической практике.
Таким образом, клинико-фармакологические эффекты и опыт клинического применения свидетельствуют о целесообразности широкого использования препарата Вазопро® при различных формах цереброваскулярной патологии в рамках комплексной терапии, а также раскрывают новые горизонты в реализации стратегии нейро- протекции.
1. Бурчинский С.Г. Ишемия головного мозга: возможности комплексной фармакологической коррекции // Укр. вісн. психоневрол. — 2006. — Т. 14, вип. 1. — С. 15-18.
2. Бурчинский С.Г. Нейропротекция как комплексная фармакотерапевтическая и фармакопрофилактическая стратегия // Therapia. — 2008. — № 2. — С. 53-56.
3. Виничук С.М., Черенько Т.М. Ишемический инсульт: эволюция взглядов на стратегию лечения. — К.: Комполис, 2003. — 120 с.
4. Виничук С.М., Мохнач В.А., Крылова В.Ю. и др. Клинико-гемодинамические эффекты и антиоксидантная активность препарата милдронат в остром периоде ишемического инсульта // Мед. перспективи. — 2006. — Т. ХI, № 2. — С. 85-91.
5. Дамброва М., Дайя Д., Лиепинбш Э. и др. Биохимические механизмы действия милдроната в условиях ишемического стресса // Врач. дело. — 2004. — № 2. — С. 34-38.
6. Дамулин И.В., Коберская Н.Н., Антоненко Л.М. Влияние милдроната на когнитивные нарушения при дисциркуляторной энцефалопатии: клинико-электрофизиологическое исследование // Неврол. журн. — 2006. — Т. 11, № 1. — С. 1-6.
7. Калвиньш И.Я. Милдронат и триметазидин: сходство и различие // Terra Medica. — 2002. — № 3. — С. 1-3.
8. Максимова М.Ю., Кистенев Б.А., Домашенко М.А. и др. Клиническая эффективность и антиоксидантная активность милдроната при ишемическом инсульте // Рос. кардиол. журн. — 2009. — № 4. — С. 54-61.
9. Міщенко Т.С., Здесенко І.В., Коленко О.І. та ін. Епідеміологія мозкового інсульту в Україні // Укр. вісн. психоневрол. — 2005. — Т. 13, вип. 1. — С. 23-28.
10. Суслина З.А., Максимова М.Ю., Кистенев Б.А. и др. Нейропротекция при ишемическом инсульте: эффективность милдроната // Фарматека. — 2005. — № 13. — С. 99-103.
11. Суслина З.А., Максимова М.Ю., Федорова Т.Н. Оксидантный стресс и основные направления нейропротекции при нарушениях мозгового кровообращения // Неврол. журн. — 2007. — № 4. — С. 24-28.
12. Суслина З.А., Максимова М.Ю., Федорова Т.Н. Хронические цереброваскулярные заболевания: клиническая и антиоксидантная эффективность милдроната // Врач. — 2007. — № 4. — С. 44-48.
13. Шапошник И.И., Салашенко А.О. Эффективность лечения милдронатом больных с сочетанием ишемической болезни сердца и дисциркуляторной энцефалопатии // Мед. перспективи. — 2007. — Т. XII, № 3. — С. 1-4.
14. Barja G. Free radicals and aging // Trends Neurosci. — 2004. — V. 27. — P. 595-600.
15. Simkhovich B.Z., Shutenko Z.V., Meirena D.V. et al. 3-(2,2,2-trimethylhydrazinium)propionate (THP) — a novel gamma-butyrobetaine hydroxylase inhibitor with cardioprotective properties // Biochem. Pharmacol. — 1988. — V. 37. — P. 195-202.
16. Spaniol M., Brooks H., Auer L. et al. Development and characterization of an animal model of carnitine defi ciency // Eur. J. Biochem. — 2001. — V. 268. — P. 1876-1887.
17. Stewart D.J. Clinical relevance of endothelial dysfunction in cardiovascular disorders // Agents & Action. — 1995. — V. 45. — P. 227-235.
18. Taegtmeyer H., King L.M., Jones B.E. Energy substrate metabolism, myocardial ischemia, and targets for pharmacotherapy // Amer. J. Cardiol. — 1998. — V. 82. – P. 54K-60K.
19. Vetra A., Shefere M., Scarda I. et al. Combined treatment of neurological patients: enhancement of early rehabilitation results due to inclusion of mildronate // Proc. Latv. Acad. Sci. Sect. B. — 2001. — V. 55. — P. 80-85.
