Газета «Новости медицины и фармации» Гастроэнтерология (407) 2012 (тематический номер)
Вернуться к номеру
Эрозивный гастрит: современные представления, принципы диагностики и лечения
Авторы: Т.Д. Звягинцева, Я.К. Гаманенко, Харьковская медицинская академия последипломного образования
Версия для печати
Эрозивный гастрит относится к достаточно распространенным заболеваниям органов пищеварения и подразумевает определенный спектр дифференциальной диагностики. Эрозивный гастрит бывает острым и хроническим. Острый эрозивный гастрит — это поверхностное поражение слизистой оболочки желудка (СОЖ). Хронический эрозивный гастрит (ХЭГ) характеризуется множественными эрозиями СОЖ на разных стадиях заживления. Хронические эрозии желудка (ХЭЖ) малоизучены, поскольку понятие сформировалось не так давно в основном благодаря возможности эндоскопического контроля за СОЖ. Оценить истинный характер эрозий можно лишь на основании гистологического исследования, однако расхождения между макроскопическим и гистологическим диагнозом колеблются в пределах от 30 до 100 % случаев.
ХЭЖ могут являться основной причиной кровотечений из верхних отделов желудочно-кишечного тракта (ЖКТ), а показатели летальности при этом осложнении остаются на уровне 10 %. Поэтому очень важно вовремя заподозрить эрозивные поражения гастродуоденальной зоны, а главное — своевременное начать лечение и провести адекватную профилактику.
По характеру гистологических изменений ХЭЖ можно разделить на острые (поверхностные, плоские) и хронические (полные, приподнятые, оспоподобные — вариолиформные) эрозии. При анализе степени зрелости ХЭЖ на основе данных эндоскопии необходимо руководствоваться прежде всего оценкой состояния поверхностного эпителия полиповидных образований и относить к незрелым те эрозии, у которых на вершинах имеется лишь венчик гиперемии. При наличии признаков некроза и десквамации поверхностного эпителия они считаются зрелыми. В свою очередь, эндоскопически диагностированные зрелые ХЭЖ соответствуют клинической стадии обострения хронического эрозивного гастрита, а незрелые — его ремиссии.
При морфологическом исследовании ХЭЖ можно обнаружить гиперплазию пилорических желез и ямочного эпителия, а иногда и фовеолярную гиперплазию. Это дало основание предположить возможность трансформации ХЭЖ в полипы соответствующего типа: гиперпластические, фиброзирующие или смешанные при преимущественном развитии одного из компонентов морфологического субстрата, что, в свою очередь, не исключает возможности их малигнизации.
Патогенетически под влиянием этиологических факторов в процесс образования ХЭЖ включаются следующие механизмы: снижение активности защитных факторов СОЖ; активация факторов агрессии и повышение проницаемости СОЖ.
В литературе широко обсуждается вопрос о роли хеликобактерной инфекции в развитии эрозивных поражений гастродуоденальной слизистой оболочки. Согласно результатам современных исследований, контаминация СОЖ Helicobacter pylori (НР) составляет от 66 до 85 % при локализации эрозий в желудке.
В настоящее время представляется важным изучение роли гормональных факторов в патогенезе эрозивного поражения желудка. Этот интерес обусловлен не только непосредственным влиянием ряда гормонов на репаративные процессы СОЖ, но и участием их в биоритмологических, иммуномодулирующих процессах СОЖ. Кроме того, сама гастродуоденальная зона являет собой составную часть гастроэнтеропанкреатической гормональной системы, способной синтезировать ряд гормонов, обладающих как органным, так и системным действием. К таким гормонам относят мелатонин, обладающий уникальными адаптативными возможностями, пусковым механизмом, приводящим на начальных этапах к возникновению десинхроноза, за которым следует возникновение органической патологии в СОЖ. Следовательно, сам факт нарушения продукции мелатонина может стать причиной формирования различных висцеральных нарушений, включая эрозивные поражения СОЖ.
При комплексном изучении структурно-функциональной организации экстрапинеальных мелатонинпродуцирующих апудоцитов, а также других основных клеток диффузной нейроэндокринной системы в настоящее время получены данные, свидетельствующие об активном участии экстрапинеального мелатонина в возникновении эрозивной патологии гастродуоденальной зоны.
Таким образом, принимая во внимание большое количество мелатонинпродуцирующих клеток в СОЖ, широкий спектр биологической активности мелатонина, установлено, что экстрапинеальный мелатонин играет ключевую роль как паракринная сигнальная молекула относительно локальной координации клеточной функции и межклеточных связей СОЖ в норме и патологии. Экстрапинеальный мелатонин может действовать и как типичный гормон, достигая отдаленных клеток-мишеней СОЖ по микроциркуляторному руслу. С помощью рецепторов к мелатонину неэндокринные клетки, такие как тучные клетки, эозинофильные лейкоциты и тромбоциты, могут поглощать мелатонин из крови или межклеточного пространства для переноса его к участкам, где он реализует свои эффекты. При иммуногистохимическом анализе распределения экзогенного мелатонина в СОЖ было выявлено быстрое его разрушение, а продукты метаболизма распространялись по всей СОЖ, интенсивнее всего включаясь в клетки, которые характеризуются высоким уровнем биосинтетических процессов. Следует особенно отметить, что в отличие от многих гормонов действие мелатонина на клеточные структуры зависит как от его концентрации в кровотоке или межклеточном пространстве, так и от начального состояния клетки, на которую осуществляется влияние. Эти особенности позволяют считать мелатонин универсальным эндогенным адаптогеном, который регулирует гомеостаз в соответствии с изменениями окружающей среды и действия патогенных факторов на СОЖ.
В последние годы появились немногочисленные экспериментальные исследования, касающиеся роли мелатонина в регуляции функций ЖКТ, в которых показано, что для мелатонина существует прямая корреляционная связь между его концентрациями в крови и моче при нормальном состоянии печени и почек. Кроме того, концентрация мелатонина в крови и в моче прямо коррелирует с уровнем его секреции эпифизом, так как мелатонин не накапливается пинеоцитами. На основании данных исследований можно считать, что мелатонин играет существенную роль в физиологии ЖКТ и нарушение его секреции может являться причиной возникновения эрозивных изменений гастродуоденальной зоны.
Во всех работах, посвященных ХЭГ, обсуждается только механизм возникновения, а не хронизации, в связи с чем в патогенезе данного заболевания не так важны причины возникновения эрозий, как причины отсутствия заживления. В нашей статье особенное внимание уделяется изучению ХЭГ без сопутствующей патологии, поскольку анализ результатов собственных наблюдений и данных литературы позволяет выразить мнение о том, что в значительной части случаев ХЭГ является самостоятельной нозологической формой, а не осложнением других заболеваний.
Целью настоящего исследования являлось изучение уровня секреции мелатонина в сыворотке крови и моче у больных ХЭГ с определением гистологических особенностей СОЖ .
Материалы и методы исследования
Обследовано 107 больных с ХЭЖ в стадии обострения, среди которых 87 мужчин (81,3 %) и 20 женщин (18,7 %). Средний возраст — 32,1 ± 0,7 года. Контрольную группу составили 15 практически здоровых лиц.
І группа — 61 пациент (57,1 %), заболевание характеризовалось хроническим, а также рецидивирующим течением с подавляющей частотой рецидивов 1 раз в год, а во ІІ группе у 46 больных (42,9 %) ХЭЖ были выявлены впервые.
Диагноз верифицирован с помощью клинико-лабораторных и инструментальных методов исследования.
У большинства больных (78,9 %) ХЭГ локализовались в антральном отделе, у остальных (21,1 %) — в антральном и фундальном отделах.
Единичные эрозии (от 1 до 3) выявлены у 25,9 %, у остальных 74,1 % диагностированы множественные ХЭЖ. В процессе обследования инфекция HР установлена у 73,2 % больных.
У 70 % больных отмечались боли различной степени выраженности в эпигастральной области, у 30 % данное заболевание протекало латентно и не имело характерных клинических проявлений.
Все больные в зависимости от применяемой терапии были разделены на 2 группы: пациенты І группы (61 больной) на фоне стандартной терапии (ингибиторы протонной помпы и два антибиотика) получали препарат мелатонина однократно вечером в дозе 6 мг за 1 час до сна в течение 12 дней. Больные II группы (46 человек) получали стандартную терапию.
Результаты исследования и их обсуждение
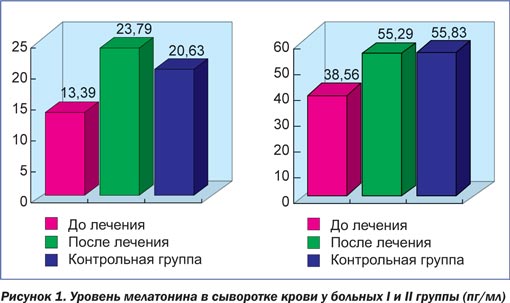
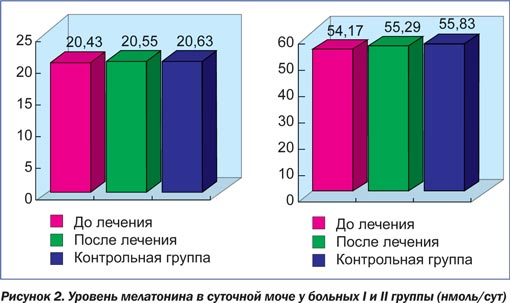
При изучении уровня мелатонина в сыворотке крови у больных I группы выявлено снижение его до 13,39 ± ± 0,40 пг/мл (р < 0,001), а в суточной моче — до 38,56 ± 1,30 нмоль/сут (р < 0,001) по сравнению с контрольной группой. После проведеного курса терапии содержание мелатонина восстанавливалось до нормальных показателей — 23,79 ± 0,60 пг/мл (р < 0,001) в сыворотке крови, а в суточной моче — 55,29 ± 1,00 нмоль/сут (р < 0,001).
У пациентов II группы в процессе обследования не было выявлено значительного снижения уровня мелатонина как в крови, так и в моче. В связи с этим им была показана только стандартная терапия. Уровень мелатонина в крови у данной группы до и после лечения в среднем составлял 20,43 ± 0,60 пг/мл (р < 0,001), а в моче — 54,17 ± 1,60 нмоль/сут (р < 0,001). После лечения уровень мелатонина в крови у данной группы больных увеличивался, но не достигал уровня, характерного для контрольной группы. Уровень мелатонина в моче оставался низким в обеих стадиях заболевания (рис. 1, 2).
В процессе исследования нами не выявлено достоверной разницы в сроках исчезновения болевого и диспептического синдромов. Однако на фоне приема мелатонина эти синдромы купировались через 2 ± 1 день у пациентов I группы, а во II группе — через 4 ± ± 1 день. При оценке эндоскопической картины установлено, что по окончании терапии на 12-е сутки полная эпителизация эрозий отмечена у 52 (85,2 %) больных І группы и у 30 (65,3 %) больных ІІ группы, в том числе полное исчезновение ХЭЖ зарегистрировано у 9 (14,7 %) больных І группы и у 16 (34,7 %) ІІ группы, что характерно для полных незрелых эрозий.
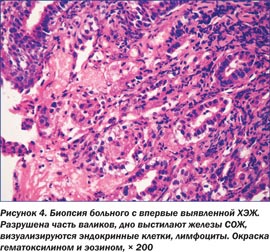
При гистологическом исследовании биоптатов с ХЭЖ у больных I группы установлено наличие высокопризматического, интенсивно продуцирующего слизь эпителия краевой зоны. При этом сеть подэпителиальных сосудов развитая, наблюдается удлинение шеечных отделов желудочных желез. В зоне ХЭЖ — чередование больших участков фиброза, кистозного расширения желудочных желез, солитарных фолликулов и интенсивная смешанная полиморфноклеточная инфильтрация СОЖ (рис. 3).
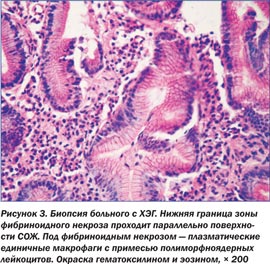
При гистологическом исследовании биоптатов СОЖ больных IІ группы выявлены ХЭГ в стадии обострения, которые характеризуются наличием коагуляционного некроза, напоминающего фибриноидный некроз как при язвенной болезни желудка, но без типичного для него фиброза краев. Гиперплазия пилорических желез в зоне ХЭЖ является причиной образования возвышения, которое служит эндоскопическим критерием. В области дна хронической эрозии выявлена грануляционная ткань, а в краевых отделах — дистрофические и атрофические изменения эпителия желез СОЖ (рис. 4).
При морфологическом изучении биоптатов из антрального отдела желудка после курса лечения было установлено позитивное влияние на характер и выраженность патологических изменений в СОЖ, что проявлялось существенным уменьшением лимфоплазмоцитарной воспалительной инфильтрации, уменьшением дистрофических изменений эпителиоцитов, исчезновением или значительным уменьшением признаков эпителиальной дисплазии (рис. 5, 6). После эрадикации НР у 81,9 % больных наблюдалась нормализация структуры поверхностного эпителия с сохранением незначительной лимфоплазмоцитарной инфильтрации в строме.
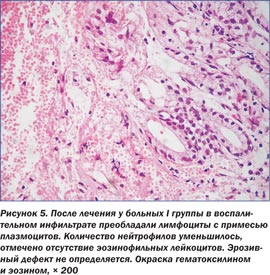
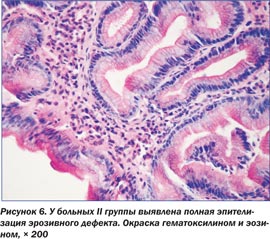
Данные результаты говорят о том, что в стадию клинико-эндоскопической ремиссии после лечения у больных І группы практически нивелирован дисбаланс мелатонина, участвующего в регуляции факторов агрессии и защиты СОЖ. Наличие нарушений суточной продукции мелатонина при обострении заболевания свидетельствует о том, что выявленные изменения являются не только реакцией организма на обострение, но и вероятным фактором возникновения эрозивного процесса в СОЖ.
Таким образом, изменение продукции мелатонина в стадию обострения является не только реакцией организма на возникновение ХЭГ, но и вероятным фактором возникновения эрозий. С учетом генетической детерменированности продукции мелатонина нарушение его секреции в стадию обострения позволяет с большой долей вероятности говорить об участии мелатонина в патогенетических механизмах возникновения ХЭЖ. Следовательно, факт нарушения продукции мелатонина влечет за собой целый спектр нарушений, каждый из которых способен привести к потенцированию образования эрозивного процесса в СОЖ. Мелатонин оказывает положительное влияние, в том числе на эффект синхронизации эндогенных биологических ритмов, только в условиях, отличных от нормы, то есть, по сути, является адаптогеном.
Выводы
1. Установлено, что развитие ХЭГ сопровождается изменением продукции мелатонина. Это, с одной стороны, свидетельствует о сложных эндогенных механизмах развития ХЭГ, с другой — открывает новые возможности коррекции развития патологических процессов и в оптимизации их лечения.
2. ХЭГ сопровождается различными формами нарушения выработки мелатонина, что требует дифференцированного подхода к тактике лечения.
3. Восстановление уровня мелатонина приводит к улучшению клинической картины заболевания, повышению качества жизни больных и снижению риска рецидива заболевания.
1. Звягинцева Т.Д., Гаманенко Я.К. Клетки APUD-системы слизистой оболочки желудка, их морфофункциональные особенности при хронических эрозиях / Т.Д. Звягинцева, Я.К. Гаманенко // Biomedical and Biosocial Anthropology. — 2008. — № 10. — С. 267-269.
2. Комаров Ф.И., Рапопорт С.И., Малиновская Н.К. Мелатонин в норме и патологии. — М.: Триада-Х, 2002. — 298 с.
3. Маев И.В. Эрозивный гастрит: отдельная нозологическая форма или универсальная реакция слизистой оболочки на повреждение? // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 2005. — № 6. — С. 53-59.
4. Хомерики С.Г. Механизмы физиологической и репаративной регенерации в органах пищеварительной системы // Рос. журн. гастроэнтерол., гепатол., колопроктол. — Приложение № 7. Материалы 15-й Юбилейной сессии Академической школы-семинара им. А.М. Уголева, 2007. — Т. IX, № 4. — С. 87-93.
5. Циммерман Я.С. Хронические гастродуоденальные эрозии: клинико-патогенетическая характеристика, классификация, дифференцированное лечение / Я.С. Циммерман, В.Е. Ведерников // Клиническая медицина. — 2005. — № 6. — С. 30-36.
6. Blask D.E., Cos S., Hill S.M. et al. Melatonin action and oncogenesis // Role of melatonin and pineal peptides in neurоimmunomodulation / F. Fraschini, R.J. Reiter (eds). — New York: Plenum Press, 2009. — P. 143-150.
7. Fichman S. Histological changes in the gastric mucosa after Helicobacter pylori eradication / S. Fichman, Y. Niv // Eur. J. Gastroenterol. Hepatol. — 2008. — Vol. 16, № 11. — P. 1183-1188.
8. Functional gastroduodenal disorders / J. Tack, N.J. Talley, M. Camilleri et al. // Best Pract. Res. Clin. Gastroenterol. — 2006. — Vol. 130, № 32. — P. 1466-1479.
