Журнал «Внутренняя медицина» 4(4) 2007
Вернуться к номеру
Перебіг серцевої недостатності та зміни внутрішньосерцевої гемодинаміки у хворих на гострий інфаркт міокарда похилого віку з дилатацією порожнини лівого шлуночка та супутньою гіпертрофією та їх корекція високими дозами небівололу
Авторы: В.В. Батушкін, к.м.н., завідувач відділом кардіореанімації. Міська клінічна лікарня № 5, м. Київ
Рубрики: Кардиология, Геронтология
Разделы: Клинические исследования
Версия для печати
У перші тижні виникнення гострого інфаркту міокарда у зміні геометрії лівого шлуночка переважають процеси дилатації порожнини де у подальшому за рахунок гіпертрофії неушкодженого міокарда формується компенсація [1, 4, 8]. Процеси ремоделювання порожнин та стінок лівого шлуночка залежать від багатьох факторів і можуть тривати від 3 до 18 місяців [2, 6]. Виділяють від 2 до 4 періодів післяінфарктної дилатації [5]. Перебіг післяінфарктного періоду у хворих віком понад 74 роки, завжди вважався гіршим у прогностичному плані. Більш виражений механізм прекондиціювання у хворих похилого віку, наявність попередньо розвинутої гіпертрофії лівого шлуночка (ЛШ) вносять важливі корективи в перебіг післяінфарктного ремоделювання та формування ознак СН [5, 7]. Тактика лікування осіб старших вікових груп із ГІМ має певні обмеження [4, 10]. Зокрема, частота призначення максимально ефективних або цільових доз β-блокаторів у хворих на ІМ похилого віку значно нижча, ніж серед осіб молодшого віку, через їх гіршу переносимість. G. Olsson, A. Oden, L. Johanssoni та співавт. (1988) у 7-річному дослідженні хворих на ІМ встановили, що тільки 37 % хворих віком понад 70 років досягли цільової дози метопрололу [5].
Висока ефективність небівололу у хворих на СН похилого віку доведена в багатьох рандомізованих дослідженнях [6, 10, 11]. В ENECA-study (2005) показані гальмування дилатації порожнини лівого шлуночка (ДПЛШ) та зростання ФВ з 25,4 до 31,9 % при лікуванні небівололом. У дослідженні SENIORS (2005) доведена краща виживаність та нижча частота госпіталізації хворих на СН віком понад 70 років протягом 30 місяців. Ефективність препарату пов'язана з певними його відмінностями від інших β-блокаторів [12]. Перш за все йому притаманна висока β1-селективність без внутрішньої симпатоміметичної активності, мембраностабілізуючих властивостей, що відносить його до групи β-блокаторів ІІІ генерації. Це, з одного боку, характеризує його важливі гемодинамічні ефекти, з іншого — забезпечує його кращу переносимість, відсутність тяжких побічних ефектів [3, 4]. Іншою важливою відмінністю є властивість ендотелійзалежної дилатації резистивних артерій.
У своїй роботі ми вивчали вплив помірної гіпертрофії лівого шлуночка (ГЛШ) на перебіг СН у хворих похилого та старечого віку з дилатацією порожнини ЛШ внаслідок ІМ та ефективність впливу високих доз небівололу на зміни внутрішньосерцевої гемодинаміки та ознаки СН протягом першого року з моменту захворювання.
Матеріали та методи дослідження
Нами обстежено 247 пацієнтів з ІМ, ускладненим СН ІІ–ІІІ ФК за класифікацією NYHA та ФВ до 50 %. Діагноз ІМ грунтувався на клініко-інструментальних та лабораторних ознаках згідно з Рекомендаціями. Більшість хворих (156, або 63,2 %) мали помірну (м'яку) супутню артеріальну гіпертензію, що в 64 % носила характер ізольованої систолічної. Лікування хворих у стаціонарі протягом 14–21 днів включало призначення β-блокаторів, інгібіторів АПФ, нітратів, станінів, аспірину, антитромбоцитарних препаратів тощо. Після виписки зі стаціонару хворі додатково застосовували діуретики, глікозиди. Після стабілізації загального стану хворих, визначення препаратів та їх доз для тривалої амбулаторної терапії за результатами ехокардіографічного дослідження (21–30-й день) усі хворі були розподілені на три групи. До І групи ввійшли 72 хворі з помірною або важкою ДПЛШ (КДО понад 180 мл) без ознак ГЛШ. ІІ групу (121 особа) склали особи, у яких дилатація ЛШ поєднувалася з ГЛШ. 54 пацієнти на момент первинного обстеження не мали ні значної дилатації, ні ГЛШ та увійшли до ІІІ групи. Усі групи були порівнянні за віком, статтю, наявністю супутніх захворювань (цукровий діабет, хронічна ниркова недостатність тощо).
У процесі однорічного дослідження вивчалися смертність хворих від серцево-судинних причин, маніфестація симптомів СН, зміни внутрішньосерцевої гемодінаміки за допомогою ЕхоКГ серця за загальноприйнятими методиками [4]. Для отримання нормативних показників ГЛШ та розмірів порожнини ЛШ додатково обстежені 20 осіб віком від 65 до 84 років без серцево-судинних уражень за результатами клінічних, лабораторно-інструментальних досліджень.
64 пацієнтів на ІМ з перших днів стабілізації загального стану був призначений β-блокатор небіволол, що титрувався згідно рівнів ЧСС та АТ з дози 5 мг на добу до максимально переносимої або до досягнення цільової дози — 10 мг. У процесі титрування дози 10 мг досягли 75,0 % хворих, 7,5 мг — 12,2 %. 6 хворим для адекватного контролю ЧСС та АТ доза небівололу була підвищена до 12,5 мг на добу. Як наслідок, середня доза препарату через рік дослідження становила 9,6 ± 4,1 мг на добу, яка була вищою, ніж в останніх відомих багатоцентрових дослідженнях (SENIORS — 7,7 мг, ENECA — 7,4 мг на добу).
За даними ініціальної ехокардіографії 44 хворі з підгрупи небівололу мали ДПЛШ у поєднанні з ГЛШ, 20 хворих — тільки ізольовану ДПЛШ.
Статистичну обробку результатів проводили за допомогою пакета прикладних програм Statisticа 6.0. Аналіз виживаності — за методом множних оцінок Каплана — Майєра. Аналіз розбіжності частот виконувався з вирахуванням класичного критерію c 2 за Пірсоном, у невеликих вибірках обчислювалася поправка Йєтса на безперервність. У деяких випадках визначався точний критерій Фішера (двосторонній тест) [6].
Результати та їх обговорення
У наших попередніх роботах було показано, що за нормальних величин порожнини ЛШ у перші 3 місяці захворювання наявність ГЛШ частіше поєднувалася з розвитком ранньої післяінфарктної стенокардії [3].
В однорічний термін ІМ виживання хворих обумовлена декількома факторами, головними з яких є систоло-діастолічна дисфункція внаслідок порушення скоротливої функції стінок ЛШ, прогресуюча дилатація порожнини ЛШ. Смертність хворих залежно від ДПЛШ та супутньої ГЛШ показана на рис. 1.
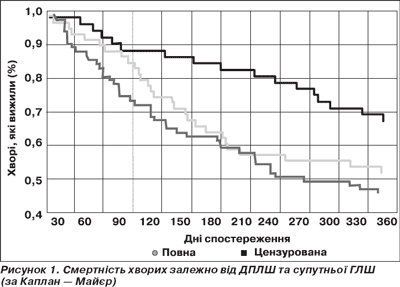
Згідно результатів нашого дослідження протягом одного року з моменту виникнення ІМ серцево-судинна смертність внаслідок СН загалом становила 33,2 %. Максимальна кількість померлих визначалася в групі з ізольованою ДПЛШ — 30 (41,7 %). Серед хворих із супутньою ГЛШ аналогічний показник становив 40 осіб (33,1 %). Значно менше — 12 (24,1 %) осіб — померли в однорічний термін в групі без дилатації чи ГЛШ (рис. 1).
Динаміка показників однорічної виживаності при дилатації ЛШ в поєднанні з ГЛШ мала певні особливості. У перші 3 місяці кількість померлих серед хворих цієї групи майже не відрізнялася від показників ІІІ групи (8 і 6 осіб відповідно). Після 90 днів із моменту розвитку ІМ крива виживаності в ІІ групі почала сходитися з кривою виживаності хворих з ізольованою ДПЛШ. Вірогідність показників між групами вирахувана за допомогою класичного критерію χ2 за Пірсоном: р = 0,034 між ІІІ та ІІ групами, р = 0,016 між І та ІІІ групами.
Отже, діастолічна дисфункція з супутньою ГЛШ, а ще більше без останньої є потужним незалежним предиктором смерті внаслідок СН протягом першого року у хворих на ІМ похилого віку.
Патофізіологічний механізм несприятливого перебігу післяінфарктної СН в осіб похилого віку з ДПЛШ багатогранний. За літературними даними, активація РААС, прогресування ендотеліальної дисфункції зумовлюють різке зростання смертності після 3-го місяця лікування. У цей період у хворих визначається більш високий проапоптотичний BAX/Bcl2 коефіцієнт, посилення експресії TNF-α, ЕТ-1, PGH2 [4, 12].
Найгірші результати відновлювального лікування з найбільшою кількістю випадків повторних госпіталізацій внаслідок дестабілізації СН протягом року були отримані при значній ДПЛШ (КДО понад 200 мл) як за наявності супутньої ГЛШ, так і без неї.
Зміни внутрішньосерцевої гемодинаміки хворих на ГІМ похилого та старечого віку залежно від супутньої ГЛШ протягом раннього післяінфарктного періоду (перші 3 місяці) та пізнього (протягом одного року з моменту ІМ) подані в табл. 1. Так спостерігалося, що прогресування ДПЛШ у хворих із ГЛШ та клінічними симптомами СН у перший триместр ІМ було меншим, ніж у І групі. Зростання КДО, КСО більше ніж на 10 % відмічалося у 34,5 % хворих, тоді як у групі без ГЛШ — у 87,2 % (р = 0,006). Максимальна швидкість вигнання була меншою від вихідної (1,44 ± 0,40 проти 1,6 ± 0,3 с-1), однак стабільною. ФВ закономірно підвищувалася до 3-го місяця з подальшим зменшенням до вихідних значень в обох групах, однак ці зміни не набували вірогідного характеру. В подальшому КСО зростав у групі з ГЛШ на 12,2 %, тоді як у групі без ГЛШ — на 19,3 % (р = 0,112).
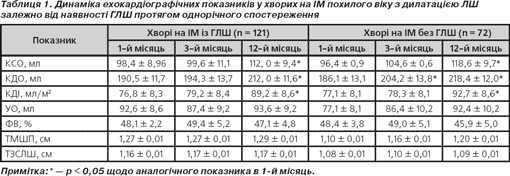
За наявності ГЛШ на ранніх етапах післяінфарктного ремоделювання визначався її позитивний вплив на швидкість дилатації порожнини ЛШ. Збільшені значення КДО та КСО внаслідок ГІМ протягом наступних 2–3 місяців спостереження (на амбулаторному етапі лікування) змінювалися незначно (на 9,3–11,0 %). Внаслідок цього зберігалася достатня пропульсивна здатність серця, що виражалася в стабільному клінічному перебігу захворювання. У цей період несприятливий перебіг з однаковою частотою характеризувався розвитком життєво небезпечних аритмій або збереженням чи посиленням недостатності кровообігу [6, 10, 13].
Після 3–4 місяців з моменту ІМ у всіх хворих похилого віку відмічалося прогресуюче зростання значень КДО, КСО, що досягали найбільших показників на кінець терміну спостереження. Ступінь переважного зростання останнього обумовлювало зниження ФВЛШ. Цей феномен у клінічному плані супроводжувався зростанням кількості випадків госпіталізації хворих із декомпенсацією серцевої недостатності на 48,7 % (р = 0,023).
Отже, на підставі оцінки різних варіантів гемодинаміки у хворих на ІМ похилого віку можна сказати, що ГЛШ при помірній дилатації порожнини ЛШ позитивно впливає на зростання скоротливої функції, що відзначалося в перші 3 місяці після ІМ, але вже до першого року захворювання цей позитивний вплив втрачає своє значення: прогресує зниження скоротливої здатності лівого шлуночка, погіршуються динамічні характеристики систоли, значно збільшуються порожнини серця.
Призначення небівололу в групі хворих на ІМ похилого віку з вихідною ДПЛШ призводило до покращання клінічного перебігу СН протягом першого року з моменту ІМ. Серед них частіше досягалися цільові значення ЧСС та АТ. Частота амбулаторного прийому сечогінних засобів була на 34 % меншою, а кількість госпіталізацій внаслідок декомпенсації СН була втричі меншою, ніж у цілому в групі. Однорічна смертність у групі небівололу становила 20,3 %.
Визнаючи велике значення високого комплаєнсу лікування в групі небівололу щодо хворих, які приймали інші β-блокатори, основну увагу в нашому дослідженні ми зосередили на особливостях протективної дії препарату на процеси ремоделювання порожнини ЛШ залежно від ГЛШ (рис. 2).
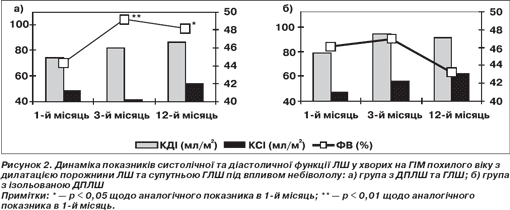
Оцінюючи стан внутрішньосерцевої гемодинаміки на всіх етапах дослідження, необхідно відзначити наступне. Призначення високих доз небівололу в ранній термін ІМ попереджає прогресування дилатації порожнини ЛШ у хворих із супутньою ГЛШ протягом першого року захворювання (рис. 2а). Найбільший ефект лікування відзначався в перші 3 місяці. У цей час спостерігалося покращання систолічної функції серця, що характеризувалося зменшенням КСІ, зростанням ФВ. Причому зростання ФВ становило 10,3 % і було вірогідним (р = 0,0414). Позитивний ефект небівололу у хворих із ГЛШ та ДПЛШ пояснюється потужною антипроліферативною властивістю та гальмуванням ангіотензин-ІІ-оксидативного стресу в міокардіоцитах, що, за думкою L.J. Ignarro, M. Sisidoia, K. Trinh (2002), реалізується через блокаду β1-рецепторів та стимуляцію через сGMP — незалежний шлях вивільнення NO [5].
У хворих на ІМ похилого віку з ізольованою ДПЛШ лікування небівололом мало певні особливості (рис. 2б.). Позитивний ефект препарату виявлявся на пізніх етапах післяінфарктного ремоделювання. На 3–4-й місяць перебігу захворювання виникало гальмування подальшої ДПЛШ із наступним регресом розмірів. Це виражалося у зменшенні КДІ з 94,3 до 82,6 мл/м2 у 73,4 % хворих. У групі хворих, які приймали інші β-блокатори, таких пацієнтів було вірогідно менше — тільки 11,2 % (р = 0,00312). Регрес дилатованої порожнини ЛШ під впливом тривалого прийому небівололу спостерігав і T. Wisenbaugh (1993) у хворих з дилатаційною кардіоміопатією. У цих хворих небіволол відновлював індуковану вільними радикалами контрактильну дисфункцію трабекулярного апарату міокардіоцитів [7].
Отримані результати можуть свідчити про попередження розвитку систолодіастолічної дисфункції на ранньому (перші 3 місяці) етапі патологічного післяінфарктного ремоделювання у хворих із вихідною ДПЛШ із супутньою ГЛШ. Призначення небівололу хворим без ГЛШ покращує діастолічну функцію на пізньому (перший рік) етапі еволюції ІМ.
Вазодилатуючі властивості небівололу пов'язані зі стимуляцією L-аргінін/NO-ендотелійзалежного шляху активації синтезу NO в ендотеліоцитах судин. Найбільш виражений вплив небівололу на ендотелій крупних та середніх судин, де він підвищує концентрацію NO2-/NO3-, активність cNOS, вміст cGMPВ в артеріальній стінці, сприяючи вазодилатації. Даний ефект препарату може призвести до нормалізації функції ендотелію вінцевих судин, покращання тканинної перфузії, що може спричиняти зменшення вираженості процесів ремоделювання ЛШ. На рівні органів та тканин небіволол виявляє численні негемодинамічні ефекти. Відчутний антиоксидантний ефект препарату обумовлений блокадою супероксид-радикалу в клітинах міокарда та попередженням оксидативного стресу [6, 11]. A. Zanchetti (2006) інформує про більш виражений вплив небівололу на агрегацію тромбоцитів, ніж пропранололу або карведилолу [12]. Іншим плейотропним ефектом небівололу може бути зниження рівнів реніну та альдостерону в плазмі, що гальмує патологічну активність РААС. Активність останньої разом із дісфункцією ендотелію та гіперзбудливістю симпатичної ланки ВНС призводить до гіпертрофії та дилатації порожнин серця, ремоделювання периферичних судин, посилення атерогенезу, зростання згортуючого потенціалу крові та агрегації тромбоцитів, змін генетичної відповіді міокардіоцитів, що призводить до програмованої смерті — апоптозу.
Як уже зазначалося, на відміну від останніх досліджень із лікування хронічної СН більшість наших хворих приймали відносно високі дози препарату. Препарат, як правило, добре переносився, побічні ефекти (головний біль, запаморочення, немотивована слабкість або дихальні розлади), що широко дискутуються в літературі, серед наших хворих не визначалися. Брадикардія або гіпотензія відмічалися лише у 8 хворих (12,5 %). Чіткого дозозалежного ефекту не спостерігалося. У жодному випадку препарат не був відмінений.
Необхідно відмзначити певні обмеження даного дослідження, що стосуються можливої непорівнянності дозувань різних β-блокаторів. В нашій роботі не використовувалися максимально переносимі дози метопрололу, бісопрололу, карведілолу з огляду на їх призначення в більш ранній термін дослідження.
Висновки
1. Супутня ГЛШ у хворих похилого віку з дилатацією порожнини ЛШ внаслідок ІМ має диференціальний вплив на перебіг СН протягом першого року з моменту захворювання.
2. Протягом перших трьох місяців з моменту ІМ помірна ГЛШ гальмує подальшу дилатацію порожнини ЛШ, покращує відновлення скоротливої здатності серця, поліпшує короткотривалий прогноз перебігу СН та виживаність хворих похилого віку.
3. Призначення тривалого прийому високих доз небівололу попереджує розвиток важкої дилатації у хворих на ГІМ похилого віку.
4. Найбільший ефект препарату спостерігається в групі з супутньою помірною гіпертрофією лівого шлуночка.
Дослідження проведено на оригінальному небівололі (Небілет) компанії «Берлін-Хемі».
