Газета «Новости медицины и фармации» Офтальмология (417) 2012 (тематический номер)
Вернуться к номеру
Современные возможности в хирургии субмакулярных кровоизлияний
Авторы: В.С. Асланова, к.м.н,. завотделением витреоретинальной и лазерной хирургии, ГУ «Институт глазных болезней и тканевой терапии им. В.П. Филатова НАМН Украины», г. Одесса
Версия для печати
Одну из актуальных проблем офтальмологии представляют субмакулярные кровоизлияния (СМК), являющиеся причиной необратимой утраты центрального зрения.
СМК представляют собой скопление крови между нейросенсорной ретиной и пигментным эпителием сетчатки (ПЭС), исходящей из сосудов хориоидеи или сетчатой оболочки, локализующиеся в макулярной области.
Наиболее часто СМК осложняют течение экссудативной формы возрастной макулодистрофии (ВМД), миопии высокой степени, некоторые виды хирургических вмешательств, разрывы ретинальных макроаневризм, друзы диска зрительного нерва, окклюзию центральной вены сетчатки, некоторые заболевания крови и др.
 В литературе описаны также единичные случаи развития СМК во время проведения флюоресцентной ангиографии, при ангиоидных полосах сетчатки, хориоидите, идиопатической полипоидальной хориоидальной васкулопатии, болезни Беста, при проведении решетчатой лазеркоагуляции по поводу идиопатической юкстафовеолярной ретинальной телеангиэктазии.
В литературе описаны также единичные случаи развития СМК во время проведения флюоресцентной ангиографии, при ангиоидных полосах сетчатки, хориоидите, идиопатической полипоидальной хориоидальной васкулопатии, болезни Беста, при проведении решетчатой лазеркоагуляции по поводу идиопатической юкстафовеолярной ретинальной телеангиэктазии.
Do D. et al. (2004) описывают 5 случаев развития обширных СМК после проведения фотодинамической терапии (ФДТ) с использованием вертепорфина, потребовавших хирургического вмешательства.
О случаях СМК, возникших на 28 из 91 глаза после ФДТ с использованием вертепорфина, проводимой по поводу полипоидальной хориоидальной васкулопатии, сообщают также Hirami Y., Tsujikawa A., Otani A. et al. (2007). В шести случаях СМК были настолько обширными и массивными, что привели к развитию кровоизлияния в стекловидное тело, по поводу чего двум пациентам была выполнена витрэктомия.
Axer-Siegel R., Ehrlich R., Rosenblatt I. (2004) наблюдали развитие СМК после ФДТ при ВМД в 14 % случаев (в 5 из 34). Об осложнении такого же характера, развившемся спустя неделю после ФДТ, сообщают Recchia F., Greenbaum S., Recchia C. (2006). Описан случай СМК, возникшего после транспупиллярной термотерапии по поводу хориоидальной неоваскулярной мембраны вследствие мультифокального хориоидита (Pathengay A. et al., 2005).
Центральная зона сетчатки (fovea centralis) в связи с особенностями ее анатомического строения отличается чрезвычайно высокой чувствительностью к процессам, происходящим при СМК.
 Отрицательное воздействие СМК на сетчатку обусловлено следующими основными моментами. Прежде всего СМК, создавая механический барьер между ПЭС и нейросенсорной ретиной, препятствуют нормальному течению метаболических процессов в сетчатке. Кроме того, ионы железа, освобождающиеся при распаде гемоглобина излившейся крови, оказывают токсическое влияние на наружные сегменты фоторецепторов. Происходящая при СМК контракция сгустка крови вызывает механическое повреждение фоторецепторов. Экспериментальные исследования, проведенные на кроликах, показали, что при объемных субретинальных кровоизлияниях происходит некроз всей сетчатки, за исключением ее внутренней пограничной мембраны (ВПМ). На обеих поверхностях ВПМ при ее микроскопическом исследовании обнаруживались фрагменты эритроцитов (Lincoff H. et al., 2003).
Отрицательное воздействие СМК на сетчатку обусловлено следующими основными моментами. Прежде всего СМК, создавая механический барьер между ПЭС и нейросенсорной ретиной, препятствуют нормальному течению метаболических процессов в сетчатке. Кроме того, ионы железа, освобождающиеся при распаде гемоглобина излившейся крови, оказывают токсическое влияние на наружные сегменты фоторецепторов. Происходящая при СМК контракция сгустка крови вызывает механическое повреждение фоторецепторов. Экспериментальные исследования, проведенные на кроликах, показали, что при объемных субретинальных кровоизлияниях происходит некроз всей сетчатки, за исключением ее внутренней пограничной мембраны (ВПМ). На обеих поверхностях ВПМ при ее микроскопическом исследовании обнаруживались фрагменты эритроцитов (Lincoff H. et al., 2003).
Возможнсть быстрого развития некроза сетчатки, наблюдающегося при объемных субретинальных геморрагиях, обосновывает необходимость как можно более раннего удаления сгустка крови из макулярной области с целью сохранения функции макулы.
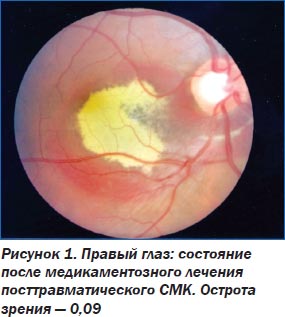
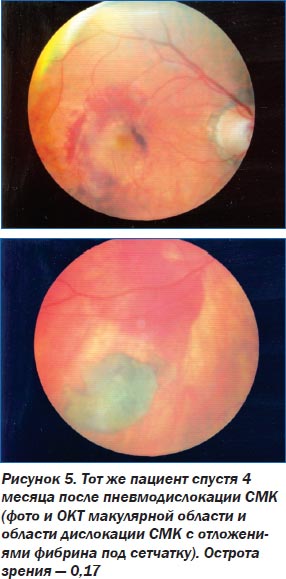
Длительное время для лечения СМК различной этиологии применялась только консервативная терапия, как общая, так и местная, в том числе физические методы воздействия. Однако, несмотря на довольно широкий арсенал медикаментозных и физических методов, применявшихся для лечения СМК, эффективность их остается довольно низкой, и СМК независимо от вызвавшей их причины нередко приводят к резкому снижению, вплоть до стойкой утраты центрального зрения (рис. 1).
Новые возможности в лечении больных с СМК появились в связи с развитием и внедрением в клиническую практику витреоретинальной хирургии.
Первое сообщение об оперативном лечении больных с СМК Hanscom и Diddie относится к 1987 году. Суть предпринятого оперативного вмешательства, произведенного ими двум больным, заключалась в следующем. Была выполнена витрэктомия, дренирующая ретинотомия, через которую осуществлена аспирация субретинальной крови. Затем вокруг зоны ретинотомии произведена эндолазеркоагуляция, внутренняя газовая тампонада. Однако, несмотря на полное дренирование субретинальной крови, существенного улучшения остроты зрения у оперированных больных отмечено не было. Так, острота зрения после выполнения хирургического вмешательства повысилась до 0,05 по сравнению с исходной, равной 0,005.
Han D. et al. (1990), сообщая о 19 случаях витрэктомии с внутренним дренированием субретинальной крови при СМК травматической этиологии, добились полной эвакуации крови из-под сетчатки только у 68 % пациентов, а незначительное улучшение остроты зрения (до 0,025) наблюдалось лишь у 32 % больных. Кроме того, в 37 % случаев потребовалось проведение повторной витрэктомии в связи с развитием таких серьезных осложнений, как пролиферативная витреоретинопатия (ПВР), отслойка сетчатки, массивный субретинальный фиброз. Vander J. et al. (1991) сообщают об 11 случаях массивного СМК на фоне экссудативной ВМД, по поводу чего было произведено витреоретинальное вмешательство с внутренним дренированием субретинальной крови. В отдаленные сроки наблюдения (3–18 месяцев) острота зрения незначительно улучшилась только у 4 (36 %) пациентов. В связи с развитием ПВР и отслойки сетчатки четырем больным потребовалось повторное оперативное вмешательство. Mandelcorn M., Menezes A. (1993) сообщили о 7, а Machemer R., Steinhorst U. (1993) — о 3 случаях витрэктомии по поводу СМК. Однако в послеоперационном периоде наблюдались серьезные осложнения и низкая острота зрения.
Однако, по данным вышеуказанных авторов, несмотря на положительный в анатомическом отношении результат, функциональные результаты оперативного лечения оставались низкими. Это можно объяснить травмой сетчатки во время субретинальных манипуляций и эндолазеркоагуляции в заднем полюсе глаза.
Обращает на себя внимание тот факт, что применение витрэктомии при удалении СМК сопровождается рядом таких серьезных интра- и послеоперационных осложнений, как появление новых субретинальных кровоизлияний, развитие массивного субретинального фиброза в 14 % развитие и прогрессирование послеоперационной ПВР, отслойки сетчатки в 36 %; образование макулярного разрыва в 6 % и др.
 Возможности хирургического лечения больных с СМК были расширены благодаря использованию рекомбинантного тканевого активатора плазминогена (ТАП). ТАП представляет собой тромболитический фермент, получение которого стало доступным благодаря возможностям рекомбинантной ДНК-технологии. ТАП вызывает специфический лизис сгустка, не оказывая системного эффекта. В офтальмологии эффективность применения ТАП была отмечена при лечении послеоперационного внутриглазного фибринообразования, тромбоза фильтрационной подушки после антиглаукоматозных операций, гифемы, тромбозах ретинальных сосудов.
Возможности хирургического лечения больных с СМК были расширены благодаря использованию рекомбинантного тканевого активатора плазминогена (ТАП). ТАП представляет собой тромболитический фермент, получение которого стало доступным благодаря возможностям рекомбинантной ДНК-технологии. ТАП вызывает специфический лизис сгустка, не оказывая системного эффекта. В офтальмологии эффективность применения ТАП была отмечена при лечении послеоперационного внутриглазного фибринообразования, тромбоза фильтрационной подушки после антиглаукоматозных операций, гифемы, тромбозах ретинальных сосудов.
Относительно применения ТАП в хирургическом лечении СМК было показано, что при его введении непосредственно в сгусток субретинальной крови в ходе выполнения витрэктомии происходит лизис фибрина, снижается адгезия кровяного сгустка к прилежащим тканям, что значительно облегчает его удаление, а это, по мнению некоторых авторов, способствует снижению травматичности оперативного вмешательства. Уменьшение адгезии субретинального сгустка крови к прилежащим тканям снижает дисперсию клеток пигментного эпителия сетчатки и ретинальной глии в витреальную полость, что, в свою очередь, уменьшает риск развития послеоперационной ПВР.
К первым сообщениям о применении ТАП для лизиса сгустка субретинальной крови относится работа Peyman G. et al. (1991), в которой авторы сообщают о применении ТАП в ходе витрэктомии по поводу СМК у 5 пациентов. Во всех случаях удалось лизировать сгусток крови, однако высокой остроты зрения достигнуто не было.
Haupert C. et al. (2004), отмечая 100-процентную анатомическую эффективность при удалении сгустка субретинальной крови после введения в него ТАП, в 27 % случаев констатируют развитие повторных СРК.
Исследование, проведенное Ibanez H. et al. (1995), посвящено сравнительному анализу результатов хирургического лечения больных с СМК и без использования ТАП. Результаты лечения были прослежены у 47 больных на 47 глазах. В 23 случаях производилось механическое удаление кровяного сгустка из-под сетчатки с помощью пинцета, а в 24 случаях для лизиса сгустка применялся ТАП. На основании проведенного анализа авторы делают вывод об отсутствии каких-либо преимуществ как в ходе операции, так и в послеоперационном периоде в группе пациентов с применением ТАП и без такового.
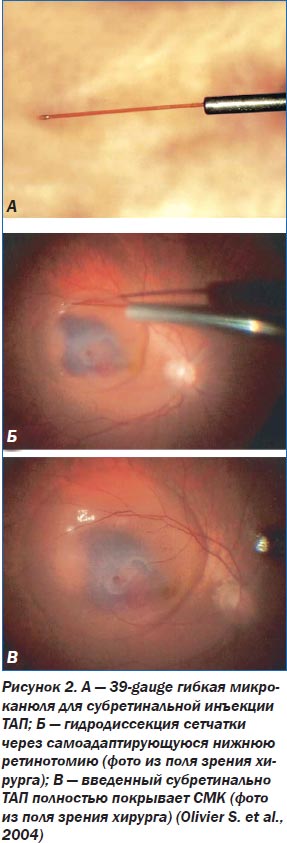
 Olivier S., Chow D., Packo K., MacCumber M., Awh C. (2004) сообщают об усовершенствованной методике хирургического лечения 28 глаз с СМК. После выполнения стандартной трехпортовой витрэктомии с помощью гибкой микроканюли 39-gauge (рис. 2А) книзу от СМК производилась самоадаптирующаяся ретинотомия. Через канюлю выполнялась гидродиссекция нейросенсорной ретины, то есть над областью СМК создавалась буллезная отслойка сетчатки путем введения раствора ТАП 125 мг/мл (рис. 2Б). Затем производилась замена жидкости на стерильный воздух. После операции пациентам рекомендовалось соблюдать положение головы вниз лицом для смещения крови из макулярной области до тех пор, пока не рассосется более 75 % воздуха.
Olivier S., Chow D., Packo K., MacCumber M., Awh C. (2004) сообщают об усовершенствованной методике хирургического лечения 28 глаз с СМК. После выполнения стандартной трехпортовой витрэктомии с помощью гибкой микроканюли 39-gauge (рис. 2А) книзу от СМК производилась самоадаптирующаяся ретинотомия. Через канюлю выполнялась гидродиссекция нейросенсорной ретины, то есть над областью СМК создавалась буллезная отслойка сетчатки путем введения раствора ТАП 125 мг/мл (рис. 2Б). Затем производилась замена жидкости на стерильный воздух. После операции пациентам рекомендовалось соблюдать положение головы вниз лицом для смещения крови из макулярной области до тех пор, пока не рассосется более 75 % воздуха.
Преимуществом предлагаемого метода авторы считают снижение травматичности операции для нейросенсорной ретины и ПЭС в связи с отсутствием субретинальных манипуляций. Кроме того, раствор ТАП полностью покрывает весь кровяной сгусток (рис. 2В), а не вводится в какую-то его часть, и используется в меньшей концентрации, что, как известно, снижает возможность его токсического воздействия. Кроме того, выполнение самоадаптирующейся ретинотомии книзу от СМК и создание отслойки нейросенсорной ретины в этой области создает потенциальное пространство для перемещения кровоизлияния в нижние отделы глазного дна. Воздушная эндотампонада в отличие от тампонады расширяющимися газами дает возможность в более ранние сроки после операции проводить диагностику и лечение предсуществующей патологии макулярной области. Однако авторы отмечают определенную травматичность вмешательства, требующего наличия дорогостоящего оборудования.
Эра интравитреальной анти-VEGF-фармакотерапии открыла новые возможности в лечении СМК, осложнивших течение экссудативной формы ВМД. По данным литературы, в том числе мультицентровых исследований ведущих клиник Европы, интравитреальное применение анти-VEGF-препаратов зарекомендовало себя как безопасный и эффективный метод лечения хориоидальной неоваскуляризации при ВМД, неоваскуляризации при пролиферативной диабетической ретинопатии, а также другой этиологии, что доказано результатами многочисленных исследований.
Бевасизумаб (Avastin™) представляет собой полноразмерное гуманизированное антитело против всех изоформ эндотелиального фактора роста сосудов.
В 2005 году американские исследователи Rosenfeld P., Puliafito C. сообщили о первом опыте применения бевасизумаба у пациентов с экссудативной формой ВМД, у которых, несмотря на предшествующее проведение ФДТ или лечение макугеном, наблюдалось прогрессирующее снижение остроты зрения. О безопасности бевасизумаба при перфузии культуры бычьей сетчатки in vitro сообщают Luke M. et al. (2007). При одновременном применении 20 мг/мл ТАП и 0,25 мг/мл бевасизумаба признаки ретинальной токсичности при регистрации электроретинограммы не определялись.
Shah S. et al. (2009) сообщают об успешном комбинированном субмакулярном введении анти-VEGF-препарата и ТАП во время витрэктомии по поводу массивного СМК при ВМД у двух пациентов.
В январе 2010 года British Journal of Ophthalmology опубликовал статью немецких офтальмохирургов Treumer F., Klatt C., Roider J., Hillenkamp J. о сочетанном субретинальном применении ТАП и бевасизумаба у 12 пациентов в ходе витрэктомии по поводу экссудативной формы ВМД, осложненной СМК. Всем пациентам были выполнены стандартная 3-портовая витрэктомия с удалением задней гиалоидной мембраны, субретинальное введение через гибкую канюлю 41-gauge 10–20 мг ТАП, растворенного в 0,05–0,10 мл раствора BSS, и 1,25 мг бевасизумаба (Avastin™, Roche, Basel, Switzerland), разведенного в 0,05 мл раствора BSS, газовая тампонада 20% SF6. После операции пациенты сохраняли вынужденное положение головы вниз лицом в течение суток. Полного смещения крови из субмакулярной области удалось достичь у 9 из 12 пациентов. Через 4 недели после вмешательства повышение остроты зрения авторы наблюдали у 8 пациентов. Через 12 недель острота зрения улучшилась у 10 пациентов. Через 4 и 8 недель после операции пациентам производились интравитреальные инъекции бевасизумаба (1,25 мг). Среди интраоперационных осложнений авторы отмечали разрыв ПЭС (1 пациент) и образование макулярного разрыва (1 случай).
 В 1996 году на ежегодном заседании Американской академии офтальмологии австралийским хирургом W. Heriot сделано первое сообщение о возможности смещения субретинального кровоизлияния из макулярной области с помощью интравитреального введения ТАП и перфлюорокарбонового газа. Это позволило уменьшить травматичность вмешательства, снизить риск возникновения осложнений, связанных с выполнением витрэктомии. Однако применявшаяся доза ТAП (100 мкг/0,1 мл) оказывала токсическое воздействие на сетчатку, вплоть до развития некротических дефектов и острого некроза сетчатки.
В 1996 году на ежегодном заседании Американской академии офтальмологии австралийским хирургом W. Heriot сделано первое сообщение о возможности смещения субретинального кровоизлияния из макулярной области с помощью интравитреального введения ТАП и перфлюорокарбонового газа. Это позволило уменьшить травматичность вмешательства, снизить риск возникновения осложнений, связанных с выполнением витрэктомии. Однако применявшаяся доза ТAП (100 мкг/0,1 мл) оказывала токсическое воздействие на сетчатку, вплоть до развития некротических дефектов и острого некроза сетчатки.
В последующем методика, предложенная W. Heriot, была несколько модифицирована путем снижения дозы вводимого интравитреально ТAП до 25–50 мкг/0,1 мл. Следует отметить, что из-за высокого риска повторных кровоизлияний интравитреальное введение ТАП рекомендуется проводить не ранее, чем спустя трое суток с момента кровоизлияния. Тем не менее и при соблюдении необходимых доз и сроков введения ТАП в послеоперационном периоде наблюдалось развитие гемофтальма, что авторы связывали с применением ТAП.
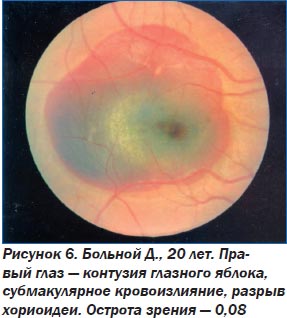
Kokame G. описывает 2 случая лечения СМК вследствие разрыва ретинальных макроаневризм с помощью интравитреального введения ТАП и перфлюорокарбонового газа SF6. В обоих случаях на следующий день после вмешательства автор наблюдал развитие массивного гемофтальма, по поводу которого пациентам была произведена витрэктомия. На развитие гемофтальма в послеоперационном периоде после пневматической дислокации СМК с применением ТАП указывают также Tsai S. et al., Ratanasukon M. et al., Olivier S. et al. Кровоизлияние в СТ авторы связывают именно с применением ТАП.
Tsai S. et al. в 20 % случаев отмечают неполное смещение кровоизлияния из макулярной области, а также ухудшение послеоперационной остроты зрения в 1 из 15 случаев. Ratanasukon M. et al. указывают на развитие отслойки сетчатки в послеоперационном периоде в 2 из 19 случаев. О развитии отслойки сетчатки после пневматической дислокации СМК сообщают также Hejny C., Sternberg P.
Chen S. et al. (2003) сообщают о таком серьезном осложнении, как токсическое воздействие ТАП на сетчатку, которое отмечено ими в двух случаях интравитреального введения ТАП и пневматической дислокации СМК.
Такое грозное осложнение, как эндофтальмит, развившийся после интравитреального введения ТАП и пневматической дислокации СМК, описано Vote В. et al. (2004). В ряде случаев в позднем послеоперационном периоде имело место развитие дистрофических и атрофических изменений в макулярной области, наблюдавшееся в случае смещения СМК в зону папилло-макулярного пучка. Кроме того, в некоторых случаях применение этой методики не сопровождалось предполагаемым эффектом дислокации СМК.
 До конца не выясненным остается вопрос о способности ТАП проникать из стекловидного тела в субретинальное пространство через интактную сетчатку. Данные экспериментальных исследований, проведенные Kamei с соавторами, свидетельствуют о том, что ТАП, меченный флюоресцеина изотиоцианатом и введенный интравитреально, в субретинальное пространство кроликов не проникает.
До конца не выясненным остается вопрос о способности ТАП проникать из стекловидного тела в субретинальное пространство через интактную сетчатку. Данные экспериментальных исследований, проведенные Kamei с соавторами, свидетельствуют о том, что ТАП, меченный флюоресцеина изотиоцианатом и введенный интравитреально, в субретинальное пространство кроликов не проникает.
В 1998 Ohji M. et al. сообщили о возможности дислокации СМК из макулярной области с помощью интравитреального введения перфторпропана без применения ТАП.
О применении пневматической дислокации СМК как самостоятельного метода лечения сообщали также Daneshvar H. et al., Manesh G. et al., Yang P. et al. Представленные ими случаи единичны. Кроме того, в ряде случаев авторы отмечали фрагментацию СМК, часть которого не удавалось сместить из макулярной области. В некоторых случаях наблюдалась дислокация СМК в зону папилло-макулярного пучка.
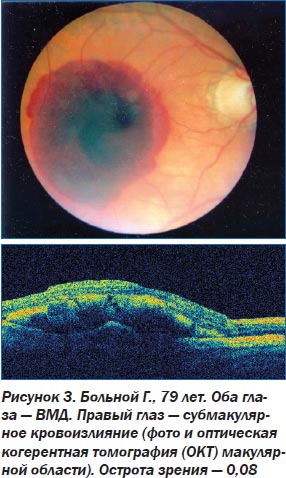
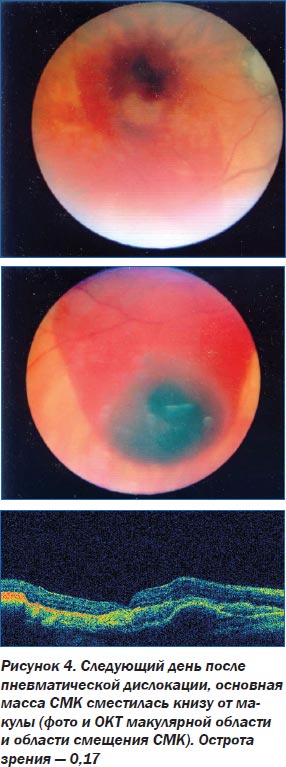
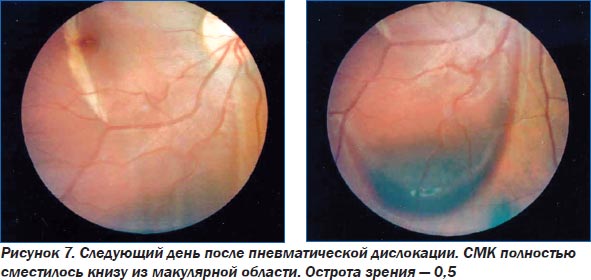
С 2001 года мы используем собственную методику пневматической дислокации СМК без применения ТАП, суть которой заключается в следующем. После общепринятой предоперационной подготовки больного, местной инстилляционной анестезии и пальцевого массажа глазного яблока интравитреально в полость стекловидного тела вводится 0,4–0,6 мл 100% перфлюоропропана (С3F8), после чего пациенту рекомендуется соблюдать наклонное кпереди положение головы под углом 45° на протяжении 1–3 дней для обеспечения дислокации субретинального кровоизлияния единой массой без фрагментации (патент Украины № 55160 А).
К настоящему времени эффективность предложенной нами методики доказана при лечении 95 пациентов с субмакулярными кровоизлияниями различной этиологии. Модифицированный нами способ пневматической дислокации СМК позволил в 95,8 % случаев достичь эвакуации субретинальной крови из макулярной области в нижние отделы глазного дна с повышением остроты зрения > 0,2 в 62,5 % случаев уже на следующий день после оперативного вмешательства. Положительный эффект пневматической дислокации СМК обусловлен быстрым смещением крови из субретинального пространства макулярной области, что предотвращает токсическое воздействие ионов железа крови на фоторецепторы центральной зоны сетчатки, устраняет механический барьер, препятствующий осуществлению нормальных метаболических процессов, позволяет избежать механического повреждения фоторецепторов и тем самым предупреждает необратимую потерю центрального зрения. Сравнивая полученные нами данные с данными литературы, следует отметить более высокую эффективность примененного нами способа, а также отсутствие осложнений.
1. Асланова В.С., Красновид Т.А. Субмакулярные кровоизлияния. Клиника, диагностика, лечение. — Одесса: Астропринт, 2010. — 176 с.
2. Асланова В.С., Красновид Т.А. Эффективность пневматической дислокации субмакулярных кровоизлияний травматической этиологии без ТАП // Материалы юбилейной конференции «Поражения органа зрения», посвященной 190-летнему юбилею основания кафедры офтальмологии Воен.-мед. академии. — Санкт-Петербург, 2008. — С. 16-17.
3. Вит В.В. Строение зрительной системы человека. — Одесса: Астропринт, 2003. — 664 с.
4. Гундорова Р.А., Малаев А.А., Южаков А.М. Травмы глаза. — М.: Медицина, 1986. — 368 с.
5. Думброва Н.Е., Асланова В.С., Молчанюк Н.И. Ультраструктурные исследования сетчатки кроликов при экспериментально моделированном субретинальном кровоизлиянии и его пневматической дислокации // Проблеми екологічної та медичної генетики і клінічної імунології. — 2005. — Вип. 2(65). — № 2. — С. 153-160.
6. Красновид Т.А., Родин С.С., Асланова В.С. Сравнительная оценка эффективности лечения посттравматических субмакулярных кровоизлияний // Офтальмол. журн. — 2003. — № 2. — С. 6-9.
7. Логай І.М., Родін С.С., Красновид Т.А., Асланова В.С. Спосіб хірургічного лікування субмакулярних крововиливів // Патент України 55160А від 17.03.2003. — Бюл. № 3.
8. Линник Л.Ф., Касмынин И.Р. Создание экспериментальной модели субретинальных кровоизлияний // Экспериментальные исследования в офтальмологии. — 1986. — С. 120-122.
9. Линник Л.Ф., Касмынин И.Р. К вопросу о хирургических методах удаления субретинальных кровоизлияний // Актуальные проблемы хирургии хрусталика, стекловидного тела и сетчатки. — М.: Москва, 1986. — С. 145-147.
10. Родин С.С., Асланова В.С. Бевасизумаб (авастин) в комплексном хирургическом лечении больных с пролиферативной стадией диабетической ретинопатии // Український медичний альманах. — 2008. — Т. 11, № 3. — С. 126-128.
11. Родин С.С., Асланова В.С., Красновид Т.А. Эффективность пневматической дислокации субмакулярных кровоизлияний различной этиологии без тканевого активатора плазминогена // Офтальмохирургия. — 2008. — № 2 (спецвып). — С. 14-19.
12. Ципурская С.С., Бабич Г.А., Киваев А.А., Балашанская Т.И., Розенфельд И.А. Кровоизлияния при миопии (по клиническим и флюоресцентно-ангиографическим данным) // Вестник офтальмологии. — 1989. — Т. 105, № 5. — С. 61-64.
13. Шевалев В.Е., Бабанина Ю.Д. Оперативное лечение отслойки сетчатой оболочки. — М.: Медицина, 1965. — 143 с.
14. Шершевская Р.Ф., Шерин О.И., Чавдар Н.И. К вопросу о геморрагических изменениях желтого пятна при миопической болезни // Тезисы докладов III Всерос. съезда офтальмологов. — Москва, 1975. — Т. 2. — С. 115-117.
15. Axer-Siegel R., Ehrlich R., Rosenblatt I. et al. Photodynamic therapy for occult choroidal neovascularization with pigment epithelium detachment in age-related macular degeneration // Arcn Ophthalmol. — 2004. — Vol. 122. — P. 453-459.
16. Agnelli G., Buchanan M.R., Fernendez F. et al. A comparison of trombolytic and hemorrhagic effects of tissue-type plasminogen activator and streptokinase in rabbits // Circulation. — 1985. — Vol. 72. — P. 178-182.
17. Aslanova V. An atraumatic method of submacular hemorrhage management // 9th EVRS Meeting. — Marrakesh: Abstract Book, 2009. — P. 190.
18. Avery R., Fekrat S., Hawkins B., Bressler N. Natural history of subfoveal subretinal hemorrhage in age-related macular degeneration // Retina. — 1996. — Vol. 16. — P. 133-139.
19. Baeteman C., Hoffart L., Galland F., Ridinags B., Conrath J. Subretinal hemorrhage after intravitreal injection of anti-VEGF for age-related macular degeneration: a retrospective study // J. Fr. Ophthalmol. — 2009. — Vol. 32(5). — P. 309-313.
20. Beck A. et al. Subretinal hemorrhage associated with cytomegalovirus retinitis in a patient without concurrent thrombocytopenie // Retina. — 2004. — Vol. 24, № 4. — P. 611-613.
21. Benner J., Hay A., Landers M., 3rd, Hjelmeland L., Morse L. Fibrinolytic-assisted removal of experimental subretinal hemorrhage within sevendaysreducesouter retinal degeneration // Ophthalmology. — 1994. — Vol. 101. — P. 672-681.
22. Berrocal M. Preoperative Bevacizumab in the Surgical Management of TRD and T + RRD // Retina Today. — 2009. — Vol. 4, № 1. — P. 70-72.
23. Brent B., Gonce M., Diamond J. Pars plana vitrectomy for complications of retinal arterial macroaneurysms — a case series // Ophthalmic Surg. — 1993. — Vol. 24. — P. 534-536.
24. Brown G., Tasman W., Shields J. Massive subretinal hemorrhage and anticoagulant therapy // Can. J. Ophthalmol. — 1982. — Vol. 17. — P. 227-230.
25. Chan W., Kwok A., Liu D., Choi P., Lam S., Lam D. Hemorrhagic complication in an unsuspected macular choroidal melanoma // Am. J. Ophthalmol. — 2004. — Vol. 137, № 3. — P. 574-577.
26. Collen D., Stassen J., Marafino B. et al. Biological properties of human tissue-type plasminogen activator obtained by expression of recombinant DNA in mammalian cells // J. Pharmacol. Exp. Ther. — 1984. — Vol. 231. — P. 146-152.
27. Collen D., Lijnen H. Tissue-type plasminogen activator: mechanism of action and trombolytic properties // Haemostasis. — 1986. — Vol. 16 (suppl). — P. 25-32.
28. Do D., Bressler N., Bressler S. Large submacular hemorrhage after verteporfin therapy // Am. J. Ophthalmol. — 2004. — Vol. 137, № 3. — P. 558-560.
29. Friedman S., Mames R., Stewart M. Subretinal hemorrhage after grid laser photocoagulation for idiopathic juxtafoveolar retinal telangiectasis // Ophthalmic. Surg. — 1993. — Vol. 24. — P. 551-553.
30. Fung A., Rosenfeld P., Reichel E. The International Intravitreal Bevacizumab Safety Survey: using the internet to assess drug safety worldwide // Br. J. Ophthalmol. — 2006. — Vol. 90. — P. 1344-1349.
31. Goverdhan S., Lochhead J. Submacular haemorrhages after intravitreal bevacizumab for large occult choroidal neovascularisation in age-related macular degeneration // British Journal of Ophthalmology. — 2008. — Vol. 92. — P. 210-212.
32. Hassan A., Johnson M., Schneiderman T. et al. Management of submacular hemorrhage with intravitreous tissue plasminogen activator injection and pneumatic displacement // Ophthalmology. — 1999. — Vol. 106. — P. 1900-1906.
33. Hejny C., Sternberg P. Jr. Retinal detachment after pneumatic displacement for subfoveal hemorrhage // Retina. — 2001. — Vol. 21. — P. 260-262.
34. Hoh H., Palmowski A. Central subretinal hemorrhage from a retinal arterial macroaneurysm — two-step treatment with laser and vitreoretinal surgery // Ger. J. Ophthalmol. — 1992. — Vol. 1. — P. 335-337.
35. Holland D., Wiechens B. Intravitreal r-TPA and gas injection in traumatic submacular hemorrhage // Ophthalmologica. — 2004. — Vol. 218. — P. 64-69.
36. Hoops J., Buhl M., Scheider M. Retinal macroaneurisms: clinical signs, therapy and outcome in 17 patients // 97th DOG Annual Meeting Abstract Book. — 1999. — P. 451.
37. Hrach C., Johnson M., Hassan A., Lei B., Sieving P., Elner V. Retinal toxicity of commercial intravitreal tissue plasminogen activator solution in cat eyes // Arch. Ophthalmol. — 2000. — Vol. 118. — P. 659-663.
38. Humphrey W., Schepens C., Elzeneiny I., Moura R. The release of subretinal fluid and its complications // Retina Congress. — New York, 1972. — P. 383.
39. Humayun M., Lewis H., Flynn H. Jr., Sternberg P. Jr., Blumenkranz M. Management of submacular hemorrhage associated with retinal arterial macroaneurysms // Am. J. Ophthalmol. — 1998. — Vol. 126. — P. 358-361.
40. Johnson M. Pneumatic displacement of submacular hemorrhage // Curr. Opin. Ophthalmol. — 2000. — Vol. 11. — P. 201-206.
41. Kamei M., Misono K., Lewis H. A study of ability of tissue plasminogen activator to diffuse into the subretinal space after intravitreal injection in rabbits // Am. J. Ophthalmol. — 1999. — Vol. 128. — P. 739-746.
42. Kamei M., Tano Y. Tissue plasminogen activator-assisted vitrectomy: surgical drainage of submacular hemorrhage // Dev. Ophthalmol. — 2009. — Vol. 44. — P. 82-88.
43. Kokame G. Vitreous hemorrhage after intravitreal tissue plasminogen activator (t-PA) and pneumatic displacement of submacular hemorrhage // Am. J. Ophthalmol. — 2000. — Vol. 129. — P. 546-547.
44. Kyoko O., Mariko I., Takahiro M. Pneumatic displacement was effective in a case of submacular hemorrhage // Japanese Journal of Clinical Ophthalmology. — 1999. — Vol. 53, № 12. — P. 1883-1889.
45. Manesh G., Giridhar A., Saikumar S., Elias A. Intravitreal gas for submacular hemorrhage // Indian J. Ophthalmol. — 2003. — Vol. 51, № 4. — P. 349-350.
46. Mandelcorn M., Menezes A. Surgical removal of subretinal hemorrhage and choroidal neovascular membranes in acute hemorrhagic age-related macular degeneration // Can. J. Ophthalmol. — 1993. — Vol. 28. — P. 19-23.
47. Millsap C., Peyman G., Greve M. Subretinal hemorrhage removal with multiple retinotomy sites in age — related macular degeneration // Ophthalmic Surg. — 1994. — Vol. 25. — P. 723-725.
48. Nasrallah F., Jalkh A., Trempe C., McMeel J., Schepens C. Subretinal hemorrhage in atrophic age-related rnacular degeneration // Am. J. Ophthalmol. — 1989. — Vol. 107. — P. 38-41.
49. Ohji M., Saito Y., Hayashi A., Lewis J., Tano Y. Pneumatic displacement of subretinal hemorrhage without tissue plasminogen activator // Arch. Ophthalmol. — 1998. — Vol. 116. — P. 1326-1332.
50. Olivier S., Chow D., Packo K., MacCumber M., Awh C. Subretinal recombinant tissue plasminogen activator injection and pneumatic displacement of thick submacular hemorrhage in age-related macular degeneration // Ophthalmology. — 2004. — Vol. 111, № 6. — P. 1201-1208.
51. Pathengay A., Malhotra S., Das T. Pneumatic displacement of subretinal hemorrhage followed by transpupillary thermotherapy of choroidal neovascular membrane secondary to multifocal choroiditis // Eye. — 2005. — Vol. 19. — P. 929-931.
52. Rosenfeld P., Moshfeghi A., Puliafito C. Optical coherence tomography findings after an intravitreal injection of bevacizumab (Avastin) for neovascular age-related macular degeneration // Ophthalmic Surg. Lasers Imaging. — 2005. — Vol. 36. — P. 331–335.
53. Recchia F., Greenbaum S., Recchia C. et al. Self-reported acute decrease in visual acuity after photodynamic therapy for age-related macular degeneration // Retina. — 2006. — Vol. 26. — P. 1042-1048.
54. Rubsamen P., Flynn H. Jr., Civantos J. et al. Treatment of massive subretinal hemorrhage from complications of scleral buckling procedures // Am. J. Ophthalmol. — 1994. — Vol. 118. — P. 299-303.
55. Schneiderman T., Kalina R. Subretinal hemorrhage precedes development of angioid streaks // Arch. Ophthalmol. — 1994. — Vol. 112. — P. 1622-1623.
56. Shah S., Hubschman J., Gonzales C., Schwartz S. Submacular combination treatment for management of acute, massive submacular hemorrhage in age-related macular degeneration // Ophthalmic Surg. Lasers Imaging. — 2009. — Vol. 40(3). — P. 308-315.
57. Slusher M.M. Evacuation of submacular hemorrhage: technique and timing // Vitreoretinal surgery and technology. — 1989. — Vol. 2. — P. 3-8.
58. Steinhorst U., Theischen M., Winter R. Subretinal lavage: a technique of continuous subretinal irrigation for removal of traumatic submacular hemorrhage // Ophthalmologica. — 1997. — Vol. 211. — P. 399-401.
59. Toth C., Morse L., Hjelmeland L., Landers M. Fibrin directs early retinal damage after experimental subretinal hemorrhage // Arch. Ophthalmol. — 1991. — Vol. 109. — P. 723-729.
60. Treumer F., Klatt C., Roider J., Hillenkamp J. Subretinal coapplication of recombinant tissue plasminogen activator and bevacizumab for neovascular age-related macular degeneration with submacular haemorrhage // British J. Ophthalmol. — 2010. — Vol. 94. — P. 48-53.
61. Tsai S., Lin J., Chen H. Intravitreous recombinant tissue plasminogen activator and gas to treat submacular hemorrhage in age-related macular degeneration // Kaohsiung J. Med. Sci. — 2003. — Vol. 19, № 12. — P. 608-616.
62. Vander J., Federman J., Greven C., Slusher M., Gabel V. Surgical removal of massive subretinal hemorrhage associated with age — related macular degeneration // Ophthalmology. — 1991. — Vol. 98. — P. 23-27.
63. Vander J. Tissue plasminogen activator irrigation to facilitate removal of subretinal hemorrhage during vitrectomy // Ophthalmic Surg. — 1992. — Vol. 23. — P. 361-363.
64. Vote B., Buttery R., Polkinghorne P. Endophthalmitis after intravitreal injection of frozen preprepared tissue plasminogen activator (tPA) for pneumatic displacement of submacular hemorrhage // Retina. — 2004. — Vol. 24, № 5. — P. 808-809.
65. Wade E., Flynn H., Jr., Olsen K., Blumenkranz M., Nicholson D. Subretinal hemorrhage management by pars plana vitrectomy and internal drainage // Arch. Ophthalmol. — 1990. — Vol. 108. — P. 973-978.
66. Weinberg R., Nerney J. Bilateral submacular hemorrhage associated with an influenza syndrome // Ann. Ophthalmol. — 1983. — Vol. 15, № 8. — P. 710-712.
67. Yeh P., Yang C., Lin Y. et al. Bevacizumab pretreatment in vitrectomy with silicone oil for severe diabetic retinopathy // Retina. — 2009. — Vol. 29, № 6. — P. 768-774.
