Газета «Новости медицины и фармации» Кардиология (412) 2012 (тематический номер)
Вернуться к номеру
Ацетилсалициловая кислота у пациентов с высоким риском тромботических осложнений
Авторы: А.Н. Беловол, член-корр., д.м.н., профессор, И.И. Князькова, д.м.н., доцент кафедры внутренней медицины № 1 и клинической фармакологии Харьковского национального медицинского университета
Версия для печати
Сердечно-сосудистые заболевания справедливо называют эпидемией XXI века. По данным Всемирной организации здравоохранения [1], в 2008 году от ССЗ умерло 17,3 млн человек, что составило 30 % всех случаев смерти в мире. Из этого числа 7,3 млн человек умерло от ишемической болезни сердца (ИБС) и 6,2 млн человек — в результате инсульта. Прогнозируется, что к 2030 году около 23,6 млн человек умрет от ССЗ, главным образом от болезней сердца и инсульта, которые, по прогнозам, останутся единственными основными причинами смерти. Наблюдается устойчивая тенденция к «омоложению» сердечно-сосудистой смертности. У лиц молодого возраста развитие артериальных тромбозов обусловлено в первую очередь нарушениями тромбоцитарного гемостаза [2]. Важным фактором сохранения нормальной работы сердечно-сосудистой системы является своевременное предупреждение острых кардиологических состояний путем раннего и достоверного определения возможных рисков патологических изменений миокарда. В клинической практике для блокирования процессов тромбоцитарной агрегации широкое применение получили аспирин, блокаторы гликопротеиновых рецепторов IIb/IIIa (абциксимаб, эптифибатид, монафрам) и клопидогрель [3]. В данной статье рассмотрены клинические данные по применению АСК у пациентов с высоким риском развития тромботических осложнений.
История применения АСК уходит своими корнями в глубокую древность. Ассирийцы и египтяне были хорошо осведомлены об обезболивающем эффекте отвара мирта и листьев ивы при болях в суставах [4]. Со времен Гиппократа, Цельса и Галена известно о применении в качестве жаропонижающих и анальгезирующих лекарств из коры ивы [5]. В 1838 году итальянский химик Рафаэль Пирию обнаружил активный ингредиент коры ивы — салициловую кислоту [6]. Однако лишь в 1897 году Феликс Хоффман, работавший в фармацевтической компании Bayer, синтезировал ацетилированную форму салициловой кислоты, которая получила название «аспирин» и стала наиболее широко используемым препаратом всех времен [7]. Благодаря исследованиям британского фармаколога Джона Вейна, установившего, что основной механизм действия связан с ингибированием синтеза простагландинов, с 1971 года аспирин стали применять для профилактики сердечно-сосудистых заболеваний. В 1982 году за свое открытие Джон Вейн получил Нобелевскую премию в области медицины. Королева Великобритании Елизавета II посвятила Вейна в рыцари.
Последующие клинические и экспериментальные исследования показали, что АСК необратимо ацетилирует гидроксильную группу остатка серина в положении 529 (семенные пузырьки барана) или остатка серина в положении 530 (человеческие тромбоциты) в молекуле циклооксигеназы-1 (ЦОГ-1) тромбоцитов, вследствие чего блокируется синтез простагландинов G2/H2, являющихся предшественниками мощного вазоконстриктора и индуктора агрегации тромбоцитов — тромбоксана А2 [8]. Это первая реакция в серийном преобразовании арахидоновой кислоты в мощный агонист тромбоцитов тромбоксан А2, которая объясняет эффективность АСК у больных с ИБС и мозговым инсультом [9]. Помимо снижения синтеза тромбоксана, прием АСК приводит к уменьшению образования простациклина — вещества с вазодилатирующим и дезагрегационным эффектами [10]. Нарушение секреции простациклина в результате действия АСК весьма нежелательно. Однако в отличие от безъядерных тромбоцитов эндотелиальные клетки способны синтезировать активную ЦОГ-1 и делают это постоянно, даже на фоне действия АСК. Для полного восстановления активности ЦОГ-1 в эндотелии требуется 3–6 часов [11].
Следует подчеркнуть, что АСК ингибирует ЦОГ-1 в тромбоцитах при их прохождении через печень. Здесь же АСК почти полностью инактивируется, поэтому лишь следовые ее количества попадают в системный кровоток. АСК применяется в качестве антиагреганта в небольших дозах, а ее распределение по всему организму при этом весьма ограничено. Период полувыведения АСК составляет всего 15–20 минут, что укорачивает длительность ее контакта с организмом [12]. Риск снижения продукции простациклина в эндотелии под влиянием аспирина минимален, особенно при применении низких доз препарата.
Установлено, что АСК характеризуется многообразием эффектов, что существенно отличает этот препарат от других антиагрегантных средств. Отмечено, что антитромботический эффект АСК включает воздействие на формирование фибриногена и процесс фибринолиза. АСК ацетилирует остатки лизина в молекуле фибриногена и таким образом препятствует их окислению. Измененный фибриноген не может превратиться в фибрин и вызвать образование тромба [13]. Кроме того, ацетилирование остатков лизина, которые в норме стабилизируют сеть из элементов фибрина, способствует растворению тромба [14]. Более того, АСК вызывает образование более толстых нитей фибрина и сетей с более крупными порами. Это дает положительный эффект у больных с сердечно-сосудистыми заболеваниями, для которых характерно наличие плотных фибриновых сгустков. Кроме того, увеличение пор облегчает доступ к фибриновым нитям активаторов плазминогена, вызывающих их растворение [14]. АСК подавляет образование тромбина, который катализирует превращение фибриногена в фибрин [15]. Показано, что высокие дозы аспирина могут оказывать как угнетающий, так и стимулирующий эффект на фибринолиз, причем фибринолитический эффект доминирует [16].
АСК подавляет как экспрессию генов, вовлеченных в активацию воспалительных процессов, так и активацию провоспалительных цитокинов (фактора некроза опухоли a (NK-kB) и интерлейкина-1b) [17], а также нормализует уровень С-реактивного белка [18]. Это имеет большое значение, так как воспалительные процессы повышают риск разрыва атеросклеротических бляшек и тромбообразования [19]. Кроме того, антиоксидантное действие АСК способствует стабилизации атеросклеротических бляшек [20]. Отмечено, что АСК и ее метаболиты способствуют защите эндотелия от продуктов перекисного окисления, в частности от ОН-радикалов [20]. Также АСК влияет на синтез витамина К в печени, разобщает окислительное фосфорилирование, истощает запасы АТФ, блокирует продукцию внеклеточного аденозина [21]. По мнению ряда исследователей, эти свойства АСК не менее значимы, чем ее влияние на агрегацию тромбоцитов [22].
Эффект аспирина наиболее выражен, когда тромбоциты находятся в состоянии гиперактивности, т.е. имеют повышенную склонность к агрегации. Инфаркт миокарда (ИМ) или разрыв атеросклеротической бляшки — типичные состояния, при которых тромбоциты активируются [23]. Уровень тромбоксана А2 в плазме после этих событий может оставаться повышенным в течение двух лет [24]. Значительно усиливает агрегацию тромбоцитов курение [25].
Доказательная база применения АСК в настоящее время одна из наиболее больших и мощных. Назначение АСК приводит к снижению частоты ИМ и инсультов (как повторных, так и первичных), риска тромбоэмболических осложнений и смертности от сердечно-сосудистых причин. Причем АСК не влияет на клинические проявления стенокардии и прогрессирование атеросклероза. Подавление функции тромбоцитов сопровождается, по-видимому, угнетением тромбообразования, что проявляется уменьшением частоты тромботических осложнений атеросклероза.
Показания к назначению АСК:
— острая стадия ИМ;
— больные с постинфарктным кардиосклерозом;
— нестабильная и стабильная стенокардия;
— коронарная реваскуляризация;
— транзиторные ишемические атаки и инсульты по ишемическому типу в анамнезе;
— острая фаза ишемического инсульта;
— наличие мерцательной аритмии;
— больные с облитерирующими заболеваниями периферических артерий;
— наличие тромбозов глубоких вен;
— после пересадки искусственных клапанов.
Первые данные о возможном противотромботическом действии АСК были получены в середине ХХ столетия. У людей с повышенным риском сердечно-сосудистых заболеваний L. Craven [26] наблюдал уменьшение частоты возникновения ИМ при ежедневном употреблении АСК в дозах от 250 до 750 мг в сутки. Позднее он предположил, что АСК может также предотвращать мозговой тромбоз. По мере развития понимания патофизиологических механизмов тромботической окклюзии кровеносных сосудов и значения функции тромбоцитов в патогенезе атеросклероза и тромбоза сосудов рос научный интерес к использованию АСК при этих заболеваниях. С тех пор как статистически было установлено, что регулярное употребление АСК связано со снижением вероятности возникновения ИМ [27], было проведено множество клинических исследований, несомненно доказавших эффективность АСК в предотвращении тромбоэмболических осложнений.
Первое большое рандомизированное плацебо-контролируемое исследование эффективности АСК для профилактики повторных инфарктов миокарда было проведено в начале 1970-х годов [28]. Это было многоцентровое исследование, включавшее 1239 больных в возрасте до 65 лет с подтвержденным ИМ, которым назначалась АСК 300 мг в сутки (n = 615) либо плацебо (n = 624) в течение максимум 2 лет (в среднем 18 месяцев). В течение периода наблюдения в группе плацебо умер 61 больной, а в группе принимавших АСК было только 47 смертельных исходов. После 6 месяцев лечения общий уровень смертности среди больных, принимавших АСК, был на 12 % ниже, чем в контрольной группе. Через 12 месяцев эта разница в пользу группы больных, принимавших АСК, была еще более выражена и составляла 25 %.
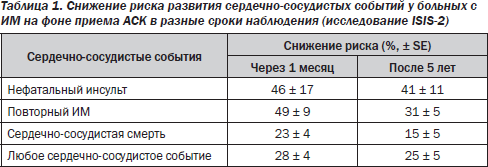
В рандомизированном плацебо-контролируемом исследовании ISIS-2 (Second International Study of Infarct Survival) [29] изучена эффективность АСК в острой фазе ИМ. В исследование вошли 17 187 больных ИМ с подъемом сегмента ST, которые в первые 24 часа от развития симптомов были рандомизированы к терапии АСК — 162,5 мг/сут, стрептокиназы — 1,5 млн ЕД, их комбинации либо плацебо. Через 35 дней наблюдения отмечено достоверное снижение сердечно-сосудистой смертности на 23 %, частоты повторных ИМ — на 49 % и частоты ишемических инсультов — на 46 %. При этом риск развития серьезных кровотечений, в т.ч. геморрагических инсультов, не увеличивался. Наиболее оптимальным было сочетание АСК с тромболитиком, снижавшее показатели смертности на 42 % по сравнению с группой плацебо. Снижение абсолютного риска развития серьезных сосудистых событий у больных острым ИМ, получавших АСК в течение 1 месяца, составило 38 на 1000 пролеченных больных, что является основой современных рекомендаций, в соответствии с которыми всем пациентам с подозрением на ИМ (ИМ с элевацией сегмента ST) следует назначать АСК в дозе 162–325 мг. С формальной точки зрения результаты этого исследования относятся и к больным без подъемов сегмента ST, т.к. исследование выполнялось по широким критериям, для включения требовалось лишь наличие подозрения на ИМ. Дальнейшее наблюдение за пациентами продемонстрировало сохранение достигнутого в первый месяц увеличения выживаемости и в последующие годы (табл. 1) [30].
Продемонстрировано, что подобно результатам больных ИМ с элевацией сегмента ST, АСК имеет существенные преимущества в качестве вторичной профилактики у пациентов с нестабильным коронарным синдромом (нестабильная стенокардия/ИМ без подъема сегмента ST). В 4 клинических исследованиях [31–34] с участием пациентов с нестабильной стенокардией/ИМ без подъема сегмента ST доказана эффективность АСК в снижении риска смерти или рецидива ИМ на 50 % и более. Отмеченные преимущества привели к тому, что в 1985 году FDA (Food and Drug Administration) одобрило применение АСК и для лечения и вторичной профилактики острого ИМ.
В 2002 г. Antithrombotic Trialists’ Collaboration (АТТ) опубликовало крупнейший метаанализ рандомизированных клинических исследований по оценке эффективности и безопасности применения АСК и других антиагрегантов у пациентов с высоким риском развития сердечно-сосудистых осложнений [35]. В метаанализ вошло 287 исследований с участием 212 тысяч пациентов с высоким риском развития осложнений, включая острый коронарный синдром с подъемом и без подъема сегмента ST на электрокардиограмме, хроническую стабильную стенокардию, ишемический инсульт, периферический атеросклероз, а также артериальную гипертензию, сахарный диабет и другие серьезные факторы риска развития сердечно-сосудистых заболеваний. Продемонстрировано, что назначение АСК как антиагреганта указанной категории больных позволяет снизить риск развития серьезных сердечно-сосудистых осложнений (нефатальный ИМ + нефатальный инсульт + смертность от сердечно-сосудистых заболеваний) на 22 % (р < 0,0001). Так, у больных, перенесших ИМ, назначение АСК на протяжении 27 месяцев позволяет предотвратить 37 серьезных сердечно-сосудистых эпизодов, в том числе 18 повторных нефатальных ИМ, 14 смертей от сердечно-сосудистых причин и 5 нефатальных инсультов, на каждую 1000 леченых пациентов. Терапия АСК в дозе 75–150 мг/сут ассоциировалась с 32% снижением риска сосудистых событий.
По данным метаанализа [35], включавшего 12 рандомизированных клинических исследований, в которых принимали участие более 5 тысяч пациентов с нестабильной стенокардией, назначение АСК сопровождается достоверным снижением риска серьезных сердечно-сосудистых осложнений на 46 % (p < 0,0001). Эти данные согласуются с проспективным рандомизированным исследованием RISK (1990), в котором оценивали эффективность АСК в дозе 75 мг в сутки в сравнении с плацебо. Через 3 и 12 месяцев риск развития ИМ и смерти уменьшался на 64 и 48 % соответственно.
В настоящее время представлены многочисленные исследования по влиянию АСК на клинику и прогноз стабильной стенокардии. Анализ подгруппы из 333 участников US-American Physicians’ Health Study [36], страдавших стабильной стенокардией перед началом исследования, не показал изменения клиники стенокардии. Не отмечено и какого-либо влияния препарата на динамику коронарного атеросклероза у принимавших АСК (по 325 мг через сутки) в течение 5 лет по сравнению с контрольной группой. Однако прием АСК у пациентов основной группы приводил к снижению у них количества первичных инфарктов миокарда на 87 % (p < 0,001), тогда как среди больных, не страдающих стабильной стенокардией, при употреблении АСК оно составило 44 %. Доказательства профилактического действия АСК при стабильной стенокардии получены в проспективном рандомизированном исследовании SAPAT (Swedish Angina Pectoris Trial) [37]. Действие низких доз АСК изучалось у 2035 больных со стабильной стенокардией, которые принимали 40–480 мг соталола в сутки (средняя доза 160 мг). Кроме того, они получали 75 мг АСК (n = 1009) или плацебо (n = 1026). Период наблюдения составил в среднем 50 месяцев. Продемонстрировано снижение риска ИМ или случаев внезапной смерти на 34 % (p = 0,003) в группе АСК по сравнению с плацебо. Среди принимавших АСК было на 26 % меньше смертельных исходов от сердечно-сосудистых причин. Согласно данным метаанализа Antithrombotic Trialists’ Collaboration [35], включавшего 7 рандомизированных клинических исследований с участием около 3 тысяч пациентов со стабильной стенокардией, назначение АСК пациентам со стабильной стенокардией сопровождается достоверным (p = 0,00004) 33% снижением риска серьезных сердечно-сосудистых событий (ИМ + инсульт + сердечно-сосудистая смертность).
У пациентов, перенесших операции на коронарных артериях, польза от применения АСК также высокая. По данным метаанализа (Antithrombotic Trialists’ Collaboration) [35], включавшего 9 рандомизированных клинических исследований, назначение АСК больным после коронарной ангиопластики сопровождалось 53% снижением риска сердечно-сосудистых осложнений (p < 0,0001). Результаты применения АСК у больных после аортокоронарного шунтирования выглядят скромнее — снижение риска серьезных сердечно-сосудистых осложнений всего на 4 % (данные 25 рандомизированных исследований, более 6 тысяч пациентов).
В 2009 г. представлен следующий этап работы Antithrombotic Trialists’ Collaboration, посвященный изучению эффективности и безопасности АСК как во вторичной, так и в первичной профилактике [38]. Были использованы данные 16 исследований по вторичной профилактике (17 тысяч больных категории высокого риска, 43 тысяч человеко-лет, 3306 серьезных сосудистых событий). Прием АСК приводил к абсолютному снижению риска сосудистых осложнений (6,7 % на фоне АСК и 8,2 % без АСК за год наблюдения; p < 0,0001), включая все инсульты (2,08 и 2,54 % в год соответственно; p = 0,002) и коронарные события (4,3 и 5,3 % в год соответственно; p < 0,0001), примерно на 20 %, при этом не отмечено достоверного увеличения частоты геморрагического инсульта.
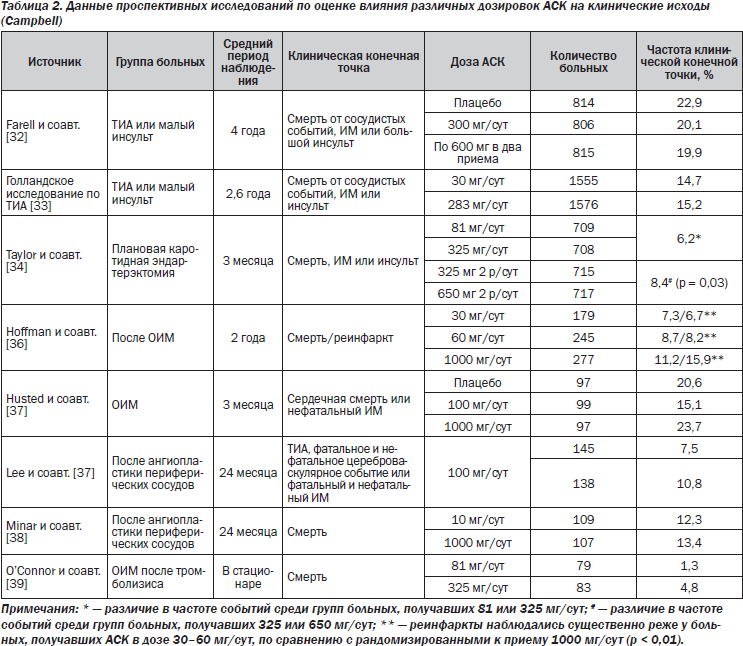
Оценка оптимальной дозы АСК в различных клинических ситуациях проведена в ряде крупномасштабных слепых контролируемых исследований, а также в нескольких метаанализах плацебо-контролируемых исследований. Следует отметить, что в большинстве исследований не выявлено взаимосвязи между увеличением дозы АСК и улучшением эффективности. При этом отмечена тенденция благоприятных эффектов более низких доз препарата. По данным анализа маркетинговых исследований фармацевтического рынка, большинство (около 60 %) врачей выбирают АСК в дозе 81 мг/сут и лишь небольшая часть (около 35 %) назначает препарат в дозе 325 мг/сут. При этом дозировка АСК, по-видимому, не связана со специальностью врача. Однако кардиологи немного чаще использовали АСК в дозе 325 мг/сут [39].
Исследования по оценке клинических исходов в зависимости от применяемых доз АСК включили почти 10 000 пациентов практически со всеми клиническими проявлениями атеросклероза: инсультом, транзиторной ишемической атакой (ТИА), чрескожными коронарными и периферическими вмешательствами, каротидной эндартерэктомией и ИМ (табл. 2). Дозировка АСК составляла от 30 до 1300 мг/сут. В исследованиях не отмечено существенных преимуществ более высоких доз АСК, а по данным большинства исследований, меньшая частота событий отмечалась среди пациентов, рандомизированных к приему малых доз АСК. Одно из лучших исследований [40] по длительной терапии включало больных после ТИА или инсульта (3131), рандомизированных у приемц АСК в дозе 283 или 30 мг/сут. Период наблюдения составил в среднем 2,6 года. Продемонстрировано, что комбинированная конечная точка (инсульт, инфаркт миокарда или смерть от сосудистых событий) была одинаковой в обеих группах (14,7 % для 30 мг/сут против 15,2 % для 283 мг/сут; отношение рисков 0,91, 95% доверительный интервал (ДИ) от 0,76 до 1,09).
Влияние дозировки АСК на клинические исходы изучено в нескольких метаанализах. При анализе 11 клинических исследований с участием 5228 пациентов, рандомизированных к приему АСК или плацебо после ТИА или инсульта, установлена сходная эффективность АСК в дозе от 50 до 1500 мг/сут [41]. Метаанализ более чем 60 исследований также не обнаружил взаимосвязи между дозой АСК и эффективностью терапии [35]. Причем наибольшее снижение риска наблюдалось в исследованиях с применением 75–150 мг АСК. Анализ исследований [42], включавших больных с острым коронарным синдромом, по оценке АСК в сравнении с плацебо показал, что низкие дозы АСК ассоциируются с лучшими клиническими исходами.
Ретроспективный анализ ряда крупномасштабных клинических исследований не выявил преимуществ более высоких доз АСК. В исследовании BRAVO (Blockade of the Glycoprotein IIb/IIIa Receptor to Avoid Vascular Occlusion) [43] 9190 больных с сосудистыми заболеваниями были рандомизированы к приему 1 из 2 доз антагониста гликопротеинов IIb/IIIa лотрафибана или плацебо в дополнение к АСК в дозе 75–325 мг/сут на усмотрение лечащего врача. Среди пациентов, рандомизированных к приему плацебо, 2410 больных получали АСК в дозе 75–162 мг/сут и 2179 — более 162 мг/сут. Период наблюдения составил в среднем 366 дней. Не выявлено достоверных различий по влиянию на первичную конечную точку (смерть, ИМ, инсульт, рецидив ишемии, требующей госпитализации, и ургентная реваскуляризация), но отмечена тенденция в пользу более низких доз АСК. При анализе комбинированной конечной точки (смертность от всех причин, ИМ или инсульт) различий между двумя когортами пациентов не отмечено. При многофакторном регрессионном анализе [43] установлено, что более высокие дозы АСК ассоциируются с меньшей летальностью (отношение рисков 0,74; 95% ДИ от 0,56 до 0,97, р = 0,03), однако данные большее нигде не дублировались. При многофакторном анализе исследований GUSTO (Global Use of Strategies to Open Occluded Coronary Arteries) IIb и PURSUIT (Platelet Glycoprotein IIb/IIIa in Unstable Angina: Receptor Antagonism Using Integrilin Therapy) [44] через 6 месяцев наблюдения доза АСК менее 150 мг/сут ассоциировалась с тенденцией к снижению первичной конечной точки (смерть, ИМ или инсульт), хотя при корректировке АСК в дозе 150 мг/сут или более ассоциировалась со значительно меньшей частотой ИМ, но большей частотой инсультов с отсутствием различий по влиянию на смертность. В исследовании CURE (Clopidogrel in Unstable Angina to Prevent Recurrent Events) [45] 12 562 больных с острым коронарным синдромом без подъема сегмента ST были рандомизированы в группы клопидогреля или плацебо в дополнение к длительной терапии АСК в дозе 75–325 мг/сут на усмотрение исследователя. Важно отметить, что в указанных исследованиях не проводилась рандомизация по дозе АСК, но полученные результаты почти у 35 000 пациентов подтверждают недостаточную эффективность АСК в случае увеличения ее дозировки.
По данным метаанализа Antithrombotic Trialists’ Collaboration [35], снижение риска сердечно-сосудистых осложнений на фоне применения АСК в дозе 500–1500 мг составило 19 %, в дозе 160–325 мг — 26 % и в дозе 75–150 мг — 32 %. В то же время на фоне применения доз АСК < 75 мг в сутки отмечен меньший эффект — снижение риска на 13 % (p = 0,05). При этом риск развития больших кровотечений был одинаков при различных дозах АСК в пределах до 325 мг в сутки: 1,7 для доз < 75 мг, 1,5 для доз 75–150 мг и 1,4 для доз 160–325 мг.
Необходимость проведения длительной (порой пожизненной) антитромботической терапии требует жесткого контроля ее безопасности, т.к. прекращение приема антитромбоцитарных препаратов приводит к увеличению риска сосудистых осложнений, таких как инфаркт миокарда и инсульт. Доказано, что при прекращении приема АСК риск повторного инсульта в течение месяца повышается в три раза [14]. Вероятно, ведущую роль в этом играет резкое повышение активности тромбоцитов. Основной причиной прекращения приема АСК в большинстве случаев является развитие побочных эффектов, связанных с воздействием на желудочно-кишечный тракт (ЖКТ).
Частота развития и тяжесть побочных эффектов, возникающих на фоне приема АСК, в первую очередь связаны с дозой препарата [46]. Тяжелые поражения верхних отделов желудочно-кишечного тракта (ЖКТ) при приеме АСК встречаются относительно редко и связаны прежде всего с дозой препарата. Частота развития диспептических явлений варьирует от 5,2 до 40 %. Механизм развития желудочно-кишечных кровотечений, связанных с приемом АСК, обусловлен как ингибированием ЦОГ-1 тромбоцитов, так и дозозависимым подавлением синтеза простагландинов в слизистой желудка. Таким образом, применение даже очень низких доз (30–50 мг/сут) АСК не может полностью исключить риск развития желудочно-кишечных осложнений, однако риск усиливается при увеличении дозы препарата. Основными факторами риска развития желудочно-кишечных кровотечений при длительном приеме АСК являются: предшествующий анамнез желудочно-кишечных кровотечений, совместное применение НПВП, антикоагулянтов, кортикостероидов, возраст старше 60 (и особенно более 75) лет. В некоторых исследованиях в качестве фактора риска рассматривается также наличие Helicobacterpylori. Риск повторных желудочно-кишечных кровотечений при терапии АСК у лиц с предшествующим анамнезом составляет 15 % в течение года. Установлено, что замена АСК на клопидогрель у больных с анамнезом желудочно-кишечных кровотечений оказалась менее эффективной и приводила к большему количеству повторных кровотечений, чем продолжение терапии АСК в комбинации с ингибитором протонной помпы. Однако постоянное использование противоязвенных препаратов в качестве сопутствующей терапии не может быть приемлемым у большинства пациентов [46].
Частично ульцерогенные эффекты АСК можно уменьшить при использовании минимальной эффективной дозы препарата, другим путем улучшения переносимости АСК является создание его более безопасных форм. Так, потенциально большую безопасность в отношении развития осложнений со стороны ЖКТ может обеспечить применение кишечнорастворимых форм АСК. В настоящее время большинство рандомизированных исследований, которые посвящены эффективности АСК, проводится с использованием именно кишечнорастворимых форм АСК.
Использование кишечнорастворимой формы АСК существенно повышает стоимость препарата, что негативно сказывается на приверженности больного к лечению. Облегчить финансовое бремя пациентов может применение генерических препаратов, например недавно появившегося на украинском фармацевтическом рынке препарата Полокард, выпускаемого заводом «Польфарма» (Польша).
В 2010 году в России закончено исследование ИКАР, целью которого являлось сравнительное изучение дезагрегантной способности таблетированных препаратов ацетилсалициловой кислоты в кишечнорастворимой оболочке Тромбопол 75 мг («Польфарма», Польша. На украинском рынке выпускается под названием Полокард) и аспирин кардио 100 (Bayer AG, Германия) у больных высокого риска сердечно-сосудистых осложнений. В ходе исследования не выявлено достоверных различий в дезаграгентной активности сравниваемых препаратов (генерического и оригинального), выпускаемых в кишечнорастворимой оболочке. Побочных эффектов, связанных с приемом исследуемого средства, ни при приеме оригинального, ни при приеме генерического препарата установлено не было [47].
Итак, АСК на сегодняшний день остается наиболее доступным и широко распространенным антитромботическим препаратом, клиническая эффективность и безопасность которого подтверждены многочисленными контролируемыми исследованиями и метаанализами. Антиагрегантная терапия с применением АСК является краеугольным камнем терапии большинства сердечно-сосудистых заболеваний. При правильном назначении (в рекомендуемых дозах) АСК — эффективное и хорошо переносимое средство профилактики тяжелых осложнений у больных с разными проявлениями атеротромбоза и ИБС.
1. Информационный бюллетень ВОЗ № 317 // http://www.who.int — 2011, сентябрь.
2. Руксин В.В. Тромбозы в кардиологической практике. — Минск.: Беларусь, 1998. — 126 с.
3. Бокарев И.Н., Попова Л.В. Атеротромбоз. Современное состояние проблемы и пути ее разрешения // Клиническая медицина. — 2008. — Т. 86, № 8. — С. 4-12.
4. Levesque H., Lafont O. Aspirin throughout the ages: a historical review // Rev. Med. Interne. — 2000. — Vol. 21 (Suppl. 1). — P. 8S-17S.
5. Vane J.R. The fight against rheumatism: from willow bark to COX-1 sparing drugs // J. Physiol. Pharmacol. — 2000. — Vol. 51. — P. 573-586.
6. Marson P., Pasero G. The Italian contributions to the history of salicylates // Reumatismo. — 2006. — Vol. 58. — P. 66-75.
7. Vainio H., Morgan G. Aspirin for the second hundred years: new uses for an old drug // Pharmacol. Toxicol. — 1997. — Vol. 81. — P. 151-152.
8. Лупанов В.П. Применение ацетилсалициловой кислоты с целью вторичной профилактики коронарной болезни сердца // Русский медицинский журнал. — 2005. — 13, 15. — 1053-1056.
9. McAuliffe S.J., Moors J.A., Jones H.B. Comparative effects of anti-platelet agents as adjuncts to tissue plasminogen activator in a dog model of occlusive coronary thrombosis // Br. J. Pharmacol. — 1994. — Vol. 112. — P. 272-276.
10. Patrono C., Coller B., Garret A. et al. Platelet-Active Drugs: The Relationships Among Dose, Effectiveness, and Side Effects. The Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy // Chest. — 2004. — 126. — 234S-264S.
11. Vesterqvist O. Rapid recovery of vivo prostacyclin formation after inhibition by aspirin-evidence from measurements of the major urinary metabolite of prostacyclin by GC-MS // Eur. Clin. Pharmacol. — 1986. — Vol. 30. — P. 69-73.
12. Schror K. Acetylsalicylsaur. — Stuttgart: Georg Thieme Verlag, 1992.
13. Upchurch R.G. et al. Prothrombotic consequences of oxidation of fibrinogen and their inhibition by aspirin // J. thrombosis and thrombolysis. — 1998. — Vol. 5. — P. 9-14.
14. Williams S. et al. Greater increase in fibrinogen gel porosity by low dose than intermediate dose acetylsalicylic acid // Eur. Heart J. — 1998. — Vol. 19. — P. 1666-1672.
15. Wallen N.H. et al. Influence of low- and high-dose aspirin treatment on thrombin generation in whole blood // Thrombosis Research. — 1998. — Vol. 92. — P. 189-194.
16. Roux S. et al. Effects of aspirin on coronary reocclusion and recurrent ischemia after thrombolysis: a meta-analysis // J. Am. Coll. Cardiol. — 1992. — Vol. 19. — P. 671-677.
17. Yin M. et al. The anti-inflammatory agents aspirin and salicylate inhibit the activity of IkappaB kinase-beta // Nature. — 1998. — Vol. 396. — P. 77-80.
18. Ikonomidis I. et al. Increased proinflammatory cytokines in patients with chronic stable angina and their reduction by aspirin // Circulation. — 1999. — Vol. 100. — P. 793-798.
19. Husain S. et al. Aspirin improves endothelial dysfunction in atherosclerosis // Circulation. — 1998. — Vol. 97. — P. 716-20.
20. Shi X. et al. Antioxidant properties of aspirin: characterization of the ability to inhibit silica-induced lipid peroxidation, DNA damage, NF-kB activation // Mol. Cell. Bioch. — 1999. — Vol. 199. — P. 93-102.
21. Roncaglioni M.C. et al. The vitamin K-antagonism of salycilate and warfarin // Thromb. Res. — 1986. — Vol. 42. — P. 727-736.
22. Metha J.L. Salutary effects of aspirin in coronary artery disease are not limited to its platelet inhibitory effects // Clin. Cardiol. — 1998. — Vol. 21. — P. 879-884.
23. Александров А.А. Аспирин и сахарный диабет: реалии профилактики сердечно-сосудистых осложнений // Фарматека. — 2005. — № 3(99).
24. Мartines-Sales V. et al. Elevated thrombotic activity after myocardial infarction: a 2-year follow-up study // Haemostasis. — 1998. — Vol. 28. — P. 301-306.
25. Putter M. et al. Inhibition of smoking- induced platelet aggregation by aspirin and pycogenol // Throbosis Research. — 1999. — Vol. 95. — P. 155-161.
26. Craven L.L. Experiences with aspirin (acetylsalicylic acid) in the nonspecific prophylaxis of coronary thrombosis // Miss Valley Med. J. — 1953. — Vol. 75. — P. 38.
27. Jick H., Miettinen O.S. Regular aspirin use and myocardial infarction // Br. Med. J. — 1976. — Vol. 1 (6017). — P. 1057.
28. Elwood P.C., Williams W.O. A randomized controlled trial of aspirin in the prevention of early mortality in myocardial infarction // J. R. Coll Gen. Pract. — 1979. — Vol. 29(204). — P. 413, 415-416.
29. Randomised trial of intravenous streptokinase, oral aspirin, both, or neither among 17,187 cases of suspected acute myocardial infarction: ISIS-2. ISIS-2 (Second International Study of Infarct Survival) Collaborative Group // Lancet. — 1988. — Vol. 2. — P. 349.
30. ISIS-2 (Second International Study of Infarct Survival) Collaborative Group. Short- and long-term risk reduction in vascular events with aspirin // Expert Rev. Cardiovasc. Ther. — 2008. — Vol. 6(1). — P. 95-107.
31. Risk of myocardial infarction and death during treatment with low dose aspirin and intravenous heparin in men with unstable coronary artery disease: the RISC Group // Lancet. — 1990. — 336. — 827-830
32. Cairns J.A., Gent M., Singer J. et al. Aspirin, sulfinpyrazone, or both in unstable angina: results of a Canadian multicenter trial // N. Engl. J. Med. — 1985. — Vol. 313. — P. 1369-1375.
33. Lewis H.D., Davis J.W., Archibald D.G. et al. Protective effects of aspirin against acute myocardial infarction and death in men with unstable angina: results of a Veterans Administration Cooperative Study // N. Engl. J. Med. — 1983. — Vol. 309. — P. 396-403.
34. Theroux P., Ouimet H., McCans J. et al. Aspirin, heparin, or both to treat acute unstable angina // N. Engl. J. Med. — 1988. — Vol. 319. — P. 1105-1111
35. Antithrombotic Trialists' Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients // BMJ. — 2002. — Vol. 324. — P. 71-86.
36. Ridker P.M., Manson J.E., Gaziano J.M. et al. Low-dose aspirin therapy for chronic stable angina. A randomized, placebo-controlled clinical trial // Ann. Intern. Med. — 1991. — Vol. 114(10). — P. 835-839.
37. Juul-Muller S., Edvardsson N., Jahnmatz B. et al. Double-blind trial of aspirin in primary prevention of myocardial infarction in patients with stable chronic angina pectoris. The Swedish Angina Pectoris Aspirin Trial (SAPAT) Group // Lancet. — 1992. — Vol. 340(8833). — P. 1421-1425.
38. Baigent C., Blackwell L., Collins R. et al. Antithrombotic Trialists (ATT) Collaboration. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials // Lancet. — 2009. — Vol. 373(9678). — P. 1849-1860.
39. National Disease and Therapeutic Index [database]. — Norwalk, Conn: IMS Health; September 2006.
40. Dutch TIA Study Group. A comparison of two doses of aspirin (30 mg vs 283 mg a day) in patients after transient ischemic attack or minor ischemic stroke // N. Engl. J. Med. — 1991. — Vol. 325. — P. 1261-1266.
41. Johnson E.S., Lanes S., Wentworth C. et al. A metaregression analysis of the dose-response effect of aspirin on stroke // Arch. Intern. Med. — 1999. — Vol. 159. — P. 1248-1253.
42. Kong D.F., Hasselblad V., Kandzari D.E. et al. Seeking the optimal aspirin dose in acute coronary syndromes // Am. J. Cardiol. — 2002. — Vol. 90. — P. 622-625.
43. Topol E.J., Easton D., Harrington R.A. et al. Randomized, double-blind, placebo-controlled, international trial of the oral IIb/IIIa antagonist lotrafiban in coronary and cerebrovascular disease // Circulation. — 2003. — Vol. 108. — P. 399-406.
44. Quinn M.J., Aronow H.D., Califf R.M. et al. Aspirin dose and six-month outcome after an acute coronary syndrome // J. Am. Coll. Cardiol. — 2004. — Vol. 43. — P. 972-978.
45. Peters R.J., Mehta S.R., Fox K.A. et al. Effects of aspirin dose when used alone or in combination with clopidogrel in patients with acute coronary syndromes: observations from the Clopidogrel in Unstable Angina to Prevent Recurrent Events (CURE) study // Circulation. — 2003. — Vol. 108. — P. 1682-1687.
46. Толпыгина С.Н., Марцевич С.Ю., Хосева Е.Н. Применение ацетилсалициловой кислоты в кишечнорастворимой форме у пациентов с высоким риском сердечно-сосудистых осложнений // Сердце: журнал для практикующих врачей. — 2011. — Т. 10, № 1. — С. 3-8.
47. Марцевич С.Ю., Толпыгина С.Н., Бойченко Е.С., Дубинская Р.Э., Лукина Ю.В., Воронина В.П. Сравнительное изучение дезагрегантной эффективности оригинального и воспроизведенного препарата ацетилсалициловой кислоты в кишечнорастворимой форме у пациентов высокого риска сердечно-сосудистых осложнений. Простое слепое перекрестное рандомизированное контролируемое исследование (ИКАР) // Рациональная фармакотерапия в кардиологии. — 2010. — № 6. — С. 800-806.