Газета «Новости медицины и фармации» 9 (415) 2012
Вернуться к номеру
Функциональная диспепсия: современные представления, механизмы и тактика ведения пациентов
Авторы: А.Э. Дорофеев, Н.Н. Руденко, О.В. Томаш - Кафедра внутренних болезней № 2 Донецкого национального медицинского университета им. М. Горького
Версия для печати
Под функциональной диспепсией (ФД) в настоящее время понимается симптомокомплекс, как связанный с приемом пищи, так и не зависящий от него. Он включает в себя: a) боль или дискомфорт в эпигастральной области; б) тяжесть после еды; в) раннее насыщение. Достаточно часто ФД может сочетаться с тошнотой, отрыжкой, вздутием и жжением в эпигастрии.
Распространенность неисследованной диспепсии в разных странах — 7–40 %, из них на долю ФД приходится 50–70 %. Она нарушает физические, психические и социальные аспекты качества жизни. Степень снижения последнего при ФД близка к таковой у пациентов с астмой и воспалительными заболеваниями кишечника.
В соответствии с Римскими критериями III (2006), диагноз ФД правомочен при наличии у пациента как минимум одного из следующих длящихся не менее 3 последних месяцев и возникших впервые не менее полугода назад симптомов:
- чувства переполнения после еды, тревожащего больного;
- раннего насыщения;
- эпигастральной боли;
- эпигастрального жжения.
При этом указывается, что обязательно должны отсутствовать органические, системные или метаболические заболевания, которые могли бы сопровождаться аналогичными симптомами.
В современной классификации клинические формы ФД сведены к 2 ее вариантам: постпрандиальному дистресс-синдрому (ПДС) и эпигастральной боли (ЭБ).
Диагностические критерии ПДС (симптомы возникают как минимум несколько раз в неделю):
- беспокоящее пациента чувство переполнения после приема обычного объема пищи, и/или
- раннее насыщение, препятствующее приему обычного объема пищи.
Критериями, подтверждающими диагноз ПДС, являются ощущение вздутия в эпигастрии, а также тошнота или чрезмерная отрыжка после еды. На данный вариант приходится примерно половина всех случаев ФД.
Диагностические критерии ЭБ (необходимо сочетание всех критериев):
- боль или жжение в эпигастрии умеренной или выраженной интенсивности, возникающее не реже 1 раза в неделю;
- интермиттирующий характер боли;
- отсутствие абдоминальной боли другой локализации и боли в грудной клетке;
- отсутствие улучшения после дефекации или отхождения газов (это улучшение характерно для синдрома раздраженной кишки (СРК));
- отсутствие критериев функциональных расстройств ЖП и сфинктера Одди.
Наличие жгучей (но не распространяющейся за грудину!) боли и ее возможная зависимость от приема пищи (как возникновение, так и облегчение после еды) подтверждают диагноз ЭБ. Изолированная ЭБ встречается примерно у четверти пациентов с ФД.
Как в случае ПДС, так и при ЭБ диагноз правомочен, если их симптомы длятся не менее 3 последних месяцев и впервые возникли не менее полугода назад. Возможно сочетание ПДС с ЭБ у одного и того же пациента, а также трансформация одной формы ФД в другую. Кроме того, достаточно часто ФД сочетается с другими функциональными заболеваниями ЖКТ (прежде всего СРК), а также с гастроэзофагеальной рефлюксной болезнью (ГЭРБ).
Этиопатогенетические причины ФД весьма разнообразны. В многочисленных исследованиях показана взаимосвязь ее симптомов с нарушением желудочной секреции, моторики верхних отделов желудочно-кишечного тракта (ЖКТ) (в том числе желудочной аккомодации и эвакуации), висцеральной гиперестезией, нарушенными кортико-висцеральными взаимодействиями, центральным нарушением восприятия, генетическими и психосоциальными факторами, острым и/или хроническим воспалением слизистой оболочки желудка и двенадцатиперстной кишки. Следует отметить, что отсутствует четкая взаимосвязь между патогенетическим механизмом и клиническими проявлениями ФД.
Поскольку синдром диспепсии не является специфичным, диспептические симптомы можно трактовать как проявление ФД только при исключении всех возможных органических причин! Таким образом, эта патология, как и любое другое функциональное заболевание, является диагнозом исключения.
Поэтому нозологическая диагностика данного синдрома строится прежде всего на верификации заболеваний, входящих в круг органической диспепсии (эрозивно-язвенные поражения гастродуоденальной зоны, рак желудка, ГЭРБ, заболевания поджелудочной железы и желчного пузыря). Необходимо также помнить о возможности вторичного нарушения моторики верхних отделов ЖКТ (например, гастропарез при сахарном диабете, пищеводная дисмоторика при системной склеродермии). Только убедившись в отсутствии этой патологии, следует вести речь о ФД.
Также необходимо обращать внимание на наличие так называемых симптомов тревоги (alarm symptoms), или «красных флагов» (red flags), обнаружение которых исключает диагноз ФД и требует проведения тщательного диагностического поиска с целью выявления более серьезного органического заболевания. К таким симптомам относятся лихорадка, дисфагия, частая рвота, гепатоспленомегалия, лимфаденопатия, пальпируемые образования в брюшной полости, примесь видимой крови в кале, немотивированное похудение, анемия, лейкоцитоз, повышение скорости оседания эритроцитов, семейный онкологический анамнез, манифестация симптомов в возрасте старше 40 лет.
При обследовании больных в обязательном порядке проводят клинический и биохимический анализы крови, анализ кала на скрытую кровь, фиброэзофагогастродуоденоскопию (ФЭГДС), ультразвуковое исследование (УЗИ) органов брюшной полости, по показаниям — рентгенологическое исследование с взвесью сульфата бария, компьютерную томографию. Теоретически возможное проведение электрогастрографии, сцинтиграфии желудка с изотопами технеция и индия (для диагностики нарушения моторики верхних отделов ЖКТ) весьма проблематично в рутинной клинической практике.
В мире и в Украине продолжаются дискуссии относительно того, каким должен быть диагностический оптимум при наличии диспепсии у пациента без симптомов тревоги. При этом предложены 2 различных подхода. Первый предполагает проведение комплекса диагностических мероприятий (в том числе ФЭГДС и УЗИ органов брюшной полости). Второй подразумевает терапию ex juvantibus, и только в случае ее неэффективности — проведение углубленного обследования. Каждый из этих подходов имеет свои достоинства и недостатки. Действительно, у большинства не имеющих симптомов тревоги пациентов (особенно молодых) комплексное лабораторно-инструментальное обследование не выявляет никакой органической патологии. Таким образом, затраченные на обследование время и средства принципиально не влияют на назначаемое в дальнейшем лечение. Однако при отсутствии инструментальной диагностики (прежде всего ФЭГДС) диспепсия так и остается неисследованной. При этом врач, по сути, лечит не заболевание, а симптомы патологии, которую он не верифицировал. В этой ситуации всегда остается вероятность наличия у пациента недиагностированного органического заболевания (иногда жизнеугрожающего!), требующего совершенно иной лечебной тактики. Современные национальные стандарты ведения больных с диспепсией пока не позволяют формулировать клинический диагноз как «неисследованная диспепсия». Кроме того, высокая распространенность в Украине эрозивно-язвенной патологии и рака желудка не позволяет слепо копировать рекомендации, предложенные специалистами западных стран, в которых эта патология гораздо менее актуальна. Так, например, Азиатский консенсус по ведению больных ФД (2011) предусматривает обязательное проведение ФЭГДС и тестирование на Helicobacter pylori (Нр). И, наконец, совершенно справедливо указывается, что проведение инструментальных исследований позволяет не только уточнить нозологический диагноз, но и успокоить пациента с повышенным уровнем тревожности (ведь именно они чаще обращаются за медицинской помощью при наличии симптомов диспепсии).
Необходимо отметить еще одну национальную проблему, существующую в рамках ведения больных с ФД. Достаточно часто у этих пациентов при ФЭГДС выявляется хронический гастрит (ХГ) (гастродуоденит). Как известно, основная его причина — хеликобактерная инфекция. Украина, к сожалению, относится к странам с высоким уровнем инфицированности населения Нр, причем инфицирование происходит в детском или молодом возрасте. Это приводит к тому, что при ФЭГДС у большинства обследуемых (особенно старших возрастных групп) действительно обнаруживаются эндоскопические признаки хронического гастрита. Но ошибка терапевта (а иногда, к сожалению, и гастроэнтеролога) заключается в том, что он отождествляет эндоскопический диагноз с клиническим. Эта широко распространенная практика справедливо критикуется ведущими украинскими гастроэнтерологами. Следующим ошибочным шагом зачастую становится определение «кислотности желудочного сока», поскольку этого требовали гастроэнтерологические руководства 70–80-х годов прошлого века. Итог такого подхода — лечение «хронического гастрита с пониженной/повышенной кислотностью»…
В связи с этим хочется акцентировать внимание на двух моментах. Во-первых, не нужно лечить «повышенную» или «пониженную кислотность», поскольку та или иная (отличная от среднего уровня) желудочная секреция сама по себе не является патологией! Медикаментозная коррекция секреторного статуса желудка необходима только в двух ситуациях. При наличии у пациента так называемых кислотозависимых заболеваний (прежде всего ГЭРБ и пептических гастродуоденальных язв) требуется максимально эффективное подавление кислотной продукции, что, как правило, достигается назначением ингибиторов протонной помпы (ИПП) или Н2-блокаторов. Что касается «пониженной (нулевой) кислотности», то истинная гипо-/ахлоргидрия действительно может приводить к нарушению пищеварения в виде явлений мальдигестии и мальабсорбции. В этом (и только в этом!) случае необходима заместительная терапия препаратами, содержащими HCl и ферменты желудочного сока. Классическим примером подобной ситуации является аутоиммунный атрофический гастрит, при котором действие аутоантител направлено против вырабатывающих HCl париетальных клеток. К счастью, в практической деятельности эта патология встречается достаточно редко. При наличии морфологически доказанной атрофии, следствием которой является гипо-/ахлоргидрия, совершенно неэффективны так называемые «стимуляторы желудочной секреции» — плантаглюцид, сок подорожника и т.п.
Во-вторых, как уже было сказано, на сегодняшний день сама формулировка клинического диагноза как «хронический гастрит» считается неправомочной. Многочисленные исследования показали отсутствие какой-либо связи между наличием у пациента синдрома диспепсии, с одной стороны, и наличием ХГ, а также его активностью, с другой. Большинство лиц, имеющих эндоскопически (а иногда и морфологически) установленный диагноз ХГ, никогда не имели, не имеют и, возможно, не будут иметь диспептических жалоб. В то же время у многих пациентов молодого возраста, прежде всего детей, не имеющих (или еще не имеющих) ХГ, диспепсия встречается достаточно часто. Именно поэтому в современной гастроэнтерологии ХГ считается морфологическим понятием, а не клиническим диагнозом. В связи с этим уместно подчеркнуть, что единственным методом исследования, подтверждающим наличие этой патологии, является морфологическое исследование гастробиоптатов. Оно позволяет оценить наличие и степень выраженности характерных для ХГ изменений (инфильтрация слизистой оболочки желудка различными клетками, атрофия, метаплазия и т.д.). Национальная практика диагностирования ХГ на основании эндоскопического заключения не соответствует современным требованиям.
Гетерогенность патофизиологических механизмов ФД обусловливает разнообразие подходов к ее лечению. Последнее представляет собой сложную задачу, поскольку требует комплексного подхода с включением не только тех или иных лекарственных препаратов, но и мероприятий по нормализации образа жизни, режима и характера питания, при необходимости — психотерапевтических методов. Эти подходы были сформулированы K. McQuaіd еще в 1998 г. в виде заповедей для практических врачей, которые остаются актуальными и сегодня.
Заповеди при лечении больных с функциональной диспепсией (McQuaіd K., 1998):
- Определите причину, заставившую больного обратиться за медицинской помощью. Тщательно выясните медицинский, семейный и социальный анамнез больного. Это позволит выявить стрессы, которые вызвали ухудшение самочувствия.
- Выясните, не могли ли изменения рациона питания или прием каких-либо лекарственных препаратов вызвать появление у больного диспептических жалоб. Убедите пациента в необходимости отказа от курения, кофе, алкоголя.
- В беседе с больным характеризуйте ФД как реально существующее заболевание. Избегайте говорить пациенту, что причина всех имеющихся у него жалоб «в его голове».
- Обсудите с пациентом патофизиологические механизмы имеющихся у него диспептических расстройств, включая изменения гастроинтестинальной моторики, повышенную висцеральную чувствительность, нарушенную нервную регуляцию двигательной функции ЖКТ.
- При обдумывании плана лечения ставьте перед собой реальные цели. Имейте в виду, что большинство симптомов являются хроническими и характеризуются волнообразным рецидивирующим течением.
- В случаях рефрактерности диспептических симптомов не забывайте о возможности их психогенной природы и обращайтесь за помощью к психологу или психотерапевту.
Из столь любимых в национальной гастроэнтерологической практике диетических ограничений в настоящее время доказана лишь эффективность уменьшения содержания животных жиров в рационе. У отдельных пациентов может быть полезным отказ от индивидуально непереносимых продуктов.
В метаанализах многочисленных рандомизированных контролируемых исследований (РКИ) показана эффективность целого ряда лекарственных средств в уменьшении клинической симптоматики при ФД: ИПП, Н2-блокаторов, антацидов, прокинетиков, антидепрессантов. Традиционно считалось, что антисекреторные препараты более эффективны для купирования ЭБ, а прокинетики — для лечения ПДС. Однако результаты РКИ последних лет не подтверждают эту точку зрения.
В 2005 году Национальным институтом здоровья и клинического мастерства (NICE, Великобритания) был предложен алгоритм лечения пациентов с ФД (рис. 1).
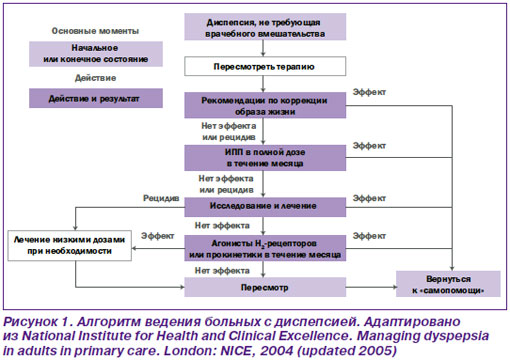
В соответствии с алгоритмом NICE пациент с диспепсией при отсутствии симптомов тревоги изначально не нуждается в диагностических исследованиях. Лечение следует начинать с модифицирующих мероприятий (режим и рацион питания, стрессы, вредные привычки). Кроме того, в случае приема препаратов, способных вызывать диспептическую симптоматику (аспирин, НПВП), целесообразна их отмена. В качестве следующего шага предлагается лечение ИПП в течение 1 мес. Сохраняющиеся или рецидивирующие симптомы требуют оценки Нр-статуса пациента с последующей эрадикационной терапией при наличии инфекции («test and treat»). Отсутствие эффекта от эрадикационной терапии или возобновление симптоматики у Нр-негативных пациентов обосновывает использование Н2-блокаторов или прокинетиков (также в течение 1 мес.). В случае эффективности лечения на любом уровне целесообразно прекращение медикаментозной терапии и переход к мероприятиям «самопомощи» (self care). В дальнейшем при рецидиве симптомов возможно повторное использование препаратов, оказавшихся эффективными на последней ступени лечения, в режиме «по требованию». Отсутствие эффекта от всех предлагаемых шагов ставит под сомнение правильность постановки диагноза ФД; для его верификации требуются дополнительные обследования.
Однако современные рекомендации по ведению пациентов с ФД предполагают дифференцированный подход к терапии в зависимости прежде всего от Нр-статуса больного. Первым шагом в лечении Нр-позитивного пациента с ФД (а таких в Украине, очевидно, большинство) должна быть эрадикационная терапия, проводимая в соответствии c Маастрихтским консенсусом. Считается, что такое лечение максимально эффективно у пациентов с ЭБ. Следует помнить, что и после эрадикации Нр симптомы ФД могут сохраняться или возобновляться в дальнейшем. В этом случае позитивная роль антихеликобактерной терапии заключается в снижении риска пептических гастродуоденальных язв и Нр-ассоциированного рака желудка.
В качестве следующего шага в лечении пациентов с сохраняющимися в отсутствие Нр симптомами ФД (он же — первый у исходно Нр-негативных лиц) рекомендована антисекреторная терапия. Многочисленные исследования показали сопоставимую эффективность при этом ИПП и Н2-блокаторов (считается, что при отсутствии выраженной исходной «гиперацидности» ИПП не имеют преимуществ перед Н2-блокаторами; кроме того, ИПП могут замедлять эвакуацию из желудка, что негативно влияет на симптоматику ПДС). В последнее время многие исследователи все чаще высказывают обоснованное мнение о нецелесообразности лечения ИПП ФД. Доказано, что длительный прием ИПП сопровождается развитием клинически значимых побочных эффектов (синдром отмены с возникновением клинической симптоматики даже у исходно здоровых «бессимптомных» лиц; нарушение всасывания Са, Mg, Fe, витамина B12; повышение риска переломов в связи со сниженной минерализацией костной ткани; более частое возникновение кишечных и респираторных инфекций). В связи с этим использование при ФД в качестве стартовой антисекреторной терапии Н2-блокаторов представляется более обоснованным и безопасным.
У пациентов, не ответивших на лечение антисекреторными препаратами, могут быть эффективны прокинетики. На любом из этапов лечения при повышенном уровне тревожности следует рассмотреть целесообразность назначения антидепрессантов и анксиолитиков (в том числе с целью повышения порога болевой чувствительности). В нескольких РКИ показана эффективность фитотерапии, особенно традиционных восточных сборов.
Длительность терапии на каждой ступени (кроме антихеликобактерной) составляет не менее 1 мес. При достаточной эффективности она может использоваться и в дальнейшем при возврате симптомов (лечение «по требованию»). Полное отсутствие эффективности проводимого лечения заставляет усомниться в правильности поставленного диагноза, в связи с чем могут потребоваться дополнительные диагностические мероприятия.
Таким образом, следует помнить, что ФД — одно из наиболее распространенных заболеваний, правомочность диагноза которого определяется, помимо всего прочего, его присутствием в МКБ-10 (код К30).
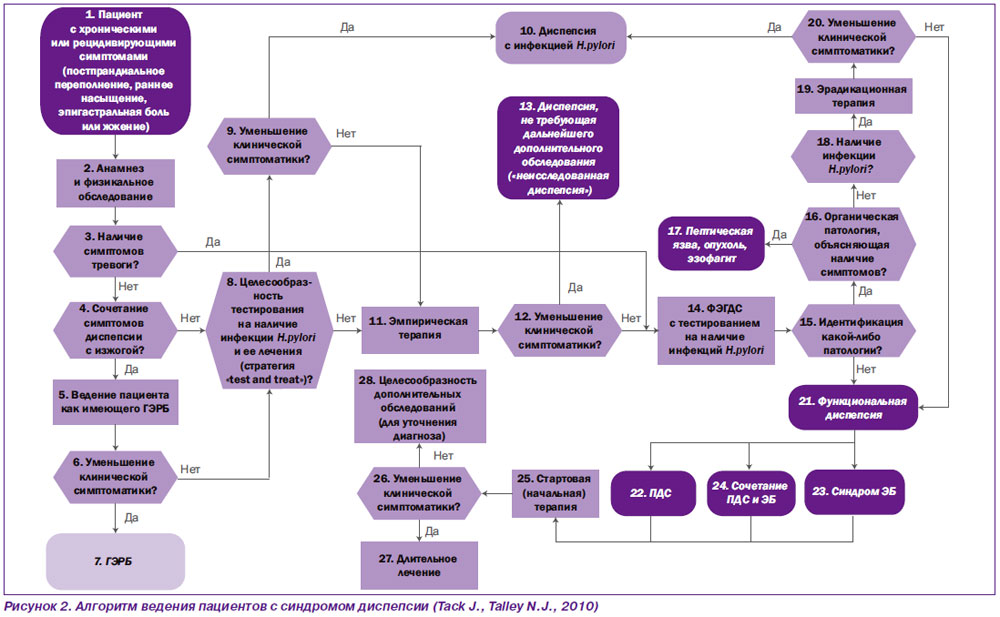
В 2010 году Римский фонд (Rome Foundation) предложил тактику ведения пациентов с синдромом диспепсии в виде диагностического алгоритма. Он более подробный, чем алгоритм NICE (2005), но в то же время понятен и доступен для выполнения в реальной клинической практике, в том числе национальной (рис. 2).