Газета «Новости медицины и фармации» Артериальная гипертензия (229) 2007 (тематический номер)
Вернуться к номеру
Роль блокады ренин-ангиотензиновой системы в современной стратегии модуляции кардиоваскулярного риска
Авторы: В.А. Визир, А.Е. Березин, Запорожский государственный медицинский университет
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
Длительное время антагонисты рецепторов к ангиотензину-2 (АРА) рекомендовались при плохой переносимости ингибиторов ангиотензинпревращающего фермента (ИАПФ) или по субъективному желанию врача и/или пациента. При этом АРА оказались сопоставимыми с ИАПФ по способности снижать уровень системного АД, улучшать клинический статус больных с сердечной недостаточностью (СН), предотвращать возникновение манифестного сахарного диабета, снижать риск развития мозгового инсульта и фибрилляции предсердий (Miura S., Saku K., 2007). В последующем АРА стали рассматриваться как лекарственные средства, имеющие некоторые преимущества перед ИАПФ, особенно у больных с инфарктом миокарда, сахарным диабетом 2-го типа и диабетической нефропатией (McMurray J., Solomon S., Pieper K. et al., 2006; Dickstein K., Kjekshus J., 2002; Casas J.P., Chua W., Loukogeorgakis S. et al., 2005). Кроме того, в исследованиях AMAZE и COOPERATE было показано, что совместное применение ИАПФ и АРА у больных с АГ не только способствует повышению качества контроля величины офисного и суточного АД, но и оказывает аддитивное влияние в отношении протекции органов-мишеней (Gosse P., Neutel J.M., Schumacher H. et al., 2007). Более того, у пациентов с манифестной и асимптомной сердечной недостаточностью использование АРА позволяет существенно снизить риск повторных госпитализаций и частоту внезапной сердечной смерти (Pfeffer M.A., Swedberg K., Granger C.B. et al., 2003; Ruilope L.M., Red у n J., Schmieder R., 2007; Reinecke A., Xia Q., Penz S. et al., 1999).
Таким образом, в течение последних лет сформировались представления о реальной возможности модуляции кардиоваскулярного риска с помощью длительной хронической блокады ренин-ангиотензиновой системы (РАС) при назначении АРА. Идея выглядела достаточно оптимистичной, особенно если принять во внимание тот факт, что в большинстве случаев при расчете величина абсолютного тотального риска существенно занижается, хотя перечень наиболее важных факторов уже определен (Conroy R., Pyorala K., Fitzgerald A. et al., 2003). В соответствии с рекомендациями Европейского общества кардиологов (ESC-ESH) среди факторов риска наибольшее клиническое значение имеют возраст, половая принадлежность, количество выкуренных сигарет, уровень общего холестерина плазмы крови, АГ, а также поражения органов-мишеней (гипертрофия левого желудочка, утолщение интима-медиального сегмента общей сонной артерии, хроническое заболевание почек, микроальбуминурия) и наличие клинически манифестных кардиоваскулярных заболеваний, метаболического синдрома и сахарного диабета (European guidelines on CVD prevention ESC Committee for Practice Guidelines to improve the quality of clinical practice and patient care in Europe, 2003).
В большинстве своем ошибки при расчете тотального кардиоваскулярного риска происходят вследствие неточного учета всех дополнительных (особенно метаболических) факторов риска. По данным G. De Backer (2006), ошибки при расчете риска и, соответственно, занижение его величины встречаются более чем в 50 % случаев. Последний факт имеет очень серьезное клиническое значение, поскольку ранее в многочисленных исследованиях было показано, что пациенты при наличии большого числа дополнительных факторов риска демонстрируют более тяжелый прогноз, чем больные без таковых. Так, один фактор риска способствует увеличению вероят ности смертельного исхода у пациента в 5 раз, а три до полнительных факторах риска — в 15 раз (Weiner D.E., Tighiouart H., Griffith J.L., 2007). Таким образом, модель расчета суммарного кардиоваскулярного риска явилась неотъемлемой частью стратегии, направленной на предотвращение возникновения первичных и вторичных случаев кардиоваскулярных событий (Joint British Societies' guidelines on prevention of cardiovascular disease in clinical practice, 2005). В связи с этим практикующий специалист вправе рассчитывать на мониторирование глобального риска. В клиническом смысле это означает: нет ответа на вмешательство — неправильно рассчитан риск — неадекватно выбрана интенсивность лечения. В то же время возможность ошибки при расчете риска заложена в самой идее экстраполяции величины популяционного риска на индивидуальный риск (Campbell N.R.C., Khan N.A., Grover S.A., 2006). Поэтому возникла необходимость внедрения концепции, основанной на возможности реализации максимально эффективной (с позиции сегодняшнего дня) профилактики манифестации и прогрессирования кардиоваскулярных событий. Одним из компонентов этой стратегии является хроническая блокада РАС с помощью АРА и/или ИАПФ. В какой же мере АРА отвечают ожиданиям практикующих специалистов? Очевидно, что наряду с практически идеальной переносимостью этот класс веществ позволяет добиться высокоэффективной превенции манифестации кардиоваскулярных событий даже при ошибочном расчете величины индивидуального риска. Последние годы ознаменовались ожиданием получения клинических доказательств этого предположения. Одна из наиболее крупных программ, направленных на получение сведений, касающихся этого вопроса, — PREVENTION — близка к своему завершению. Многие рандомизированные клинические исследования, входящие в нее в качестве компонентов, уже завершены с благоприятным результатом. Последний вклад в предоставление доказательств роли АРА в стратегии модификации риска пациентов с высоким риском должен внести проект ONTARGET (Ongoing Telmisartan Alone and in Combination With Ramipril Global Endpoint Trial) / TRANSCEND (Telmisartan Randomized Assessment Study in ACE-Intolerant Subjects With Cardiovascular Disease), результаты которого ожидаются в ближайшем будущем.
Значение ренин-ангиотензиновой системы в модуляции сердечно-сосудистого риска
Установлено, что РАС играет одну из ведущих ролей в поддержании водно-солевого равновесия и сосудистого тонуса (Timmermans P.B.M.W.M., Wong P.C., Chiu A.T. et al., 1993). Кроме того, РАС непосредственно участвует в процессах роста и дифференцировки тканей, модуляции процессов воспаления и апоптоза, а также потенциации синтеза и секреции целого ряда нейрогуморальных субстанций (McMurray J., 2000). Основным кондуктором, обеспечивающим практически все известные влияния РАС, является ангиотензин-2. Последний реализует свои тонические влияния посредством стимуляции специфических рецепторов. Номенклатура, локализация и основные эффекты стимуляции рецепторов к ангиотензину-2 суммированы в табл. 1.
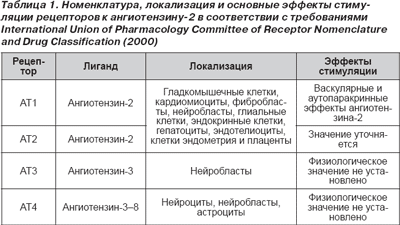
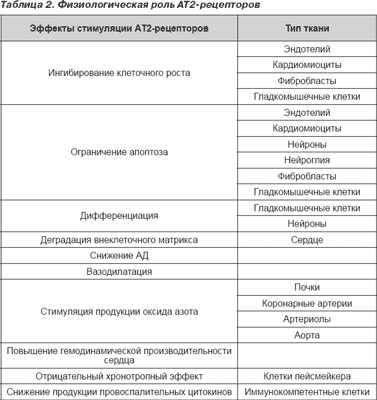
Установлено, что активация АТ1- и АТ2-рецепторов приводит к противоположным результатам. АТ1-рецепторы обусловливают вазоконстрикторный эффект, стимулируют высвобождение вазопрессина, альдостерона, эндотелина, норадреналина, кортикотропин-рилизинг-фактора. В исследованиях in vitro и in vivo установлено, что ангиотензин-2 способствует накоплению коллагенового матрикса, продукции цитокинов, адгезивных молекул, активации внутриклеточной сигнальной системы (multiple intracellular signaling cascades) посредством стимуляции киназы митогенактивирующего протеина (mitogen-activated protein — MAP), киназы тирозина и различных факторов транскрипции (Morsing P., Adler G., Brandt-Eliasson U. et al., 1999). Физиологическая роль АТ2-рецепторов представлена в табл. 2.
Многочисленными исследованиями подтверждено участие активации РАС в процессах ремоделирования сердца. Так, большое значение придается участию ангиотензина-2 в процессах формирования патологической гипертрофии левого желудочка (ЛЖ), которая не только связана с увеличением массы миокарда, но и ассоциируется с качественными изменениями в кардиомиоците и нако плением внеклеточного коллагенового матрикса (Aoki H., Izumo S., Sadoshima J., 1998). Ангиотензин-2 непосредственно способствует повышению экспрессии генов фетального фенотипа (Everett A.D., Tufro-McReddie A., Fisher A. Gomez R.A., 1994), таких как гены тяжелых цепей β-миозина, скелетного α-актина, предсе рдного натрийуретического фактора. Увеличение экспрессии фетальных изоформ контрактильных протеинов приводит к повышению массы ЛЖ (Geisterfer A.A., Peach M.J., Owens G.K., 1988) с последующим снижением вначале релаксационной, а затем и тотальной насосной функции сердца (Duff J.L., Berk B.C., Corson M.A., 1992). Кроме того, ангиотензин-2 способствует экспрессии «immediate-early» или «фетальных» генов, таких как jun B, еgr-1, c-myc, c-fos, c-jun, ответственных за интенсивность внутриклеточного протеинсинтеза (Baker K.M., Aceto J.F., 1990). И хотя роль активации этих генов до конца не ясна, многие исследователи связывают повышение их экспрессии с нарушением внутриклеточного сигнального каскада и активизацией фетального типа обмена веществ (Zou Y., Komuro I., Yamazaki T. et al., 1998).
Установлено, что ангиотензин-2 может играть центральную роль и в процессах ремоделирования артерий, интенсификации оксидантного стресса и апоптоза (Yamada T., Horiuchi M., Dzau V.J., 1996). Кроме того, ангиотензин-2 может принимать участие в формировании и прогрессировании артериальной гипертензии (Simon G., Altman S., 1992), сердечной недостаточности (Weber K.T., 1997), атеросклеротического повреждения сосудов (Berk B.C., Corson M.A., 1997), диабетической и недиабетической нефропатий (Border W.A., Noble N.A., 1998), ангиопатий при сахарном диабете (Border W.A., Noble N.A., 1998; Border W.A., Ruoslahti E., 1992), эклампсии беременных, болезни Альцгеймера и многих других заболеваний (Timmermans P.B.M.W.M., Wong P.C., Chiu A.T., 1993; Unger T., 2001).
Необходимо отметить, что неблагоприятное влияние ангиотензина-2 в отношении прогрессирования кардиоваскулярных заболеваний осуществляется независимо от его вазопрессорного эффекта (Bauer J.H., Reams G.P., 1995). Вместе с тем участие большинства молекулярных и клеточных механизмов РАС в прогрессировании кардиоваскулярных заболеваний подтверждено экспериментальными исследованиями или in vitro. В связи с этим клиническое и прогностическое значение многих из них еще придется установить (Schunkert H., Sadoshima J., Cornelius T. еt al., 1995).
Таким образом, ангиотензин-2 представляется одним из центральных звеньев в сложном каскаде активации РАС, оказывающей негативное влияние на структурные и функциональные характеристики сердечно-сосудистой системы. Теоретически ограничение влияние ангиотензина-2 на клеточные рецепторные субъединицы может явиться реальным способом медикаментозного вмешательства в формирование и прогрессирование кардиоваскулярных заболеваний.
Роль хронической блокады РАС в предотвращении возникновения и прогрессирования кардиоваскулярных заболеваний
Впервые гипотеза о предотвращении возникновения и прогрессирования кардиоваскулярных заболеваний с помощью блокады РАС была успешно подтверждена в исследовании HOPE (Yusuf S., Sleight P., Pogue J. et al., 2000), в котором было рандомизировано 9297 пациентов в возрасте старше 55 лет, имеющих клинические признаки кардиоваскулярных заболеваний (ишемическая болезнь сердца, цереброваскулярная недостаточность, заболевания периферических артерий) или сахарный диабет 1-го типа и один из следующих факторов риска: АГ, гиперлипидемия, курение, микроальбуминурия. После рандомизации все больные были распределены в группы плацебо или ИАПФ рамиприла. Анализ полученных данных показал, что частота достижения первичной конечной точки у пациентов, получавших рамиприл, была на 17,8 % ниже, чем у больных в группе плацебо (14 % в группе рамиприла и 17,85 в группе плацебо). При этом относительный риск возникновения комбинированной первичной точки составил 0,78 (P < 0,001), смерти вследствие кардиоваскулярных причин — 0,74 (P < 0,001), инфаркта миокарда — 0,80 (P < 0,001), инсульта — 0,68 (P < 0,001), СН — 0,77 (P < 0,001). Не было установлено достоверных различий между частотой возникновения случаев смерти от некардиоваскулярных причин. В дальнейшем в субисследовании HOPE-SECURE было установлено, что отмеченные результаты не были зависимы от выраженности антигипертензивного эффекта и являлись внутренним качеством самого препарата (Lonn E., Yusuf S., Dzavik V. et al., 2001). В то же время в последующих РКИ, посвященных трандолаприлу (PEACE), периндоприлу (EUROPE) и рамиприлу (DREAM), были получены неоднозначные результаты в отношении возможности вторичной профилактики кардиоваскулярных событий (The EURopean Trial On reduction of cardiac events with Perindopril in stable coronary Artery disease Investigators., 2003; Gerstein H.C., Yusuf S., Bosch J. et al., 2006). Тем не менее ИАПФ в настоящее время рекомендованы ведущими медицинскими обществами пациентам высокого и очень высокого кардиоваскулярного риска с целью проведения программ вторичной профилактики кардиоваскулярных событий (Fox K., Gar-cia M.A.A., Ardissino D. et al., 2006).
Положительные результаты исследований, посвященных перспективам применения ИАПФ с целью первичной и вторичной профилактики кардиоваскулярных заболеваний, явились серьезным побудительным мотивом для проведения аналогичных испытаний с АРА. Впервые способность АРА улучшать отдаленный прогноз у больных ГБ была доказана в исследованиях LIFE и SCOPE. Так, в LIFE (Losartan Intervention For Endpoint Reduction) была сопоставлена клиничес кая эффективность АРА лозартана и бета- адреноблокатора атенолола у 9222 больных АГ с ЭКГ-признаками гипертрофии левого желудочка (ГЛЖ). Оказалось, что средние уровни АД в обеих группах больных регрессировали в одинаковой степени. Вместе с тем темп реверсии ГЛЖ при применении лозартана был существенно выше, чем при назначении атенолола. Исследователи отметили также достоверно меньшую частоту случаев смерти от кардиоваскулярных причин, развития нефатального инфаркта миокарда или инсульта в группе лозартана, чем при лечении атенололом. Кроме того, лозартан способствовал достоверному снижению риска развития инсульта на 25 % и недостоверному регрессу общей смертности. Обращала на себя внимание достоверно более низкая частота развития новых случаев сахарного диабета в группе лозартана по сравнению с больными, получавшими атенолол. Позитивное влияние лозартана на отдаленный прогноз было документировано и в селективно отобранных группах больных АГ (пациенты с изолированной систолической АГ, фибрилляцией предсердий, сахарным диабетом, с недавно перенесенным инсультом) (Dahlof B., Devereux R.B., Kjeldsen S.E. et al., 2002).
В рандомизированном плацебо-контролируемом исследовании SCOPE (Study of COgnition and Prognosis in Elderly) была подвергнута оценке клиническая эффективность кандесартана у 4973 пожилых больных АГ. Анализ полученных данных показал, что через 3,7 года наблюдения в группе больных, получавших кандесартан, частота кардиоваскулярных событий была недостоверно ниже, а нефатального инсульта — достоверно ниже (–28 %, р = 0,04), чем в группе плацебо (Skoog I., Lithell H., Hansson L. et al., 2005). Вместе с тем исследователи отметили значительное снижение (–20 %) новых случаев сахарного диабета в когорте больных, получавших АРА (р = 0,085). Кроме того, было установлено, что препарат способствовал сохранению когнитивных функций у больных АГ, не оказывая существенного влияния на риск развития деменции.
Завершившаяся программа CHARM убедительно демонстрирует успешность применения кандесартана у пациентов с манифестной СН независимо от возраста, пола, длительности заболевания, наличия сахарного диабета, величины ФВ, сопутствующего применения бета-адреноблокаторов (Granger C.B., McMurray J.J., Yusuf S. et al.). Необходимо подчеркнуть и тот факт, что назначение кандесартана в ветви CHARM-Alternative было проведено больным, ранее отказавшимся от применения ИАПФ по причине возникновения побочных эффектов. Препарат оказался не только высокоэффективным, но и вполне безопасным. Кроме того, в ветви CHARM-Added улучшение выживаемости пациентов было достигнуто при добавлении кандесартана к рекомендованным дозам ИАПФ и бета-адреноблокаторов. К настоящему времени установлено, что АРА, в частности кандесартан и телмисартан, могут быть использованы в качестве препаратов первой линии при лечении манифестной и асимптомной СН в случае непереносимости ИАПФ (Dunselman P.H., 2001; Parker A.B., Azevedo E.R., Baird M.G. et. al., 1999).
Существуют проекты, в которых не удалось продемонстрировать преимущества АРА в программах вторичной профилактики кардиоваскулярных заболеваний. Так, в контролированном рандомизированном исследовании VALUE (Valsartan Antihypertensive Long-term Use Evaluation), включавшем 15 300 больных АГ старше 50 лет с одним и более фактором риска возникновения кардиоваскулярных событий, валсартан продемонстрировал реальные преимущества перед амлодипином только по способности редуцировать случаи сахарного диабета и СН. Частота возникновения кардиоваскулярной смертности в обеих группах пациентов существенно не различалась (Julius S., Kjeldsen S.E., Weber M. et al., 2004). Аналогичный результат был получен и при сопоставлении эффективности валсартана с каптоприлом в исследовании VALIANT. Сюрпризом явилось некоторое повышение частоты встречаемости инфаркта миокарда в группе пациентов, получавших валсартан. С другой стороны, в популяционном исследовании UMPIRE частота манифестации инфаркта миокарда в группе пациентов, леченных валсартаном, была даже ниже, чем у больных, получавших ИАПФ (ОР = 0,89, 95% доверительный интервал (ДИ) = 0,76–1,04) (Verma S., Mamdani M.M., Al-Omran M. et al., 2007).
Энтузиасты более широкого использования АРА в клинической практике полагают, что этот класс лекарственных средств будет эффективнее, чем ИАПФ, влиять на отдаленный прогноз не только кардиоваскулярных заболеваний, но и большинства заболеваний почек, в том числе и диабетической нефропатии. Так, данные исследований CALM, IDNT, RENAAL и особенно DETAIL и ABCD-2V дают основание считать, что АРА могут служить реальной альтерна тивой ИАПФ при лечении диабетической нефропатии (Hostetter T.H., 2003; Mogensen C.E., Steen Neldam S., Tikkanen I., Oren S., Viskoper R., Watts R.W., Cooper M.E., 2000). Исследователи ожидают также существенного успеха и от сочетанного применения АРА с ИАПФ, по скольку уже имеются не только глубокое теоретическое обоснование целесообразности такой комбинации, но и предварительные результаты широкомасштабных клинических исследований (Sleight P., 2002).
К настоящему времени существует достаточно большой объем завершенных клинических исследований, результаты которых дают возможность заключить, что длительное применение АРА позволяет эффективно редуцировать кардиоваскулярные риски посредством реализации органопротекторных влияний. Прежде всего это касается их возможности редуцировать величину массы миокарда ЛЖ, способствовать улучшению эндотелиальной функции, реверсировать альбуминурию и снижать суточную потерю белка с мочой, предотвращать увеличение плазменной концентрации креатинина, повышать чувствительность тканей к инсулину. При этом, по результатам оценки вышеуказанных вторичных (суррогатных) точек, телмисартан оказался более эффективным, чем другие представители класса АРА (Yano Y., Hoshide S., Ishikawa J. et al., 2007; Bahadir O., Uzunlulu M., Oguz A., Bahadir M.A., 2007; Ceriello A., Piconi L., Esposito K., Giugliano D., 2007; Fogari R., Derosa G., Zoppi A. et al., 2007). Обращает на себя внимание его уникальная способность оказывать стимулирующее влияние на PPR-γ-рецепторы, что приводит к редукции объема жировой ткани (Zanchi A., Dulloo A.G., Perregaux C. et al., 2007). В связи c этим представляет интерес проведение прямых клинических сопоставлений эффективности телмисартана и других АРА. К настоящему времени уже существуют сведения о том, что у пациентов с дисфункцией ЛЖ телмисартан не отличается от лосартана по способности редуцировать частоту возникновения смертельного исхода (ОР = 0,92 , 95% ДИ = 0,55–1,54) (Hudson M., Humphries K., Tu J.V. et al., 2007). Окончательное решение вопроса о месте и роли АРА телмисартана в стратегии профилактики кардиоваскулярных событий откладывается до получения результатов ONTARGET/TRANSCEND (Sleight P., 2007).
В целом можно заключить, что после длительного периода нахождения в тени ИАПФ и АРА наконец продемонстрировали свои уникальные качества и клиническую исключительность в лечении многих кардиоваскулярных заболеваний, в том числе АГ, диабетической и недиабетической нефропатии, метаболического синдрома и СН.
Таким образом, перспективы ограничения возникновения и прогрессирования кардиоваскулярных заболеваний в настоящее время фактически полностью связываются с нейрогуморальной блокадой РАС, осуществляющейся преимущественно по трем основным стратегическим направлениям: изолированное применение ИАПФ, АРА или сочетанное использование каждого из них. Ожидается, что новая парадигма профилактики кардиоваскулярных заболеваний явится одним из лейтмотивов, определяющих прогресс клинической кардиологии нового столетия.
1. Aoki H., Izumo S., Sadoshima J. Angiotensin II activates RhoA in cardiac myocytes: A critical role of RhoA in angiotensin II induced premyofibril formation // Circ. Res. — 1998. — 82. — 666-676.
2. Bahadir O., Uzunlulu M., Oguz A., Bahadir M.A. Effects of telmisartan and losartan on insulin resistance in hypertensive patients with metabolic syndrome // Hypertens. Res. — 2007 Jun. —; 30(6). — 573.
3. Barnett A.H. Preventing renal complications in diabetic patients: the Diabetic Exposed to telmisartan and enalapril (DETAIL) study // Acta Diabetol. — 2005. — 42. — S42-S49.
4. Bauer J.H., Reams G.P. The angiotensin II type 1 receptor antagonists: A new class of antihypertensive drugs // Arch. Intern. Med. — 1995. — 155. — 1361-1368.
5. Berk B.C., Corson M.A. Angiotensin II signal transduction in vascular smooth muscle: Role of tyrosine kinases // Circ. Res. — 1997. — 80. — 607-616.
6. Border W.A., Noble N.A. Interactions of transforming growth factor-beta and angiotensin II in renal fibrosis // Hypertension. — 1998. — 31. — 181-188.
7. Border W.A., Ruoslahti E. Transforming growth factor-b in disease: The dark side of tissue repair // J. Clin. Invest. — 1992. — 90. — 1-7.
8. Campbell N.R.C., Khan N.A., Grover S.A. Barriers and remaining questions on assessment of absolute cardiovascular risk as a starting point for interventions to reduce cardiovascular risk // J. Hypertens. — 2006. — 24. — 1683-1685.
9. Ceriello A., Piconi L., Esposito K., Giugliano D. Telmisartan shows an equivalent effect of vitamin C in further improving endothelial dysfunction after glycemia normalization in type 1 diabetes // Diabetes Care. — 2007. — 30 (7). — 1694-1698.
10. Conroy R., Pyorala K., Fitzgerald A., Sans S., Menotti A., De Backer G. et al. Prediction of 10-year risk of fatal cardiovascular disease in Europe: the SCORE project // Eur. Heart J. — 2003. — 24. — 987-1003.
11. Dahlof B., Devereux R.B., Kjeldsen S.E., Julius S., Beevers G., de Faire U., Fyhrquist F., Ibsen H., Kristiansson K., Lederballe-Pedersen O., Lindholm L.H., Nieminen M.S., Omvik P., Oparil S., Wedel H. LIFE Study Group. Cardiovascular morbidity and mortality in the Losartan Intervention For Endpoint reduction in hypertension study (LIFE): a randomized trial against atenolol // Lancet. — 2002. — 359. — 995-1003.
12. De Backer G.J. A total cardiovascular risk estimate should not be used dichotomously // Hypertens. — 2006. — 24 (9). — 1697-1698.
13. Duff J.L., Berk B.C., Corson M.A. Angiotensin II stimulates the pp44 and pp42 mitogen-activated protein kinases in cultured rat aortic smooth muscle cells // Biochem. Biophys. Res. Commun. — 1992. — 188. — 257-264.
14. European guidelines on CVD prevention ESC Committee for Practice Guidelines to improve the quality of clinical practice and patient care in Europe. Third Joint European Societies' Task Force on Cardiovascular Disease Prevention in Clinical Practice // Eur. J. Cardiovasc. Prev. Rehabil. — 2003. — 10 (Suppl. 1). — S1-78.
15. Everett A.D., Tufro-McReddie A., Fisher A. Gomez R.A. Angiotensin receptor regulates cardiac hypertrophy and transforming growth factor-beta 1 expression // Hypertension. — 1994. — 23. — 587-592.
16. Fogari R., Derosa G., Zoppi A., Preti P., Lazzari P., Destro M., Fogari E., Rinaldi A., Mugellini A. Effect of telmisartan-amlodipine combination at different doses on urinary albumin excretion in hypertensive diabetic patients with microalbuminuria // Am. J. Hypertens. — 2007. — 20 (4). — 417-22.
17. Fox K., Garcia M.A.A., Ardissino D. et al. The Task Force on the Management of Stable Angina Pectoris of the European Society of Cardiology // Eur. Heart J. — 2006; doi:10.1093/eurheartj/ehl001.
18. Geisterfer A.A., Peach M.J., Owens G.K. Angiotensin II induces hypertrophy, not hyperplasia, of cultured rat aortic smooth muscle cells // Circ. Res. — 1988. — 62. — 749-756.
19. Gerstein H.C., Yusuf S., Bosch J., Pogue J., Sheridan P., Dinccag N., Hanefeld M., Hoogwerf B., Laakso M., Mohan V., Shaw J., Zinman B., Holman R.R. Diabetes Reduction Assessment with ramipril and rosiglitazone Medication Trial Investigators; Effect of rosiglitazone on the frequency of diabetes in patients with impaired glucose tolerance or impaired fasting glucose: a randomized controlled trial // Lancet. — 2006. — 368. — 1096-1105.
20. Gosse P., Neutel J.M., Schumacher H., Lacourci и re Y., Williams B., Davidai G.The effect of telmisartan and ramipril on early morning blood pressure surge: a pooled analysis of two randomized clinical trials // Blood Press. Monit. — 2007. — 12 (3). — 141-147.
21. Granger C.B., McMurray J.J., Yusuf S. et al. for the CHARM Investigators and Committees. Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function intolerant to angiotensin-converting-enzyme inhibitors: the CHARM-Alternative trial // Lancet. — 2003. — 326. — 772-776.
22. Hostetter T.H. Prevention of the Development and Progression of Renal Disease // J. Am. Soc. Nephrol. — 2003. — 14. — S144-S147.
23. Hudson M., Humphries K., Tu J.V., Behlouli H., Sheppard R., Pilote L. Angiotensin II receptor blockers for the treatment of heart failure: a class effect? // Pharmacotherapy. — 2007. — 27 (4). — 526-534.
24. Joint British Societies' guidelines on prevention of cardiovascular disease in clinical practice // Heart. — 2005. — 91 (Suppl. 5). — V1-V52.
25. Julius S., Kjeldsen S.E., Weber M., Brunner H.R., Ekman S., Hansson L., Hua T., Laragh J., McInnes G.T., Mitchell L., Plat F., Schork A., Smith B., Zanchetti A. VALUE trial group. Outcomes in hypertensive patients at high cardiovascular risk treated with regimens based on valsartan or amlodipine: the VALUE randomised trial // Lancet. — 2004. — 363. — 2022-2031.
26. Lonn E., Yusuf S., Dzavik V. et al. Effects of ramipril and vitamin E on atherosclerosis: the study to evaluate carotid ultrasound changes in patients treated with ramipril and vitamin E (SECURE) // Circulation. — 2001. — 103. — 919-925.
27. McMurray J. AT1 receptor antagonists — beyond blood pressure control: pos sible place in heart failure treatment // Heart. — 2000. — 84, I. — i42-i45.
28. Miura S., Saku K. Do all angiotensin II type 1 receptor blockers have the same beneficial effects? // British Journal of Pharmacology. — 2007. — 151. — 912-913.
29. Mogensen C.E., Steen Neldam S., Tikkanen I., Oren S., Viskoper R., Watts R.W., Cooper M.E. Randomised controlled trial of dual blockade of renin-angiotensin system in patients with hypertension, microalbuminuria, and non-insulin dependent diabetes: the candesartan and lisinopril microalbuminuria (CALM) study // BMJ. — 2000. — 321. — 1440-1444.
30. Morsing P., Adler G., Brandt-Eliasson U. et al. Mechanistic Differences of Various AT1-Receptor Blockers in Isolated Vessels of Different Origin // Hypertension. — 1999. — 33. — 1406-1413.
31. Pfeffer M.A., Swedberg K., Granger C.B. et al. for the CHARM Investigators and Committees. Effects of candesartan on mortality and morbidity in patients with chronic heart failure and reduced left-ventricular systolic function taking angiotensin-converting-enzyme inhibitors: the CHARM-Overall programme // Lancet. — 2003. — 326. — 759-766.
32. Reinecke A., Xia Q., Penz S. et al. Comparison between angiotensin AT-1 receptor antagonism, ACE inhibition and conbined treatment. Effects on mortality, functional and morphological parameters after experimental myocardial infarction in stroke prone SHRs // Hypertension. — 1999. — 34. — 696.
33. Ruilope L.M., Red у n J., Schmieder R. Cardiovascular risk reduction by reversing endothelial dysfunction: ARBs, ACE inhibitors, or both? Expectations from the ONTARGET Trial Programme // Vasc. Health Risk Manag. — 2007. — 3 (1). — 1-9.
34. Schunkert H., Sadoshima J., Cornelius T., Kagaya Y., Weinberg E.O., Izu mo S., Riegger G., Lorell B.H. Angiotensin II induced growth responses in isolated adult rat hearts: Evidence for load-independent induction of cardiac protein synthesis by angiotensin II // Circ. Res. — 1995. — 76. — 489-497.
35. Simon G., Altman S. Subpressor angiotensin II is a bifunctional growth factor of vascular muscle in rats // J. Hypertension. — 1992. — 10. — 1165-1171.
36. Skoog I., Lithell H., Hansson L., Elmfeldt D., Hofman A., Olofsson B., Trenkwalder P., Zanchetti A. SCOPE Study Group. Effect of baseline cognitive function and antihypertensive treatment on cognitive and cardiovascular outcomes: Study on COgnition and Prognosis in the Elderly (SCOPE) // Am. J. Hypertens. — 2005. — 18. — 1052-1059.
37. Sleight P. Angiotensin II and trials of cardiovascular outcomes // Am. J. Cardiol. — 2002. — 89. — 11A-17A.
38. The EURopean Trial On reduction of cardiac events with Perindopril in stable coronary Artery disease Investigators. Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomised, double-blind, placebo-controlled, multicentre trial (the EUROPA study) // Lancet. — 2003. — 326. — 782-788.
39. Timmermans P.B.M.W.M., Wong P.C., Chiu A.T., Herblin W.F., Benfield P., Carini D.J., Lee R.J., Wexler R., Saye J., Smith R. Angiotensin II receptors and angiotensin II receptor antagonists // Pharmacol. Rev. — 1993. — 45. — 205-251.
40. Unger T. Inhibiting rennin-angiotensin in the brain: the possible therapeutic implications // Blood Press. — 2001. — 10. — 12-16.
41. Weber K.T. Extracellular matrix remodeling in heart failure: A role for de novo angiotensin II generation // Circulation. — 1997. — 96. — 4065-4082.
42. Weiner D.E., Tighiouart H., Griffith J.L. Kidney Disease, Framingham Risk Scores, and Cardiac and Mortality Outcomes. — 2007. — 6. — 552.e1-552.e8.
43. Yamada T., Horiuchi M., Dzau V.J. Angiotensin II type 2 receptor mediates programmed cell death // Proc. Natl. Acad. Sci. USA. — 1996. — 93. — 156-160.
44. Yano Y., Hoshide S., Ishikawa J. et al. The differential effects of angiotensin II type 1 receptor blockers on microalbuminuria in relation to low-grade inflammation in metabolic hypertensive patients // Am. J. Hypertens. — 2007. — 20 (5). — 565-572.
45. Yusuf S., Sleight P., Pogue J. et al. Effects of an angiotensin-converting- enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients. The Heart Outcomes Prevention Evaluation Study Investigators. 2000 // Engl. J. Med. — 342. — 145-153.
46. Zanchi A., Dulloo A.G., Perregaux C., Montani J.P., Burnier M. Telmisartan prevents the glitazone-induced weight gain without interfering with its insulin-sensitizing properties // Am. J. Physiol. Endocrinol. Metab. — 2007. — 293 (1). — E91-95.
47. Zou Y., Komuro I., Yamazaki T., Kudoh S., Aikawa R., Zhu W., Shiojima I., Hiroi Y., Tobe K., Kadowaki T., Yazaki Y. Cell type-specific angiotensin II-evoked signal transduction pathways: Critical roles of G-beta-gamma subunit, Src family, and Ras in cardiac fibroblasts // Circ. Res. — 1998. — 82. — 337-345.
48. Verma S., Mamdani M.M., Al-Omran M. et al. Angiotensin receptor blockers vs angiotensin converting enzyme inhibitors and acute coronary syndrome outcomes in elderly patients: a population-based cohort study (UMPIRE study results) // J. Am. Soc. Hypertens. — 2007. — 1. — 286-294.
49. Sleight P. The ONTARGET/TRANSCEND Trial Programme: baseline data // Acta Diabetol. — 2007. — 42 (Suppl. 1). — S50-S56.
50. Dunselman P.H. Effects of the replacement of the angiotensin converting enzyme inhibitor enalapril by the angiotensin II receptor blocker telmisartan in patients with congestive heart failure. The replacement of angiotensin converting en zyme inhibition (REPLACE) investigators // Int. J. Cardiol. — 2001. — 77 (2–3). — 131-138.
51. Parker A.B., Azevedo E.R., Baird M.G., Smith S.J., Arnold J.M., Humen D.P., Moe G.W., Parker J.O., Butt R.W., Parker J.D. ARCTIC: assessment of haemodynamic response in patients with congestive heart failure to telmisartan: a multicentre dose-ranging study in Canada // Am. Heart J. — 1999. — 138 (5 Pt 1). — 843-848.
