Газета «Новости медицины и фармации» 9 (415) 2012
Вернуться к номеру
Хронічна хвороба нирок
Авторы: А.Н. Корж, д.м.н., професор, завідувач кафедри загальної практики — сімейної медицини ХМАПО, член Всесвітньої організації сімейних лікарів WONCA, Д.Д. Іванов, д.м.н., професор, заслужений лікар України, завідувач кафедри нефрології і нирково-замісної терапії НМАПО імені П.Л. Шупика
Версия для печати
З 2002 року з ініціативи Національної нефрологічної спілки (NKF-K/DOQI) США в сучасній нефрології використовуються поняття хронічної хвороби нирок (ХХН; chronic renal disease — CKD) та класифікація стадій ХХН. З 2003 року термін запропоновано також у дитячій нефрології. З 2005 року, після затвердження 2-м з’їздом нефрологів України, діагноз «хронічна хвороба нирок» для дорослих та «хронічне захворювання нирок» (тобто може відбуватися відновлення функції та зворотній перебіг ураження) використовується і в нашій країні. Останній перегляд світових рекомендацій проведений у 2011 році (Detection, Monitoring and Care of Patients with CKD).
Наявність ХХН повинна встановлюватись незалежно від первинного діагнозу, ґрунтуючись на наявності пошкодження нирок та/або швидкості клубочкової фільтрації. При цьому ХХН може сама розглядатися як діагноз, наприклад: ХХН 3-ї стадії, гіпертонічна хвороба 2-ї ст., дефіцитна анемія 1-ї ст.
У пацієнта ХХН, якщо наявний будь-який із таких критеріїв:
1. Пошкодження нирок ≥ 3 міс., що виявлене за структурними або функціональними порушеннями нирок, зі зниженням ШКФ або без нього, та проявляється однією та більше з таких ознак:
- порушення в аналізах крові або сечі;
- порушення, виявлені при візуалізаційних дослідженнях;
- порушення, виявлені при біопсії нирки.
2. ШКФ < 60 мл/хв/1,73 м2 протягом ≥ 3 міс. з іншими ознаками пошкодження нирок, наведеними вище, або без них (Am. J. Kidney Dis. 2002; 39 (2, suppl. 1): S18; 2-й з’їзд нефрологів України, 2005).
У роз’ясненні визначення та класифікації ХХН (A.S. Levey et al., 2005) наголошено, що лікарям загальної практики недоцільно включати назву «захворювання нирок» у діагноз ХХН. ХХН може бути виявлена без установлення причини, тому що останнє може потребувати специфічних знань та/або проведення діагностичних процедур, недоступних широкому колу лікарів.
Результати аналізу сечового осаду, візуалізаційні дослідження нирки та деякі клінічні симптоми можуть виявити різні типи ХХН, у тому числі гломерулярні, судинні, тубулоінтерстиціальні та кістозні. При цьому вважається, що всі реципієнти з нирковим трансплантатом незалежно від ШКФ, наявності або відсутності маркерів ураження нирок мають ХХН.
Визначення ШКФ треба повторити через 2 тижні; якщо ШКФ стабільна, наступне визначення рекомендується провести через 3 місяці (1D).
Для виявлення ХХН та ідентифікації типу захворювання нирки необхідні оцінка аналізу сечі за індикаторним папірцем та мікроскопічне дослідження сечового осаду, особливо в поєднанні з оцінкою протеїнурії. Патологічні результати візуалізаційних досліджень можуть свідчити про судинні, урологічні чи паренхімні захворювання нирок. Візуалізаційні дослідження рекомендуються для більшості пацієнтів із відомою ХХН та підвищеним ризиком її розвитку. У певних випадках можуть бути прийнятними інвазивні процедури (наприклад, біопсія нирки). Деякі клінічні симптоми ХХН можуть викликати характерні зміни в крові, наприклад, при нирковому канальцевому ацидозі або нефрогенному нецукровому діабеті.
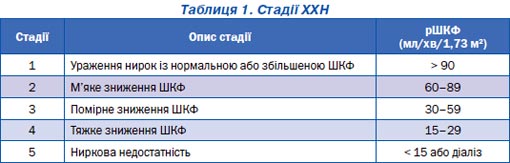
Несприятливі наслідки ХХН часто можуть бути попереджені або відстрочені шляхом ранньої діагностики та лікування. Перші стадії ХХН можна виявити рутинними лабораторними дослідженнями. У пацієнтів із ХХН, окрім тих, які отримують діаліз, стадія захворювання встановлюється за швидкістю клубочкової фільтрації (1В) (табл. 1, рис. 1).

Діагноз ХХН вже має відповідні коди в США та міститься в уточненнях Всесвітньої організації охорони здоров’я 2007 року (рубрика N18, табл. 2). З ціллю збереження загальноприйнятої структури діагноз ХХН рекомендується вказувати після основного захворювання. Кодування хвороби встановлюється відповідно до МКХ-Х за основним захворюванням, а при неможливості виявлення останнього — за рубриками N18.1–9. У разі проведення діалізу або трансплантованої нирки рекомендують робити відповідні відмітки в діагнозі, наприклад, «стадія 5D» (діалізна) або «стадія 3T» (після трансплантації) відповідно.

За відсутності ознак ушкодження нирок і при ШКФ 60–89 мл/хв/1,73 м2 стадія ХХН не встановлюється, а в діагнозі відзначається зниження ШКФ. У літніх осіб (> 65 років) показники ШКФ у межах 60–89 мл/хв/1,73 м2 можуть розцінюватися як варіант норми. Пацієнтам на діалізі встановлюють 5-ту стадію ХХН.
Після введення класифікатора для ХХН було запропоновано ще декілька нових термінів, що використовуються сьогодні в практиці:
1. Діабетична хвороба нирок = діабет + хронічна хвороба нирок (раніше — діабетична нефропатія; KDOQI, 2007).
2. Гіпертензивна хвороба нирок, що є наслідком гіпертензії (Росія, 2009).
3. Ішемічна хвороба нирок, що є наслідком атеросклерозу.
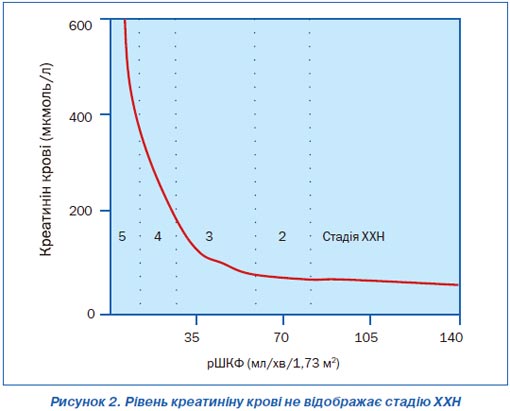
Пошкодження нирки виявляється за наявності маркерів хвороби в крові, сечі або за даними візуалізаційних досліджень, а не за допомогою біопсії нирки. При цьому персистуюча протеїнурія та гіпертензія — найважливіші ознаки пошкодження нирки. Обґрунтуванням розміщення осіб із нормальною ШКФ у групу ХХН є часта маніфестація значних пошкоджень нирок ще до зниження цього ключового показника ниркових функцій, а також той факт, що ці пацієнти мають підвищений ризик несприятливого закінчення ХХН. Обґрунтуванням розміщення осіб із ШКФ < 60 мл/хв/1,73 м2 без будь-яких інших ознак пошкодження нирок є те, що зменшення ниркових функцій нижче від цього рівня віддзеркалює втрату ниркою як мінімум 50 % своїх нормальних функцій (рис. 2). Крім того, це рівень, нижче від якого починає зростати кількість ускладнень ХХН.
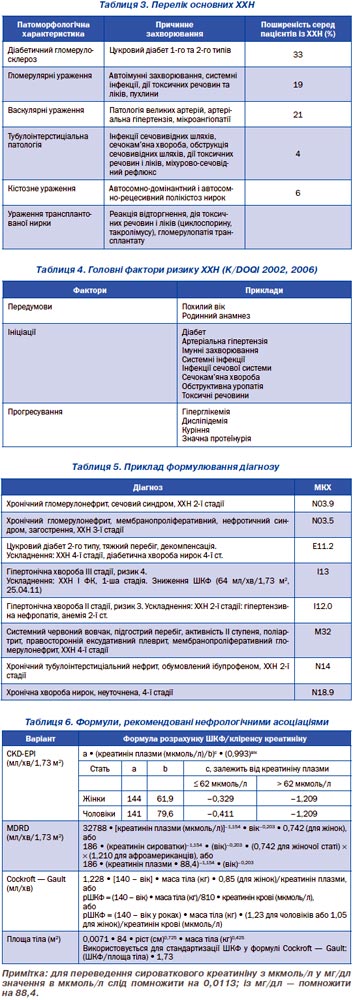
Перелік основних ХХН залежно від етіологічного та патоморфологічного чинників наведено в табл. 3 (адаптовано згідно з http://www.kidney.org/professionals/kdoqi/guidelines_ckd/Gif_File/kck_t34.gif).
При можливості визначення причинного фактора ХХН діагноз можна сформулювати таким чином: автосомно-домінантний полікістоз нирок, дорослий тип, ХХН 4-ї стадії, артеріальна гіпертензія 2-ї ст., дефіцитна анемія 1-ї ст.
Виявлення причинного чинника ХХН дозволяє призначити специфічну терапію та значно відстрочити розвиток хронічної ниркової недостатності. Сам термін «хронічна хвороба нирок» передбачає, що захворювання прогресує з втратою функції нирок, на жаль, у більшості випадків незворотньо.
У дітей визначений свій перелік захворювань, що призводять до розвитку ХХН:
- Полікістозна нирка або інші генетичні хвороби нирок у сімейному анамнезі.
- Мала вага тіла при народженні.
- Гостра ниркова недостатність у результаті перинатальної гіпоксемії або інших гострих пошкоджень нирок.
- Ниркова дисплазія або гіпоплазія.
- Урологічні розлади, особливо обструктивні уропатії.
- Міхурово-сечовідний рефлюкс, пов’язаний із повторними інфекціями сечовивідних шляхів та рубцюванням нирок.
- Гострий нефрит або нефротичний синдром в анамнезі.
- Гемолітико-уремічний синдром в анамнезі.
- Хвороба Шенлейна — Геноха в анамнезі.
- Цукровий діабет.
- Системний червоний вовчак.
- Гіпертензія в анамнезі, зокрема внаслідок тромбозу ниркової артерії чи ниркової вени в перинатальному періоді.
Приклад формулювання діагнозу:геморагічний васкуліт, змішана форма. ХХН 1-ї ст. (тривалістю перебігу понад 3 місяці): гломерулонефрит, ізольований сечовий синдром без порушення функції нирок.
У нефрології виділяють 4 групи ризик-факторів, що впливають на розвиток та перебіг ХХН. Перша — це фактори, що мають імовірність впливати на розвиток ХХН, наприклад зростаючий вік пацієнта, сімейний анамнез щодо наявності в родичів ХХН, зниження розмірів та об’єму нирок, низька вага при народженні або недоношеність (дозрівання кількості нефронів спостерігається на 38-му тижні внутрішньоутробного розвитку), низький матеріальний дохід (соціальний статус) та освітній рівень. Друга група — ризик-фактори, що ініціюють ХХН, включають наявність цукрового діабету 1-го та 2-го типів, гіпертензію, автоімунні захворювання, інфекції сечових шляхів, сечокам’яну хворобу, обструкцію сечових шляхів, токсичний вплив ліків. Третя група — ризик-фактори, що призводять до прогресування ХХН, вона представлена високим ступенем протеїнурії або гіпертензії, неналежним контролем за гіперглікемією, курінням. Ризик-фактори кінцевого ступеня ХХН включають низьку діалізну дозу, тимчасовий судинний доступ, анемію, низький рівень альбуміну, пізній початок діалізу.
У дітей та підлітків виділяють такі самі групи ризик-факторів розвитку ХХН, як і у дорослих. Слід додати, що дозрівання нормальної кількості нефронів спостерігається на 38-му тижні гестації за наявності нормальної маси плода. Тому всі недоношені або новонароджені з малою вагою тіла мають меншу за нормальну кількість нефронів. Це фактор ризику розвитку ХХН, ранньої гіпертензії та більш тяжкого перебігу набутих захворювань нирок.
Для дорослих пацієнтів виділяють головні фактори ризику розвитку ХХН (табл. 4).
Найвагоміші причини ХХН (понад 50 %) у дорослому віці — діабет і гіпертензія, тому дуже часто вони можуть бути виявлені терапевтом, сімейним лікарем, ендокринологом або кардіологом. За наявності мікроальбумінурії та при підозрі на ХХН пацієнтів треба направити до нефролога для консультації та корекції лікування. При досягненні рівня ШКФ < 30 мл/хв/1,73 м2 пацієнти обов’язково повинні консультуватись нефрологом/дитячим нефрологом, адже вони потребують відповідної інформації щодо замісної ниркової терапії (консервативні заходи, діаліз, трансплантація нирки) (табл. 5).
Поширеність ХХН, за різними даними, коливається від 10 до 30 % у різних вікових групах. Так, за даними Morbidity and Mortality Weekly Report of the US Centers for Disease Control, у 2007 році 16,8 % населення США віком понад 20 років страждало від ХХН. Аналіз більш ранніх даних дослідження NHANES III свідчить про наявність у 11 % із обстежених 19,2 мільйона американців хронічних захворювань нирок, а саме: 3,3 % мали першу стадію ХХН (персистуюча мікроальбумінурія зі ШКФ > 90 мл/хв); 3 % — другу стадію ХХН (ШКФ 60–89 мл/хв); 4,3 % — третю стадію (ШКФ 30–59 мл/хв); 0,2 % — четверту (ШКФ 15–29 мл/хв) і 0,1 % — п’яту (ШКФ <15 мл/хв).
Слід ще раз звернути увагу, що стадії ХХН визначаються згідно з ШКФ, а не креатиніном крові. Це пов’язано з тим, що креатинін крові починає збільшуватись, коли ШКФ зменшується наполовину від нормальної (рис. 2). Тобто гіперкреатинінемія спостерігається за наявності понад 50 % непрацюючих нефронів. Крім того, відмінності між клінічними лабораторіями в калібровці креатиніну сягають 20 %. Тому пропонується взагалі відмовитися від рутинного визначення ШКФ (проби Реберга — Тареєва) через більш коректне визначення рівня клубочкової фільтрації за даними креатиніну крові з урахуванням маси тіла й віку пацієнта або менш доступного проведення радіонуклідного визначення ШКФ при проведенні реносцинтиграфії.
Сама по собі концентрація креатиніну сироватки крові не повинна використовуватись для оцінки функції нирок. Клінічні лабораторії повинні видавати оцінку ШКФ з використанням формули у доповнення до видачі результату оцінки креатиніну сироватки. Виробники автоматичних аналізаторів та клінічні лабораторії повинні калібрувати устаткування для визначення креатиніну сироватки, використовуючи міжнародний стандарт. Визначення кліренсу креатиніну з використанням сечі, зібраної за певний проміжок часу (наприклад, добової), не покращує оцінку ШКФ порівняно з формулою.
Зразок добової сечі може надати корисну інформацію:
- для оцінки ШКФ у осіб із незвичайним харчовим раціоном (вегетаріанська дієта, харчові добавки з креатином) або особливостями м’язової маси (ампутація, недостатня вгодованість, атрофія);
- оцінки дієти та харчового статусу;
- визначення необхідності початку діалізу.
У світі для визначення ШКФ використовують формули, що рекомендовані нефрологічними асоціаціями (табл. 6).
Для пацієнтів дитячого віку найчастіше використовується формула Schwartz:
Кліренс креатиніну (мл/хв) = = 0,0484* • зріст (см)/креатинін крові (мкмоль/л).
Примітка: * — для дітей до 3 років — 0,0312, для хлопчиків старше 13 ро-ків — 0,0616.
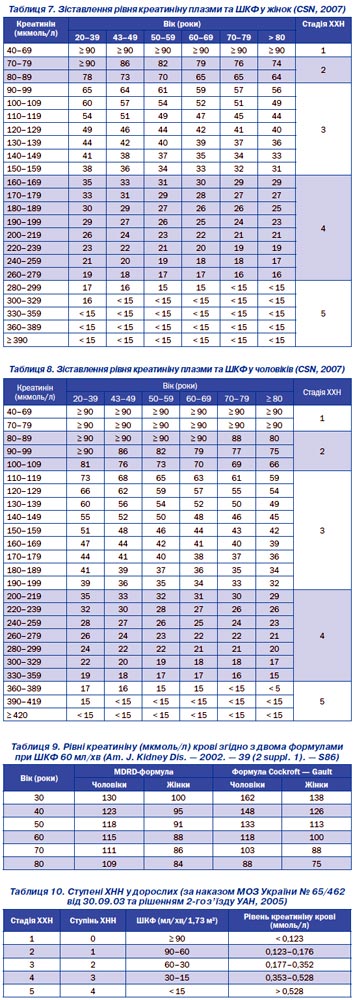
Для швидкого визначення ШКФ залежно від рівня креатиніну зручно користуватись таблицями (табл. 7, 8).
Як вже було зазначено, рівень креатиніну сироватки крові збільшується при зниженні ШКФ понад половину від норми. Крім того, рівень креатиніну крові залежить від віку, статі, раси та поверхні тіла пацієнта. Критичним із точки зору прогресування ХХН є зменшення ШКФ нижче 60 мл/хв.
Підстави для визначення ШКФ менше 60 мл/хв як межової полягають у наступному:
- наявність ШКФ вище зазначених цифр залишає час та можливість для лікування ниркового захворювання для попередження ХНН;
- це менше ніж половина нормальної ШКФ у дорослих;
- ШКФ нижче зазначеної дуже рідко має місце в нормі в осіб до 40 років;
- рівні нижче 60 мл/хв пов’язані зі зростанням рівня ускладнень ХХН;
- ШКФ нижче зазначеної асоційована з погіршенням прогнозу, зокрема кардіоваскулярних подій та смертності в пацієнтів із цукровим діабетом і без нього;
- такий межовий рівень та нижчі рівні можуть бути визначені за формулами розрахунку ШКФ, що базуються на рівні креатиніну крові.
Співвідношення ШКФ менше 60 мл/хв із рівнем креатиніну набувають вагомого значення зі збільшенням віку пацієнтів (табл. 9).
До 30 років ШКФ становить у середньому 125 мл/хв, потім починає знижуватись на 1 мл/хв кожен рік.
Існує перелік станів, за наявності яких ШКФ слід вимірювати за допомогою екзогенних маркерів (інуліну та радіонуклідних досліджень):
- екстремальні розміри тіла (індекс маси тіла < 19 та > 35 кг/м2);
- похилий вік;
- вагітність;
- порушення харчування або ожиріння;
- параплегія або тетраплегія;
- хвороби скелетних м’язів;
- вегетаріанська дієта;
- швидкі зміни функції нирок;
- необхідність призначення токсичних ліків, що виводяться нирками;
- у можливих донорів нирки;
- клінічні дослідження, в яких вплив на ШКФ є першочерговим показником.
Для більшої зручності та національної стандартизації рівень креатиніну крові можна (не зовсім коректно!) зіставити зі значеннями ШКФ у наказі МОЗ України. Ці значення затверджені 2-м з’їздом Української асоціації нефрологів як тимчасові (табл. 10).
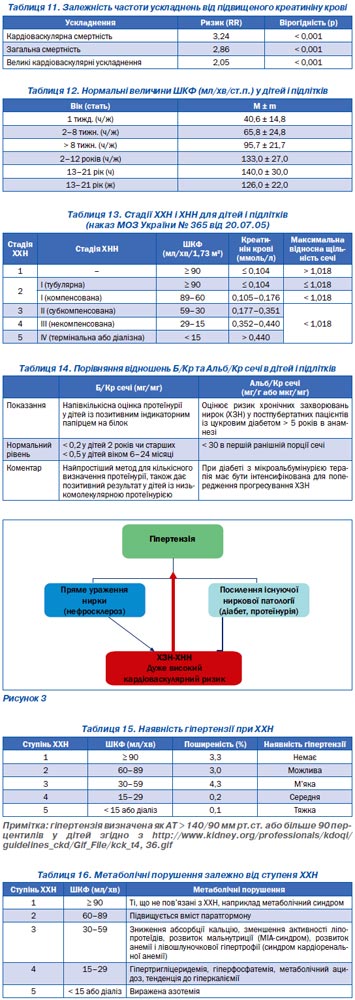
Зі зростанням креатиніну крові збільшується ризик розвитку фатальних епізодів. Так, у дослідженні HOT наведені дані про залежність клінічних ускладнень від рівня креатиніну крові, більшого за 130 мкмоль/л (табл. 11).
З огляду на ці дані ризик підвищеного креатиніну крові для настання смерті важливіший за інші фактори, наприклад наявність діабету або попереднього інфаркту міокарда.
У дітей нормальні рівні ШКФ наведені в табл. 12.
Класифікація ХХН і ХНН у дітей наведена в табл. 13.
ХХН сімейними лікарями найчастіше діагностується за наявності протеїнурії й гіпертензії, у тому числі на тлі цукрового діабету й кардіоваскулярних захворювань та в пацієнтів із обтяженим сімейним анамнезом ХХН. У нормі з сечею виділяється дуже мала кількість білка. Постійно підвищена екскреція білка, як правило, є маркером пошкодження нирок. Екскреція специфічних типів білків, таких як альбуміни або низькомолекулярні глобуліни, залежить від типу ураження нирок. Підвищена екскреція альбуміну — чутливий маркер ХХН, викликаних цукровим діабетом, гломерулярними хворобами та гіпертензією. Підвищена екскреція низькомолекулярних глобулінів є чутливим маркером деяких типів тубулоінтерстиціальних хвороб. У цьому положенні термін «протеїнурія» означає підвищену екскрецію з сечею альбуміну, інших специфічних білків або загального білка; «альбумінурія» означає специфічно підвищену екскрецію альбуміну; «мікроальбумінурія» — екскрецію альбуміну, вищу за нормальну, але нижчу за рівень, до якого чутливі індикаторні папірці для визначення загального білка.
У більшості випадків для виявлення та контролю протеїнурії слід використовувати випадкові разові порції сечі. Як правило, для цих досліджень немає необхідності в збиранні сечі тривалий час (нічні чи добові порції). Бажаною є перша ранкова порція, але випадкові порції прийнятні, якщо ранкова порція не зібрана. У більшості випадків скринінг із допомогою індикаторних папірців є прийнятним для виявлення протеїнурії:
1. Стандартний індикаторний папірець для сечі, прийнятний для виявлення підвищеного загального білка (може використовуватись амбулаторно лікарем).
2. Альбумінспецифічні індикаторні папірці прийнятні для виявлення альбумінурії.
3. У пацієнтів із позитивними тестами за допомогою індикаторних папірців (1+ чи більше) протеїнурія має бути підтверджена за допомогою кількісних методів (відношення білок/креатинін (Б/Кр) чи альбумін/креатинін (Альб/Кр)) протягом 3 місяців.
У пацієнтів, у яких два із трьох чи більше кількісних тестів, що розділені в часі 1–2 тижнями, виявились позитивними, слід діагностувати персистуючу протеїнурію та призначити їм подальше обстеження.
Усі пацієнти з ХХН повинні щорічно обстежуватись на наявність протеїнурії (1С).
Метод, що найчастіше використовується в розвинених країнах для виявлення протеїнурії у загальній практиці, — це індикаторний папірець, що в першу чергу виявляє альбумін і є нечутливим до низькомолекулярних білків. Кольорова реакція між альбуміном сечі та тетрабромфеноловим синім дає різні відтінки зеленого забарвлення залежно від концентрації альбуміну в зразку. Навпаки, коли клінічні лабораторії визначають «загальний білок», обладнання визначає як низько-, так і високомолекулярні глобуліни — додатково до альбуміну. В Україні індикаторний папірець використовується ще досить рідко.
Визначення білка в добовій сечі довгий час було золотим стандартом для кількісної оцінки протеїнурії. Альтернативним методом є вимірювання відношення білка або альбуміну до креатиніну в разовій порції сечі. Межовим є рівень у співвідношенні альбумін/креатинін понад 30 мг/г у дорослих та відповідно — у дітей і підлітків (табл. 14). Значення співвідношення альбумін/креатинін ≥ 300 мг/г у жінок та ≥ 200 мг/г у чоловіків відповідає терміну «макроальбумінурія» або «клінічна протеїнурія».
Ці відношення згладжують коливання концентрації білка в сечі внаслідок гідратації і є більш зручними, ніж збирання добової сечі. У більшості випадків саме разові порції сечі, а не добова сеча мають використовуватись для виявлення та контролю протеїнурії у дітей і підлітків.Найбільш прийнятною є перша ранішня порція, оскільки концентрація білка в сечі може значно коливатись протягом дня. Поширеність протеїнурії серед здорових дітей за даними великих досліджень, коли береться до уваги лише випадкова разова порція сечі, коливається від 5 до 15 %. Виявлення персистуючої протеїнурії в повторних зразках сечі в подібних дослідженнях зустрічається набагато рідше. Більшість дітей, у яких виявлено протеїнурію, що не реєструвалась при повторних обстеженнях, повинні розглядатись як такі, що мають транзиторну протеїнурію, доброякісний стан, що часто поєднується з гарячкою, стресом або фізичними навантаженнями.
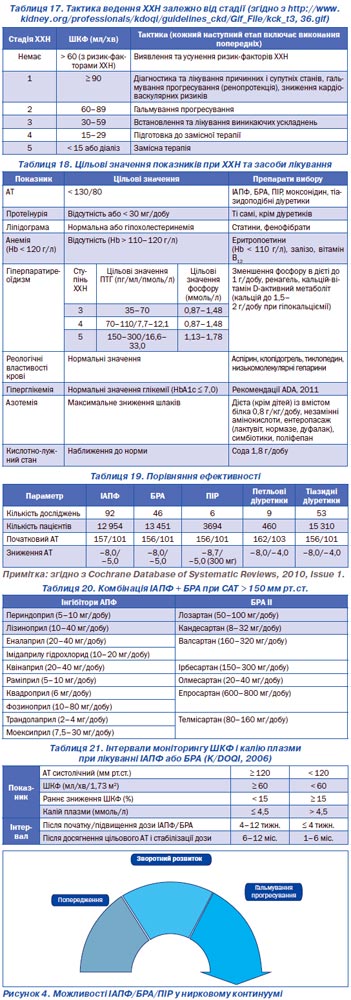
Гіпертензія — один із найчастіших проявів ХХН. Гіпертензія може бути причиною ХХН і навпаки: наявність ХНН завжди викликає гіпертензію de novo за рахунок розвитку гіперактивності симпатичної системи та еритропоетинзалізодефецитної анемії (рис. 3, табл. 15).
Лікувальна тактика гіпертензії базується на підтриманні АТ нижче 140/90 мм рт.ст., а за наявності протеїнурії 0,3–1,0 г/л або діабетичної нефропатії — менше за 130/90 мм рт.ст. Препаратами вибору є ІАПФ, БРА, прямі інгібітори реніну, діуретики, моксонідин та кальцієві блокатори, що не порушують ниркову гемодинаміку, насамперед лерканідипін. Зменшення САТ нижче 120 мм рт.ст. слід уникати (1В).
Другим за частотою після гіпертензії патологічним проявом ХХН є анемія, а потім метаболічні порушення (табл. 16).
Лікування пацієнтів із ХХН вимагає аналізу діагнозу, супутніх станів, гостроти хвороби, її ускладнень і ризику втрати функції нирок та серцево-судинних хвороб.
Лікування ХХН повинно поєднувати:
1. Специфічну терапію, основану на діагнозі.
2. Виявлення та лікування супутніх станів.
3. Уповільнення втрати функції нирок.
4. Профілактику та лікування серцево-судинних хвороб.
5. Профілактику та лікування ускладнень зниження функції нирок (таких як гіпертензія, анемія, ацидоз, затримка фізичного розвитку — для дітей).
6. Підготовку до терапії термінальної ниркової недостатності.
7. Заміщення функції нирок шляхом діалізу або трансплантації, якщо наявні симптоми уремії.
На основі стадії ХХН для кожного пацієнта має бути розроблений план клінічних дій. При цьому при кожному візиті пацієнта має здійснюватись перегляд засобів лікування, що має на меті:
1. Підбір доз на основі рівня функції нирок.
2. Виявлення потенційних несприятливих наслідків щодо функції нирок або ускладнень ХХН.
3. Визначення взаємодії лікарських засобів.
4. При можливості моніторинг вмісту ліків в організмі.
Залежно від установленої стадії ХХН пропонується така терапевтична тактика (табл. 17).
Терапевтична тактика ХХН та цільові значення наведені в табл. 18.
Практичні аспекти лікування ХХН
Оптимальне лікування ХХН гальмує прогресування до ХНН. На сьогодні доведено:
- ХХН може бути призупинена за темпом свого розвитку;
- лікування на більш ранніх стадіях більш ефективне;
- для всіх ступенів ХХН цільовим АТ є 130/80 мм рт.ст.;
- усім пацієнтам із ХХН призначається терапія препаратами, що пригнічують активність ренін-ангіотензинової системи (ІАПФ/БРА/ПІР) з метою уповільнення прогресування ниркової хвороби та/або зниження/недопущення розвитку мікроальбумінурії/протеїнурії;
- діуретики (перевага надається нетіазидним) повинні застосовуватись у більшості пацієнтів;
- підбір додаткових препаратів, що зменшують кардіоваскулярний ризик, для досягнення цільового тиску повинен здійснюватись згідно з офіційними рекомендаціями;
- пацієнти з ХХН складають групу більш високого ризику з виникнення ускладнень фармакологічної терапії, ніж загальна популяція, і відповідно повинні спостерігатися частіше;
- модифікація стилю життя для зменшення АТ і ризику кардіоваскулярної патології повинна рекомендуватися всім пацієнтам із ХХН.
Згідно з цими рекомендаціями NKF ХХН прирівнюється до коронарної хвороби серця. Зауважено також, що побічні дії при застосуванні препаратів, що знижують холестерин, можуть виникати за рахунок зниженої функції нирок. Також визначено, що лікування протеїнурії може бути складовою лікування дисліпідемії.
Антигіпертензивна ефективність ІАПФ, БРА та ПІР практично однакова (табл. 19).
Вибір препаратів груп ІАПФ та БРА досить великий (табл. 20).
Препарати, що виводяться переважно нирками (сірий сектор), мають дещо більш потужний ефект у зниженні АТ та протеїнурії, але потребують більш пильної уваги при зниженні функції нирок та зменшення дози при ШКФ нижче 30 мл/хв. Серед ІАПФ, що не потребують корекції при всіх ступенях ХХН, енала-прил (доза до 20 мг/добу), фозиноприл (40 мг/добу), зофеноприл (30 мг/добу), серед БРА не потребує корекції телмісартан. Відзначимо, що необхідність призначення ІАПФ/БРА обумовлена вже наявністю ХХН, тобто ІАПФ/БРА призначаються в тому числі пацієнтам, які не мають підвищеного АТ.
Серед ІАПФ та БРА перевага надається препаратам із кращою доказовою базою, а саме раміприлу, еналаприлу, периндоприлу/індапаміду, лізиноприлу, лозартану, олмесартану, ірбесартану.
Перевагою ІАПФ є суттєве зниження кардіоваскулярного ризику, ризику розвитку цукрового діабету 2-го типу та альбумінурії, перевагою БРА — зменшення ймовірності розвитку альбумінурії і здатність значно зменшувати протеїнурію та вірогідність розвитку цукрового діабету 2-го типу.
Призначення ІАПФ/БРА потребує контролю креатиніну (для розрахун-ку ШКФ) та калію сироватки крові (табл. 21).
Комбінація ІАПФ + БРА або БРА + ІАПФ несе в собі потенціальні ризики зниження ШКФ, але має більш потужний антипротеїнуричний ефект. При цьому найбільш важливим є недопущення розвитку мікроальбумінурії (олмесартан — RОADMAP, лозартан — RENAAL, периндоприл/індапамід — ADVANCE) (рис. 4). Згідно з метааналізом, у 21 708 пацієнтів (A. Maione et al., 2011) вірогідне зниження ризику нефатальних кардіоваскулярних подій спостерігається при застосуванні ІАПФ порівняно з плацебо, ІАПФ проти БРА, ІАПФ + БРА проти монотерапії. Розвиток ХНН і прогресування мікроальбумінурії в макроальбумінурію вірогідно знижується при призначенні ІАПФ порівняно з плацебо, БРА проти плацебо, і комбінація ІАПФ + БРА не має переваг проти монотерапії.
Зниження протеїнурії може суттєво не впливати на тривалість життя. Про це свідчать результати дослідження AVOID (Aliskiren in the Evaluation of Proteinuria in Diabetes), в якому призначали 300 мг аліскірену в поєднанні зі 100 мг лозартану при цукровому діабеті 2-го типу з артеріальною гіпертензією й альбумінурією впродовж 6 місяців. Використання моделі Маркова показало, що збільшення часу до термінальної ХНН, тривалості й якості життя склало 0,1772; 0,1021 і 0,0967 року відповідно. Тобто для продовження життя слід не допускати розвитку мікроальбумінурії, що, очевидно, і є справжньою ренопротекцією. Таким чином, абсолютна значущість незалежного від зниження АТ ефекту ренопротекції при блокаді ренін-ангіотензинової системи набагато менше, ніж ефект від самого зниження АТ. Тому сьогодні термін «ренопротекція» більшою мірою передбачає досягнення цільового АТ.
Серед інших антигіпертензивних препаратів, що пригнічують активність ренін-ангіотензин-альдостеронової системи, слід відзначити антагоністи альдостерону (спіронолактон, еплеренон), небіволол (доведене зниження смертності за рахунок зменшення центрального аортального тиску) та карведилол. Серед дигідропіридинових антагоністів кальцію перевага сьогодні надається лерканідипіну.
Ліпідознижуюча терапія є складовою захисту судин у корекції АТ і застосовується для первинної і вторинної профілактики. У нефрології доказова база недостатня, з опорою на кардіологічні дослідження можливе застосування симвастатину, аторвастатину, розувастатину та нового фенофібрату — трайкору (FIELD). Нагадаємо, що дослідження AURORA не показало яких-небудь переваг розувастатину в дозі 10 мг порівняно з плацебо в зниженні комбінованої кардіоваскулярної точки, інфаркту й інсульту впродовж 3,8 року застосування у 396 пацієнтів із ХНН на діалізі. Більш пізній аналіз показав відсутність різниці у ШКФ протягом двох років прийому аторвастатину між його високими (80 мг) та низькими (10 мг) дозами в пацієнтів із діабетичною нефропатією (М.К. Rutter, 2011).
Серед діуретиків перевага віддається тіазидоподібним (індапамід, ксипамід) або петльовим (торасемід). Слід пам’ятати, що торасемід має кращий порівняно з фуросемідом профіль із кардіоваскулярних ризиків. Проте в термінальній ХНН сечогінний ефект фуросеміду більше виражений. Доза індапаміду 0,625 або 1,25 мг/добу для тривалого прийому, ксипаміду — від 10 до 80 мг/добу (вище при меншій ШКФ!), торасеміду — від 5 до 200 мг/добу (при діабетичній хворобі нирок), фуросеміду — від 10 до 500 мг/добу (при діабеті). Великі дози торасеміду, фуросеміду та ксипогами призначаються 1–2 дні, потім 1–2 дні перерви. Враховуючи калійзберігаючий ефект ІАПФ/БРА, додаткове призначення калію при сечогінній терапії у пацієнтів із ХХН вважають недоцільним.
У 2010 році отримані доказові дані про додатковий ефект алопуринолу в зниженні лівошлуночкової гіпертрофії та збереженні ШКФ у пацієнтів із ХХН. У більшості пацієнтів із ХХН порушений пуриновий обмін per se або обумовлений призначенням ІАПФ/БРА. Тому є обґрунтованим застосування алопуринолу (за непереносимості — магнероту) в дозі 300–100 мг після сніданку 1 раз на добу.
Таким чином, основна комбінація для блокади ренін-ангіотензинової системи для досягнення цільового АТ < 130/80 мм рт.ст. та/або зменшення/недопущення розвитку мікроальбумінурії може бути представлена так:
1. Монотерапія ІАПФ/БРА/ПІР, за відсутності бажаного ефекту їх поєднання між собою або з тіазидоподібним діуретиком (ксипогама, індапамід) або петльовим (торасемід) із подальшою комбінацією з небівололом/карведилолом, або моксонідином, або лерканідипіном.
Для забезпечення якості та подовження життя також необхідні:
2. Терапія ниркової анемії: залізо + еритропоетинстимулюючий агент.
3. Зниження шлаків і фосфору (якщо необхідно): активний метаболіт вітаміну D2 або D3-цінакальцет або ренвела (ренагель) + некремнієвий ентеросорбент (поліфепан) + сода 1,8 г/добу.
4. Ліпідознижуюча терапія (аторвастатин, розувастатин, трайкор).
5. Антитромбоцитарна терапія (аспірин, тиклопедин, клопідогрель).
6. Алопуринол.
1. Иванов Д.Д. Лекции по нефрологии. — Донецк: Издатель Заслав-ский А.Ю., 2010. — 193 с.
2. http://therapy.irkutsk.ru/doc/city/crd2011a.pdf
3. Наказ АМН України та МОЗ Укра-їни «Про поліпшення якості та організації системи медичної допомоги дорослим хворим нефрологічного профілю» від 30 вересня 2003 року № 65/462.
4. Anonymous. Part 1. Executive sum-mary // Am. J. Kidney Dis. — 2002. — Vol. 39, Suppl. 1. — P. S17-S31.
5. Levey A.S. et al. Definition and classification of chronic kidney disease:A position statement from Kidney Diseases: Improving Global Outcomes (KDIGO) // Kidney Int. — 2005. — Vol. 67. — P. 2089-2100 / М. Колесник, М. Кулизький: Визначеннятакласифікаціяхронічноїхворобинирок: формуванняпозиціїдляполіпшенняглобальнихрезультатів(KDIGO).
6. REENA 2010 (CD)
7. www.aakp.org (American Association of Kidney Patients)
8. www.kidney.org/professionals/kdoqi/guidelines_bp/index.htm (National Kidney Foundation)
9. www.nephrology.kiev.ua (Перший Український нефрологічний сайт)
10. www.niddk.nih.gov (National Institute of Diabetes and Digestive and Kidney Diseases)
11. www.circ.ahajornals.org/cgi/content/full/109/5/672
12. www.niddk.nih.gov (National Institute of Diabetes and Digestive and Kidney Diseases)
13. Macaulay A. Onuigbo // Nephron Clin. Pract. — 2009. — 113. — c63-c70.
14. Delea T.E., Sofrygin O., Palmer J.L. et al. Cost-effectiveness of aliskiren in type 2 diabetes, hypertension, and albuminuria // J. Am. Soc. Nephrol. — 2009 Oct. — 20(10). — 2205-13. Epub 2009 Sep 17. (Original) PMID: 19762496
15. http://plus.mcmaster.ca/EvidenceUpdates/NewArticles.aspx?Page=1&ArticleID=37938#Data
16. Хроническая болезнь почек. Рекомендации по диагностике и лечению / Под ред. Ф.И. Белялова и Н.Н. Винковой. — Иркутск, 2011. — 27 с. http://therapy.irkutsk.ru/doc/city/crd2011a.pdf
17. Rutter M.K., Prais H.R., Charlton-Menys V. et al. Protection Against Nephropathy in Diabetes with Atorvastatin (PANDA): a randomized double-blind placebo-controlled trial of high- vs. low-dose atorvastatin(1) // Diabet. Med. — 2011 Jan. — 28(1). — 100-8. doi: 10.1111/j.1464-5491.2010.03139.x. (Original) PMID: 21166851
18. Upadhyay A., Earley A., Haynes S.M. et al. Systematic review: blood pressure target in chronic kidney disease and proteinuria as an effect modifier // Ann. Intern. Med. — 2011 Apr 19. — 154(8). — 541-8. Epub 2011 Mar 14. (Review) PMID: 21403055
19. http://www.renal.org/Clinical/Guide-linesSection/Detection-Monitoring-and-Care-of-Patients-with-CKD.aspx
20. Maione A. et al. // Nephrol. Dial. Transplant. — 2011. — 26. — 2827-2847.