Газета «Новости медицины и фармации» Неврология (413) 2012 (тематический номер)
Вернуться к номеру
Коррекция холинергической недостаточности у больных с острой и хронической цереброваскулярной патологией
Острые нарушения мозгового кровообращения и черепно-мозговые травмы (ЧМТ) являются одними из ведущих причин летальности и инвалидизации больных. По данным ВОЗ, ежегодно регистрируется около 7 млн случаев инсультов и 1,4 млн черепно-мозговых травм. Нередко при данных видах патологии возникают депрессивные расстройства, нарушения когнитивных и мнестических функций, которые существенно влияют на течение основного заболевания, способствуя развитию осложнений, ухудшая его прогноз и серьезно нарушая процесс социальной адаптации больных.
18–20 апреля в г. Судаке состоялась XIV Международная конференция «Возрастные аспекты неврологии», на которой были рассмотрены вопросы совершенствования диагностики и принципы эффективной восстановительной терапии цереброваскулярных заболеваний и ЧМТ.
Перспективные направления применения холина альфосцерата в клинике неотложных состояний обсуждались в докладе доктора медицинских наук, профессора, заведующего кафедрой медицины неотложных состояний, медицины катастроф и военной медицины ХМАПО, действительного члена Международной академии ЭИН В.В. Никонова.
Препарат Глиатилин (холина альфосцерат) появился на мировом фармацевтическом рынке несколько десятков лет назад. Сегодня он широко применяется в лечении поражений мозга различной этиологии, в том числе токсического генеза, при острой церебральной недостаточности, связанной с травмой, инфарктом мозга, инсультом, гипоксической энцефалопатией. Многолетний международный опыт его применения в медицине неотложных состояний позволяет рекомендовать его введение уже на догоспитальном этапе, что очень важно в прогностическом плане у пациентов с церебральными повреждениями.
Хорошо известно, что возникающая вследствие прекращения кровотока гипоксия ткани мозга приводит к разрушению мембран и истощению энергетических ресурсов, что сопровождается многочисленными функциональными и морфологическими нарушениями. Гипоксия мозга может развиваться при заболеваниях сердечно-сосудистой си-стемы — инфаркте миокарда, сердечной недостаточности, гипертонической энцефалопатии, гипотонических состояниях, шоках различного генеза, в том числе при кардиогенном шоке. Поэтому первоочередной задачей врача является назначение такому пациенту препаратов, повышающих толерант-ность ткани мозга к гипоксическому повреждению.
Еще в середине 70–80-х годов прошлого века было показано, что фосфолипиды биологических мембран играют важную роль в регуляции функционирования как самой клетки, так и ткани мозга. В условиях гипоксии первыми поражаются биологические мембраны, что требует проведения мероприятий для восстановления их целостности и обеспечения восстановления функции нейрона, межнейрональных взаимодействий и мозга в целом. Поэтому оптимальным считается назначение фосфолипидов и диацетилированных фосфолипидов, поддерживающих целостность биологических мембран и нормализующих их функцию.
Одним из ведущих медиаторов нервной системы является ацетилхолин, который оказывает нейропротективный и нейротрофический эффекты. Такие факторы, как возраст, сосудистые заболевания, травмы, стрессы, приводят не только к дефициту ацетилхолина, но и к снижению чувствительности рецепторного аппарата к остаточному количеству этого медиатора. В свою очередь, ацетилхолинергическая недостаточность нарушает работу не только центральной нервной системы, но и всех систем организма, приводя в том числе к развитию эндотелиальной дисфункции.
Фармакологическое действие центрального холиномиметика холина альфосцерата многогранно. Он является источником холина и других важных веществ — мембранных фосфолипидов, поэтому при его примене-нии восстанавливается физиологически оптимальный уровень ацетилхолина, стабилизируются нейрональные мембраны, восстанавливается межнейрональная трансмиссия. Применение холина альфосцерата не сопровождается развитием характерных для данной группы лекарственных средств побочных эффектов, что свидетельствует о высоком профиле его безопасности. В частности, он не связывается с ацетилхолиновыми рецепторами, не оказывает влияния на активность холин-эстеразы, не вмешивается в механизмы церебральной ауторегуляции. Холина альфосцерат играет важную роль в восстановлении сознания и устранении когнитивных нарушений. Так, при применении Глиатилина у пациентов с острым нарушением мозгового кровообращения в рамках многоцентрового пилотного клинического исследования (GLIA, Одинак, 2010) на базе трех клинических центров России существенно ограничивался рост зоны инфаркта мозга с первых суток терапии.
На 90-е сутки объем кортикального поражения по данным МРТ приближался по величине к зоне некроза. Таким образом, холина альфосцерат (Глиатилин) продемонстрировал способность повышать выживаемость нейронов зоны ишемической полутени в острый период мозговой катастрофы, когда еще продолжается формирование очага, что позволяет в значительной степени повлиять на тяжесть исхода инсульта (рис. 1).
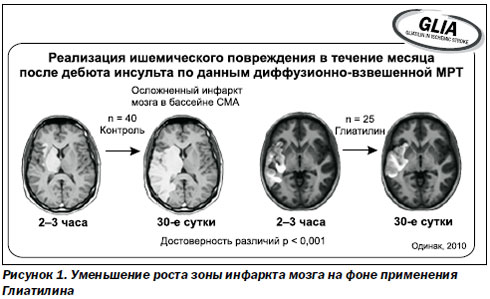
Далее профессор привел результаты исследования, проведенного на базе клиники кафедры медицины неотложных состояний, медицины катастроф и военной медицины ХМАПО. Целью исследования было изучение эффективности и безопасности применения холина альфосцерата при острой церебральной недостаточности на фоне ишемического инсульта и черепно-мозговой травмы. Полученные результаты еще раз подтвердили способность холина альфосцерата (Глиатилина) уменьшать длительность коматозного состояния, улучшать когнитивные и мнестические функции, ускорять пробуждение пациента, а также ускорять регресс очаговой неврологической симптоматики, уменьшать длительность пребывания больных на искусственной вентиляции легких (ИВЛ), что очень важно для больных с инсультом, черепно-мозговой травмой и политравмой. Известно, что уменьшение сроков пребывания пациентов на ИВЛ снижает частоту развития вентилятор-ассоциированных пневмоний и других тяжелых осложнений.
Как было показано в данном исследовании, уровень сознания у пациентов с ишемическим инсультом в группе холина альфосцерата на 2-е сутки был значительно выше, с более быстрым пробуждением, чем у больных группы сравнения. На 5-е сутки разница в степени восстановления сознания и улучшении состояния больных в среднем составила около 30 % с лучшими показателями в группе холина альфосцерата (Глиатилина).
У больных с ЧМТ применение холина альфосцерата (Глиатилина) сопровождалось более быстрым восстановлением сознания, двигательной активности и восстановлением самостоятельного дыхания, что чрезвычайно важно в прогностическом плане. Также показан значительно более быстрый регресс очагового неврологического дефицита в постреанимационном периоде в группе больных, которым назначили холина альфосцерат (Глиатилин).
Перспективность применения холина альфосцерата (Глиатилина) у больных хирургического профиля связана с улучшением временных характеристик восстановления функции внешнего дыхания и двигательной активности в постоперационном периоде. Введение холина альфосцерата (Глиатилина) за 20–30 минут до окончания длительного и травматичного оперативного вмешательства значительно улучшает течение послеоперационного периода со значительно лучшим прогнозом в плане выздоровления. Так, в исследовании первые признаки восстановления сознания у больных группы Глиатилина отмечались через 50 минут после окончания оперативного вмешательства, у больных контрольной группы — на 91-й минуте. Самостоятельное дыхание через интубационную трубку у больных, которым был введен Глиатилин, по-явилось на 25-й минуте, в контрольной группе — на 63-й минуте. Экстубация трахеи в группе Глиатилина проведена на 61-й минуте, в контрольной группе — на 150-й минуте. Такое существенное снижение времени пребывания на ИВЛ у больных в тяжелом состоянии, их более быстрое пробуждение снижает риск развития послеоперационных осложнений в дальнейшем (рис. 2).
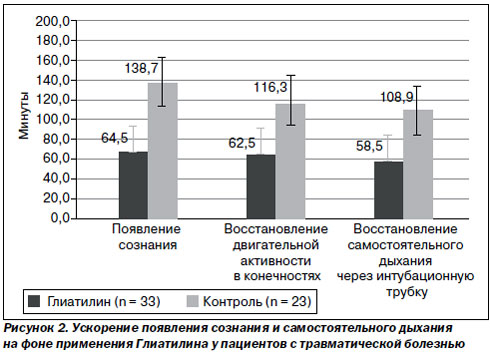
Также в группе Глиатилина выявлен еще один эффект — улучшение моторно-эвакуаторной функции желудочно-кишечного тракта на 3-и – 4-е сутки, что связывают с опосредованным влиянием на синаптическую передачу в кишечной стенке.
Таким образом, пробуждающий эффект, который обеспечивается введением Глиатилина в дозе 1–4 г/сут, восстановление высших корковых функций, быстрое восстановление сознания пациента, а также обеспечение защиты мозга при длительном наркозе и при политравме на догоспитальном этапе важны в практике врача-анестезиолога и интенсивиста.
Доцент кафедры неврологии и медицинской генетики Донецкого нацио-нального медицинского университета им. М. Горького, к.м.н. Т.В. Черний рассказала о коррекции холинергической недостаточности в восстановительном периоде лечения травматической болезни головного мозга и мозгового инсульта.
В настоящее время выделяют два основных направления патогенетической терапии ишемии головного мозга: восстановление нарушенного кровотока в ишемизированном участке и нейропротекцию, в основе которой лежит обеспечение метаболической защиты мозга, предупреждение развития фокальной ишемии на клеточном и молекулярном уровнях и коррекция ее последствий. Нейропротекция обеспечивает увеличение длительности периода выживания нейронов в условиях ишемического поражения головного мозга, при ее своевременном применении можно добиться торможения механизмов реакций ишемического каскада, приводящих к гибели клетки.
Основными направлениями нейропротективной терапии являются:
— коррекция энергетического обмена путем снижения повреждающего действия гипоксии и уменьшения энергетических потребностей нейронов;
— стимуляция окислительно-восста-новительных процессов и усиление утилизации глюкозы;
— торможение высвобождения воз-буждающих медиаторов (глутамат, аспартат), обладающих эксайтотоксическим действием;
— стимуляция систем нейротранс-миссии и нейромодуляции.
Одним из наиболее перспективных направлений метаболической защиты мозга от ишемии считается непосредственное воздействие на системы нейротрансмиттеров и нейромодуляторов головного мозга, на нейрональные рецепторы, а также нормализация соотношения процессов возбуждающей и тормозной нейротрансмиссии.
Как правило, следствием церебральной недостаточности является возникновение когнитивных нарушений, в основе которых лежит холинергическая недостаточность, обусловленная снижением выработки ацетилхолина и потерей холинергических нейронов.
Существует два достаточно известных класса медикаментозных препаратов, действие которых направлено на преодоление холинергической недостаточности:
1. Препараты — предшественники холина: центральный холинергический препарат холина альфосцерат (L-альфа-глицерилфосфорилхолин, альфа-GPC, Глиатилин), являющийся прекурсором ацетилхолина, проникающим через гематоэнцефалический барьер; цитидин-5-дифосфохолин натрия (СDР, цитиколин), который является донором холина в процессах синтеза ацетилхолина.
2. Ингибиторы ацетилхолинэстеразы: прозерин, галантамин, нейромидин.
В исследованиях J.L. Saver et al. (2010) было установлено, что предшественники холина: лецитин, цитиколин (цераксон, Nycomed) и холина альфосцерат (Глиатилин, Italfarmaco) — это экзогенные средства, которые в организме превращаются в холин. Они обеспечивают восстановление и синтез de novo фосфолипидов клеточных мембран, участвуют в синтезе нейромедиаторов ацетилхолина и дофамина. Обладают высокой эффективностью при лечении многих неврологических заболеваний, включая ишемический и геморрагический инсульт, ЧМТ. Имеют крупнейшую доказательную базу.
Глиатилину присущ следующий механизм нейропротективного действия: из активного вещества в головном мозге происходит высвобождение холина, который участвует в биосинтезе ацетилхолина — одного из основных медиаторов нервного возбуждения. Он широко представлен в различных отделах нервной системы: базальных ганглиях и таламусе, сером веществе полушарий, хвостатом ядре, ядрах моста, передних рогах боковых желудочков, вегетативных образованиях ЦНС. Ацетилхолин улучшает обмен информацией между нейронами, а также положительно воздействует на мембранную пластичность, что, в свою очередь, позитивно влияет на синаптическую трансмиссию. Альфосцерат биотрансформируется до глицерофосфата, являющегося предшественником фосфолипидов, участвует в синтезе фосфатидилхолина, обеспечивая улучшение эластичности мембран и функции рецепторов.
Механизм действия доноров холина (D. Orlando, 1995) основывается на усилении синтеза фосфатидилхолина. Это обусловливает восстановление нейронной мембраны, вследствие чего восстанавливается функциональная ак-тивность нейронов. Происходит ослабление и накопление свободных жирных кислот на участках вызванного инсультом повреждения нервов, что защищает клетки от повреждения. За счет интенсификации производства ацетилхолина восстанавливаются поврежденные холинергические нейроны и улучшаются двигательные функции (рис. 3).
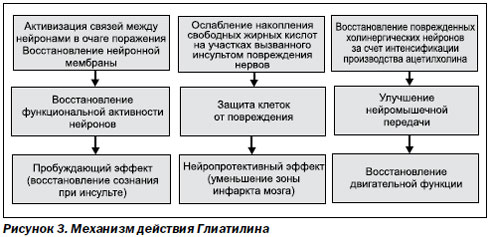
По данным зарубежных исследований L. Parnetti, J.L. Saver (2001), цитиколин и Глиатилин, обеспечивая нейропротективное действие при острой церебральной ишемии, обладают еще и преимущественными эффектами по сравнению друг с другом.
Преимущественные эффекты цитиколина:
— прямая репарация нейрональных мембран;
— уменьшение дегенерации свободных жирных кислот.
Преимущественные эффекты Глиатилина:
— повышение продукции медиатора ацетилхолина;
— выделение ацетилхолина из терминалей в ответ на введение препарата (дозозависимый эффект).
В качестве нейропротективной терапии возможно назначение нейромидина — антихолинэстеразного препарата, стимулятора нервно-мышечной проводимости. Он улучшает передачу импульсов на уровне синаптической щели вследствие блокирования действия холинэстеразы, разрушающей медиаторы, тем самым увеличивая их количество и усиливая активность пост-синаптической клетки.
На базе кафедры были проведены исследования по определению эффективности применения Глиатилина, цитиколина и нейромидина у пациентов с острыми церебральными нарушениями различного генеза: инсультами в левом и правом полушариях, ЧМТ. Использовался метод интегрального количественного анализа ЭЭГ-паттернов и изучения реактивности мозга в ответ на применение препаратов.
Проводилась оценка клинических форм расстройств сознания, глубина коматозного состояния пациентов определялась по шкале Глазго и Скандинавской шкале инсультов. Регистрация биопотенциалов мозга осуществлялась с помощью нейрофизиологического комплекса, состоящего из 8-канального электроэнцефалографа фирмы Medicor, ПК IBM PC AT с аналого-цифровым преобразователем и специальным программным обеспечением Brain Mapping.
ЭЭГ-исследования проводились за 30 мин до введения и через 30 мин после введения препаратов: Глиатилина, цитиколина и нейромидина.
Протокол записи ЭЭГ включал регистрацию биопотенциалов головного мозга пациентов в покое, с последующей ахроматической ритмической фотостимуляцией (ФТС) частотой 2 и 10 Гц. Изучались показатели межполушарной когерентности и абсолютной спектральной мощности (АСМ) для тета- и дельта-частотных диапазонов ЭЭГ в формировании целостного паттерна ЭЭГ. Расчет интегральных коэффициентов производили суммарно по правому и левому полушарию.
Реактивность мозга оценивали по изменению спектральной мощности исследуемых диапазонов в ответ на фармакологическое воздействие (введение нейротропного препарата) и интегральных коэффициентов на основании классификации типов реакции ЦНС.
Типы реакций ЦНС
I тип — отсутствие достоверных изменений показателей АСМ.
II тип, подгруппы 1а, 1б — увеличение СМ ЭЭГ-паттерна.
II тип, подгруппы 2а, 2б— уменьшение СМ ЭЭГ-паттерна.
III тип, подгруппы 1а, 1б — пере-распределение ЭЭГ-мощности.
III тип, подгруппы 2а, 2б — пере-распределение ЭЭГ-мощности.
III тип, подгруппы 3а, 3б — пере-распределение ЭЭГ-мощности.
ЭЭГ больных были разделены на 4 группы в зависимости от недостаточности модулирующих систем мозга.
Усвоение навязываемого ритма световых мельканий при фотостимуляции свидетельствовало о функциональной состоятельности активирующей системы ретикулярной формации ствола, базальной холинергической системы переднего мозга и активирующей-инактивирующей системы неспецифического таламуса (таламокортикальной системы).
Затем пациентам всех 4 групп проводили исследование после введения Глиатилина, цитиколина, нейромидина.
В 1-й группе при воздействии низкочастотной (2 Гц) ФТС усваивался навязываемый дельта-ритм, при высокочастотной (10 Гц) ФТС имелась тенденция к усвоению навязываемого ритма.
На основании этого был сделан вывод, что в условиях сохранности всех звеньев холинергической системы моз-га фармакологические эффекты Глиатилина реализуются на корковом и корково-подкорковом уровнях. Аналогично реализуются эффекты цитиколина. При введении нейромидина отмечено до 25 % ареактивных реакций.
Во 2-й группе при действии низкочастотной (2 Гц) и высокочастотной (10 Гц) ФТС усвоения навязываемого ритма не выявлено.
Таким образом, при недостаточности всех звеньев холинергической системы мозга фармакологические эффекты Глиатилина реализуются преимущественно на корковом уровне, т.е. преобладают реакции III типа (60 % реакций). Было выявлено до 10 % ареактивных реакций, так же реализовались эффекты цитиколина. Нейромидин продемонстрировал до 20 % ареактивных реакций при одинаковом соотношении корковых и корково-подкорковых реакций.
В 3-й группе при высокочастотной (10 Гц) ФТС отмечалось усвоение навязываемого альфа-ритма.
Это позволило сделать заключение, что при функциональной сохранности всех звеньев холинергической системы мозга фармакологические эффекты Глиатилина реализуются преимущественно на корково-подкорковых уровнях (75 %), т.е. характерно преобладание реакций II типа. Фармакологические эффекты цитиколина соответствуют таковым Глиатилина. Нейромидин вызвал до 30 % ареактивных реакций при преобладании корковых реакций.
В 4-й группе при действии высокочастотной (10 Гц) ФТС усвоение навязываемого альфа-ритма не регистрировалось, усваивались ритмы других диапазонов.
То есть в условиях относительной сохранности активирующей базальной холинергической системы фармакологические эффекты Глиатилина, цитиколина и нейромидина реализуются на корковом уровне — преобладание реакций III типа (60 %). Нейромидин продемонстрировал до 20 % ареактивных реакций.
На основании проведенных исследований можно сделать заключение, что у нейромидина при выраженной функ-циональной недостаточности отдельных звеньев холинергической системы, как и в условиях сохранности всех ее звеньев, фармакоэффекты не связаны в полной мере с антихолинэстеразным (а значит, холиномиметическим) действием препарата в условиях острой церебральной недостаточности, клеточной гипоксии и гипоэргоза (недостаточность АТФ).
Эффекты нейромидина связаны с его способностью блокировать калиевые каналы мембран возбужденной клетки, поэтому она дольше находится в деполяризованном состоянии, дольше не может передавать новый импульс, снижается частота передачи сигналов.
По данным J.L. Saver, цитиколин увеличивает синтез дофамина, вероятно, за счет усиления активности тирозингидроксилазы, тормозящей обрат-ный захват дофамина в нервные окончания. Он угнетает образование свободных жирных кислот, индуцирует синтез ацетилхолина и увеличивает содержание норадреналина и дофамина в нервной ткани. Кроме этого, цитиколин способен ингибировать глутамат-индуцированный апоптоз и усиливать механизмы нейропластичности. Доказанные эффекты цитиколина позволяют широко назначать его при ЧМТ, острой и хронической ишемии.
Принципиальным отличием холина альфосцерата (Глиатилина) является способность нормализовывать уровень ацетилхолина (от холина Глиатилин отделяет одна неэнергозатратная реакция). Его можно успешно применять при лечении ЧМТ и мозговых инсультов, так как он обеспечивает регресс психических функций, восстановление памяти, праксиса, внимания, речи, уменьшает двигательные расстройства при наличии парезов и параличей, обеспечивает регресс афатических и амнестических проявлений, повышение общей работоспособности, уменьшение астенических явлений (рис. 4).
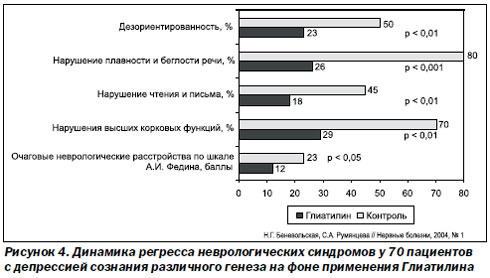
Поэтому в условиях функциональной состоятельности базальной холинергической системы переднего мозга (1-я и 3-я группы) преобладали реакции ЦНС II типа, отражающие функциональные изменения корково-подкорковых взаимодействий, и при этом не было зафиксировано гипо- и ареактивных реакций. Если базальная холинергическая система переднего мозга функционально несостоятельна (2-я и 4-я группы), то преобладали корковые реакции ЦНС III типа (62,9 %), из которых доминировали реакции III типа подгруппы 2а (44,4 %) с активацией альфа-ритма. Гипо- и ареактивные реакции составляли до 16 % всех реакций ЦНС.
Таким образом, назначение Глиатилина как нейропротектора может быть рекомендовано в остром периоде ЧМТ, преимущественно со стволовыми нарушениями (в том числе при нарушении сознания, коматозном состоянии), при нарушениях мозгового кровообращения по ишемическому (острый и восстановительный период) и геморрагическому типу (восстановительный период), при хронической цереброваскулярной недостаточности, а также деменции различного генеза.
Подготовила Татьяна Чистик
