Газета «Новости медицины и фармации» Неврология (413) 2012 (тематический номер)
Вернуться к номеру
Виникнення цереброваскулярних захворювань на тлі асоціації герпетичної та ентеровірусної інфекції
Авторы: Н.С. Турчина, В.Ю. Крилова, П.П. Уніч - Національний медичний університет імені О.О. Богомольця, м. Київ
Версия для печати
Як відомо, до основних предикторів розвитку цереброваскулярних захворювань належатьартеріальна гіпертензія; атеросклероз судин; гіперхолестеринемія (> 5,2 ммоль/л); патологія серця: ішемічна хвороба, миготлива аритмія, фібриляція передсердь, пролапс мітрального клапана, інфаркт міокарда, постінфарктні аневризми, тромби в порожнині лівого шлуночка, ревматичні ураження серця, штучні клапани серця (1); стенози або оклюзія магістральних артерій голови, цукровий діабет, наявність в анамнезі транзиторної ішемічної атаки (ТІА) або інсульту; прийом оральних контрацептивів у жінок, генетичні фактори (2) тощо.
У виникненні порушень мозкового кровообігу має значення інфекційний чинник. Зокрема, гострі та хронічні інфекції пов’язані з такими системними проявами запалення, як підвищення в плазмі крові концентрації фібриногену, С-реактивного білка, інтерлейкінів-6,-8 (ІЛ-6, ІЛ-8) додатково підвищують ризик виникнення цереброваскулярних захворювань.
Результати нещодавно проведених досліджень показали, що за наявності цитомегаловірусної інфекції зростає рівень кріоглобулінів, а відтак зростає ризик тромбоутворення [4]. Інфекційний фактор, що передує гострим цереброваскулярним подіям або виникає після їх розвитку, ускладнює їх перебіг у третині випадків і негативно впливає на наслідки захворювання [3].
Здебільшого розвиток ЦВЗ зумовлений коаліцією ризик-факторів: поєднанням атеросклерозу з артеріальною гіпертензією, артеріальної гіпертензії з цукровим діабетом або атеросклерозу з артеріальною гіпертензією і цукровим діабетом. Дослідження будови судинної стінки підтвердили можливість існування вірусної інфекції в ній. Поглиблене вивчення патофізіології атеросклеротичного процесу свідчить, що відкладання холестерину, формування атеросклеротичної бляшки, імовірно, починається у місці пошкодження ендотелію судини вірусом простого герпесу, який потрапляє під час вірусемії в кров’яне русло. Для ілюстрації наводимо можливий механізм формування атеросклеротичної бляшки на тлі герпесвірусної інфекції (рис. 1).
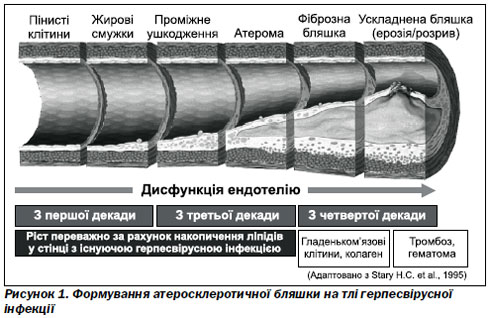
Відомі 6 патогенних вірусів, що мають певний вплив на розвиток атеросклеротичного процесу: віруси герпесу 1-го, 2-го, 6-го типів, вірус Епштейна — Барр, цитомегаловірус та ентеровірус. Навіть виведено індекс залежності підвищення ризику виникнення мозкового інсульту від асоційованої інфекції та інфекційного навантаження [6]. Отже, інфекція є досить важливим предиктором розвитку ЦВЗ, може зумовлювати їх виникнення за рахунок пошкодження ендотелію судин, запальних механізмів, які виникають на тлі асоційованих інфекцій [5].
Значно частіше на розвиток ЦВЗ впливає саме асоціація вірусної інфекції та інших ризик-факторів. Проте у вітчизняній літературі цій важливій проблемі присвячені лише поодинокі дослідження.
Мета дослідження:покращити діа-гностику та ефективність лікування хворих на ЦВЗ на тлі герпес- та ентеровірусної інфекції.
Матеріал та методи
Проведено комплексне клініко-лабораторне обстеження 66 хворих (чоловіків — 27; жінок — 39) віком від 65 до 85 років із різними клінічними формами ЦВЗ, асоційованими з вірусною інфекцією, які становили основну групу. Серед обстежених у 9 пацієнтів були минущі порушення мозкового кровообігу, у 37 — гострі ішемічні інсульти, у 2 — внутрішньомозкові крововиливи, у 18 — дисциркуляторна атеросклеротична та гіпертонічна енцефалопатія ІІ ст. Контрольну групу становили 65 пацієнтів, у яких не виявлено асоціації вірусної інфекції: 27 хворих із гострим ішемічним інсультом та 38 — із дисциркуляторною атеросклеротичною та гіпертонічною енцефалопатією ІІ ст.
Для клініко-неврологічного дослідження хворих на інсульт використовували Скандинавську шкалу інсульту та модифіковану шкалу Ренкіна (мШР), проводили нейровізуалізацію за допомогою спіральної комп’ютерної томографії (СКТ) або магнітно-резонансної томографії (МРТ) головного мозку, визначали протромбіновий індекс (ПТІ), рівень холестерину; проводили допплерографічні дослідження магістральних судин голови та інтракраніальних артерій. У сироватці крові визначали вміст антитіл IgG та IgM до вірусів простого герпесу 1-го, 2-го, 6-го типів, Епштейна — Барр, цитомегаловірусу, ентеровірусу. Методом визначення вірусних антигенів у культурі клітин досліджували наявність вірусної інфекції. Культуру клітин, чутливу до зазначених вірусів, вирощували в плашках. Для ідентифікації вірусу клітини заражали культуральним сере-довищем. Інкубація заражених плашок проводилась в умовах температури 37 °C + 5% CO2. Облік цитопатогенної дії проводили протягом 6–7 діб.
Результати досліджень
Аналіз результатів вірусологічного дослідження виявив вірогідну різницю вмісту антитіл IgG та IgM до вірусів герпесу 1-го, 2-го, 6-го типів, а також вірусу Епштейна — Барр, цитомегаловірусу та етеровірусу в крові пацієнтів основної групи порівняно з контрольною групою. Зокрема, серед 9 хворих із минущими порушеннями мозкового кровообігу в 7 хворих із церебральним гіпертонічним кризом спостерігалась асоціація вірусів герпесу 1-го, 2-го типів, вірусу Епштейна — Барр, цитомегаловірусу, ентеровірусу, у 2 пацієнтів із ТІА — асоціація вірусів герпесу 1-го, 2-го типів та бактерії Сhlamidia pneumonia. Серед 39 хворих на інсульт у 37 пацієнтів з ішемічним інсультом найпоширенішою була асоціація вірусів герпесу 1-го, 6-го типів, вірусу Епштейна — Барр, цитомегаловірусу, ентеровірусу, у 2 пацієнтів із внутрішньомозковим крововиливом — асоціація вірусу Епштейна — Барр, бактерії Chlamidia pneumonia. У 18 хворих на дисциркуляторну атеросклеротичну та гіпертонічну енцефалопатію виявляли асоціацію вірусів герпесу 1-го, 2-го типів.
Інфекція значно ускладнювала клінічний перебіг ЦВЗ. Неврологічний дефіцит у хворих на гострий інсульт за Скандинавською шкалою в осіб основної групи становив 46 ± 10 балів, що відповідало інсульту середньої тяжкості, у контрольній групі — 54 ± 10 балів, інвалідизація за мШР у хворих основної групи — 2–3 бали, у хворих контрольної — 1–2 бали.
У всіх хворих основної групи спостерігались зміни внутрішньої судинної стінки на УЗДГ: високий цереброваскулярний ризик зумовлювало потовщення комплексу інтима-медіа, що призводило до стенозу внутрішньої сонної або хребтових артерій. Такі структурні зміни судинної стінки, безумовно, могли бути спричинені асоціацією вірусної інфекції (рис. 2, 3).
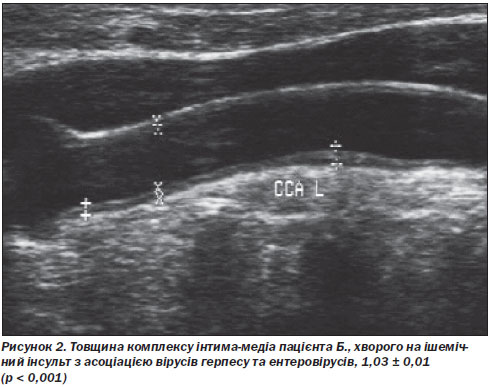
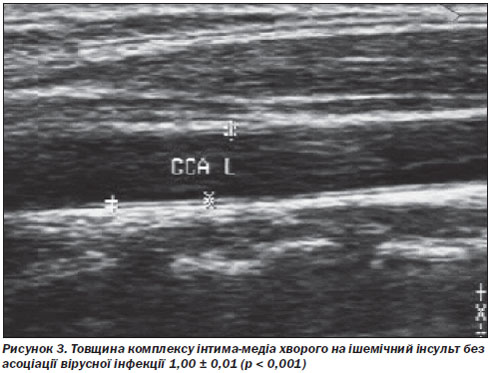
За даними СКТ- та МРТ-досліджень у хворих основної та контрольної груп підтверджена наявність змін, що відповідають осередку інсульту або дисциркуляторної енцефалопатії, обумовленої перенесеними в анамнезі лакунарними інфарктами.
У хворих основної групи спостерігалось підвищення рівня ПТІ (87,14 ± 1,20 %) та сироваткового холестерину (6,39 ± 0,22 ммоль/л). На тлі інфекційного фактора виявлено підвищення параметрів в’язкості крові. У контрольній групі були нижчі показники ПТІ (84,9 ± 1,2 %) та сироваткового холестерину (5,28 ± 0,22 ммоль/л). Отже, параметри в’язкості крові у пацієнтів контрольної групи були більш сприятливими.
Лікування хворих основної групи із гострими порушеннями мозкового кровообігу на тлі асоційованої інфекції проводили комплексно з використанням препаратів різних фармакологічних груп: специфічної терапії ішемічного та геморагічного інсульту; нейропротекторів (цераксон, корвітин, актовегін); антиагрегантів (аспірин, плавікс), а також через 10 днів після початку захворювання додавали противірусну терапію: гевіран по 800 мг 5 разів на добу протягом 5 діб, одночасно призначали циклоферон по 2 мл один раз на добу внутрішньом’язово протягом 2 днів, а потім через день 8 ін’єкцій, якщо до асоціації входили віруси герпесу 1-го та 2-го типів, або поліоксидоній 6 мг у розведенні на 2 мл протягом 2 днів, а відтак 1,5 мл упродовж 8 днів, якщо до асоціації входив вірус герпесу 6-го типу. Профілактичні курси лікування: вальтрекс 500 мг 3 рази на добу протягом 10 діб призначались двічі або тричі на рік.
Хворим основної групи з дисциркуляторною енцефалопатією на тлі асоційованої інфекції також призначали вазоактивні та нейропротекторні препарати, а через 10 днів після надходження додавали вальтрекс 500 мг 3 рази на добу протягом 10 діб. Одночасно призначали циклоферон по 2 мл один раз на добу внутрішньом’язово протягом 2 днів, потім через день — 8 ін’єкцій. Використовували також аміксин по 1 таблетці двічі на день упродовж 2 днів, потім по 1 таблетці один раз на 2 дні протягом місяця, а потім проводили профілактичні курси лікування 2 рази на рік.
Після стаціонарного лікування хворим рекомендували прийом статинів: аторвастатину 20 мг 1 раз на добу та антиагрегантів: кардіомагнілу 150 мг один раз на добу ввечері тривалий час.
Комплексна терапія пацієнтів контрольної групи з використанням нейропротекторів, антиагрегантів, статинів сприяла швидшому відновленню втрачених функцій, пом’якшувала клінічний перебіг гострих і повільно прогресуючих порушень без асоціації вірусної інфекції.
Висновки
Проведені дослідження підтверджують, що асоційована герпесвірусна та ентеровірусна інфекція є одним із предикторів розвитку гострих та повільно прогресуючих порушень мозкового кровообігу .
Підвищення в’язкості крові та рівня холестерину у хворих на тлі інфекційного фактору, зокрема герпетичної та ентеровірусної інфекції, поглиблює механізми порушення мозкового кровообігу.
Доцільно в комплексному лікуванні хворих на ЦВЗ із асоційованою вірусною інфекцією використовувати противірусні препарати ацикловірового ряду, що сприяє посиленню ефективності судинної лікування та попередженню розвитку повторних цереброваскулярних подій.
1. Коллектив авторов исследований ЕОБИ, ЕНС, ЕФНС, 2001.
2. Кузнецова С.М. Факторы риска и профилактика инсульта // Лікування та діагностика. — 1998. — № 3.
3. Charakida M., Donald A.E., Terese M., for ALSPAC (Avon Longitudinal Study of Parents and Children). Study Team Endothelial dysfunction in childhood infection // Circulation. — 2005. — Vol. 111. — P. 1660-1665.
4. Grau A.J., Buggle F., Steichen-Wlehn C. et al. Clinical and biochemical analysis in infection-associated stroke // Stroke. — 1995. — Vol. 26. — P. 1520-1526.
5. Hennerici M.G. The unstable plaque // Cerebrovasc Dis. — 2004. — Vol. 17 (Suppl. 3). — P. 17-22.
6. Clayton T.C., Thomson M., Mea-de T.W. Recent respiratory infection and risk of cardiovascular disease: case-control study through a general practice database // Euro-pean Heart Journal. — 2008. — 29. — 96-103.
