Газета «Новости медицины и фармации» Гастроэнтерология (414) 2012 (тематический номер)
Вернуться к номеру
Аутоиммунный гепатит
Авторы: Т.Д. Звягинцева, д.м.н., профессор, А.И. Чернобай, д.м.н., доцент - Харьковская медицинская академия последипломного образования
Версия для печати
По данным различных авторов, распространенность аутоиммунного гепатита (АИГ) варьирует от 2,2 до 17 случаев на 1 млн населения. В европейской популяции она составляет 0,1–1,9 на 100 000 жителей в год, в Японии значительно ниже — 0,01–0,08 случая на 100 000 населения. Аутоиммунным гепатитом обусловлены 10–23 % хронических заболеваний печени. Болеют преимущественно женщины (соотношение мужчин и женщин 1 : 12). Заболевание чаще развивается в возрасте от 15 до 24 лет, второй пик заболеваемости отмечается в возрастной период от 45 до 55 лет. На долю АИГ приходится 2–6 % всех трансплантаций печени.
Причина аутоиммунного гепатита остается неизвестной. В качестве возможных этиологических факторов обсуждается роль вирусной инфекции (вирусы гепатита А, B, D и С, Е, вируса простого герпеса 1-го типа, кори, вируса Эпштейна — Барр (ЕВV), ВИЧ, ретровирусов), реактивных метаболитов лекарственных препаратов, экзогенных веществ, наследственной предрасположенности.
Роль вирусов гепатита и других гепатотропных вирусов как триггерных факторов в развитии АИГ заключается в следующем:
- могут индуцировать аутоиммунитет посредством высвобождения цитокинов, которые активируют аутореактивные Т-клетки и модифицируют процессинг и презентацию собственных собственного антигена;
- могут активировать аутореактивные Т-клетки путем молекулярной мимикрии (сходство структур нормальных белков и белков вируса) собственных антигенов или путем суперантигенной стимуляции значительной части Т-клеток, которые включают аутореактивные иммуноциты.
У ряда больных АИГ (4 % по данным клиники Мэйо) имеются серологические маркеры НВV-инфекции.
Аутоиммунный гепатит в редких случаях может быть исходом ранее перенесенного вирусного гепатита А, что объясняется рядом специфических иммунных нарушений, характерных для данной инфекции.
Особая роль в развитии АИГ отводится вирусу гепатита С (НСV) в связи с частым выявлением этой инфекции при АИГ II типа (HCV RNA встречается с частотой от 10 до 80 %), а также свойственными ей внепеченочными поражениями и серологическими маркерами аутоиммунитета (криоглобулины, ANA, SMA, LKM-1 и др.), НСV-инфекция также выявляется у 11 % больных АИГ I типа.
К настоящему времени получены данные, которые свидетельствуют о том, что вирусы гепатита и другие гепатотропные вирусы в зависимости от ответа хозяина (обусловленного генетически) могут вызвать развитие различных форм хронического гепатита: І — хронический вирусный гепатит (В, С, D) — при персистенции агента и незначительной роли аутоиммунных нарушений; ІІ — выраженные аутоиммунные реакции в отсутствии персистенции вируса, который играет роль триггерного фактора (HAV, HBV, EBV, НЕV); ІІІ — выраженные аутоиммунные реакции в сочетании с хронической вирусной инфекцией (персистенция вирусов: HBV, HDV, HCV).
Генетические факторы играют важную роль в патогенезе АИГ. Предрасположенность к заболеванию аутоиммунным гепатитом определяется носительством аллелей HLA DR B1*0301 или HLA DR B1*0401.
У больных с гаплотипом HLA DR3 заболевание манифестируется раньше, а частота неэффективности лечения и рецидивов после его прекращения оказывается выше, чем у пациентов с типом DR4.
Реактивные метаболиты лекарственных средств могут инициировать иммунопатологические реакции. Установлено, что биохимические, иммуносерологические и гистологические изменения печени, неотличимые от таковых при спорадическом АИГ, могут вызвать оксифенизатин, метилдопа, нитрофурантоин, миноциклин, диклофенак, пемолин, пропилтиоурацил, тиэниловая кислота (АИГ ІІ типа). Другие препараты (сульфаниламиды, изониазид) могут индуцировать гистологические изменения печени, наблюдаемые при АИГ, которые не сопровождаются характерными иммуносерологическими признаками.
Метаболизирующие лекарства ферменты семейства цитохрома Р450 (СYP2D6) и УДФ-глюкуронилтрансферазы являются мишенями аутоиммунных реакций, индуцируемых как лекарствами, так и вирусами.
Возможно, что в развитии заболевания принимают участие несколько этиологических факторов, которые при наличии наследственной предрасположенности к аутоиммунным реакциям запускают воспалительный процесс в печени.
Ключевую роль в патогенезе АИГ играют Т-лимфоцитам. Аутоантигены клеток печени (прежде всего клеточной мембраны) связываются с антигенпрезентирующими клетками или непосредственно с гепатоцитами вместе с молекулами HLA класса II для распознавания CD4 Т-хелперными лимфоцитами (Тх1 и Тх2). При недостаточной ответной реакции CD8 Т-супрессорных лимфоцитов (Тс) активированными хелперными лимфоцитами высвобождаются и вырабатываются различные цитокины (ИЛ-2,ФНО-а, ИФН-g,). При этом включаются следующие механизмы, ведущие к разрушению гепатоцита: стимуляция цитотоксичных Т-лимфоцитов, активация макрофагов с помощью ИФН-g, выработка аутоантител В-лимфоцитами или плазматическими клетками, опосредованное антителами разрушение гепатоцитов клетками-киллерами и комплементом.
У пациентов с аутоиммунным гепатитом при отсутствии лечения и в периоде обострения обнаруживается дефицит или функциональная недостаточность CD4+ CD25+ регуляторных Т-клеток.
Обнаруживаемые при АИГ аутоантитела (главные признаки данного заболевания) не являются патогенными, их продукция обусловлена деструкцией гепатоцитов.
Диагностическое значение имеют следующие антитела: ANA — антинуклеарные антитела, SMA — антитела к гладкой мускулатуре (актиновые), LKM — антитела к микросомальному антигену печени и почек (LKM-1 к CYP2D6, LKM-2 к CYP2C9, LKM-3 к УДФ-глюкуронилтрансферазе и CYP1А2), LM — антитела к микросомам печени, анти-ASgP-R — антитела к асиалогликопротеиновому рецептору, анти-SLA — антитела к растворимому антигену печени (цитокератину), анти-LС1 — антитела к цитозольному антигену печени, анти-LР — антитела к цитозольному антигену печени и поджелудочной железы, анти-LРМ — антитела к ангигену 60-kDa плазматической мембраны гепатоцитов человека, антитела к сфинголипидам — антитела к сульфатированному галактоцерамиду.
Выделяют три типа АИГ соответственно профилям выявляемых аутоантител.
Для АИГ І типа характерно наличие антиядерных и/или антител к гладкой мускулатуре (анти-SMA, анти-ANA-позитивный). АИГ І (в Европе и Северной Америке) сочетается с HLA-A1-B8-DR3-гаплотипом и реже с HLA-1-B8-DR4-гаплотипом. В Японии у больных АИГ І выявляется только HLA DR4.
Для АИГ І типа характерным является циркуляция ANA у 70–80 % больных и/или SMA у 50–70 %, нередко в сочетании с антинейтрофильными цитоплазматическими антителами р-типа (p-ANCA), и наличие НСV-инфекции в 11 % случаев. Наиболее специфичными являются антиактиновые антитела (ААА). АИГ І наблюдается чаще у женщин (8 : 1). Заболевание развивается в основном у лиц старшего возраста (к этому типу относится и классический люпоидный гепатит молодых девушек), характеризуется внепеченочными проявлениями и хорошим прогнозом. Больные адекватно отвечают на лечение кортикостероидами, причем у 20 % больных сохраняется стойкая ремиссия после отмены иммуносупрессоров. Цирроз печени формируется у 43 % нелеченных больных в течение 3 лет.
Для АИГ ІІ типа характерным является наличие сывороточных печень — почки микросомальных антител 1-го типа (анти-LKM-1-позитивный — у 100 % больных, иногда в сочетании с LKM-3 и антителами к печеночно-цитозольному антигену — анти-LK-1). При этом типе АИГ с различной частотой (от 10 до 80 % и выше) определяются анти-HСV и HCV РНК, что послужило основанием для выделения HCV-сочетающегося аутоиммунитета. Вирус простого герпеса в данном случае принимает участие в индукции образования антител и возникновении АИГ.
АИГ ІІ составляет 10–15 % всех случаев заболевания, преимущественно у пациентов до 14 лет; взрослые составляют до 20 % больных. Заболевание характеризуется более высокой биохимической и гистологической активностью. АИГ ІІ более резистентен к иммуносупрессии, и отмена препаратов ведет к рецидиву. Цирроз печени за 3 года формируется у 82 % больных, что ухудшает прогноз заболевания.
При АИГ ІІІ типа определяются антитела к растворимому печеночному антигену и печеночно-панкреатическим антигенам (анти-SLA-позитивный и анти-LP-позитивный). В ряде случаев его считают подтипом АИГ І в связи со сходным клиническим течением и частым выявлением ANA и SMA. Наблюдается у лиц молодого возраста, в основном у женщин (90 %).
Заболевание чаще всего начинается постепенно, но у 25–40 % пациентов может проявляться внезапно. Примерно у трети больных заболевание клинически неотличимо от затянувшегося острого вирусного гепатита (ОВГ), однако длительно сохраняющаяся желтуха позволяет заподозрить хроническое заболевание печени. У ряда пациентов заболевание может не проявляться клинически и диагноз устанавливается случайно, в 10–20 % случаев уже на стадии цирроза печени (ЦП).
АИГ наиболее часто проявляется неспецифическими симптомами и характеризуется широким спектром клинических проявлений: от бессимптомного до тяжелого, иногда фульминантного гепатита с наличием или отсутствием внепеченочных признаков.
АИГ может возникнуть незаметно в виде тяжести в правом подреберье, общего недомогания, образования кровоподтеков, эпизодов желтушного окрашивания слизистых оболочек и кожных покровов. Характерным для данного заболевания является сочетание поражения печени и признаков иммунных нарушений.
Наиболее часто больные жалуются на слабость, утомляемость, снижение работоспособности, анорексию, интенсивную желтуху, увеличение печени, темную мочу, артралгии, миалгии, лихорадку. У 1/3 женщин наблюдается аменорея. В сыворотке крови резко повышается уровень билирубина до 100–300 мкмоль/л и активность трансаминаз (более 10 норм), что требует проведения дифференциальной диагностики с ОВГ.
Другой вариант начала АИГ проявляется внепеченочными симптомами — фебрильной лихорадкой, повышенной СОЭ до 50 мм/час, тахикардией, в течение нескольких лет может протекать под маской тиреотоксикоза, ревматоидного полиартрита, миокардита, системной красной волчанки, лимфогранулематоза, иммунного васкулита и др. В дальнейшем присоединяется иктеричность склер и кожных покровов, увеличение печени и селезенки.
Лихорадка часто сочетается с болями в животе, артралгиями, миалгиями, на поздних стадиях к этим симптомам присоединяются прогрессирующая желтуха, кожный зуд, геморрагические высыпания (рецидивирующая пурпура) в виде точек и пятен, не исчезающих при надавливании и оставляющих после себя темную пигментацию. Иногда присоединяется волчаночная и узловатая эритема, очаговая склеродермия.
Клиническая картина в развернутой стадии заболевания многообразна: характерно медленное неуклонное прогрессирование желтухи, лихорадки до фебрильных цифр (39 °С), нарастание кожного зуда, выраженных артралгий и миалгий, боли в животе, геморрагических высыпаний, гепатомегалии, присоединяются эндокринные нарушения (стрии, гирсутизм, акне). При объективном исследовании часто обнаруживаются перемежающаяся желтуха, усиливающаяся при выраженной активности заболевания, «печеночные знаки» — телеангиэктазии, пальмарная эритема, гепатомегалия с болезненным умеренно плотным краем печени, у части больных — спленомегалия. Асцит встречается значительно реже.
АИГ — системное заболевание и сопровождается поражением ряда внутренних органов, кожи, серозных оболочек.
Внепеченочные проявления (аутоиммунные синдромы) выявляются у 48 % больных АИГ, связаны с повышенным уровнем сывороточных циркулирующих иммунных комплексов, содержащих IgМ, и титра аутоантител (ANA, SMA), а также с перекрестными иммунными комплексами связанных с общностью тканевых антигенов ряда органов (антигены желчных протоков, слизистых оболочек желудка, почек, слюнных желез и др.).
Аутоиммунные синдромы включают: лихорадку, рецидивирующую пурпуру, кожные васкулиты, артралгии с вовлечением крупных суставов с периартикулярным воспалением, миалгии, полимиозит, лимфаденопатию, фиброзирующий альвеолит, первичную легочную гипертензию, плеврит, перикардит, миокардит, тиреоидит Хашимото, гломерулонефрит, синдром Шегрена, язвенный колит, болезнь Крона, идиопатическую тромбоцитопению и другие заболевания.
Печеночная энцефалопатия развивается в терминальной стадии, признаки малой печеночной недостаточности (сонливость, вялость, снижение трудоспособности) часто наблюдаются в период обострения заболевания. Большинство больных погибают в течение первых лет заболевания, особенно при непрерывно рецидивирующем течении, у части больных формируется макронодулярный цирроз печени. Следует отметить, что переход хронического АИГ в ЦП сопровождается более высокой летальностью по сравнению с активным хроническим вирусным гепатитом.
Диагноз АИГ устанавливается при отсутствии в анамнезе гемотрансфузий, приема гепатотоксических медикаментов, злоупотребления алкоголем, при уровнях g-глобулинов и IgG, более чем в 1,5 раза превышающих нормальные значения, при титрах ANA, SMA, LKM выше 1 : 88 для взрослых. Значительно и в большей степени повышается активность АЛТ, АСТ, g-глобулинов, IgG по сравнению со щелочной фосфатазой и гамма-глютамилтранспептидазой на фоне характерных для заболевания алелей HLA B8 и DR3 у большинства больных (80 %).
Диагноз АИГ может быть установлен только после исключения более распространенных заболеваний печени, таких как алкогольные, лекарственные и вирусные гепатиты, первичные аутоиммунные холестатические заболевания печени, болезнь Вильсона — Коновалова, недостаточность альфа1-антитрипсина, наследственный гемохроматоз.
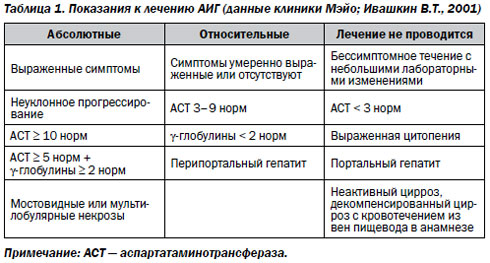
Терапия АИГ направлена на предотвращение прогрессирования заболевания, развития ЦП и гепатоцеллюлярной карциномы.
Согласно рекомендациям экспертов AASLD, терапия обязательно показана:
- при повышении активности сывороточных трансаминаз в 10 раз и более от верхней границы нормы;
- повышении активности сывороточных трансаминаз в 5 раз, уровня гамма-глобулинов в 2 раза от верхней границы нормы;
- ступенчатых или мостовидных некрозах в биоптате печени.
Традиционно для лечения АИГ в течение уже многих десятилетий используются глюкокортикостероиды (ГКС) в виде монотерапии или их сочетание с цитостатиками в течение длительного времени, а при необходимости и пожизненно. Поликлональная гаммапатия является показанием для лечения ГКС и цитостатиками в более высоких дозах, чем при выраженном невирусном цитолизе.
При положительном ответе на лечение иммуносупрессоры могут быть отменены через 1–2 года при отсутствии воспалительных изменений в печеночном биоптате.
На фоне длительной терапии глюкокортикоидами могут развиться язвы желудка и двенадцатиперстной кишки, синдром Кушинга, ожирение, акне, остеопороз, повышение артериального давления, катаракта, стероидный диабет, инфекционные осложнения.
В большинстве случаев АИГ поддается лечению комбинацией глюкокортикоидов и цитостатиков. Однако, по современным сведениям, 20 % пациентов остаются невосприимчивы к указанным препаратам или плохо их переносят, 10 % вынуждены прекратить лечение в связи с развитием серьезных побочных эффектов.
С современных позиций приоритет в лечении АИГ принадлежит урсодезоксихолевой кислоте, которая обладает цитопротективным, иммуномодулирующим, антихолестатическим и антибифротическим действием, особенно при выраженном холестазе, в дозе 15–20 мг/кг/сут. Применяется в качестве монотерапии или в комплексе с глюкокортикоидами или глюкокортикоидами 2-го поколения и цитостатиками, что позволяет снизить дозы и уменьшить побочные эффекты этих препаратов.
При достижении стабилизации активности заболевания в качестве поддерживающей терапии возможно назначение гепатопротекторов-антиоксидантов: силимаринсодержащие, вместе с комплексом витаминов группы В.
При АИГ, сочетающихся с персистенцией вирусной инфекции (HBV и HCV), рекомендуется лечение в течение 3–6 месяцев в зависимости от преобладания аутоиммунных (глюкокортикоиды) или вирусных (противовирусные препараты ИФН-а) проявлений болезни.
Продолжительность традиционного лечения АИГ обусловлена тем, что после достижения ремиссии терапию необходимо продолжать еще в течение не менее 12 мес. При прекращении лечения реактивация заболевания в течение года наблюдается у 80–90 %. Вопрос о том, какую поддерживающую терапию лучше назначить (только цитостатиками или цитостатики в комбинации с глюкокортикоидами), решается индивидуально, в зависимости от побочных эффектов препаратов.
Включение методов экстракорпоральной гемокоррекции в комплексную терапию АИГ позволяет улучшить результаты лечения: наблюдается регресс клинических симптомов, снижается концентрация сывороточных гамма-глобулинов и титр антител.
Прогноз. Нелеченный аутоиммунный гепатит имеет плохой прогноз: 5-летняя выживаемость составляет 50 %, 10-летняя — 10 %. При лечении АИГ современными методами 20-летняя выживаемость превышает 80 %, при развитии декомпенсированного ЦП она снижается до 10 %. Трансплантация печени дает хороший результат.
1. Аутоиммунный гепатит // Заболевания печени и желчевыделительной системы / Под ред. Вольфганг Герок, Хуберт Е. Блюм. — М.: МЕДпресс-информ, 2009. — С. 57-63.
2. Аутоиммунный гепатит // Основы клинической гепатологии / Под ред. В.Г. Радченко, А.В. Шаброва, Е.Н. Зиновьевой. — СПб.: Диалект; М.: БИНОМ, 2005. — С. 292-305.
3. Бурневич Э.З., Арион Е.Л. Вариантные формы аутоиммунных заболеваний // Здоров’я України. — 2010. — № 2. — С. 43.
4. Вирусы гепатита и аутоиммунный гепатит // Хронический вирусный гепатит / Под ред. В.В. Серова, З.Г. Апросиной. — М.: Медицина, 2004. — С. 168-191.
5. Ивашкин В.Т., Морозова М.А., Маевская М.В. Современные терапевтические схемы лечения аутоиммунного гепатита // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 2009. — Т. 19, № 4. — С. 4-12.
6. Ивашкин В.Т., Буеверов А.О. Аутоиммунные заболевания печени в практике клинициста. — М.: Изд. дом «М-Вести», 2001. — С. 8-30.
7. Никитин И.Г., Сторожаков Г.И. Современные аспекты терапии аутоиммунного гепатита // Фарматека. — 2006. — № 1(116). — С. 28-34.
8. Хронический аутоиммунный гепатит // Заболевания печени и желчных путей / Под ред. Ш. Шейлок, Дж. Дули. — М.: Гэотар-Мед, 2002. — С. 353-362.
9. Хронический гепатит // Практическая гастроэнтерология / Под ред. Ф.И. Комарова, М.А. Осадчук, А.М. Осадчук. — М.: ООО «Мединформагенство», 2010. — С. 314-315.
10. Abdo A., Meddings J., Swain M. Liver аbnormalities in celiac disease // Clin. Gastroenterol. Hepatol. — 2004. — Vol. 2. — P. 107-112.
11. Alvarez F. Treatment of autoimmune hepatitis: current and future therapies // Curr. Treat. Options Gastroenterol. — 2004. — Vol. 7. — P. 413-420.
12. Csepregi A., Rцcken C., Treiber G., Malfertheiner P. Budesonide induces complete remission in autoimmune hepatitis // World J. Gastroenterol. — 2006. — Vol. 12, № 9. — P. 1362-1366.
13. Hennes E.M., Zeniya M., Czaja A.J. et al. Simplified diagnostic criteria for autoimmune hepatitis // Hepatology. — 2005. — Vol. 42. — P. 295.
14. Leuschner U. Autoimmune hepatitis. — 2nd ed. — Freuburg Germany: Dr. Falk Pharma Gmbh, 2008. — P. 6-7.
15. Silveira M.G., Talwarkar J.A., Angulo Р. et al. Overlap of autoimmune hepatitis and primary biliary cirrhosis: longterm outcome // Am. J. Gastroenterol. — 2005. — Vol. 102. — P. 1244-1250.
16. Soloway R.D., Hewlett A.T. The medical treatment for autoimmune hepatitis through corticosteroid to new immunosuppressive agents: a concise review // Ann. Hepatol. — 2007. — Vol. 6, № 4. — P. 204-207.
