Газета «Новости медицины и фармации» Гастроэнтерология (414) 2012 (тематический номер)
Вернуться к номеру
Цитопротекторні та протикислотні засоби в комплексному лікуванні ерозивно-виразкових уражень гастродуоденальної зони у хворих на лейкемії
Авторы: І.М. Скрипник, д.м.н., професор, Г.С. Маслова, к.м.н. - Кафедра внутрішньої медицини № 1 ВДНЗУ «Українська медична стоматологічна академія», м. Полтава
Версия для печати
Дана стаття є фрагментом науково-дослідницької роботи ВДНЗ «Українська медична стоматологічна академія» МОЗ України на тему «Розробка нових методів діагностики, лікування та профілактики захворювань органів травлення в сполученні з іншими захворюваннями систем організму» (№ державної реєстрації 0106U000964).
Протягом останніх десятиліть досягнуто значних успіхів у лікуванні гострих і хронічних лейкемій. Спостерігається чітка тенденція до інтенсифікації схем поліхіміотерапії (ПХТ), завдяки чому суттєво змінились результати лікування. У теперішній час клініко-гематологічна ремісія досягається у 70–80 % хворих на гостру лімфобластну лейкемію (ГЛЛ) та у 60–80 % хворих на гостру мієлобластну лейкемію (ГМЛ) [2, 5]. Крім цього, 5-річна безрецидивна виживаність відмічається у 20–25 % хворих на ГЛЛ і 25–50 % хворих на ГМЛ. Переважна більшість клініцистів вважають за необхідне дотримання доз і режимів введення хіміотерапевтичних препаратів, що є важливою умовою для одужання хворого. Проте цитостатичні засоби руйнують не тільки пухлинні клітини, а і здорові клітини організму. На фоні ПХТ і особливо через 10–15 днів після її проведення виникають ураження з боку різних органів і систем. Найбільш уразливими є клітини, що швидко розмножуються, тобто клітини кісткового мозку й епітелію шлунково-кишкового тракту (ШКТ) з розвитком цитостатичної нейтропенії, тромбоцитопенії, анемії та ерозивно-виразкових уражень слизової оболонки (СО) на всьому протязі травного каналу. Саме ранні ускладнення ПХТ є причиною відхилення від протоколів лікування. На фоні запально-деструктивних процесів СО ШКТ і цитостатичної панцитопенії розвиваються більш загрозливі для життя інфекційні та геморагічні ускладнення. Отже, вдосконалення супровідної терапії є не менш важливим питанням, ніж розробка нових схем ПХТ.
Сьогодні існують лише поодинокі роботи щодо вивчення патогенетичних механізмів розвитку ерозивно-виразкових уражень гастродуоденальної зони (ГДЗ) під впливом ПХТ і, відповідно, не розроблені методи їх лікування.
Мета роботи— підвищити ефективність лікування ерозивно-виразкових уражень гастродуоденальної зони у хворих на гострі та хронічні лейкемії в динаміці поліхіміотерапії шляхом вивчення патогенетичних механізмів їх розвитку та розробки сучасних методів фармакологічної корекції із застосуванням цитопротекторних та кислотосупресивних засобів.
Матеріали і методи
Обстежено 157 хворих на гострі та хронічні лейкемії, які знаходились на лікуванні в гематологічному відділенні Полтавської обласної клінічної лікарні ім. М.В. Скліфосовського (35 пацієнтів із гострою ГМЛ, 22 — з ГЛЛ, 32 — з множинною мієломою (ММ), 35 — з В-клітинним хронічним лімфолейкозом (В-ХЛЛ), 24 — з хронічним мієлолейкозом (ХМЛ), 9 — зі справжньою поліцитемією (СП), з них 76 чоловіків та 81 жінка віком 17–79 років. Діагноз онкологічного захворювання кровотворної системи верифікований на підставі клінічних та лабораторних методів (гемограма, результати цитологічного, цитохімічного дослідження стернального пунктату).
До дослідження включались хворі на гострі та хронічні лейкемії після проведення одного курсу ПХТ: ГМЛ — курс «7 + 3» або «5 + 2» з цитазин-арабінозидом та адріаміцином; ГЛЛ – двофазний курс індукції ремісії за Hoelzer (преднізолон, вінкристин, даунорубіцин, L-аспарагіназа, циклофосфамід, цитазин-арабінозид); ММ — курс за схемою VAD (вінкристин, адріаміцин, дексаметазон); ХМЛ — курси терапії гідроксисечовиною, мієлосаном; В-ХЛЛ — курси СОР (циклофосфан, преднізолон, вінкристин), FC (флударабін, циклофосфан); СП — курси терапії гідроксисечовиною, мітоксантроном.
Верхня ендоскопія проводилась до початку та на 28,0 ± 1,2 день лікування за допомогою апарату GIF-XP-20 виробництва компанії Olympus (Японія) за наявності болю в епігастральній ділянці, виражених диспептичних явищ.
Інфікування Helicobacter pylori (НР) діагностували гістоморфологічно за допомогою експрес-тесту визначення антигену НР у фекаліях (Cito-test HР Ag, компанія «Фармаско», Україна), який має високу чутливість (92,4 %) та специфічність (91,9 %).
82 пацієнти з ерозивно-виразковими ураженнями ГДЗ залежно від асоціації з НР-інфекцією розподілялись на дві групи: І (n = 42) — НР-позитивні і ІІ (n = 40) — НР-негативні. За призначеними лікувальними комплексами хворі І і ІІ груп додатково розподілялись на підгрупи:
І-А (n = 23) — антигелікобактерна терапія (АГБТ): пантопразол 80 мг/добу, кларитроміцин (клацид) 1000 мг/добу, амоксицилін (флемоксин солютаб) 2000 мг/добу — 10 днів, потім пантопразол 40 мг уранці до 28 днів;
І-Б (n = 19) — АГБТ, аналогічна І групі, 10 днів, потім пантопразол 40 мг вранці до 28 днів і цитопротектор ребаміпід 100 мг 3 рази на день 28 днів;
ІІ-А (n = 18) — пантопразол 40 мг 2 рази на добу 10 днів з наступним переходом на 40 мг вранці до 28 днів;
ІІ-Б (n = 22) — пантопразол 40 мг 2 рази на добу 10 днів із наступним переходом на 40 мг вранці до 28 днів і ребаміпід (мукоген) 100 мг 3 рази на день — 28 днів.
Пацієнтам, у яких не була досягнута ерадикація НР, призначалась «друга лінія» АГБТ — пантопразол 80 мг/добу (28 днів), вісмуту субцитрат 480 мг/добу, метронідазол 1000 мг/добу, тетрациклін 2000 мг/добу 10 днів.
Стан слизового бар’єра ГДЗ та протеїназно-інгібіторного дисбалансу вивчали перед початком та на 28-й день лікування. Зміни метаболічних процесів у СОШ та СОДК досліджували неінвазивними методами, враховуючи тяжкість стану пацієнтів. Визначали вміст N-ацетилнейрамінової кислоти (NANA) у сироватці крові (Колб В.Г., Камышников В.С., 1976) та рівень її екскреції із сечею (Анасашвили А.Ц, 1968), концентрацію фукози, зв’язаної з білком, у сироватці крові (Шараев П.Н. и соавт., 1997) та рівень її екскреції із сечею (Видершайн Г.Я., Колибаба Л.Г., 1977). У сироватці крові визначали сумарну протеолітичну активність (Уголев А.М., 1969), концентрацію а1-протеїназного інгібітору (а1-ПІ) (Веремеенко К.Н., 1988).
Отримані дані клінічних та біохімічних досліджень обробляли за допомогою варіаційно-статистичного аналізу методом Стьюдента — Фішера. Обчислення проводилось із застосуванням таблиць Excel пакета офісних програм Microsoft Office 2000 (США).
Результати і їх обговорення
Нами встановлена наявність ерозивно-виразкових уражень ГДЗ у 82 (52 %) пацієнтів: у 43 (52,4 %) — ерозії шлунка та дванадцятипалої кишки, у 29 (35,4 %) — виразка дванадцятипалої кишки, у 10 (12,2 %) — ерозії шлунка та луковиці дванадцятипалої кишки і виразка дванадцятипалої кишки.
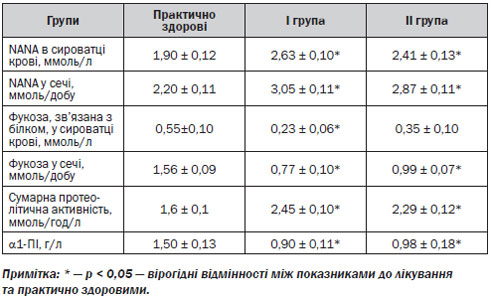
Концентрація NАNА в сироватці крові до лікування в І групі НР-позитивних хворих підвищувалась на 36 % (р < 0,001), а в ІІ групі НР-негативних — на 24 % (р < 0,05) порівняно з практично здоровими (табл. 1). Рівень екскреції NАNА з сечею у пацієнтів І групи зростав на 42 % (р < 0,001), ІІ групи — на 33 % (р < 0,001) порівняно з нормальними показниками (табл. 1). Підвищення концентрації NАNА у сироватці крові та сечі у хворих на гострі та хронічні лейкемії з ерозивно-виразковими ураженнями ГДЗ свідчить про підсилення деградації протективних білків слизу та активність перифокального запалення на фоні лейкемії, ПХТ та запально-деструктивних процесів у СОШ і СОДК [6]. Проте максимальні значення рівня сіалових кислот спостерігаються за умов асоціації ерозивно-виразкових уражень ГДЗ з НР-інфекцією, що свідчить про активацію пептичного протеолізу глікопротеїнів слизового бар’єра ГДЗ під впливом продукції НР муциназ і протеаз [4]. NАNА можна вважати маркером гострої фази запалення СОШ та СОДК [12].
До лікування концентрація фукози, зв’язаної із білком, у сироватці крові знижувалась у НР-позитивних пацієнтів І групи в 2,5 раза (р < 0,05), а у НР-негативних пацієнтів ІІ групи — в 1,6 раза порівняно з нормальними значеннями (табл. 1). Рівень екскреції фукози з сечею до лікування знижувався в І групі в 2 рази (р < 0,001), у ІІ групі — в 1,6 раза (р < 0,001) порівняно з практично здоровими (табл. 1). Отже, у хворих на лейкемії з ерозивно-виразковими ураженнями СОШ та СОДК спостерігається підвищення деградації і зменшення продукції фукопротеїнів слизу, які саме і виконують функції захисту від ушкоджуючих факторів. Наявність максимальних змін у І групі свідчить про важливе значення інфікування НР у зниженні резистентності слизового бар’єра ГДЗ.
Сумарна протеолітична активність у сироватці крові до лікування в І групі збільшувалась в 1,5 раза (р < 0,001), у ІІ групі — в 1,4 раза (р < 0,001) порівняно з практично здоровими. Концентрація a1-ПІ у сироватці крові в І і ІІ групах до лікування знижувалась в 1,7 та 1,5 раза відповідно (р < 0,01) порівняно з нормальними значеннями (табл. 1). Отже, провідною ланкою патогенезу ерозивно-виразкових уражень ГДЗ у хворих на лейкемії можна вважати протеїназно-інгібіторний дисбаланс, а саме зростання активності протеїназ на фоні зменшення концентрації 1-ПІ [1, 3] з максимальним ступенем вираженості змін у НР-позитивних пацієнтів, що пояснюється додатковою продукцією НР протеолітичних ферментів.
У пацієнтів І та ІІ груп на 3-тю — 5-ту добу від початку лікування відмічалось покращення загального стану, зменшення диспептичних явищ та больового синдрому.
На 28-й день лікування клініко-ендоскопічна ремісія була зафіксована у 21 (91,3 %) хворого І-А підгрупи, у 18 (94,7 %) — І-Б підгрупи та у 20 (95,2 %) хворих ІІ-А підгрупи і у 19 (100 %) — ІІ-Б підгрупи. Ерадикація НР-інфекції на 28-й день лікування спостерігалась у 20 (86,9 %) хворих І-А підгрупи та у 18 (94,7 %) хворих І-Б підгрупи. Отже, у хворих І-Б і ІІ-Б підгруп, які додатково приймали цитопротектор ребаміпід, зареєстрований більший відсоток клініко-ендоскопічних ремісій та ерадикацій НР-інфекції, ніж в І-А і ІІ-А підгрупах.
На 28-й день лікування концентрація NАNА у сироватці крові НР-позитивних хворих зменшилась в І-А і І-Б підгрупах на 12 % і на 27 % відповідно (р < 0,05). У НР-негативних хворих ІІ-А і ІІ-Б підгруп відмічалась тенденція до зниження вмісту досліджуваного показника у крові.
Рівень екскреції NАNА із сечею після лікування знизився у хворих І-А і ІІ-А підгруп на 19 % (р < 0,01), в І-Б і ІІ-Б підгрупах на 30 і 27 % відповідно (р < 0,01). Зменшення концентрації NАNА в сироватці крові та рівня її екскреції з сечею у хворих на лейкемії з ерозивно-виразковими ураженнями ГДЗ на 28-й день лікування відображає пригнічення процесів деградації сіалопротеїнів, який був підвищений в активній фазі запалення.
У результаті додаткового призначення ребаміпіду у хворих І-Б підгрупи концентрації фукози, зв’язаної з білком, у сироватці крові зростала в 2,4 раза (р < 0,001), а у пацієнтів ІІ-Б підгрупи — в 1,5 раза (р < 0,05). У хворих І-А і ІІ-А підгруп відмічалась тенденція до зростання рівня фукози у крові. Слід відзначити, що у хворих ІІ-Б підгрупи вміст фукози, зв’язаної з білком, у сироватці крові досягнув нормальних значень.
Рівень екскреції фукози із сечею після проведеної терапії зріс у хворих І-А і ІІ-Б підгруп в 1,5 раза (р < 0,001), І-Б підгрупи — в 1,9 раза (р < 0,01) та ІІ-А підгрупи — в 1,3 раза (р < 0,001). Максимальна позитивна динаміка зафіксована у пацієнтів, які отримували ребаміпід у комбінації з ІПП, у тому числі у складі АГБТ, що свідчить про підвищення продукції основних глікозаміногліканів слизу, що мають захисні властивості і відображають стан резистентності слизового бар’єра шлунка і дванадцятипалої кишки.
Сумарна протеолітична активність у сироватці крові після проведеного лікування підвищилась в І-А і ІІ-А підгрупах в 1,2 раза (р < 0,05), в І-Б і ІІ-Б підгрупах на фоні прийому ребаміпіду — в 1,3 і 1,4 раза відповідно (р < 0,05). Концентрація а1-ПІ у сироватці крові в результаті проведеного лікування зросла в І-А підгрупі в 1,4 раза, у І-Б підгрупі — в 1,6 раза, ІІ-А підгрупі — в 1,3 раза і ІІ-Б підгрупі — в 1,5 раза (р < 0,05). Отже, найбільш виражене пригнічення протеїназ та активація системи інгібіторів протеолізу спостерігались у хворих І-Б і ІІ-Б підгруп на фоні додаткового призначення цитопротекторної терапії.
Таким чином, застосування комбінації ребаміпіду й ІПП, у тому числі у складі АГБТ, з метою корекції ерозивно-виразкових уражень СОШ та СОДК у хворих на лейкемії призводить до більш вираженого підвищення продукції та зменшення деградації протективних білків слизу, а також усунення протеїназно-інгібіторного дисбалансу, тобто до підвищення резистентності слизового бар’єра ГДЗ. Механізм дії ребаміпіду полягає в підвищенні синтезу ендогенних простагландинів Е2, І2) [7], стимуляції продукції бікарбонатів [11], покращенні мікроциркуляції [10], підвищенні синтезу секреторного ІgА у шлунковому соку, пригніченні синтезу еластази гранулоцитів, тим самим попереджуючи руйнування міжклітинних зв’язків, стимуляції продукції поверхневого слизу на 160 % [8] та стимуляції проліферації у СО, що в сукупності підвищує резистентність слизового бар’єра ГДЗ відповідно сприяє загоєнню ерозивно-виразкових ускладнень, що виникають унаслідок ПХТ [11]. Підвищення відсотка ерадикації НР-інфекції під впливом ребаміпіду пояснюється зменшенням адгезії НР до СОШ та СОДК [9], що доводить доцільність його призначення на фоні антигелікобактерних комплексів сумісно з ІПП та антибактеріальними засобами.
Висновки
1. У 52 % хворих на гострі та хронічні лейкемії на фоні ПХТ виникають ерозивно-виразкові ураження ГДЗ, що супроводжуються зниженням резистентності слизового бар’єра: деградацією сіалопротеїнів, пригніченням синтезу фукопротеїнів, протеїназно-інгібіторним дисбалансом.
2. Застосування комбінації ребаміпіду та ІПП, у тому числі у складі АГБТ, у НР-позитивних хворих на лейкемії з ерозивно-виразковими ураженнями сприяє підвищенню відсотка клініко-ендоскопічної ремісії та ерадикації НР-інфекції до 94,7 %.
3. З метою підвищення ефективності лікування ерозивно-виразкових уражень ГДЗ у хворих на лейкемії в результаті ускладнень ПХТ показано призначення комбінації кислотосупресивної терапії — ІПП, у тому числі у складі АГБТ, та цитопротекторного засобу ребаміпіду по 100 мг 3 рази на добу за 30 хв до вживання їжі протягом 28 днів.
1. Акбашева О.Е. Состояние протеолиза и оксидативные процессы при заболеваниях желудочно-кишечного тракта / О.Е. Акбашева, В.А. Бурковская, Э.И. Белобородова // Клин. лаб. диагностика. — 2008. — № 9. — С. 57.
2. Баранова О.Ю. Анализ результатов различных програм терапии острых нелимфобластных лейкозов М0-М2, М4-М7 ФАБ вариантами (по данным Российского онкологического научного центра им. Блохина, РАНМН) / О.Ю. Баранова, М.А. Волкова, М.А. Френкель [и др.] // Гематол. и трансфузиология. — 2003. — Т. 48, № 2. — С. 3-10.
3. Веремеенко К.Н. Протеолиз в норме и при патологии / К.Н. Веремеенко, О.П. Голобородько, А.И. Кизим. — К.: Здоров’я, 1988. — 200 с.
4. Дегтярева И.И. Клиническая гастроэнтерология / И.И. Дегтярева. — М.: МИА, 2004. — 616 с.
5. Климов В.С. Острые лейкозы взрослых и показатели выживаемости в Приморском крае / Климов В.С., Кондратовский П.М., Алексашкина А.П. [и др.] // Гематол. и трансфузиология. — 2004. — Т. 49, № 6. — С. 8-12.
6. Скрипник І.М. Роль та місце антисекреторної терапії у лікуванні та профілактиці ерозивно-виразкових уражень шлунково-кишкового тракту у хворих гемобластозами / І.М. Скрипник, Г.С. Маслова // Гастроентерологія: Міжвід. зб. — 2009. — Вип. 43. — С. 153-160.
7. Dong H. Effect of Lubiprostone on duodenal mucosal bicarbonate secretion / H. Dong, Ch. Contreras, X. Dong, K.E. Barrett // Digestive disease week 2008. Turning Science into Medicine. — 2008. — N. T1081. — CD-ROM to search the DDW2008 accepted abstracts. — Pentium III, 128 MB of RAM; CD-ROM Windows Vista/XP.
8. Iijima K. Rebamipide a cytoprotective drug, increases gastric mucus secretion in human – evaluation with the endoscopic gastrin test / K. Iijima, K. Ishihara, M. Ogawa [et al.] // Digestive disease week 2008. Turning Science into Medicine. — 2008. — N. W1732. — CD-ROM to search the DDW2008 accepted abstracts. — Pentium III, 128 MB of RAM; CD-ROM Windows Vista/XP.
9. Ilver D. Helicobacter pylori toxin VacA is transferred to host cell via a novel contact-dependent mechanism / D. Ilver, S. Barone, D. Mercati [et al.] // Cell. Microbiol. — 2004. — Vol. 6. — P. 167-174.
10. Kobayashi T. Suppressive effect of rebamipide an antiulcer agent, against activation of human neutrophils exposed to formyl-methionyl-leucyl-phenylalanine / Kobayashi T., Zinchuk V.S., Garcia del Saz E. [et al.] // Histol. Histopatol. — 2000. — Vol. 15, № 4. — P. 1067-1076.
11. Matysiak-Budnik T. Rebamipide and the digestive epithelial barrier / T. Matysiak-Budnik, M. Heyman, F. Megraud // Aliment. Pharmacol. Ther. — 2003. — № 18. — P. 55-62.
12. Vaters P.J. Measurement of sialic acid in serum and urine: clinical applications and limitabione / Vaters P.J., Lewry E.Z., Pennock C. // Аnn. Clin. Biochem. — 1992. — Vol. 29, № 6. — P. 625-637.
