Газета «Новости медицины и фармации» Гастроэнтерология (414) 2012 (тематический номер)
Вернуться к номеру
Сучасний підхід до лікування хронічних ерозій шлунка
Авторы: Т.Д. Звягінцева, д.м.н., профессор, Я.К. Гаманенко - Харківська медична академія післядипломної освіти
Версия для печати
Важливою віхою у вивченні проблем ерозивної патології слизової оболонки шлунка (СОШ) стало встановлення того факту, що разом із гострими банальними ерозіями, що швидко минають, існують хронічні ерозії шлунка (ХЕШ) із прогредієнтним характером клінічного перебігу. Особлива увага до проблеми поверхневих деструктивних змін СОШ пов’язана з широким впровадженням у клінічну практику ендоскопічних методів дослідження, але оцінити дійсний характер ерозій можна лише на підставі гістологічного дослідження. Однак буває так, що це неможливо, оскільки ендоскопісту не завжди вдається провести біопсію з самої ерозії, тому розбіжності між макроскопічним і гістологічним діагнозом коливаються у межах від 30 до 100 % випадків [2].
За характером гістологічних змін можна виділити зрілий і незрілий типи ХЕШ. У першому випадку ХЕШ епітелізуються, а набряк СОШ повністю зникає; у другому випадку вибухання залишається внаслідок розвинутого фіброзу тканин і вираженого продуктивного запалення на тривалий час. В оточуючій повні ерозії СОШ морфологічно можна виявити гіперплазію пілоричних залоз і ямкового епітелію, а іноді і фавеолярну гіперплазію. Це дозволяє припустити можливість трансформації ерозій у поліпи відповідного типу та ймовірність їх малігнізації, що є важливим аспектом, який характеризує необхідність перегляду поглядів щодо діагностики ХЕШ.
Відомо, що своєчасна діагностика провідного патогенетичного фактора виникнення ХЕШ дозволяє їх ефективно лікувати. В усіх роботах, присвячених ХЕШ, обговорюється тільки механізм їх утворення, а не хронізації, у зв’язку із чим у патогенезі даного захворювання важливі не стільки причини виникнення ерозій, скільки причини відсутності загоєння. Разом із тим вважають, що лікувати ХЕШ необхідно за загальноприйнятими стандартами, а під час терапії H.рylori-асоційованих процесів обов’язково треба проводити ерадикацію H.рylori [9].
Інгібітори протонного насосу (ІПН) справляють гастропротективний ефект, оскільки підвищують оксигенацію СОШ, стимулюють вироблення гідрокарбонатів, гальмують синтез пепсину. При тривало існуючих ХЕШ ерозивний дефект СОШ загоюється через 7 днів [1]. Для лікування ХЕШ застосовуються ІПН у комбінації з антибіотиками. При лікуванні ІПН у комбінації з амоксициліном і кларитроміцином у 90 % випадків вдається позбавитися від H.рylori і добитися загоєння ерозії в семиденний термін.
На сьогодні накопичена достатня кількість даних, що підтверджують високу ефективність і переносимість ІПН у складі антигелікобактерної терапії.
У ряді клінічних досліджень показано, що після вдалої ерадикації гелікобактерної інфекції для загоєння ХЕШ не потрібно подальше призначення ІПН. На підставі великої кількості опублікованих досліджень документально підтверджено, що ерадикація інфекції у хворих з ерозивно-виразковими ураженнями СОШ у комбінації з ІПН є доведеним ефективним підходом до лікування і, що особливо важливо, призводить до зупинки процесу рецидивування, а отже й до зниження ризику ускладнень [10, 14].
У нашій роботі особлива увага приділяється вивченню ХЕШ без супутньої патології, оскільки аналіз результатів власних спостережень і даних літератури дозволяє висловити думку, що у значній частині випадків ХЕШ є самостійною нозологічною формою, а не ускладненням інших захворювань.
Метою дослідженнябуло вивчення гістологічних особливостей СОШ у хворих із ХЕШ залежно від тривалості захворювання, а також встановлення ефективності призначення ІПН стосовно загоєння ерозій при ХЕШ.
Матеріали і методи дослідження
Відповідно до Маастрихтського консенсусу ІV та стандартів лікування кислотозалежних хвороб для ерадикації H.рylori використано ІПН, амоксицилін та кларитроміцин. Тривалість ерадикаційної терапії становила 7 діб. В основній — І групі (n = 61) використовували ІПН 40 мг/добу, у групі порівняння — ІІ (n = 46) — ІПН 20 мг/добу.
Клінічні групи (основну та контрольну) формували на підставі верифікації діагнозу при ФГДС. Ідентифікацію H.рylori здійснювали за допомогою швидкого уреазного URE-Н.рylori тесту, та імуноферментного методу визначення анти-H.рylori-антитіл. У разі інфікування план лікування хворих передбачав ерадикацію H.рylori.
Під спостереженням перебували 107 хворих із ХЕШ у стадії загострення, асоційованими з H.рylori, серед яких 87 чоловіків (81,3 %), і 20 жінок (18,7 %). Середній вік становив 32,1 ± 0,7 року. Контрольну групу становили 15 практично здорових осіб.
У І групі — 61 пацієнт (57,1 %) — захворювання характеризувалося хронічним, а також рецидивуючим перебігом із переважною частотою рецидивів 1 раз на рік, а в ІІ групі — 46 хворих (42,9 %) — ХЕШ були виявлені вперше.
Верхню ендоскопію проводили з використанням апарата GIF-ХР-20 компанії Olympus (Японія) з прицільною біопсією до початку лікування та через 6 ± 2 доби після його завершення за стандартною методикою.
Вираженість запального процесу оцінювали за ступенем лімфоплазмоцитарної інфільтрації СОШ, а активність ХЕШ — за розміром гранулоцитарного (нейтрофільного) компонента в запальному інфільтраті. Оцінку стану СОШ у біоптатах проводили морфометрично за допомогою комп’ютерного цитоаналізатора Olympus ВХ-41, окуляра мікрометра АМ9-2, окулярної лінійки та морфометричної сітки Г.Г. Автанділова, що дозволило встановити товщину слизу, висоту покривного епітелію та зробити кількісну оцінку нейтрофілів (щільність клітин у 1 мм2) із подальшим мікрофотографуванням.
Результати дослідження
При гістологічному дослідженні біоптатів із ХЕШ у пацієнтів I групи встановлено наявність високопризматичного, інтенсивно продукуючого слиз епітелію крайової зони. При цьому розвинена мережа підепітеліальних судин, є видовження шийкових відділів шлункових залоз. Виявлено, що епітелій у разі посиленої проліферації не дозріває повністю та не стає спроможним до повноцінної функціональної активності. У зоні ХЕШ спостерігається чергування великих ділянок фіброзу, кістозного розширення шлункових залоз, солітарних фолікулів та інтенсивна змішана поліморфноклітинна інфільтрація СОШ (рис. 1).
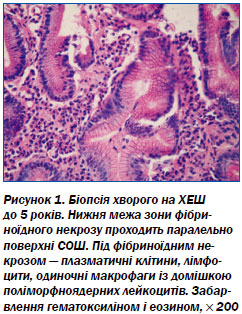
При гістологічному дослідженні біоптатів СОШ хворих IІ групи виявлені ХЕШ у стадії загострення, які характеризуються наявністю коагуляційного некрозу, що нагадує фібриноїдний некроз, як при ВХШ, але без типового для нього фіброзу країв. Гіперплазія пілоричних залоз у зоні ХЕШ є причиною утворення узвишшя, яке служить ендоскопічним критерієм. В ділянці дна хронічної ерозії виявлена грануляційна тканина, а у крайових відділах — дистрофічні й атрофічні зміни епітелію залоз (рис. 2).
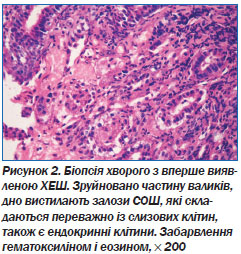
Висота епітелію СОШ хворих I групи становила 19,04 ± 0,07 мкм (р < 0,05), що вірогідно нижче за нормальні показники. Функціональна активність також була зниженою і становила 103,11 ± 1,25 мкм (р < 0,01). У хворих I групи більше ніж у 3 рази в СОШ збільшувалася кількість міжепітеліальних лімфоцитів (МЕЛ), оточених обідками прояснення, — 28,04 ± 2,53 (при нормі 9,26 ± 1,30) на 100 епітеліоцитів (р < 0,001). У хворих II групи цей показник становив 20,75 ± 1,61 на 100 епітеліоцитів (р < 0,01).
Отже, у хворих I групи дистрофічні зміни епітелію поєднувалися з більш вираженою інфільтрацією власної пластинки СОШ лімфоцитами, плазмоцитами, еозинофілами й нейтрофілами.
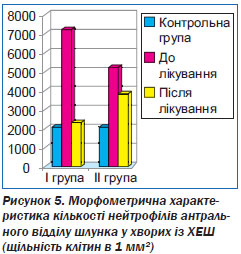
Так, при оцінці нейтрофільної інфільтрації антрального відділу шлунка у хворих із ХЕШ було встановлено, що в період загострення кількість нейтрофільних лейкоцитів у хворих IІ групи становила 7200 в 1 мм2, що в 3,1 раза більше порівняно з контрольною групою (р < 0,01), а в I групі — 8000 в 1 мм2, що в 3,8 раза більше порівняно з контрольною групою (р < 0,01).
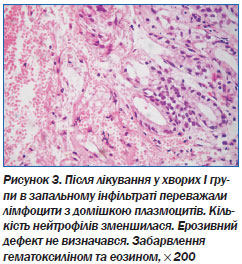
Після проведеного лікування пацієнти I та ІІ груп досягали клініко-ендоскопічної ремісії, але відсоток загоєння ерозій у хворих із ХЕШ після 7 діб був вищим у хворих основної групи (92,4 порівняно з 83,1 % (р ≥ 0,05)).
При морфологічному вивченні біоптатів з антрального відділу шлунка після курсу лікування був установлений позитивний вплив на характер і вираженість патологічних змін у СОШ, що проявлялося істотним зменшенням лімфоплазмоцитарної запальної інфільтрації, зменшенням дистрофічних змін епітеліоцитів, зникненням або значним зменшенням ознак епітеліальної дисплазії. Після ерадикації H.pylori у 89,6 % хворих спостерігалася нормалізація структури поверхневого епітелію зі збереженням незначної лімфоплазмоцитарної інфільтрації у стромі.
Після проведеної комплексної терапії ХЕШ характеризувалися ампутацією валиків, вкритих епітелієм. Так, висота епітелію СОШ у хворих I групи становила 29,68 ± 0,22 мкм (р < 0,05), функціональна активність — 151,04 ± 5,64 мкм (р < 0,01), що свідчить про підвищення захисних властивостей СОШ.
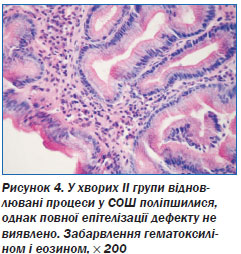
Висота епітелію СОШ у хворих II групи становила 30,81 ± 1,07 мкм (р > 0,05), що не відрізнялося від нормальних параметрів. Однак функціональна активність СОШ була знижена — 107,12 ± 3,19 мкм (р < 0,01).
У поверхневому епітелії СОШ у хворих I і II груп визначалися окремі МЕЛ, кількість яких наближалася до норми і становила відповідно 10,2 ± 1,5 (р < 0,01) і 8,9 ± 1,2 (р < 0,01) на 100 епітеліоцитів. МЕЛ виявлені поблизу клітин дна ямок, які мітотично діляться, що можна вважати показником їх участі у процесах регенерації.
У хворих із ХЕШ (I група) встановлена нормалізація кількості зрілих нейтрофілів: спостерігали зниження кількості нейтрофілів до 2320 в 1 мм2 (р < 0,05), а в II групі — 3840 в 1 мм2 (р < 0,05). Установлені позитивні результати вивчення ефективності терапії хворих із ХЕШ (I група), обумовлені властивістю ІПН пригнічувати активність нейтрофілів (рис. 5).
Висновки
1. Перебіг ХЕШ залежить від тривалості хвороби, ендоскопічної картини захворювання, морфологічних змін СОШ.
2. Морфологічні зміни епітеліального шару у хворих із ХЕШ із частотою рецидивів 1 раз на рік були більш вираженими порівняно з вперше виявленими ХЕШ.
3. Застосування стандартної ерадикаційної терапії у хворих із ХЕШ, асоційованої з H.pylori, сприяє морфологічному та функціональному відновленню СОШ, що призводить до епітелізації ерозій.
1. Наумова Л.А. Особенности клинико-морфологических проявлений атрофического процесса в слизистой оболочке желудка при отсутствии и наличии инфицированности Helicobacter pylori (І этап) // Эксперимент. клин. гастроэнтерол. — 2005. — № 2. — С. 22-28.
2. Сереброва С.Ю., Стародубцев А.К., Писарев В.В. Фармакокинетика, продолжительность антисекреторного эффекта омепразола — вероятные причины их изменений при язвенной болезни двенадцатиперстной кишки // Экспериментальная и клиническая гастроэнтерология. — 2009. — № 4. — С. 86-92.
3. Al-Sabah S., Barkun A.N., Herba K., Adam V. et al. Cost-Effectiveness of Proton-Pump Inhibition Before Endoscopy in Upper Gastrointestinal Bleeding // Clin. Gastroenterol. Hepatol. — 2008. — Vol. 6. — P. 418-425.
4. Besancon M., Simon A., Sachs G., Shin J.M. Sites of reaction of the gastric H,K-ATPase with extracytoplasmic thiol reagents // J. Biol.Chem. — 2004. — 346. — P. 765-783.
5. Maiferthemer P., Megraud F., O`Morain C. et al. Current concept in the management of Helicobacter pylori infection: the Maastricht III Consensus Report // Gut. — 2007. — 56. — P. 772-781.
6. Sakai T., Aoyama N., Kita T. et al. CYP2C19 genotype and pharmacokinetics of three proton pump inhibitors in healthy subjects // Pyarm. Res. — 2005. — 18(9). — P. 645-653.
