Газета «Новости медицины и фармации» 11 (421) 2012
Вернуться к номеру
Индивидуальный подход к ведению пациентов с гипергликемией на фоне сахарного диабета 2-го типа (Рекомендации Американской диабетической ассоциации и Европейской ассоциации по изучению сахарного диабета)
Авторы: SILVIO E. INZUCCHI, MD, Section of Endocrinology, Yale University School of Medicine and Yale-New Haven Hospital, New Haven, Connecticut; RICHARD M. BERGENSTAL, MD, International Diabetes Center at Park Nicollet, Minneapolis, Minnesota; John B. BUSE, MD, PHD, Division of Endocrinology, University of North Carolina School of Medicine, Chapel Hill, North Carolina; MICHAELA DIAMANT, MD, PHD, Diabetes Center/Department of Internal Medicine, VU University Medical Center, Amsterdam, the Netherlands; ELE FERRANNINI, MD, Department of Medicine, University of Pisa School of Medicine, Pisa, Italy; MICHAEL NAUCK, MD, Diabeteszentrum Bad Lauterberg, Bad Lauterberg im Harz, Germany; ANNE L. PETERS, MD, Division of Endocrinology, Keck School of Medicine, University of Southern California, Los Angeles, California;
APOSTOLOS TSAPAS, MD, PHD, Second Medical Department, Aristotle University Thessaloniki, Thessaloniki, Greece; RICHARD WENDER, MD, Department of Family and Community Medicine, Jefferson Medical College, Thomas Jefferson University, Philadelphia, Pennsylvania; DAVID R. MATTHEWS, MD, DPHIL, Oxford Centre for Diabetes, Endocrinology and Metabolism, Churchill Hospital, Headington, Oxford, U.K.; the National Institute for Health Research (NIHR), Oxford Biomedical Research Centre, Oxford, U.K.; and the Harris Manchester College, University of Oxford, Oxford, U.K.
Версия для печати
В связи с увеличением на рынке количества фармакологических препаратов подходы к контролю уровня гликемии у пациентов с сахарным диабетом 2-го типа становятся все сложнее и, в определенной степени, противоречивее [1–5], особенно если принимать во внимание возможные нежелательные явления, вызываемые лекарственными препаратами, а также не совсем доказанное эффективное влияние жестких мер по контролю уровня гликемии с целью профилактики макроангиопатии и связанных с ней осложнений [6–9]. Данные факты затрудняют выбор оптимальной стратегии лечения врачом-клиницистом. Приняв во внимание вышесказанное, Американская диабетическая ассоциация (American Diabetes Association — ADA) и Европейская ассоциация по изучению сахарного диабета (European Association for the Study of Diabetes — EASD) объединили усилия для анализа имеющегося опыта и разработки рекомендаций по ведению гипергликемии у взрослых пациентов (женщин — небеременных) на фоне сахарного диабета 2-го типа.
Таким образом, членами вышеуказанных ассоциаций по сахарному диабету [10], а также членами других ассоциаций и объединений [2, 11–15] было разработано несколько соответствующих руководств. Кроме того, назрела необходимость обновления имеющихся рекомендаций, поскольку накопилось достаточно новой информации относительно возможных пользы и риска гликемического контроля, данных, касающихся эффективности и безопасности некоторых новых классов лекарственных препаратов [16, 17], изъятия из арсенала одних препаратов и ограничения в применении других, а также роста внимания к индивидуальному подходу ведения пациента [18, 19]. Настоящие рекомендации были написаны на основе богатого опыта целой группы авторов; использованы данные, полученные в ходе кропотливой работы и анализа рекомендаций других экспертов. В статье освещены проблемы контроля уровня гликемии, а также необходимость снижения мультифакториального риска при сахарном диабете. Данные положения основаны на информации, свидетельствующей о повышенном риске сердечно-сосудистой заболеваемости и смертности среди пациентов с сахарным диабетом 2-го типа. Агрессивная борьба с факторами риска развития осложнений со стороны сердечно-сосудистой системы (прием антигипертензивных, липидоснижающих и антитромбоцитарных препаратов, отказ от курения), возможно, приносит больше пользы, чем контроль уровня гликемии. Предложенные рекомендации необходимо применять индивидуально для каждого пациента в зависимости от его потребностей, предпочтений и переносимости, что является залогом успеха в лечении. Данные рекомендации, в отличие от предыдущих, выдержаны в менее строгих и алгоритмических рамках. Это обусловлено недостаточным количеством сравнительных исследований эффективности в данной области медицины. Поэтому нашим заданием является еще раз довести до сведения всех врачей, насколько серьезным и изменчивым по своей природе может быть сахарный диабет 2-го типа, специфическую роль каждого отдельно взятого лекарственного препарата, а также разнообразных факторов как со стороны пациента (возраст, сопутствующая патология [4–6]), так и со стороны заболевания, способные повлиять на принятие решения относительно тактики ведения пациента [20–23]. Применение настоящих рекомендаций требует от клиницистов тщательного анализа имеющегося опыта в ведении пациентов с сахарным диабетом 2-го типа наряду с оценкой возможных ограничений и потребностей, индивидуальных для каждого пациента.
Индивидуальный подход к пациенту
Рекомендации, основанные на доказательной медицине, должны рассматриваться с учетом их перво-источника. Таким образом, первоисточником должны являться результаты клинических исследований, проводимых на тщательно отобранных пациентах с помощью общепризнанных методик. Не имеет значения использование дополнительной терапии или применение дополнительных методик обследования. Даже в случаях, когда подобные данные имеются, результаты демонстрируют средние показатели ответов на лечение, в то время как остается нерешенным главный вопрос относительно того, какой пациент на какое лечение получил результат и с чем это связано [24]. Индивидуальный подход в лечении пациента подразумевает применение той или иной терапии в зависимости от предпочтений и потребностей отдельно взятого пациента, а также ожидаемой пользы, которая оправдает выбранную тактику лечения [25]. Данный подход должен быть основополагающим у пациентов с любым хроническим заболеванием, однако, учитывая отсутствие жестких рамок для выбора тактик лечения и их последовательности, он особенно подходит пациентам с сахарным диабетом 2-го типа. Более того, это пациенты, принимающие решение относительно лечения, исходя из своего образа жизни и, в определенной степени, в зависимости от тех лекарственных препаратов, которые они принимают; осуществление выбранной тактики лечения зависит от реального образа жизни, который ведет пациент (дома и в социуме).
Индивидуальное определение тактики лечения для конкретного пациента является одним из ключевых принципов доказательной медицины, требующих проведения тщательного анализа наилучшего опыта лечения, представленного в литературе, с учетом компетентности врача и особенностей пациента [26]. Определяясь с тактикой лечения, врачу необходимо оценить общее состояние пациента, а также каждый из возможных подходов к лечению [21]. С целью достижения согласия в выборе тактики лечения врачу и пациенту необходимо действовать обоюдно, предоставляя друг другу всю необходимую информацию и совместно обдумывая конкретные нюансы, которые могут повлиять на выбор тактики лечения [27]. Существует достаточно доказательств эффективности данного подхода [28]. Также является очень важным тот факт, что совместное обсуждение будущего лечения может значительно улучшить приверженность к ней пациента.
Обоснование
Эпидемиология и задачи системы здравоохранения
Как распространенность, так и заболеваемость сахарным диабетом 2-го типа растут во всем мире, особенно интенсивно в развивающихся странах, наряду с ростом частоты ожирения и изменениями образа жизни. Стремительно растет и сопутствующая экономическая нагрузка на систему здравоохранения, что связано с дороговизной лечения заболевания и его осложнений. Сахарный диабет 2-го типа остается основной причиной сердечно-сосудистых заболеваний, нарушения зрения, в том числе слепоты, терминальной почечной недостаточности, ампутаций, а также госпитализаций пациентов в стационар. Сахарный диабет 2-го типа также связан с повышенным риском развития злокачественных новообразований, серьезных психических расстройств, когнитивных нарушений, хронических заболеваний печени, быстроразвивающегося артрита, а также других состояний, приводящих к инвалидизации и смертельному исходу. В данном случае крайне важным является рациональный подход к выбору правильной тактики лечения.
Связь между контролем уровня гликемии и исходом заболевания
Хорошо известно, что риск развития микро- и макроангиопатий, а также связанных с ними осложнений зависит от уровня гликемии, определяемого по гликированному гемоглобину (HbA1c), достижение нормального уровня которого остается одной из основных целей терапии сахарного диабета 2-го типа [29]. В ходе проспективных рандомизированных исследований было выявлено снижение частоты микрососудистых осложнений у пациентов с сахарным диабетом 2-го типа, в ходе лечения которых низкий уровень гликемии являлся целевым значением. В ходе Британского проспективного исследования сахарного диабета (UK Prospective Diabetes Study — UKPDS) [30, 31] пациенты с впервые диагностированным сахарным диабетом были рандомизированы в две группы. В стандартной группе в качестве основной тактики лечения была выбрана модификация образа жизни пациента с применением лекарственной терапии только в случае высоких показателей уровня глюкозы в крови. Во второй группе (группе интенсивного лечения) пациентам рандомизированно назначалось лечение препаратами сульфонилмочевины либо инсулином, а подгруппа пациентов с избыточной массой тела получала метформин. Общий достигнутый уровень HbA1c в группе интенсивного лечения был на 0,9 % ниже по сравнению со стандартной группой (7,0 % против 7,9 %). Снижение риска развития микрососудистых осложнений (ретинопатии, нефропатии, нейропатии) благодаря интенсивному лечению было связано с разницей в подходах к контролю уровня гликемии. Статистически значимой разницы в снижении частоты развития инфаркта миокарда не наблюдалось [30]. Напротив, у небольшой группы пациентов, получавших лечение метформином, частота развития инфаркта миокарда, а также частота смертности, связанной с диабетом, и частота общей смертности [32], несмотря на средний уровень HbA1c, были всего лишь на 0,6 % ниже по сравнению со стандартной группой. В ходе 10-летнего периода наблюдения после завершения исследования UKPDS были продемонстрированы данные, касающиеся относительной пользы рандомизации пациентов с последующим интенсивным лечением, сохранявшейся на протяжении всего 10-летнего периода наблюдения; статистически значимая польза была оказана на конечные точки заболеваний сердечно-сосудистой системы и общую смертность пациентов, изначально получавших сульфонилмочевину/инсулин, а также пациентов, получавших метформин [33], принимая во внимание тот факт, что средние уровни HbA1c пациентов разных групп достигали одинакового значения после завершения рандомизации. В 2008 году было проведено три краткосрочных исследования: «Изучение контроля риска сердечно-сосудистых осложнений у больных сахарным диабетом» (Action to Control Cardiovascular Risk in Diabetes — ACCORD) [34], «Изучение профилактики сосудистых осложнений у больных сахарным диабетом: контролированная оценка действия претеракса и диамикрона замедленного высвобождения» (Action in Diabetes and Vascular Disease: Preterax and Diamicron Modified-Release Controlled Evaluation — ADVANCE) [35], «Исследование течения сахарного диабета у пожилых людей» (Veterans Affairs Diabetes Trial — VADT) [36]), по результатам которых было проанализировано влияние двух уровней гликемического контроля на конечные точки сердечно-сосудистых заболеваний у пациентов среднего и старшего возрастов с подтвержденным сахарным диабетом 2-го типа и высоким риском сердечно-сосудистых осложнений. В ходе исследований ACCORD и VADT целевой показатель HbA1c < 6,0 % достигался путем применения сложных комбинаций пероральных препаратов с инсулином. В ходе исследования ADVANCE целевой показатель HbA1c ≤ 6,5 % достигался более простым путем применения препарата сульфонилмочевины гликлазида. Результаты ни одного из исследований не продемонстрировали статистически значимого снижения первично объединенных конечных точек сердечно-сосудистых заболеваний. Более того, в ходе исследования ACCORD на фоне интенсивной терапии наблюдался рост общей смертности на 22 %, большая часть смертельных исходов была обусловлена осложнениями со стороны сердечно-сосудистой системы. Попытки объяснить этот факт вызывают затруднения, особенно если учесть, что при интенсивном лечении уровни гликемии были в три раза ниже, чем таковые у пациентов с простыми схемами лечения. Что оказалось основной причиной сердечно-сосудистых осложнений и смертельных исходов (сыграла определенную роль гипогликемия или же другие факторы, например увеличение массы тела или более сложная схема лечения), остается неясным. В ходе исследований были получены доказательства, что пациенты, у которых отсутствовали явные проявления сердечно-сосудистых заболеваний, длительность сахарного диабета была относительно небольшая, а показатель HbA1c на исходном уровне был ниже, больше пользы получали благодаря интенсивному лечению. В ходе исследований было также продемонстрировано умеренное улучшение конечных точек микрососудистых осложнений. Также в ходе метаанализа сердечно-сосудистых осложнений было подтверждено, что снижение показателя HbA1c на ~ 1 % может снизить относительный риск нефатального инфаркта миокарда на 15 %, однако не оказывает влияния на нарушения мозгового кровообращения и общую смертность [36].
Обзор патогенеза сахарного диабета 2-го типа
Увеличение показателя уровня гликемии обусловлено преобладанием поступления глюкозы в плазму крови над ее высвобождением. Гипергликемия натощак обусловлена избыточным образованием глюкозы в печени. Постпрандиальная гипергликемия вызвана недостаточным угнетением образования глюкозы, а также недостаточным воздействием инсулина на усвоение глюкозы в тканях-мишенях, преимущественно в скелетных мышцах. Как только показатель почечного канальцевого транспорта глюкозы достигает максимума, уровень глюкозурии снижается, что, однако, не предотвращает дальнейшего нарастания уровня гликемии.
Нарушение функции β-клеток поджелудоч- ной железы является основным и характерным признаком сахарного диабета 2-го типа.
На ранних стадиях заболевания образование инсулина не нарушено или даже увеличено (в абсолютных цифрах), однако имеется диспропорция относительно чувствительности клеток к инсулину, которая, как правило, снижена. В то же время значительно страдает способность в-клеток поджелудочной железы вырабатывать гормон в достаточном количестве при повышении уровня гликемии. Это функциональное нарушение островков поджелудочной железы определяет количественный показатель уровня гипергликемии [37] и прогрессирует с течением заболевания. Более того, у пациентов с сахарным диабетом 2-го типа в-клетки поджелудочной железы вырабатывают в избыточном количестве глюкагон, что, в свою очередь, стимулирует образование глюкозы в печени [38]. Также важным является тот факт, что дисфункция островковых клеток, как правило, обратима. Возобновление действия инсулина разгружает в-клетки поджелудочной железы, а любое вмешательство, позволяющее нормализировать уровень гликемии, — от диеты до бариатрической хирургии — может помочь до определенной степени восстановить функцию β-клеток [39]. Для сахарного диабета 2-го типа также характерны нарушения в инкретиновой системе, представленной гормонами желудочно-кишечного тракта, глюкагоноподобным пептидом-1 (GLP-1), глюкозозависимым инсулинотропным пептидом (GIP). Они обнаружены относительно недавно, однако остается неясным, являются эти изменения первичными или вторичными по своей природе [40]. У большинства пациентов с сахарным диабетом 2-го типа, особенно страдающих ожирением, важной деталью является инсулинорезинстентность тканей-мишеней (печени, мышц, жировой ткани, миокарда). В результате наблюдаются избыточное образование глюкозы и недостаточная ее утилизация. Кроме того, повышенное поступление жирных кислот в печень приводит к их окислению, что, в свою очередь, ведет к избыточному глюконеогенезу, а абсолютный избыток жиров лежит в основе развития стеатогепатоза [41].
Действие антигипергликемических лекарственных средств направлено на одно и более патофизиологических звеньев сахарного диабета 2-го типа или же на физиологические процессы, связанные с аппетитом, всасыванием питательных веществ или выведением продуктов их обмена в организме. Необходимо всегда помнить о том, что сахарный диабет 2-го типа является заболеванием, которое может при одном и том же патогенезе давать совершенно разнообразную клиническую картину, — это особенно важно при индивидуальном подходе в выборе тактики лечения.
Антигипергликемическая терапия
Целевые уровни контроля гликемии
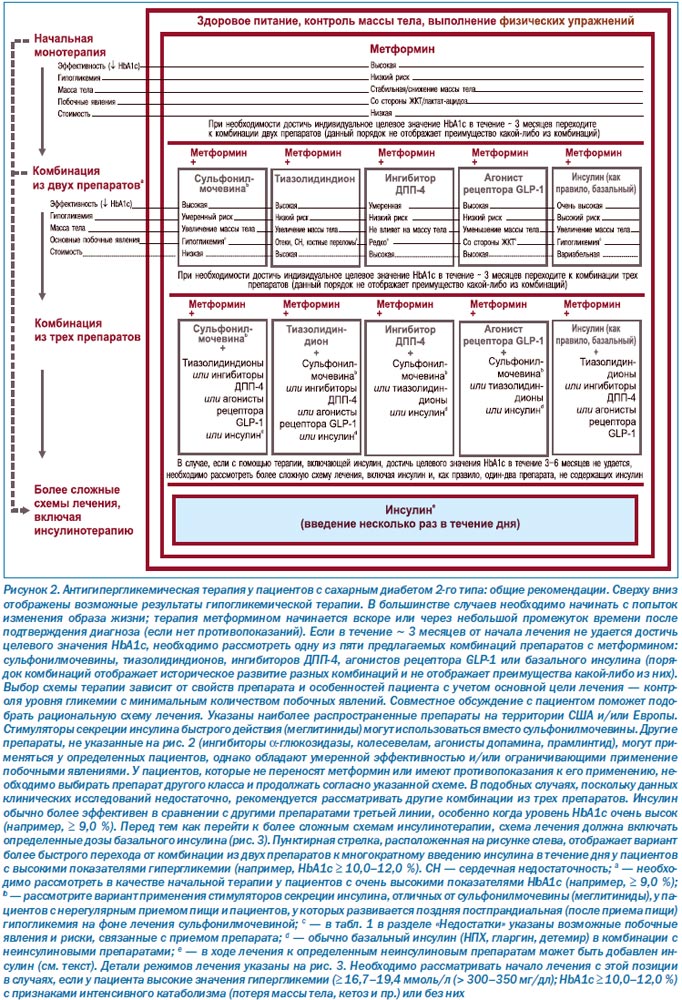
Американская диабетическая ассоциация с целью снижения частоты развития микрососудистой патологии в «Стандартах оказания медицинской помощи пациентам, страдающим сахарным диабетом» рекомендует снижение уровня HbA1c до < 7,0 % [42]. Такой показатель может быть достигнут при среднем значении глюкозы в плазме крови на уровне ~ 8,3–8,9 ммоль/л (~ 150–160 мг/дл); идеальный уровень глюкозы натощак и перед едой должен составлять < 7,2 ммоль/л (< 130 мг/дл), а после еды < 10 ммоль/л (< 180 мг/дл). Достижение более строгих целевых уровней HbA1c (например, 6,0–6,5 %) необходимо рассматривать у пациентов определенных групп (с короткой длительностью заболевания, большой ожидаемой продолжительностью жизни, отсутствием клинически выраженных проявлений сердечно-сосудистых заболеваний) при условии, что такой уровень гликемии может быть достигнут на фоне отсутствия угрозы развития серьезной гипогликемии и других нежелательных явлений в ходе лечения [20, 43]. В то же время менее строгие целевые уровни HbA1c, например 7,5–8,0 % и даже несколько выше, могут подходить для пациентов с наличием в анамнезе тяжелых гипогликемических состояний, небольшой ожидаемой продолжительностью жизни, прогрессирующими осложнениями, тяжелой сопутствующей патологией, а также для пациентов, у которых сложно добиться указанных показателей, несмотря на достаточное обучение пациента, проводимые регулярные консультации, применение эффективных комбинаций гипогликемических препаратов, в том числе инсулина [20, 44]. Анализ результатов проведенных исследований у пациентов с сахарным диабетом 2-го типа и сердечно-сосудистыми осложнениями показал, что не у каждого пациента наблюдается польза от жестких мер, применяемых для контроля уровня гликемии. Отсюда следует сделать вывод о роли индивидуального подхода к ведению пациента [5, 34–36]. Детали, на которые необходимо ориентироваться врачу при выборе целевого уровня HbA1c, приведены на рис. 1. Как уже указывалось ранее, необходимо также учитывать пожелания и требования пациента, поскольку достижение целевого уровня гликемии возможно лишь при его активном содействии [19, 23, 45, 46]. На самом деле, достижение целевого уровня любого показателя является отражением эффективного взаимодействия между врачом и пациентом. С этим связано другое важное положение относительно того, насколько прост путь в достижении более жестких целевых показателей, поскольку это влияет на выбор тактики лечения. Исходя из вышесказанного, становится ясным, что более жесткие целевые показатели становятся показателями выбора при условии, что их можно достичь с помощью более простых схем лечения и незначительным количеством (в идеале — отсутствием) нежелательных явлений. Важным является и следующий факт: процент пациентов, у которых достигается целевой уровень HbA1c < 7,0 %, являющийся индикатором эффективности применяемого лечения и используемый организациями системы здравоохранения, не соответствует требованиям индивидуального подхода в лечении пациента с конкретными ожидаемыми целевыми показателями.
Методы лечения
 Изменение образа жизни. Критически важными аспектами в ведении пациентов с сахарным диабетом 2-го типа являются выполнение физических упражнений и изменение режима питания [47, 48]. Все пациенты должны быть обучены относительно своего заболевания (индивидуально или в группе, желательно по утвержденной программе), с расставлением акцентов на важности соблюдения диеты и выполнения физических упражнений. Регулярное повторное консультирование пациентов в ходе лечения настолько же важно, как и первичная консультация после подтверждения диагноза. Снижение массы тела, достигнутое путем соблюдения одной лишь диеты или же посредством применения лекарственных препаратов и хирургического вмешательства, способствует контролю уровня гликемии, а также снижению риска развития сердечно-сосудистых осложнений. Умеренное снижение массы тела (5–10 %), как правило, способствует контролю уровня гликемии. Таким образом, одной из целей в лечении сахарного диабета является снижение массы тела пациента или, по крайней мере, поддержание ее на одном и том же уровне. Диету необходимо определять индивидуально для каждого пациента. Пациенты должны быть осведомлены о необходимости употребления здоровой пищи, состав которой может зависеть от диетических рекомендаций для конкретного региона, а также от предпочтений самого пациента. Особое внимание необходимо уделить пище, богатой клетчаткой (овощи, фрукты, цельные злаки, бобовые), продуктам с низким содержанием жиров и рыбе.
Изменение образа жизни. Критически важными аспектами в ведении пациентов с сахарным диабетом 2-го типа являются выполнение физических упражнений и изменение режима питания [47, 48]. Все пациенты должны быть обучены относительно своего заболевания (индивидуально или в группе, желательно по утвержденной программе), с расставлением акцентов на важности соблюдения диеты и выполнения физических упражнений. Регулярное повторное консультирование пациентов в ходе лечения настолько же важно, как и первичная консультация после подтверждения диагноза. Снижение массы тела, достигнутое путем соблюдения одной лишь диеты или же посредством применения лекарственных препаратов и хирургического вмешательства, способствует контролю уровня гликемии, а также снижению риска развития сердечно-сосудистых осложнений. Умеренное снижение массы тела (5–10 %), как правило, способствует контролю уровня гликемии. Таким образом, одной из целей в лечении сахарного диабета является снижение массы тела пациента или, по крайней мере, поддержание ее на одном и том же уровне. Диету необходимо определять индивидуально для каждого пациента. Пациенты должны быть осведомлены о необходимости употребления здоровой пищи, состав которой может зависеть от диетических рекомендаций для конкретного региона, а также от предпочтений самого пациента. Особое внимание необходимо уделить пище, богатой клетчаткой (овощи, фрукты, цельные злаки, бобовые), продуктам с низким содержанием жиров и рыбе.
Высококалорийную пищу, в том числе и содержащую насыщенные жиры, сладкие десерты, а также разного рода закуски необходимо употреблять реже и в меньших количествах [52]. Пациенты, которым удается добиться снижения массы тела и поддерживать ее на постояном уровне, придерживаются подобного предписания после повторных эпизодов удачной попытки сбросить лишний вес, которая сопровождалась повторным набором массы. Врачу не следует осуждать образ жизни пациента, однако необходимо регулярно вносить в него коррективы и при необходимости психологически поддерживать пациента. Пациенту рекомендуется выполнять максимально возможное количество умеренных физических упражнений, идеально — заниматься аэробикой, упражнениями на выносливость, гимнастикой минимум 150 минут в неделю [53]. У пациентов старшего возраста, а также у пациентов с нарушениями подвижности скелетно-мышечной системы любое повышение физической нагрузки с учетом возможностей сердечно-сосудистой системы является очень полезным. Высокомотивированным пациентам с подтвержденным диагнозом сахарного диабета, у которых показатель HbA1c на исходном уровне близок к целевому (например, < 7,5 %), можно предоставить возможность отложить терапию лекарственными препаратами (обычно метформином) на 3–6 месяцев и попробовать внести коррективы в образ жизни. У пациентов со средними значениями гипергликемии, а также у пациентов, у которых ожидается маловероятный эффект от изменения образа жизни, необходимо сразу же после подтверждения диагноза начинать лечение гипогликемическими препаратами (также обычно метформином). В дальнейшем в зависимости от эффекта терапию можно будет модифицировать, а также отменить в случае, если в образе жизни пациента будут достигнуты положительные изменения.
Пероральные и инъекционные препараты, не содержащие инсулин
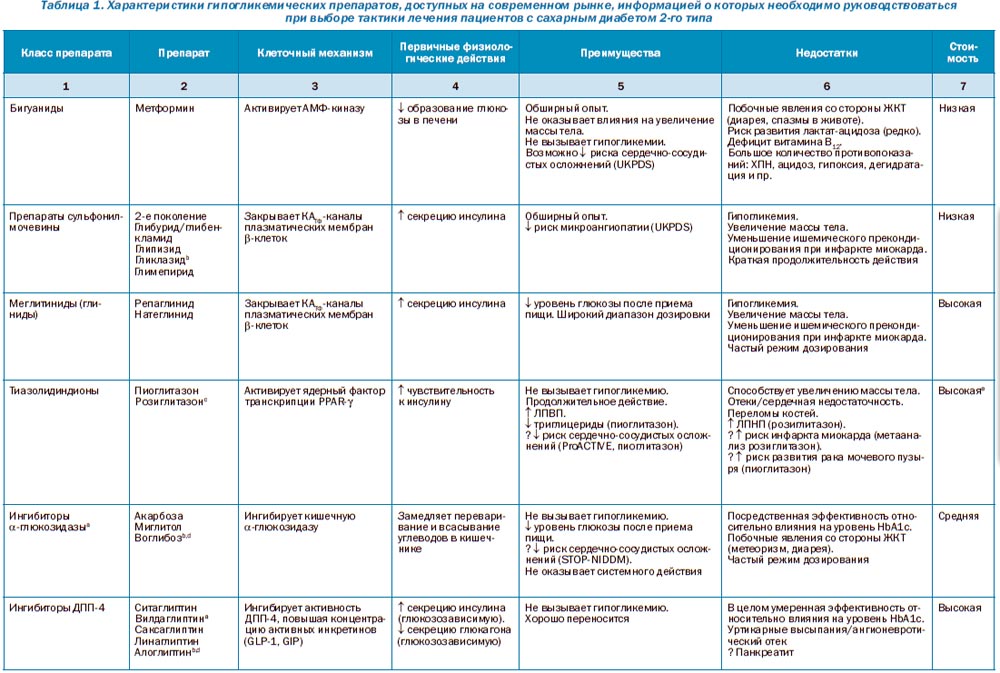
Основные характеристики антигипергликемических препаратов, которые могут сыграть роль в выборе тактики лечения при индивидуальном подходе, отображены в табл. 1. Конечными целями контроля уровня гликемии являются избежание острых осмотических симптомов гипергликемии, колебаний содержания глюкозы в крови на протяжении определенного периода времени, а также предотвращение/замедление развития осложнений сахарного диабета, максимально поддерживая уровень качества жизни пациента. Информации относительно того, могут ли все это обеспечить лекарственные препараты, представленные на фармацевтическом рынке, недостаточно. Чтобы ответить на заданные вопросы, потребуется проведение долгосрочных крупномасштабных клинических исследований, которые, к сожалению, недоступны для большинства препаратов. Мониторинг воздействия на косвенные показатели гликемического контроля (например, HbA1c) может позволить определить возможность развития микроангиопатии, но не всегда с таким же успехом можно будет судить о риске развития макрососудистых осложнений. Принимая во внимание показатели у отдельно взятого пациента, одной из специфических целей в ходе лечения может быть контроль метаболических показателей на протяжении определенного периода времени. Метформин, препарат группы бигуанидов, остается наиболее распространенным препаратом первой линии в лечении сахарного диабета 2-го типа. Механизм его действия в основном заключается в угнетении образования глюкозы в печени [54, 55]. Считается, что метформин при длительном применении не оказывает влияния на массу тела, а также не способствует развитию гипогликемических состояний. Для метформина характерны побочные явления со стороны желудочно-кишечного тракта, с осторожностью необходимо применять у пациентов с риском развития лактат-ацидоза (например, при прогрессирующей почечной недостаточности, алкоголизме), хотя это и является редким осложнением терапии. Как уже было указано ранее, применение метформина может оказать положительный эффект на сердечно-сосудистую систему, однако подтверждающих этот факт данных на сегодня недостаточно.
Наибольший опыт использования пероральных лекарственных средств имеют стимуляторы секреции инсулина — препараты сульфонилмочевины. Препараты данной группы стимулируют секрецию инсулина посредством закрытия АТФ-чувствительных калиевых каналов -клеток поджелудочной железы [56]. В то время как препараты являются достаточно эффективными для контроля уровня гликемии, их применение может быть связано с увеличением массы тела и риском развития гипогликемических состояний. Кроме того, в ходе исследований было продемонстрировано, что существует риск развития резистентности к препаратам данной группы, которая по интенсивности может превышать резистентность к другим препаратам, применяемым с целью стимуляции функции -клеток поджелудочной железы [57]. Стимуляторы секреции инсулина короткого действия (меглитиниды, или глиниды) увеличивают секрецию инсулина посредством того же механизма действия, но реже вызывают состояния гипогликемии [58]. Однако требуется более частая дозировка данных препаратов.
Препараты группы тиазолидиндионов являются y-активаторами рецептора, активируемого пролифератором пероксисом [59], улучшают чувствительность скелетных мышц к инсулину, а также угнетают образование глюкозы в печени [54, 55]. Препараты данной группы не увеличивают риск развития гипогликемических состояний, а продолжительность эффекта может быть более длительной, чем у препаратов сульфонилмочевины и метформина [57]. В ходе крупномасштабного исследования, в котором были задействованы пациенты с клинически выраженными признаками макроангиопатии, было выявлено, что пиоглитазон оказывает умеренный эффект в предотвращении сердечно-сосудистых осложнений [60]. Другой препарат этого класса, розиглитазон, используется значительно реже после того, как была доказана его роль в увеличении риска развития инфаркта миокарда [61]. Также были получены данные о том, что пиоглитазон способствует увеличению риска развития рака мочевого пузыря [62]. Среди побочных явлений, характерных для применения тиазолидиндионов, следует упомянуть следующие: увеличение массы тела, застой жидкости, который ведет к отекам и/или сердечной недостаточности у пациентов, которые имеют к этому определенные предпосылки, а также риск переломов костей [57, 60].
Препараты, механизм действия которых связан с инкретиновой системой, были разработаны относительно недавно [63]. Инъекционные агонисты рецептора GLP-1 действуют по типу эндогенного глюкагоноподобного пептида, стимулируя таким образом секрецию инсулина поджелудочной железой по глюкозозависимому механизму, угнетая секрецию поджелудочной железой глюкагона, замедляя эвакуацию желудочного содержимого и уменьшая аппетит. Основным преимуществом агонистов рецептора GLP-1 является умеренное уменьшение массы тела, которое, однако, у некоторых пациентов может быть достаточно выраженным. Побочными явлениями, которые ограничивают применение данных препаратов на начальном этапе, могут быть тошнота и рвота. Вопросы относительно риска развития панкреатита остаются открытыми. Пероральные ингибиторы дипептидилпептидазы-4 увеличивают концентрацию циркулирующих активных глюкагоноподобного и гастроинтестинального пептидов [64]. Основной эффект пероральных ингибиторов ДПП-4 заключается в регуляции секреции инсулина и глюкагона, препараты не влияют на массу тела. Как правило, ни один из классов препаратов, действующих на инкретиновую систему, не вызывает развития гипогликемических состояний.
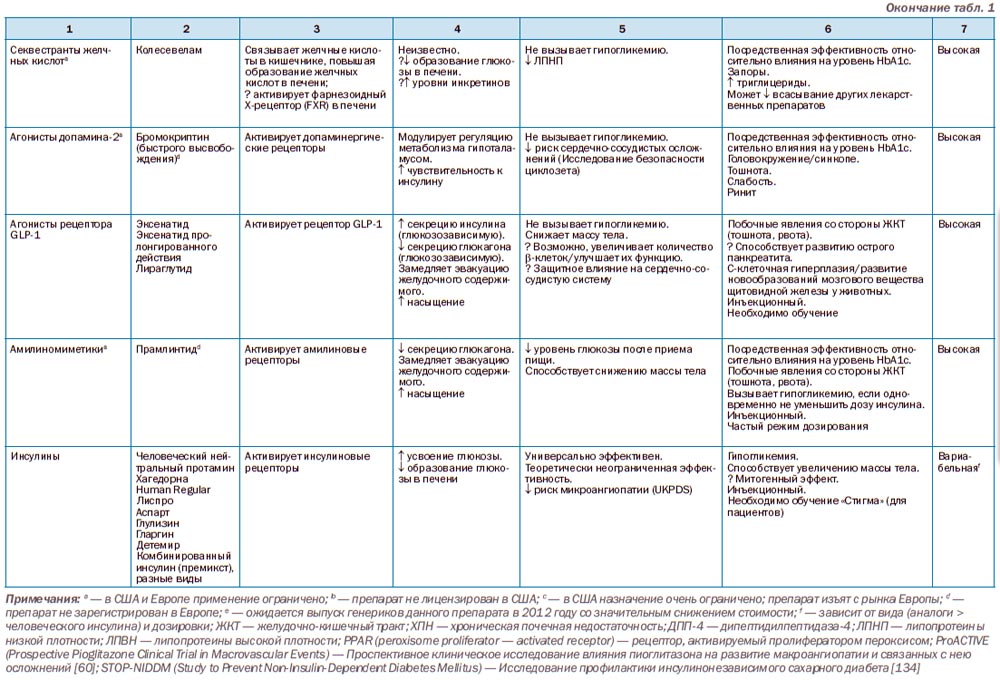
Двумя препаратами, которые редко используются в США и Европе, являются ингибиторы a-глюкозидазы, замедляющие всасывание углеводов в желудочно-кишечном тракте [65], и колесевелам, секвестрант желчных кислот, важным дополнительным эффектом которого является снижение уровня ЛПНП [66]. Механизм гипогликемического действия колесевелама до сих пор в достаточной мере не изучен. Оба препарата вызывают побочные явления со стороны желудочно-кишечного тракта: ингибиторы a-глюкозидазы приводят к метеоризму, а колесевелам является причиной запоров. Единственным из свободно доступных гипогликемических препаратов на территории США является бромокриптин [67]. Механизм действия и его роль до сих пор остаются неясными. Агонист амилина, прамлинтид, как правило, применяется у пациентов, получающих интенсивную терапию инсулином по поводу сахарного диабета 1-го типа. Прамлинтид регулирует колебания уровня глюкозы после приема пищи посредством угнетения секреции глюкагона и замедления эвакуации желудочного содержимого [68]. Для следующих препаратов, не содержащих инсулин, характерен высокий гипогликемический эффект: метформин, препараты сульфонилмочевины, тиазолидиндионы, а также агонисты GLP-1 (ожидаемое снижение уровня HbA1c ~ 1,0–1,5 %) [1, 69, 70]. Несколько ниже гипогликемический эффект наблюдается у меглитинидов, ингибиторов ДПП-4, ингибиторов a-глюкозидазы, колесевелама и бромокриптина (~ 0,5–1,0 %). Необходимо обратить внимание на то, что более старые препараты изучались в исследованиях с участием пациентов с более высоким исходным показателем HbA1c, что связано с более интенсивными снижениями показателей уровня гликемии, независимо от тактики лечения. Согласно прямым сравнительным исследованиям, разница их влияния на уровень глюкозы незначительна. Таким образом, выбор препарата зависит как от характеристик самого препарата (частота приема, побочные явления и пр.), так и от возможностей пациента (стоимость препарата).
Инсулин. Частая необходимость в заместительной терапии инсулином обусловлена прогрессирующей дисфункцией -клеток, характерной для сахарного диабета 2-го типа [71]. Важным является и тот факт, что у большинства пациентов сохраняется эндогенная секреция инсулина даже на поздних стадиях заболевания. Исходя из этого, можно сделать вывод, что в сложных схемах интенсивной терапии сахарного диабета не всегда есть необходимость [72].
В идеале терапия инсулином предполагает достижение максимально близкого к целевому значению уровня гликемии без увеличения массы тела и развития состояний гипогликемии [73]. В качестве стартовой терапии, при условии, что у пациента значения гликемии на относительно невысоком уровне и/или отсутствуют симптомы гипергликемии, используется монотерапия базальным инсулином [74]. Базальный инсулин обеспечивает относительно стабильную концентрацию на протяжении суток, контролируя уровень глюкозы главным образом путем угнетения образования глюкозы в печени между приемами пищи, а также во время сна. Могут применяться инсулин средней продолжительности действия (нейтральный протамин Хагедорна — НПХ) или инсулин длительного действия (гларгин — человеческий инсулин A21Gly,B31Arg,B32Arg), или инсулин детемир (человеческий инсулин B29Lys(-тетрадеканоил), desB30). Действие двух последних препаратов (инсулин гларгин, инсулин детемир) может быть связано с развитием более легких гипогликемических состояний в ночное время и меньшим влиянием на увеличение массы тела (инсулин детемир) в сравнении с НПХ, однако стоимость этих препаратов выше [75, 76]. Необходимо обратить внимание на то, что дозировка аналогов базального инсулина может отличаться. В ходе большинства сравнительных исследований было показано, что наибольшая дозировка требуется для инсулина детемир [77]. Хотя большинству пациентов с сахарным диабетом 2-го типа, которые нуждаются в инсулинотерапии, может быть достаточно монотерапии одним базальным инсулином, некоторым пациентам может потребоваться введение болюсного инсулина (короткого действия) вследствие прогрессирующего снижения возможности организма секретировать инсулин. В качестве болюсного инсулина могут использоваться аналоги инсулина быстрого действия: инсулин лиспро (человеческий инсулин B28Lys,B29Pro), инсулин аспарт (человеческий инсулин B28Asp), инсулин глулизин (человеческий инсулин B3Lys,B29Glu), которые можно вводить непосредственно перед приемом пищи. В результате создаются условия более эффективного контроля уровня гликемии после приема пищи в сравнении с более дешевыми и распространенными человеческими инсулинами, применение которых в данных условиях не совсем рационально. В идеале схема инсулинотерапии должна подбираться индивидуально для каждого пациента в соответствие с его образом жизни и диетой, а также характерным для пациента уровнем гликемии. Ожидаемые показатели снижения уровня гликемии должны соответствовать режиму инсулинотерапии, а также ожидаемым целевым показателям (рис. 1). Крайне важным является обучение пациента относительно правильного контроля уровня гликемии, техники введения инсулина, хранения инсулина, распознания симптомов гипогликемии/первоочередных мер по ее устранению, а также распорядка дня. Рекомендуется, чтобы, по возможности, обучение в ходе терапии проводилось лицами, имеющими соответствующий сертификат.
Ключевые моменты
Целевые уровни гликемии и гипогликемическая терапия должны подбираться в индивидуальном порядке.
Соблюдение диеты, выполнение физических упражнений, а также обучение пациента являются основой любой лечебной программы сахарного диабета 2-го типа.
При условии отсутствия определенных противопоказаний метформин является препаратом первой линии для лечения сахарного диабета 2-го типа.
Относительно применения других препаратов доказательных данных на сегодня недостаточно. Дополнительное применение одного-двух пероральных или инъекционных гипогликемических препаратов является целесообразным, поскольку позволяет избежать возможных побочных эффектов.
Рано или поздно для контроля уровня гликемии большей части пациентов понадобится применение инсулина в качестве монотерапии или в комбинации с другими препаратами.
По возможности принятие решений относительно тактики лечения должно проводиться совместно с пациентом, учитывая его предпочтения, потребности и ценности.
Основной целью терапии является максимально возможное снижение риска развития сердечно-сосудистых осложнений.
Подход к лечению
Стартовая лекарственная терапия
На сегодня является общепризнанным, что метформин, учитывая отсутствие противопоказаний и хорошую переносимость, является достаточно рентабельным препаратом первой линии в лечении сахарного диабета 2-го типа [42] (рис. 2). Метформин назначается практически сразу после подтверждения диагноза сахарного диабета, особенно если у пациента наблюдаются проблемы в попытках изменить образ жизни, а также если врач считает, что возможность достичь целевого показателя HbA1c маловероятна. Поскольку применение метформина часто сопровождается побочными явлениями со стороны желудочно-кишечного тракта, необходимо начинать с малой дозы с постепенным ее увеличением. У пациентов с высоким исходным уровнем HbA1c (например, ≥ 9,0 %) вероятность достижения целевого значения HbA1c с помощью монотерапии очень низкая. В подобных случаях может быть оправданным начало лечения с применением комбинации двух препаратов, не содержащих инсулин, либо же непосредственно с инсулина [78]. В случаях наличия клинически выраженных симптомов гипергликемии и/или критически высоких значений глюкозы в плазме крови (например, ≥ 16,7–19,4 ммоль/л (> 300–350 мг/дл)) или HbA1c (например, ≥ 10,0–12,0 %) применение инсулина необходимо рассматривать с самого начала лечения. Применение инсулина абсолютно показано в случае развития ацидоза за счет интенсивных катаболических процессов, а также кетонурии, что демонстрирует выраженную недостаточность инсулина. Необходимо обратить внимание на то, что если у пациента не подтвержден диагноз сахарного диабета 1-го типа, по мере уменьшения симптоматики и выведения токсических продуктов метаболизма глюкозы инсулин может быть частично или полностью заменен на препараты (возможно применение комбинации), не содержащие инсулин. Если по какой-либо причине метформин не может быть применен, можно выбрать другой пероральный препарат, например, сульфонилмочевина/глинид, пиоглитазон, ингибитор ДПП-4; в особых случаях, когда, например, в ходе лечения крайне необходимым является снижение массы тела, полезным может оказаться начало лечения с помощью агониста рецептора GLP-1. По возможности, у конкретных пациентов, необходимо также рассмотреть варианты применения менее часто используемых препаратов (ингибиторы a-глюкозидазы, колесевелам, бромокриптин), которые сами по себе являются менее привлекательными вследствие умеренного гипогликемического эффекта и побочных явлений. Во время выбора лекарственного препарата необходимо помнить о предпочтениях и особенностях пациента, возможности развития у него побочных эффектов, риске увеличения массы тела и гипогликемических состояний в ходе лечения [20, 21]. (Особенности индивидуального подхода к пациенту представлены на рис. 2.)
Переход на комбинированную терапию двумя препаратами
На рис. 2 также отображены возможные результаты интенсификации гипогликемической терапии на фоне метформина. Если с помощью монотерапии не удается достичь/поддерживать целевой уровень HbA1c на протяжении более 3 месяцев от начала лечения, необходимо добавить в схему лечения второй пероральный препарат — агонист рецептора GLP-1 — или базальный инсулин [5, 10]. Необходимо обратить внимание на то, что чем больше показатель HbA1c, тем больше вероятность того, что потребуется применение инсулина. Добавление в схему терапии второго перорального препарата позволяет достичь снижения HbA1c ~ 1 % [70, 79]. Если все же не удается достичь необходмого снижения показателя уровня гликемии (то есть пациент не отвечает на лечение), необходимо проанализировать приверженность пациента к лечению. Если приверженность пациента к лечению удовлетворительная, препарат необходимо заменить препаратом с другим механизмом действия. Единых рекомендаций относительно того, какой препарат эффективнее всего комбинировать с метформином, нет, поскольку данных, полученных в долгосрочных сравнительных исследованиях, недостаточно [80]. Поэтому необходимо рассматривать преимущества и недостатки каждого препарата для пациента индивидуально (табл. 1).
Некоторые антигипергликемические препараты способствуют увеличению массы тела. Это может указывать на прогрессирование резистентности тканей к инсулину, а также на увеличение риска развития сердечно-сосудистых осложнений. Единственным исключением могут быть тиазолидиндионы [57]; увеличение массы тела на фоне приема препаратов данной группы сопровождается снижением резистентности тканей к инсулину. Несмотря на то, что данных, которые свидетельствуют в пользу связи между увеличением массы тела, характерного для определенных препаратов, и увеличением риска развития сердечно-сосудистых осложнений, недостаточно, очень важной остается необходимость правильного выбора схемы лечения и дозировки с целью избежать увеличения массы тела.
Необходимо обращать внимание и на переносимость препаратов, а также их комбинаций. Даже редкие случаи развития гипогликемического состояния могут создать немало проблем, особенно если гипогликемия достигает критически низких цифр; негативно могут повлиять на пациента и более легкие состояния гипогликемии [81]. Побочные явления со стороны желудочно-кишечного тракта могут хорошо переноситься одними пациентами и совершенно не переноситься другими. Задержка жидкости у одних пациентов может иметь клинические проявления, тогда как у других является лишь косметическим недостатком [82]. Особенно подвержены риску переломов костей пациентки в постменопаузе [57]. Также необходимо отметить, что на выбор тактики лечения в значительной степени влияет стоимость того или иного гипогликемического препарата. В случае ограниченных денежных ресурсов приходится останавливаться на более дешевых препаратах. Также во внимание необходимо принимать возможность развития побочных явлений, необходимость регулярного мониторинга процесса лечения, что может вылиться в дополнительные расходы.
Профилактика опасных для жизни отдаленных осложнений может позволить снизить расходы на лечение заболевания.
Переход на комбинированную терапию тремя препаратами
В ходе некоторых исследований была продемонстрирована эффективность добавления третьего неинсулинового препарата к препаратам, комбинация которых не позволила достичь целевого значения гликемии [83–86]. Разумеется, что если в качестве третьего препарата в комбинации будет инсулин, можно достичь значительного эффекта. И в самом деле, поскольку сахарный диабет связан с прогрессирующей утратой -клеток поджелудочной железы, большинству пациентов, особенно с длительным анамнезом заболевания, в конце концов потребуется инсулинотерапия, предпочтение которой будет отдаваться при значениях гипергликемии (например, ≥ 8,5 %), указывающих на неэффективность других препаратов [87]. Если пациент принимает тройную комбинированную терапию без инсулина, необходимо тщательно мониторировать уровень гликемии и в случае, если лечение оказалось неэффективным, рекомендуется рассмотреть возможность начала инсулинотерапии. Нельзя допускать, чтобы гипергликемия сохранялась на протяжении нескольких месяцев. При выборе тройной комбинированной терапии особенно важно рассмотреть возможность применения препаратов с механизмами действия, дополняющими друг друга (рис. 2). Количество одновременно применяемых препаратов определяет риск возможных побочных явлений, межлекарственных взаимодействий, повышает стоимость лечения, а также может являться причиной плохой приверженности пациента к лечению. Целесообразность, ожидаемую пользу и возможные побочные явления, связанные с лечением, необходимо обсуждать совместно с пациентом. Особенности пациентов, по которым можно было бы спрогнозировать вероятную степень ответа на лечение, на сегодня не определены.
Переход на инсулинотерапию и подбор дозировки

В случае если со стороны пациента с момента начала инсулинотерапии наблюдается определенное нежелание получать инъекции препарата, а на данном этапе переход к инсулинотерапии имеет важное значение, необходимо рассмотреть возможность обучения пациента и стимуляции роста его заинтересованности в лечении. Как правило, инсулин назначается в небольших дозах (например, 0,1–0,2 Ед/кг массы тела в день), однако в случае высоких показателей гипергликемии могут быть оправданы более высокие дозы инсулина (например, 0,3–0,4 Ед/кг массы тела в день). Наиболее приемлемой стратегией лечения считается разовое введение базального инсулина; время инъекции зависит от распорядка дня пациента и общего гликемического профиля (рис. 3). Хотя рекомендации по повышению дозы инсулина не могут быть охвачены в данном материале, все же большинство пациентов можно обучить правилам подбора доз по нескольким алгоритмам, каждый из которых базируется на небольшом увеличении дозы инсулина в зависимости от прогрессирования гипергликемии [74, 76, 88]. Например, рациональным может считаться увеличение дозы инсулина на 1–2 единицы (или на 5–10 % у пациентов, изначально получающих большие дозы) к дневной дозе 1–2 раза в неделю в случае, если уровень гликемии натощак превышает желаемый уровень [89]. Как только удается приблизиться к целевому значению уровня гликемии, увеличивать дозировку необходимо реже и умереннее. Возврат к предыдущей дозе может рекомендоваться при проявлении гипогликемии. Во время самостоятельного подбора дозы инсулина важное значение имеют регулярные консультации с врачом посредством телефонной связи или электронной почты. Врач непосредственно может руководить процессом подбора дозы базального инсулина, однако это потребует более тесного контакта с пациентом, что не всегда возможно в условиях профессиональной загруженности. Во время подбора дозы инсулина важное значение имеет ежедневный мониторинг уровня гликемии. По достижению эффективной дозы инсулина частота контроля уровня гликемии может быть пересмотрена [90]. Особое внимание необходимо уделить возможности добавить введение инсулина к приему пищи, когда после еды наблюдаются колебания уровня глюкозы (например, > 10 ммоль/л (>180 мг/дл)). Это также целесообразно в случаях, когда достигнуто целевое значение уровня гликемии натощак, однако показатель HbA1с остается высоким даже после 3–6 месяцев подбора дозы базального инсулина [91]. То же касается и значительных падений показателя гликемии в ночное время, а также между приемами пищи, что связано с увеличением дозы базального инсулина. Если принято решение о дополнительном введении болюсного инсулина, доза базального инсулина должна быть снижена. Хотя в основном доза базального инсулина подбирается в зависимости от уровня гликемии натощак, независимо от общей дозы, врачу необходимо знать о том, что необходимость в болюсном инсулине может быть тем больше, чем выше его суточная доза превышает 0,5 Ед/кг массы тела в сутки, особенно если доза достигает 1 Ед/кг массы тела в сутки. Целью терапии болюсным инсулином является контроль уровня гликемии после приема пищи, поскольку у определенных пациентов постпрандиальные колебания глюкозы могут быть весьма значительны, что ведет к неэффективному контролю гликемии в течение всего дня. Контроль в подобных случаях может быть достигнут с помощью двух методик.
Наиболее эффективным контролем уровня гликемии, связанного с приемом пищи, является схема базально-болюсной инсулинотерапии, которая заключается в инъекции инсулина короткого действия перед едой на фоне уже действующего базального инсулина. Одним из квалифицированных подходов считается введение болюсного инсулина перед тем приемом пищи, с которым могут быть связаны самые высокие колебания уровня гликемии (меню представлено пищей, богатой углеводами), — довольно часто, хотя и не всегда, это может быть вечерний прием пищи [92]. Следующее введение инсулина, соответственно, может быть обозначено другим приемом пищи, с которым также могут быть связаны высокие колебания уровня гликемии (чаще это бывает завтрак). И, наконец, третье введение инсулина рекомендуется перед незначительным приемом пищи (ланч) [93]. У большинства пациентов эффект данных режимов инсулинотерапии на фоне базального инсулина, как правило, умеренный [92]. Еще раз напомним, что индивидуальный подход к пациенту является ключевым звеном лечения больных сахарным диабетом, который учитывает как уровень гипергликемии, нуждающийся в контроле, так и особенности и возможности самого пациента. Важным является и тот факт, что для оптимизации контроля уровня гликемии с помощью данных режимов, а также подбора эффективных доз инсулина многое зависит от мониторинга показателей гликемии самим пациентом. Второй, возможно более удобной, однако менее применимой является схема, основанная на введении комбинированного инсулина, состоящего из фиксированной комбинации инсулина средней продолжительности действия с человеческим инсулином или аналогом инсулина короткого действия. Обычно по такой схеме инсулин вводится 2 раза в день: перед утренним и вечерним приемами пищи. В общем, сравнивая монотерапию базальным инсулином с комбинированными режимами инсулинотерапии, нужно отметить, что с помощью комбинированных режимов можно добиться снижения показателя HbA1с до более низких цифр, однако имеются больший риск развития гипогликемических состояний и вероятность увеличения массы тела [94]. Недостатком данного режима является отсутствие возможности подбирать дозы отдельно для инсулина короткого и длительного действия. Таким образом, данная схема несколько ограничена в применении, однако может быть достаточно эффективной у определенных пациентов, которые, например, в силу регулярного приема пищи нуждаются в более удобном и простом режиме инсулинотерапии, исключающем применение базального инсулина [92, 93]. (Более старым и менее употребляемым вариантом данного режима, основанного на введении двух инсулинов разной продолжительности действия, является раздельно-комбинированный режим, заключающийся в комбинации фиксированной дозы инсулина средней продолжительности действия и разных доз человеческого инсулина или аналога инсулина короткого действия. Благодаря этому создается более широкий диапазон для подбора дозы инсулина.) Анализ нескольких десятков сравнительных исследований эффективности инсулинотерапии у пациентов с сахарным диабетом 2-го типа дал следующие результаты:
1. Инсулин любой длительности действия снижает уровень глюкозы и HbA1с.
2. Применение инсулина любой длительности действия связано с увеличением массы тела и риском развития гипогликемических состояний.
3. Чем больше доза инсулина и чем более интенсивно ведется ее подбор, тем быстрее достигается целевой уровень HbA1с, однако увеличивается риск развития нежелательных явлений.
4. В целом по сравнению с человеческими инсулинами (НПХ, инсулины короткого действия) аналоги инсулина длительного действия уменьшают частоту развития гипогликемических состояний ночью, а аналоги инсулина короткого действия уменьшают колебания уровня гликемии после приема пищи, однако практически не влияют на снижение показателя HbA1с.
Применение метформина после добавления в схему лечения базального инсулина, как правило, продолжают. В исследованиях было продемонстрировано, что совместное применение базального инсулина и метформина способствует снижению массы тела [95]. Добавление в схему инсулинотерапии стимуляторов секреции инсулина не способствует снижению HbA1с, предотвращению развития гипогликемических состояний, а также снижению массы тела, особенно если доза инсулина уже подобрана. Добавление стимуляторов секреции инсулина к терапии базальным инсулином изначально может способствовать более эффективному контролю уровня гликемии. Однако в случае терапии, включающей болюсный инсулин, применения стимуляторов секреции инсулина следует избегать. С целью предотвращения развития отеков и увеличения массы тела доза тиазолидиндионов должна быть снижена (вплоть до их отмены). Однако у некоторых пациентов, которые нуждаются в больших дозах инсулина вследствие прогрессирующей инсулинорезистентности тканей, тиазолидиндионы, усиливающие чувствительность рецепторов клеток к инсулину, могут оказаться весьма эффективными в плане снижения уровня HbA1с и дозы инсулина [96]. Ведутся исследования эффективности применения инкретинов в комбинации с базальным инсулином; комбинация базального инсулина с агонистами рецептора GLP-1 может быть весьма эффективной у определенных пациентов [97,98]. Хотим напомнить, что следует учитывать возможную стоимость данных режимов лечения.
Другие варианты
Возраст
У пациентов пожилого возраста (> 65–70 лет) чаще наблюдаются интенсивные атеросклеротические изменения, гипофункция почек, а также сопутствующие заболевания [99, 100]. У большинства таких пациентов повышен риск развития нежелательных явлений, связанных с количеством принимаемых лекарственных препаратов; необходимо учитывать их социальный и экономический статусы, от которых в значительной степени может зависеть тактика лечения. Также у пациентов пожилого возраста меньше ожидаемая продолжительность жизни, особенно в случаях проявления разнообразных осложнений, развивавшихся в течение длительного времени, выше риск развития гипогликемических состояний, что может стать причиной внезапных падений и переломов [101], а осложнения со стороны сердечно-сосудистой системы могут стать причиной серьезных последствий. Из всего вышесказанного можно сделать вывод, что целевые значения уровня гликемии для пациентов пожилого возраста должны быть менее амбициозными в сравнении с таковыми для более молодых и здоровых пациентов [20]. В случаях если более низкие целевые значения не могут быть достигнуты с помощью более простых схем лечения, приемлемым может считаться значение HbA1с < 7,5–8,0 %, с повышением цифр параллельно увеличению возраста и снижению способностей пациента обеспечивать свою жизнедеятельность, ухудшению когнитивного, психологического и экономического статусов пациента, снижению функциональных резервов жизненно важных систем организма. В то время как изменение образа жизни может с успехом применяться во всех возрастных группах, у пациентов пожилого возраста необходимо тщательно подбирать схему лечения, исходя из безопасности препарата, особенно это касается возможности уменьшения риска развития гипогликемических состояний, сердечной недостаточности, нарушения функции почек, переломов костей, а также межлекарственных взаимодействий. Предпочтение рекомендуется отдавать той тактике лечения, которая предусматривает минимизацию риска развития гипогликемии. Напротив, у более здоровых пациентов, у которых ожидаемая продолжительность жизни больше, увеличивается риск развития поздних осложнений с течением времени. С целью предотвращения или замедления развития данных осложнений необходимо установить более низкие целевые значения уровня гликемии (например, HbA1с < 6,5–7,0 %) и более жесткий контроль над массой тела, артериальным давлением и липидами крови. Обычно такой подход предусматривает комбинированный режим терапии, раннее начало которого предоставляет наибольшие шансы модифицировать течение заболевания и сохранить качество жизни пациента.
Масса тела
Большинство пациентов, страдающих сахарным диабетом 2-го типа, имеют избыточный вес (~ 80 %) [102]. У пациентов с избыточной массой тела изменением образа жизни можно добиться улучшения физического состояния, контроля гликемии, уменьшения риска развития сердечно-сосудистых осложнений, однако добиться заметного снижения массы тела очень сложно [103]. Хотя считается, что у пациентов с ожирением основной причиной сахарного диабета является резистентность тканей к инсулину, у них в такой же мере наблюдается нарушение функции инсулоцитов, характерной для пациентов с нормальной массой тела [37]. Возможно, в результате этого у пациентов с избыточной массой тела чаще применяются комбинированные режимы терапии [20, 104]. Тогда как в клинической практике для лечения пациентов с избыточной массой тела преимущество отдается метформину, поскольку он способствует снижению массы тела или, по крайней мере, не оказывает на нее влияния, метформин также эффективен и у пациентов с нормальной массой тела [75]. Тиазолидиндионы, с другой стороны, считаются более эффективными у пациентов с более высоким индексом массы тела, хотя тот парадоксальный факт, что тиазолидиндионы способствуют увеличению массы тела, является причиной отказа от данной группы препаратов у пациентов с ожирением. Агонисты рецептора GLP-1 способствуют снижению массы тела [38], что может быть крайне важным для определенных групп пациентов. Бариатрическая хирургия становится все более популярной среди пацентов с избыточной массой тела. После подобных вмешательств наблюдается быстрое исчезновение признаков сахарного диабета 2-го типа. У большинства пациентов появляется возможность отменить некоторые гипогликемические препараты, или даже все, однако на какое время — пока неизвестно [105]. У пациентов с нормальной массой тела особое внимание необходимо уделять возможности наличия так называемого латентного аутоиммунного сахарного диабета взрослых, медленно прогрессирующей формы сахарного диабета 1-го типа. Пациенты с латентным аутоиммунным сахарным диабетом, у которых изначально наблюдаются умеренные проявления гипергликемии, в большинстве случаев отвечают на лечение пероральными гипогликемическими препаратами, однако в конце концов у них наблюдается развитие более серьезных гипергликемических состояний, которые требуют интенсивной инсулинотерапии [106]. Определение титров антител к островкам поджелудочной железы (anti-GAD), а также их идентификация позволяют быстрее определиться с необходимостью перехода на инсулинотерапию.
Половые, расовые, этнические, генетические различия
Поскольку определенные расовые/этнические особенности, предрасполагающие к развитию сахарного диабета, хорошо изучены (у латиноамериканцев преимущественно наблюдается инсулинорезистентность [107], у восточных азиатов — дисфункция b-клеток поджелудочной железы [108]), это позволяет определиться с рациональной тактикой лечения уже на начальных стадиях заболевания. Полигенная предрасположенность к заболеванию сегодня не вызывает сомнения. На самом деле, сопоставляя механизм действия лекарственного препарата с причинами, лежащими в основе гипергликемии у определенного пациента, получаем логичную схему лечения. Однако существуют данные, исходя из которых можно сравнить различные стратегии лечения, основанные на данном подходе [109]. Существует несколько исключений, представленных моногенными вариантами сахарного диабета, которые нередко маскируют сахарный диабет 2-го типа, например, диабет зрелого возраста у молодых (моногенная форма сахарного диабета, которая характеризуется аутосомно-доминантным наследованием, проявляется до 25-летнего возраста и нарушает глюкозостимулируемую секрецию инсулина), некоторые формы его преимущественно отвечают на лечение препаратами сульфонилмочевины [110]. В то время как ответ на лечение разными антигипергликемическими препаратами от половой принадлежности пациента практически не зависит, некоторые побочные явления (например, остеопороз, связанный с приемом тиазолидиндионов) у женщин требуют особого внимания.
Сопутствующая патология
Ишемическая болезнь сердца (ИБС)
Принимая во внимание частоту развития атеросклероза у пациентов с сахарным диабетом 2-го типа, очень важным моментом является определение стратегии ведения пациентов с диагностированной ИБС и пациентов с высоким риском ее развития. Поскольку гипогликемические состояния могут усиливать ишемию миокарда, а также являются причиной аритмий [111], рекомендуется по возможности избегать назначения лекарственных препаратов, способствующих развитию гипогликемии. Если все же целевые значения требуют применения таковых препаратов, необходимо обучить пациента относительно того, как минимизировать риск вышеуказанных осложнений. Накоплена информация относительного того, что в силу действия на калиевые каналы тканей сердца и модификации ишемического прекондиционирования [112] некоторые препараты сульфонилмочевины усугубляют ишемию миокарда, однако фактическая связь между действием препаратов сульфонилмочевины и ишемией миокарда остается недоказанной.
Метформин, оказывая положительный эф- фект на сердечно-сосудистую систему, является весьма полезным в случае ИБС, за исключением некоторых противопоказаний [32].
В ходе одного исследования было установлено, что применение пиоглитазона способствует умеренному снижению риска развития серьезных сердечно-сосудистых осложнений у пациентов с проявлениями макроангиопатии. Применение пиоглитазона ограничивается наличием признаков сердечной недостаточности [60]. Анализируя весьма ограниченные данные, можно заключить, что применение агонистов рецептора GLP-1 и ингибиторов ДПП-4 способствует снижению риска развития сердечно-сосудистых осложнений, однако данных, подтверждавших бы долгосрочность подобной перспективы, нет [113]. Также очень мало данных, свидетельствующих в пользу снижения риска сердечно-сосудистых осложнений на фоне лечения ингибиторами b-глюкозидазы [114] и бромокриптином [115].
Сердечная недостаточность
По мере постепенного старения населения планеты и снижения уровня смертности от инфаркта миокарда прогрессирующая сердечная недостаточность наблюдается все чаще [116]. В данной популяции пациентов отмечаются определенные сложности, связанные с выбором тактики комбинированных режимов лечения, частыми госпитализациями, а также противопоказаниями к применению определенных препаратов. У пациентов с прогрессирующей сердечной недостаточностью рекомендовано исключить тиазолидиндионы [117, 118]. Метформин, ранее противопоказанный пациентам с сердечной недостаточностью, сегодня можно применять при условии отсутствия грубых нарушений функции желудочков, стабильных показателях, характеризующих состояние сердечно-сосудистой системы, а также при условии сохраненной функции почек [119]. Как уже оговаривалось ранее, сегодня активно исследуется влияние инкретинов на состояние сердечно-сосудистой системы, в частности, на функцию желудочков [120].
Хроническая болезнь почек (ХБП) (хроническая почечная недостаточность)
Сахарный диабет 2-го типа часто сопровождается почечной недостаточностью; умерен-ные и тяжелые нарушения функции почек (расчетная скорость клубочковой фильтрации (рСКФ) < 60 мл/мин) возникают приблизительно у 20–30 % пациентов [121, 122]. У пациентов с прогрессирующей почечной недостаточностью повышен риск развития гипогликемических состояний, в основе которых лежит целое разнообразие факторов. Инсулин и, в определенной степени, гормоны инкретиновой системы выводятся медленнее. Таким образом, может возникнуть необходимость в снижении дозы, пересмотре противопоказаний и повторной оценке возможных осложнений терапии (гипогликемические состояния, задержка жидкости). Современные рекомендации США предостерегают относительно применения метформина у пациентов с уровнем сывороточного креатинина ≥ 133 ммоль/л (≥ 1,5 мг/дл) у мужчин и 124 ммоль/л (≥ 1,4 мг/дл) у женщин. Метформин выводится с мочой; имеются данные о случаях развития лактат-ацидоза у пациентов с почечной недостаточностью [123]. Однако относительно того, насколько эти цифры могут быть применимы у каждого пациента и получит ли пациент с умеренным поражением функции почек больше пользы, чем вреда от применения метформина, споры продолжаются [124, 125]. Рекомендации Национального института охраны здоровья и совершенствования медицинской помощи (National Institute for Health and Clinical Excellence (NICE), Великобритания) менее строгие и больше опираются на данные клинических исследований в сравнении с рекомендациями США. Согласно британским рекомендациям, применение метформина разрешено вплоть до уровня рСКФ 30 мл/мин, а снижение дозы рекомендуется при значении рСКФ 45 мл/мин [14]. Данные рекомендации являются достаточно целесообразными, учитывая современную распространенность определения рСКФ. Поскольку большинство стимуляторов секреции инсулина выводятся с мочой (исключением являются репаглинид и натеглинид), у пациентов с ХБП риск развития гипогликемических состояний выше. Большинство препаратов данной группы противопоказаны пациентам с серьезными нарушениями почечной функции. Применения глибурида (в Европе известного как глибенкламид), активные метаболиты которого обладают пролонгированным механизмом действия, у пациентов данной группы необходимо избегать. Пиоглитазон не выводится с мочой и поэтому не противопоказан пациентам с ХБП. Однако необходимо помнить о возможной задержке жидкости. Ингибиторы ДПП-4 ситаглиптин, вилдаглиптин и саксаглиптин в большинстве своем выводятся почками в одинаковом объеме. У пациентов с прогрессирующей ХБП требуется снижение дозы препаратов. Единственным исключением является линаглиптин, который преимущественно выводится через ЖКТ. Что касается агонистов рецептора GLP-1, эксенатид противопоказан при ХПН 4–5-й стадии (СКФ < 30 мл/мин), поскольку выводится почками. Безопасность применения лираглутида у пациентов с ХБП пока не доказана, хотя фармакокинетические исследования демонстрируют, что нарушение функции почек не влияет на уровень препарата, поскольку почки не принимают участия в его выведении. Более сильная степень поражения функции почек связана с замедлением скорости выведения всех инсулинов. Таким образом, необходимо тщательно подбирать дозу инсулина, особенно пролонгированного механизма действия.
Нарушения функции печени
У пациентов с сахарным диабетом 2-го типа часто наблюдаются гепатостеатоз, а также другие поражения печени [126]. Согласно некоторым данным, у пациентов с ожирением печени эффективным считается применение пиоглитазона [45, 127, 128]. У пациентов с активными заболеваниям печени и показателями аланинаминотрансферазы, в 2,5 раза превышающими верхнюю границу нормы, применения пиоглитазона необходимо избегать. Напротив, у пациентов со стеатозом печени, однако с умеренными отклонениями показателей печеночных тестов, может быть весьма эффективным. Применение препаратов сульфонилмочевины может сопровождаться незначительным повышением показателей печеночных тестов, однако это не является противопоказанием к их применению. Также у пациентов с заболеваниями печени могут применяться меглитиниды, если заболевание печени имеет тяжелое течение — стимуляторы секреции инсулина, поскольку увеличивается риск развития гипогликемических состояний. Пациентам с заболеваниями печени средней тяжести течения можно назначать препараты инкретинов, при условии, что отсутствуют признаки панкреатита. Заболевания печени не являются противопоказанием к применению инсулина, и он остается препаратом выбора даже в случаях прогрессирующего поражения печени.
Гипогликемия
Гипогликемии у пациентов с сахарным диабетом 2-го типа долгое время придавалось очень мало значения, поскольку она возникает менее часто, чем при сахарном диабете 1-го типа. Однако очень важное заключение было сделано на основе результатов недавно проведенных клинических исследований, в том числе межгрупповых: у пациентов с повторными эпизодами гипогликемии повышен риск поражения функции головного мозга. Согласно результатам исследования ACCORD, частота гипогликемий как с незначительными, так и со значительными отклонениями уровня гликемии от допустимой границы оказалась высокой у пациентов, получавших интенсивную гипогликемическую терапию, — в 3 раза выше в сравнении с пациентами, получавшими стандартную схему лечения [129]. Были ли случаи гипогликемии причиной повышенной смертности в группе, получавшей интенсивную гипогликемическую терапию, остается неясным [130, 131]. Один факт, однако, остается несомненным: гипогликемические состояния более опасны у пациентов пожилого возраста и возникают тем чаще, чем ближе целевое значение уровня гликемии. Гипогликемические состояния могут приводить к развитию аритмий, падениям и травмам (которые также несут больше угрозы пациентам старшего возраста) [132], головокружению (что также является причиной падений), нарушениям сознания (может привести к неправильной трактовке состояния и назначению неадекватной терапии), развитию инфекций (аспирация во время сна, которая в дальнейшем ведет к развитию пневмонии). Статистика причин смерти, в которой фигурирует гипогликемия, может быть неточной. Другими серьезными последствиями частых гипогликемических состояний считаются нарушение работоспособности пациента и его зависимость от членов семьи или опекуна. Таким образом, у пациентов с повышенным риском развития гипогликемических состояний подбираются препараты с учетом возможного предотвращения развития вышеуказанных осложнений, а приемлемыми могут считаться умеренные целевые уровни гликемии.
Рекомендации на будущее/необходимость проведения исследований
Данных сравнительных исследований относительно ведения пациентов с сахарным диабетом 2-го типа, за исключением монотерапии метформином, на сегодня недостаточно [70]. Назрела крайняя необходимость в проведении качественных исследований сравнительной эффективности лекарственных препаратов, но в отношении не только контроля уровня гликемии, но и стоимости лечения, а также возможных его исходов, важных для большинства пациентов, — качества жизни и профилактики осложнений, отягощающих состояние пациента и ограничивающих продолжительность жизни. Особенно это касается осложнений со стороны сердечно-сосудистой системы [19, 23, 70]. Другой важный вопрос, который требует получения дополнительной информации, — длительность эффективного действия (часто его описывают как сохранение b-клеток поджелудочной железы), которое позволит стабилизировать контроль над процессами метаболизма и уменьшить лекарственную нагрузку на организм пациента в будущем. В будущем фармакогенетика сможет достаточно быстро помочь врачу определиться с тактикой лечения, исходя из прогностических показателей для конкретного пациента и его склонности к развитию определенных нежелательных явлений. Сегодня клиницисты нуждаются в дополнительной информации относительно того, как правильно подобрать адекватную схему терапии в зависимости от особенностей течения заболевания, а также самого пациента. По мере выведения на рынок препаратов для лечения сахарного диабета 2-го типа необходимо и проведение исследований (полноценных как по длительности, так и по масштабу) их эффективности и безопасности по сравнению с наилучшими препаратами, уже успевшими зарекомендовать себя. Совершенно ясно, что подобные прямые сравнительные исследования всевозможных комбинаций препаратов потребуют массу времени, сил и ресурсов [133]. Поэтому очень важно в таких проектах получить экспертные заключения и консультации опытных клиницистов.
Благодарности
Данные рекомендации были разработаны по общей просьбе исполнительных комитетов Американской ассоциации диабетологов и Европейской ассоциации по изучению сахарного диабета, которыми и была утверждена их заключительная версия. В процессе написания было изучено большое количество литературных материалов, группа авторов провела три личных встречи, несколько телеконференций. Процесс написания находился под контролем авторов посредством переписки по электронной почте. Мы выражаем огромную благодарность за рецензию предварительной версии настоящих рекомендаций следующим специалистам: James Best, Melbourne Medical School, The University of Melbourne, Melbourne, Australia; Henk Bilo, Isala Clinics, Zwolle, the Netherlands; John Boltri, Wayne State University School of Medicine, Detroit, MI; Thomas Buchanan, Keck School of Medicine, University of Southern California, Los Angeles, CA; Paul Callaway, University of Kansas School of Medicine-Wichita, Wichita, KS; Bernard Charbonnel, University of Nantes, Nantes, France; Stephen Colagiuri, The University of Sydney, Sydney, Australia; Samuel Dagogo-Jack, The University of Tennessee Health Science Center, Memphis, TN; Margo Farber, Detroit Medical Center, Detroit, MI; Cynthia Fritschi, College of Nursing, University of Illinois at Chicago, Chicago, IL; Rowan Hillson, The Hillingdon Hospital, Uxbridge, U.K.; Faramarz Ismail-Beigi, Case Western Reserve University School of Medicine/Cleveland VA Medical Center, Cleveland, OH; Devan Kansagara, Oregon Health & Science University/Portland VA Medical Center, Portland, OR; Ilias Migdalis, NIMTS Hospital, Athens, Greece; Donna Miller, Keck School of Medicine, University of Southern California, Los Angeles, CA; Robert Ratner, MedStar Health Research Institute/Georgetown University School of Medicine, Washington, DC; Julio Rosenstock, Dallas Diabetes and Endocrine Center at Medical City, Dallas, TX; Guntram Schernthaner, Rudolfstiftung Hospital, Vienna, Austria; Robert Sherwin, Yale University School of Medicine, New Haven, CT; Jay Skyler, Miller School of Medicine, University of Miami, Miami, FL; Geralyn Spollett, Yale University School of Nursing, New Haven, CT; Ellie Strock, International Diabetes Center, Minneapolis, MN; Agathocles Tsatsoulis, University of Ioannina, Ioannina, Greece; Andrew Wolf, University of Virginia School of Medicine, Charlottesville, VA; Bernard Zinman, Mount Sinai Hospital/University of Toronto, Toronto, ON, Canada, Американской ассоциации экспертов по обучению пациентов с сахарным диабетом, Американскому колледжу терапевтов, Ассоциации эндокринологов, а также некоторым другим организациям, внесшим определенный вклад в заключительную версию рекомендаций, однако пожелавшим остаться не названными. Заключительная версия также была тщательно пересмотрена и одобрена Комитетом специалистов Американской ассоциации диабетологов, Группой по контролю за рекомендациями и заключениями диабетической ассоциации по изучению сахарного диабета. Выражаем огромную благодарность Dr. Sue Kirkman из Американской диабетической ассоциации за помощь в разработке настоящих рекомендаций. Хотим поблагодарить Carol Hill и Mary Merkin за административную поддержку.
Источники
Три встречи группы авторов были организованы при поддержке Американской диабетической ассоциации и Европейской ассоциации по изучению сахарного диабета. Авторы выражают отдельную благодарность за поддержку D.R. Matthews из Национального института исследований в сфере здравоохранения.
Список литературы находится в редакции