Газета «Новости медицины и фармации» 12 (422) 2012
Вернуться к номеру
Экономическая целесообразность и оптимальные варианты планирования, программа и контроль при проведении
Авторы: В.Д. Неробеев - к.м.н., эксперт-консультант НВП «Амид», г. Одесса; Д.В. Неробеев - врач-хирург
Версия для печати
При экспериментальных исследованиях и клинических наблюдениях, а также при изучении медико-лабораторных данных важно, чтобы исследование было правильно организовано в методическом отношении, при высоком уровне доказательной базы. Значимым аргументом является четкое обоснование экономической целесообразности и финансовых затрат, необходимое количество клинических наблюдений в конкретной ситуации, формирование контрольной группы и варианты контроля. Эти вопросы, к сожалению, недостаточно освещены в руководствах по медицинской статистике.
Законы математической теории создают основу научного предвидения и прогнозирования, дают возможность определять с высокой точностью, без излишней затраты энергии, времени и дорогостоящих материалов исходные этапы практических экспериментов. Это позволяет планировать и программировать эксперимент, выбирать оптимальные, наиболее экономичные решения. Основные усилия при этом направлены на изыскание способов повышения эффективности и надежности эксперимента, который стал объектом исследования. Успешно развивается математическая теория эксперимента, использующая методы теории вероятности и математической статистики, которые раньше применялись на последнем этапе — при статистической обработке результатов исследования.
Математическая теория эксперимента (исследования)
В настоящее время методы метаанализа применяются на всех этапах — при формализации априорных сведений, перед постановкой опыта, при планировании и программировании эксперимента, обработке его результатов и принятии решений как на промежуточных этапах, так и в завершающей стадии всей работы.
Математическая теория эксперимента имеет особую значимость в методологии научных исследований. В сложных исследованиях приходится, как правило, иметь дело с ситуациями, которые требуют специальных, тщательно продуманных приемов постановки эксперимента. Иначе результаты окажутся искаженными. В процессе изучения необходимо освоить приемы планирования эксперимента и рассмотрения его результатов, приобрести навыки критического анализа на объективной математической основе, в том числе анализа и синтеза научной информации по разделу патентного поиска, литературы по профилю исследования и необходимого объема данных по линии Интернета.
Широкое внедрение в медико-биологические исследования математических методов связано, в частности, с проблемой надежности. Надежность работы сложных механизмов, приборов и систем, а также надеж-ность и достоверность получаемой научной информации, воспроизводимость экспериментов, изучаемых явлений — все это является основными качествами современных научных исследований. Проблема надежности связана, в частности, с повторяемостью (воспроизводимостью) тех или иных биологических явлений или эффектов. Этим критерием и определяется эффективность новых лечебных препаратов, методов диагностики, лечения и другие важные вопросы, имеющие принципиальное значение в научных исследованиях.
В медицине и биологии заслуживает также серьезного внимания использование статистической теории прогноза и теории регулирования. Результаты исследований, надежность и достоверность которых сомнительна или по крайней мере не доказана с помощью соответствующих объективных общепринятых математических методов, не только не отвечают современным требованиям метаанализа, предъявляемым к научным исследованиям, но и нередко приводят к заблуждениям и недоразумениям, тормозят дальнейшее развитие исследований. Существуют вполне доступные объективные математические методы, позволяющие заранее сделать соответствующие расчеты, которые сведут к миниму элементы ошибок и максимально повысят достоверность и надежность получаемых данных. Ценность теории эксперимента заключается в том, что позволяет перевести интуитивные поиски в плоскость определенных формул, правил и идти к цели по математически обоснованному научному плану. При этом каждый получает и использует методологические приемы проведения исследования, основанные не только на опыте, интуиции и эрудиции, но и на применении специальных, главным образом математических, методов, позволяющих проводить исследования на высоком научном уровне. Успешное освоение основ математической теории эксперимента дает возможность самостоятельно применять методы планирования и программирования эксперимента. Однако в этом деле необходимо проявлять определенную осторожность. Имеющийся опыт показывает, что успешное применение математических методов в медицине и биологии требует не столько знания математики, сколько глубоких знаний самого предмета исследования.
План и программа
Планирование эксперимента включает постановку опытов по заранее составленной схеме, обладающей какими-то оптимальными свойствами. Разработка таких схем представляет собой сложную математическую задачу, как правило, с несколькими неизвестными, нередко переменными факторами. Процесс обычно делят на несколько последовательных этапов. После выполнения каждого этапа исследователь получает информацию, позволяющую изменять стратегию дальнейшей работы. Поэтому становится возможным говорить о математических методах оптимального управления экспериментом.
Планирование эксперимента позволяет построить стратегию исследования, основанную на последовательности четких, логически осмысленных и математически обоснованных операций. На основании специальных математических расчетов обеспечивается выбор оптимально правильного решения задач различного характера. Программирование научных исследований (совокупности операций, задач) осуществляется путем разработки алгоритмов (схем, расчетов или правил, обеспечивающих нахождение решения) и правил, обеспечивающих поиск правильного решения. Чем сложнее и дороже организуемое исследование, тем менее допустимы в нем волевые решения, тем большее значение приобретают объективные научные методы, позволяющие заранее оценить последствия каждого решения, исключить недопустимые варианты и рекомендовать наиболее эффективные. Классическая опора на опыт и здравый смысл в ряде случаев просто неосуществима, например, в исследованиях, подобные которым ранее не проводились. В этих случаях программирование может в известной мере заменить недостающий опыт.
Весьма ответственным является первый этап планирования исследования, когда надо отобрать самые важные факторы из большого числа потенциально возможных. Можно сделать эксперимент экономичнее в смысле затрат материала, труда и времени. Для проведения отсеивающего эксперимента достаточно нескольких десятков опытов. После того как отсеяли малозначащие факторы и выделили важнейшие, необходимо пользоваться методом варьирования всех переменных сразу, выбирая при этом некоторую оптимальную стратегию. В этих случаях весьма высокий эффект могут дать методы многофакторного варьирования, дисперсионного анализа.
При планировании экспериментов используют большие возможности методов дисперсионного анализа для выявления корреляционных взаимосвязей. Одной из эффективных форм дисперсионного анализа является многофакторный метод, позволяющий оценивать взаимодействия между факторами. Весьма важно, что оценка дисперсии получается не только по данным параллельных измерений, но и по данным всего эксперимента в целом. Воспроизводимость рассматривается по дисперсиям для всех варьируемых факторов на разных уровнях. Более полную информацию о каждом факторе можно получить при меньшем числе опытов.
Планирование эксперимента может применяться и тогда, когда механизм исследуемого процесса достаточно хорошо изучен, но возникла необходимость уточнить ряд участвующих в нем факторов. Тогда эксперимент можно планировать так, чтобы эти константы были оценены с минимально возможной ошибкой. В медицине и биологии при планировании исследований применяется метод номографии, являющейся областью математики, изучающей теорию и способы построения номограмм — геометрического изображения функциональных зависимостей, с помощью которых можно, не производя вычислений, получить решение заранее поставленных задач.
Программа эксперимента (исследования) в общем значении этого термина включает перечень вопросов, на которые в процессе исследования должны быть получены ответы, или совокупность конкретных факторов и признаков, подлежащих изучению. Методы программирования основаны на математической теории эксперимента, на использовании теории вероятности и математической статистики.
В современном представлении эксперимент — это наблюдение исследуемого явления в точно учитываемых условиях, позволяющих следить за ходом явления. Эксперименты проводят на моделях и системах (живых и неживых), животных и людях. Отличительной особенностью эксперимента на людях является строгое соблюдение таких условий, при которых его проведение исключает возможность нанесения вреда здоровью человека.
В процессе программирования необходимо четко сформулировать цели и задачи исследования и определить совокупность конкретных факторов и признаков, включая установление четких границ этих признаков, подлежащих изучению. При бессистемном изучении исследуемых признаков и факторов увеличивается объем работы, удлиняются сроки разработки. Некоторые данные не используются, отдельные признаки изучаемого явления оказываются упущенными. Программирование позволяет решать многие вопросы: как сделать большую серию опытов, когда на нее не хватает однородного материала, какое оптимальное решение можно при этом выбрать, как проводить опыты в условиях, когда многие мешающие факторы не могут быть учтены или строго стабилизированы и др.
Выборочный метод
Определение размера выборки.Исследование проблемы заключается в том, чтобы на основании данных, полученных для ограниченного массива наблюдений, сделать вывод относительно более широкого круга наблюдений. Всю совокупность наблюдений принято называть генеральной (общей, исчерпывающей), а отобранная часть — это выборочная (проба, образец). Полученная выборка называется репрезентативной (представительной), если она в полной мере характеризует свойства генеральной совокупности. Каждая выборка в той или иной мере отличается от генеральной совокупности. Числовые различия поддаются измерению при помощи методов математической статистики. Вопрос состоит в нахождении степени надежности и достоверности полученных результатов. Возможна ситуация, когда цель и задачи эксперимента определены, данные собраны, а выводы сделаны без учета того, каким образом были собраны эти данные. При этом перед исследователем неизбежно возникает вопрос: сколько наблюдений нужно сделать, то есть каков размер выборки? Наличие таких расчетов в некоторых работах еще не свидетельствует об их методических достоинствах, так как иногда авторы рассчитывают объем выборки формально и неправильно. Так, например, формула определения выборки была применена не для каждой отдельной группы, а для всего изучаемого контингента, что затем привело к грубым ошибкам при анализе результатов исследования.
При определении размера выборки необходимо учитывать по крайней мере три обязательных вопроса: 1. Какова величина смещения параметра, которую желательно обнаружить? 2. Какова величина изменчивости совокупности? 3. Какой размер риска желательно принять? Например, определив размер выборки, установили, что для исследования с заданным уровнем значимости следует провести 30 измерений (анализов). Но в этом случае может быть не менее 3 вариантов решений при одинаковом размере выборки: сделать по 1-му анализу у каждого из 30 человек (лабораторных животных), по 2-му — у 15 или по 3-му анализу — у 10 человек (лабораторных животных). Какой вариант (решение) будет лучшим? Методы программирования, математическая теория эксперимента дают ответы на такие вопросы, в частности, с учетом чувствительности и точности используемой методики, характеристики клинического материала, генотипа животных и др. Количество наблюдений в каждом конкретном случае зависит от условий исследования, от его целей и задач.
Один из самых распространенных недостатков научных исследований заключается в том, что исследователи не определяют объем выборки, то есть не планируют заранее необходимое количество измерений, анализов, проб, экспериментальных животных, обследуемых больных. В результате научная работа осуществляется вслепую, беспланово. В то же время определение объема выборки исследуемого материала дает большие преимущества, научное значение которых весьма существенное. Исследователь заранее задает уровень точности, заранее устанавливает критерий достоверности, то есть ставит медико-биологические исследования в рамки точных математических категорий и получает ответ с заранее заданной степенью достоверности.
Признаки, на которые опирается исследователь, отыскивая или подтверждая интересующие его закономерности, улавливаются с различной степенью трудности, так как они изменчивы в разной мере. Чем постояннее тот или иной признак присутствует в явлении, тем проще задача отражения его в числе и познание его посредством численного выражения. Для уяснения такого признака, при прочих равных условиях, требуется меньшее число наблюдений, чем при большей изменчивости. Для познания каждого такого явления важное значение имеет точность, с которой высказывается данное суждение. Чем больше эта точность при одинаковых прочих условиях, тем она убедительнее. Но для решения разных практических задач точность не обязательно должна быть одинаковой. В зависимости от сути исследования, а также условий, при которых оно проводится, в одних случаях она может быть меньшей, а в других большей.
Между точностью оценок суждения и степенью изменчивости исследуемых признаков существует определенное соотношение, которое выражается в том, что число необходимых наблюдений, точнее, корень квадратный из числа наблюдений, прямо пропорционально изменчивости признака и обратно пропорционально размеру ошибки, допускаемой при суждении. Каким образом можно определить необходимое количество исследований, при заданной степени точности, в порядке случайной выборки? В соответствии с упомянутой выше зависимостью числа наблюдений от степени изменчивости исследуемого признака и от степени уверенности, с которой исследователь стремится удостоверить конечный результат, необходимое число наблюдений можно определить по одной из следующих формул:
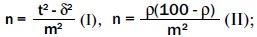
где n — искомое число наблюдений; d — среднее квадратическое отклонение, или мера изменчивости исследуемого признака, которая устанавливается на основании пробной разработки или на основе предыдущих аналогичных исследований; r — частота, с которой встречается или может встречаться исследуемый признак (при определении относительной величины); t — степень точности результата. При t = 1 ошибка не превышает заданной точности в 68 случаев из 100, при t = 2 — в 95 случаях из 100, при t = 3 — в 99 случаях из 100. Между t = 1 и t = 3 существуют, разумеется, все промежуточные значения. Начиная с t = 2 и выше, показатели считаются статистически достоверными. Первая формула позволяет определить необходимое число наблюдений в тех случаях, когда определяют средний размер какого-либо признака, вторая формула — когда конечным результатом исследования является относительная величина, выраженная в процентах. (Примечание: формулы для определения среднего квадратического отклонения d и средней ошибки средней величины m приводятся в руководствах по медицинской статистике.)
Например, исследователь планирует изучить содержание мужского полового гормона (тестостерон) в плазме крови у мужчин репродуктивного возраста 25–45 лет при вторичном гипогонадизме. В связи с этим поставлена задача: в порядке случайной выборки определить необходимое количество лиц, подлежащих обследованию, при заданной степени достоверности. Исходные данные: средняя ошибка средней величины m в 95 случаях из 100 не должна превышать 0,60 при t = 2. Среднее квадратическое отклонение d равняется 3,2. Проставив соответствующие значения в первую формулу, найдем n = 114. Следовательно, для проведения исследования и получения необходимого объема выборки в данных конкретных условиях потребуется обследовать 114 человек. Если конечным результатом исследования является относительная величина, выраженная в процентах, то для определения объема (количества единиц) случайной выборки применима вторая формула. Например, при хирургическом удалении гипофиза у крыс линии Вистар на долю неудачных результатов гипофизэктомии приходится 15 %. Следует выяснить, сколько подопытных животных (крыс) нужно для эксперимента, если средняя ошибка средней величины m составляет 4 %. Проставив соответствующие значения во вторую формулу, установим, что n = 80. Таким образом, для проведения эксперимента в данных конкретных условиях необходимо в качестве случайной выборки 80 лабораторных животных. Это свидетельствует о возможности при планировании того или иного исследования и постановке конкретной задачи точно определять необходимое число единиц наблюдения, нужное для обоснования достоверности выводов (средних и относительных величин).
Некоторые исследователи ошибочно считают, что для проведения, допустим, клинических наблюдений с ошибкой 10 % надо иметь в группе не менее 100 человек, а с ошибкой 3 % — 300 человек. Однако здесь можно легко допустить неточность, если подходить к программированию формально, без учета всей совокупности условий (программы) исследования, в частности вида изучаемого признака, его качественной и количественной характеристики, методики исследования, в том числе ее точности и чувствительности и др.
Нередко, особенно в клинических исследованиях, при изучении тех или иных признаков внутри исследуемых групп по мере разработки материала выявляются подгруппы с определенными новыми признаками, вариабельность которых высока и вследствие этого не удовлетворяет требованиям репрезентативности материала.
Другая из распространенных ошибок состоит в том, что при определении размера выборки не учитывают точность и чувствительность применяющихся в данном случае конкретных методик исследования. Иногда авторы не только не упоминают о точности и чувствительности применявшихся ими методик исследования, но и вообще не определяли этих показателей в своих исследованиях. Некоторые из них ограничились ссылками на данные литературы в отношении показателей точности и чувствительности методик. Поэтому при определении размера выборки в каждом конкретном случае важно учитывать точность методики исследования, однородность объектов, что обеспечивает правильную группировку материала.
Группировка изучаемых явлений и объектов
Одним из важных разделов программирования является группировка изучаемых явлений и объектов. Необходимо подчеркнуть, что понятие «группировка» имеет весьма широкое значение, включающее как количественные, так и качественные признаки изучаемых явлений. Однородность группируемого материала приобретает особую значимость в медико-биологических исследованиях. Задача подбора экспериментальных животных в значительной мере упрощается за счет наличия популяции чистых линий.
Значительные трудности могут возникнуть при правильном подборе больных. Основные требования однородности, сопоставимости в данном случае заключаются в подборе больных в опытных и контрольных группах по возрасту, полу, сопоставимым нозологическим единицам, формам, стадиям, давности заболевания и другим характеристическим особенностям.
Необходимо обеспечить жесткую стандартизацию изучаемого контингента лиц по всем показателям, как подлежащим непосредственному изучению, так и имеющим влияние на первое. К наиболее часто встречающимся при группировке исследуемого материала и его сопоставлении ошибкам относится объединение в исследуемые группы разнородного материала и его последующее сравнение. Например, некий автор в своих исследованиях при окончательном обобщении пытался объединить в одну группу больных хроническим простатитом с репродуктивной дисфункцией в возрасте от 22 до 50 лет без учета возрастных факторов и существующих возрастных изменений репродуктивной функции, с давностью заболевания от 6 месяцев до 10 лет, хотя в данном случае длительность заболевания является одним из определяющих факторов в развитии патологического процесса, возникновении различных осложнений болезни.
Возможны ошибки в группировке при оценке результатов лечения, когда пытаются сравнивать полученные показатели у лиц различного пола, возраста, без учета давности заболевания и других важных для оценки эффективности лечения клинических условий и прочих признаков.
Примером неправильной группировки может быть и так называемое двухступенчатое вычисление средней арифметической величины М. Например, некий автор при изучении уровня холестерина и бета-липопротеидов в крови сначала рассчитывал среднюю арифметическую величину М из троекратного анализа пробы у каждого животного, а затем полученные таким образом результаты измерений у нескольких животных оформлял в вариационный ряд и уже вторично вычислял среднюю арифметическую М. При этом величина средней арифметической М в общем итоге не изменялась, но величина средней ошибки m как бы искусственно уменьшалась, а следовательно, вероятность достоверности повышалась. Таким образом, в результате ошибочных расчетов возможны необоснованные выводы. Был нарушен принцип группировки, так как группировали не изучаемые показатели, а животных. Такие ошибки не редкость, в том числе и в медико-биологических исследованиях.
Имеют место и другие примеры неправильной группировки. Например, некий автор, изучая изменения формулы крови при железодефицитной анемии, правильно сгруппировал больных на первом этапе исследования по нозологическим формам и стадиям болезни, возрастным и половым признакам. Однако эти признаки при дальнейшей оценке гематологических показателей не были учтены и полученные данные были проанализированы недифференцированно. Ошибки, наблюдаемые при использовании средних величинам, относятся в значительном большинстве к тем средним, которые представляют измеряемое явление без детальной разбивки его на группы, качественно наиболее однородные.
Получение однородных совокупностей достигается путем применения метода группировок. Метод группировок является основой научного использования метода средних: средняя арифметическая величина М, среднее квадратическое отклонение, средняя ошибка средней арифметической m.
В лабораторных условиях при проведении тех или иных опытов для получения сравнимых данных все составные элементы являются достаточно однородными, причем исследователь при необходимости может изменить условия по ходу самого эксперимента. Средние величины, получаемые при изучении экспериментальных данных, определяются теми условиями, в которых проводятся опыты.
Иногда наблюдающиеся различия в величине проводимых средних по одному и тому же явлению (признаку) в медико-биологических исследованиях объясняются главным образом недостаточным вниманием к надлежащей группировке данных, вследствие чего сравнению подвергаются качественно неоднородные группы, что совершенно недопустимо.
Контрольные исследования
При проведении медико-биологических исследований, как правило, формируют так называемую контрольную группу. На первый взгляд может показаться, что она необходима из-за возможных случайных отклонений. Однако это не всегда так. Встречаются различные виды контроля. Необходимо выделить исследования с контрольной группой, формирование которой не связано со случайными отклонениями, а обусловлено возможным вмешательством постороннего фактора. Сказанное относится главным образом к тем экспериментальным исследованиям, в которых нельзя ввести в действие испытываемый фактор, не вводя одновременно с ним какой-либо еще.
Например, в одном из опытов исследователь изучал влияние надпочечников на возникновение экспериментальной гипотонии. При проведении эксперимента 30 подопытным крысам линии Вистар была сделана хирургическая операция по удалению надпочечников — адреналэктомия. Помимо этого была создана контрольная группа из 20 крыс, которые подверглись аналогичной операции по методу забрюшинного доступа к надпочечникам, но без удаления последних. Замысел создания контрольной группы в данном случае достаточно ясен: исследователь гарантирует себя от ошибки, которая может возникнуть из-за вмешательства посторонних факторов, связанных с самой операцией. Он должен быть уверен в том, что наблюдаемые изменения обусловлены именно удалением надпочечников, а не другими вмешательствами, неизбежными при хирургической операции по методу забрюшинного доступа.
Следует также остановиться на контрольной группе, создаваемой из-за опасения случайных отклонений. Цель образования такой группы может быть разной. При этом возникает вопрос: есть ли смысл выделять в качестве контроля определенную группу лабораторных животных или целесообразнее основывать выводы на сравнении показателей по одним и тем же животным? На этот вопрос можно ответить следующим образом. Создание контрольной группы в данном исследовании необходимо при наблюдении колеблющихся показателей или когда неизвестна норма. Например, исследователь провел определение содержания аскорбиновой кислоты в плазме крови у подопытных кроликов под влиянием воздействия гамма-лучей с фиксированной лучевой нагрузкой. Установлено, что без воздействия гамма-лучей количество аскорбиновой кислоты в крови у кроликов колеблется от 32 до 85 мкмоль/л. Без контрольной группы исследователь может принять эти данные за результат действия гамма-лучей, а в действительности это просто колебание показателей уровня аскорбиновой кислоты в крови у кроликов. Чтобы учесть это и избежать ошибки, выделена контрольная группа животных, с помощью которой определяли колебание уровня аскорбиновой кислоты в крови и среднее содержание без воздействия гамма-лучей. Учитывая данные контрольной группы, можно правильно определить влияние гамма-лучей на содержание аскорбиновой кислоты в крови у кроликов.
В некоторых случаях контроль необходим, когда при проведении эксперимента с самого начала приходится пользоваться такими измерениями, которые делают невозможным дальнейшее использование того или иного животного в опыте. Например, исследователь изучает показатели энцефалограммы головного мозга собак после однократной массивной кровопотери с исходом в стадию так называемой клинической смерти. Животные после однократной массивной кровопотери выбывают из опыта, даже если в дальнейшем они будут оживлены. Последующее использование их в опыте невозможно, так как это противоречило бы основной цели и задачам исследования. Контроль необходим здесь для наблюдения за показателями энцефалограммы головного мозга собак, не подвергшихся указанной выше операции, и для сопоставления полученных данных.
При проведении клинических наблюдений вопрос о контрольной группе также имеет принципиальное значение.
В частности, при изучении какого-либо фактора и его влияния на определенную группу лиц с тем или иным заболеванием необходима для сравнения другая группа людей, по возможности однородная с первой, за исключением того признака, который подлежит изучению. Под однородностью сравниваемых групп подразумевается такой сбор необходимого материала, чтобы он в качественном отношении подходил для сопоставления. Если же сравнивают две группы различного происхождения (одна называется при этом подопытной, другая — контрольной), то такая группировка является принципиально неверной. Например, исследователь решил применить новое лекарственное средство при лечении определенной группы больных (25 человек), другая группа (25 человек), по мнению исследователя, является контрольной. Кажущееся на первый взгляд сходство обеих групп в действительности фиктивно, так как при изучении данного заболевания исследователь, допустим, оставил без внимания следующие факторы, не зависящие от лечения и обусловленные индивидуальными особенностями (пол, возраст, условия быта, питание, профессия, наследственность и др.). Эти особенности могли обусловить более выраженный эффект нового лекарственного средства в подопытной группе по сравнению с контрольной, хотя в действительности полученный эффект зависел совершенно от других факторов. Существенное влияние на результаты исследования могут оказать и сами условия применения нового лекарственного средства, а именно: в какой стадии болезни оно было применено, в какой форме, дозировке (однократной, суточной, курсовой), последовательности приема и пр. Все это должно получить свое отражение при планировании предстоящего исследования.
Одной из наиболее распространенных ошибок является отсутствие или неправильное проведение контрольных исследований. Более часто это встречается в клинических исследованиях при разработке, апробации и внедрении новых лекарственных средств, методов диагностики, лечения, новой аппаратуры и инструментария. Иногда в клинических работах отсутствует один из важных компонентов или условий научного исследования — контроль. Поэтому не представляется возможным дать сравнительную оценку главных свойств такого исследования, показать его достоинства и преимущества перед ранее существовавшими, в том числе в цифровом выражении, включая критерий достоверности, определяемый объективными и точными математическими методами. Ссылки некоторых авторов на данные литературы, с которыми можно сопоставить результаты их собственных наблюдений, не всегда обоснованы, так как из-за отсутствия стандартных условий научных исследований данные различных авторов не всегда сопоставимы по основным показателям и условиям исследования.
Сравнительно редко в научных исследованиях встречаются проверочные исследования, которые в ряде случаев совершенно необходимы для проверки (контроля) ранее полученных данных (подтверждение воспроизводимости), а также для подтверждения или опровержения выдвинутой ранее рабочей гипотезы.
Контрольные исследования обладают еще и другим важным и полезным свойством. В процессе их выполнения (а они, как правило, предшествуют основным экспериментам) отрабатывается методика, что немаловажно для молодых начинающих специалистов, выявляются недостатки существующих методик, аппаратуры, инструментов и прочее. Следовательно, создаются предпосылки при необходимости их исключения в последующей работе.
Некоторые авторы безосновательно и ошибочно считают, что для опытных групп следует подбирать большее количество наблюдений (больных, экспериментальных животных, анализов), чем для контрольных. Это неверно, так как на показатели контрольной группы в такой же мере распространяются математические правила размера выборки. Поэтому группировка контрольных показателей осуществляется по общепринятым методикам. Здесь могут иметь значение другие факторы, действительно определяющие в некоторых случаях меньшую величину выборки и возникающие вследствие того, что в контрольной группе может быть меньшей вариабельность изучаемых показателей.
В заключение следует отметить, что методически правильная организация научных медицинских исследований, наличие значимой доказательной базы способствуют дальнейшему повышению уровня научных работ. Планирование и подсчет необходимого объема исследований, программа и параметры контрольной группы дают возможность четко ограничить оптимальный объем исследований при заданной степени точности, корректировать финансовые нагрузки и экономическую целесообразность.
- Безопасность лекарств: Руководство по фармакнадзору / Под ред. А.П. Викторова, В.И. Мальцева, Ю.В. Белоусова. — К.: МОРИОН, 2007. — 240 с.
- Бабич П.Н., Чубенко А.В., Лопач С.Н. Принципы применения статистических методов при проведении клинических испытаний лекарственных средств // Здоров’я України. — 2004. — № 17(102). — С. 24-25.
- Клинические испытания лекарств / Под ред. В.И. Мальцева, Т.К. Ефимцевой, Ю.В. Белоусова, В.М. Клименко. — К.: МОРИОН, 2006. — 456 с.
- Левашова И.Г., Мурашко А.Н., Подпружников Ю.В. Надлежащие практики в фармации. — К.: МОРИОН, 2006. — 256 с.
- Лопач С.Н., Чубенко А.В., Бабич П.Н. Основные принципы применения статистических методов в клинических испытаниях. — К.: МОРИОН, 2002. — 160 с.
- Неробеев Д.В. Стандарты диагностики и контроль токсичности лекарственных средств на репродуктивную функцию мужских половых желез // Новости медицины и фармации. — 2007. — № 17(224). — С. 31-32.
- Неробеев В.Д. Системные стандарты при экспертизе достоверности научной медицинской информации и принятии клинических решений // Новости медицины и фармации. — 2012. — № 1–2(399–400). — С. 20-23.
- Неробеев В.Д. Экспертная оценка и контроль токсичности лекарств на репродуктивную функцию мужчин // Новости медицины и фармации. — 2012. — № 6(404). — С. 20-21.
- Неробеев В.Д., Неробеев Д.В. Диагностическая значимость и доказательная база спермограммы при исследовании токсичности лекарств на репродуктивную функцию мужчин // Новости медицины и фармации. — 2012. — № 8(410). — С. 16-17.
- Руководство (42-7.1: 2005) по клиническим исследованиям. Лекарственные средства. Исследование биодоступности и биоэквивалентности. — К.: Министерство здравоохранения Украины, 2005. — 20 с.
