Газета «Новости медицины и фармации» 13-14 (423-424) 2012
Вернуться к номеру
Дифференциальная диагностика и лечение болезни Вильсона практические рекомендации Американской ассоциации по изучению болезней печени (AASLD))
Дифференциальная диагностика в целевых специфических популяциях
«Замаскированное» поражение печени.У пациентов с болезнью Вильсона (БВ), особенно у молодых, клинические и гистологические изменения могут быть практически неотличимы от таковых при аутоиммунном гепатите. На предмет наличия БВ необходимо проведение тщательного обследования всех детей с доказанным диагнозом аутоиммунного гепатита, а также всех взрослых с предполагаемым указанным диагнозом, которые быстро и адекватно не ответили на терапию кортикостероидами. У некоторых больных БВ отмечается улучшение при применении короткого курса кортикостероидов в сочетании с соответствующей терапией основного заболевания. У части пациентов нельзя исключить конкурирующие диагнозы БВ и аутоиммунного гепатита. Стеатоз печени при БВ не так выражен, как при неалкогольной жировой болезни печени (НЖБП). Тем не менее у части пациентов с БВ симптомы очень напоминают НЖБП или эти заболевания могут существовать независимо у одного и того же больного.
Острая печеночная недостаточность
У большинства пациентов с БВ и острой печеночной недостаточностью имеется характерная клиническая картина:
- гемолитическая анемия с отрицательной пробой Кумбса и признаками внутрисосудистого гемолиза;
- коагулопатия, не отвечающая на парентеральное введение витамина К;
- быстрое прогрессирование почечной недостаточности;
- относительно небольшое повышение активности сывороточных аминотрансфераз (обычно менее 2000 МЕ/л) с самого начала клинических проявлений;
- нормальное или субнормальное значение щелочной фосфатазы (ЩФ) — обычно менее 40 МЕ/л;
- соотношение «мужчины/женщины» 2 : 1.
Для постановки правильного диагноза необходимо проявлять высокую клиническую настороженность, поскольку стандартные лабораторные методы не всегда позволяют отличить острую печеночную недостаточность при БВ от того же состояния, вызванного вирусной инфекцией или лекарственной токсичностью. По сравнению с острой печеночной недостаточностью другой этиологии у большинства пациентов с БВ отмечается относительно умеренное повышение активности сывороточных аминотрансфераз, что часто приводит к недооценке тяжести состояния. Сывороточный уровень церулоплазмина (ЦПН) обычно понижен, однако прогностическая ценность этого исследования в условиях острой печеночной недостаточности незначительна. Уровень меди в сыворотке крови и ее суточное выделение с мочой существенно повышены. К сожалению, во многих лечебных заведениях невозможно быстрое получение данных показателей, поэтому диагностика должна быть основана на клинических проявлениях. Для подтверждения диагноза может быть использовано выявление колец Кайзера — Флейшера, но у 50 % таких больных они могут отсутствовать. Быстрая постановка диагноза играет очень большую роль, так как этой категории пациентов для выживания требуется экстренная трансплантация печени.
У некоторых больных с острой печеночной недостаточностью, вызванной БВ, активность АсАТ в сыворотке крови может быть выше, чем активность АлАТ, что потенциально отражает повреждение митохондрий. Тем не менее эти показатели достаточно часто и сильно варьируют, чтобы служить диагностическим критерием. Чаще в указанной ситуации отмечается низкая активность ЩФ, а соотношение ее уровня (в международных единицах на литр) и показателя общего билирубина (в миллиграммах на децилитр) составляет менее 2. Прогностический индекс, применяемый на момент постановки диагноза острой печеночной недостаточности у пациентов с БВ, который оценивает уровень выживаемости, основан на показателях общего билирубина, АсАТ в сыворотке крови и длительности протромбинового времени. Хотя данный индекс адекватно оценивает экстремальные случаи заболевания, он не слишком достоверен при более умеренной выраженности заболевания. Недавно этот индекс был переработан (теперь в него включены также показатели количества лейкоцитов и уровня альбумина в сыворотке крови), и, возможно, он станет информационно более ценным.
Острая печеночная недостаточность часто служит первым клиническим проявлением повреждения печени у пациентов с БВ, однако при обследовании у них, как правило, выявляется прогрессирующий цирроз. Предполагается, что наличие интеркуррентных заболеваний, таких как вирусная инфекция и лекарственная токсичность, может дать толчок быстрому прогрессированию печеночной патологии. Иногда у больных с острой печеночной недостаточностью, вызванной вирусным гепатитом, обнаруживается латентная БВ.
Пациенты с острой печеночной недостаточностью, вызванной БВ, включаются в высшую приоритетную группу листа ожидания для трансплантации печени по статусу 1А United Network for Organ Sharing независимо от наличия у них хронического заболевания печени.
Семейное скринирование
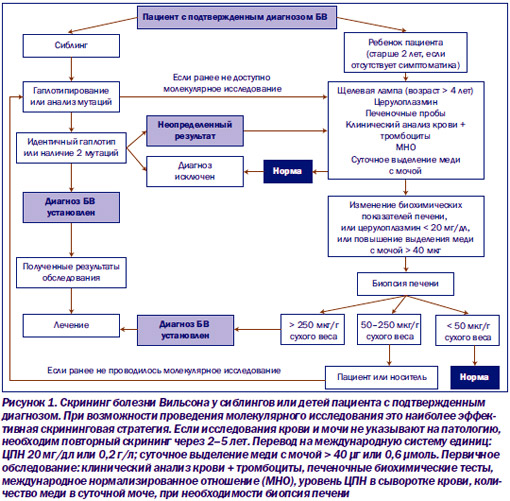
Родственники по прямой линии вновь выявленного больного с БВ должны проходить скрининг на наличие у них заболевания (рис. 1). При этом требуется выявление кратковременных эпизодов желтухи в анамнезе, заболевания печени и ранней симптоматики неврологических отклонений. В процедуру скринирования входят также физикальный осмотр, определение в сыворотке крови уровней меди, церулоплазмина, проведение функциональных печеночных тестов, включающих определение активности сывороточных аминотрансфераз, содержания альбумина, а также конъюгированного и неконъюгированного билирубина. Измеряется количество меди, выделяемой с мочой за сутки, а с помощью щелевой лампы — наличие колец Кайзера — Флейшера. Лицам, у которых последние не выявляются, но имеются субнормальные показатели ЦПН и изменения печеночных тестов, показано проведение биопсии печени для подтверждения диагноза. Если это возможно, в качестве первичного скринирования необходимо молекулярное исследование мутаций гена АТР7В или изучение гаплотипа. Всем лицам старше 3–4 лет с выявленными при семейном скрининге симптомами заболевания должно быть назначено лечение.
Скрининг новорожденных
Определение церулоплазмина в образцах мочи новорожденных или в крови методом Гатри может помочь в распознавании БВ. Однако для более точной диагностики рекомендуется применение более тонких методов исследования, включающих иммунологические.
Лечение
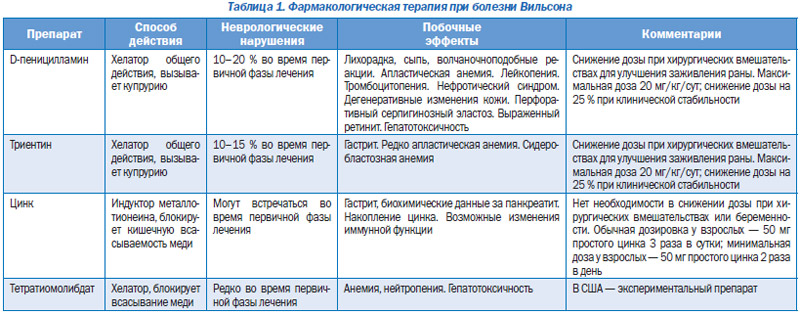
В течение 50 лет после описания БВ не было определено эффективных способов лечения этого прогрессирующего фатального заболевания. Поскольку в тот период, когда лечение стало доступным, не было возможности проводить контролируемые исследования, терапия БВ исторически развивалась от внутримышечных инъекций британского антилюизита (2,3-димеркаптопропанол, или БАЛ) до гораздо более простого перорального применения пеницилламина.
Хотя проведенными исследованиями доказана эффективность пеницилламина в зависимости от дозы и соответственного выведения меди с мочой, в первое время после начала его применения клиническое использование было ограничено доступностью самого препарата. Дозы подбирались эмпирически, так как формальных исследований дозозависимости ответа на лечение не проводилось. Интересно отметить, что при первичном применении этой терапии препарат назначался только симптоматическим больным, поскольку хороших диагностических тестов для выявления асимптомных пациентов еще не было. Одновременно с прогрессом в диагностическом тестировании БВ началась новая эра в лечении заболевания, когда было установлено, что при терапии асимптомных больных прогрессирование данной патологии и смертность от нее могут быть предотвращены. Затем был разработан препарат триентин, специально предназначавшийся для больных с побочными реакциями на пеницилламин. Отдельно рассматривалось применение цинка (табл. 1).
Сегодня основной тенденцией лечения БВ остается пожизненная фармакологическая терапия. Трансплантация печени, которая позволяет корректировать повреждение органа при БВ, применяется в тяжелых и резистентных к лечению случаях. В целом подход к назначению лечения зависит от наличия клинически доказанного заболевания или лабораторных и гистологических признаков активного воспалительного процесса — неврологического или печеночного. Терапия назначается также в случаях выявления БВ у пациента еще до появления клинических симптомов.
Рекомендуемая первичная терапия для симптоматичных больных или пациентов с активным течением заболевания — это хелатирующие препараты. Однако в некоторых работах было показано, что первичное назначение цинка также дает адекватный эффект. Самый большой опыт лечения во всем мире все еще связан с D-пеницилламином, но в настоящее время для первичной терапии чаще стал использоваться триентин. Сейчас уже существуют данные, доказывающие его эффективность в лечении пациентов с декомпенсированным неврологическим или печеночным заболеванием. Ранее препятствиями для назначения триентина служили его ограниченный запас и беспокойство о дальнейшей доступности, а также отсутствие у многих клиницистов опыта его применения.
Комбинированная терапия с использованием цинка в сочетании с хелатором имеет теоретическое обоснование, так как наряду с блокированием захвата меди происходит удаление ее излишков из организма. В некоторых работах упоминается использование такой комбинированной терапии в качестве первичного средства лечения, однако необходимы дальнейшие исследования эффективности этого метода. После стабилизации симптомов заболевания или биохимических показателей (обычно через 2–6 мес. после начала лечения) пациенты могут быть переведены на поддерживающую дозу хелаторов или цинка. Бессимптомные больные после постановки диагноза уже могут получать поддерживающие дозы лекарственного средства. Перерыв в пожизненном лечении приводит к возвращению симптомов и развитию печеночной недостаточности, что требует пересадки печени для выживания больного.
D-пеницилламин
Пеницилламин как первый пероральный препарат для лечения БВ стал применяться с 1956 г. Считалось, что он представляет собой продукт распада пенициллина, но на самом деле это дважды замещенная метиловыми группами серосодержащая аминокислота цистеин. Подобно БАЛ, пеницилламин содержит свободную сульфгидрильную группу, которая хелатирует медь. В настоящее время пеницилламин выпускается в синтезированном виде, поэтому прямого отношения к пенициллину не имеет.
Главным эффектом действия D-пеницил-ламина при БВ является увеличение выделения меди с мочой. Препарат может действовать также посредством индуцирования металлотионеина. D-пеницилламин подавляет также синтез коллагена в организме и нормализует соотношение между его растворимыми и нерастворимыми фракциями. Кроме того, обладает определенной иммуносупрессивной активностью, что позволяет применять его при ревматоидном артрите. Он представляет собой хелатор для всех металлов и используется для лечения цистиноза.
D-пеницилламин быстро всасывается из желудочно-кишечного тракта (ЖКТ) с двухпиковой кривой абсорбции в кишечнике. Захват может происходить с помощью необычных механизмов: дисульфидное связывание с мембраной энтероцита с последующим пиноцитозом. При приеме D-пеницилламина с пищей всасываемость уменьшается в целом на 50 %. Общая биодоступность оценивается в 40–70 %. После всасывания около 80 % препарата находится в циркуляции в виде связанных с плазменными белками комплексов.
Свободного D-пеницилламина в плазме мало, так как он формирует неактивные димеры или связывается с цистеином. Более 80 % препарата выводится из организма через почки. Период его полураспада составляет 1,7–7 ч, но существуют значительные индивидуальные вариации, и следы препарата или его метаболитов могут быть обнаружены в моче через несколько месяцев после прекращения терапии.
Использование D-пеницилламина как первичного средства лечения симптоматических больных БВ подтверждается многочисленными исследованиями. Во время первой фазы терапии у 10–50 % пролеченных пациентов отмечается ухудшение неврологической симптоматики. В недавних работах о таком побочном действии сообщалось для всех трех вариантов лечения БВ, но в большинстве случаев при применении D-пеницилламина (13,8 %). У больных с симптоматическим поражением печени признаки восстановления ее синтетической функции и клиническое улучшение (уменьшение выраженности желтухи и асцита) обычно наблюдаются в первые 2–6 мес. после начала терапии, но дальнейший прогресс лечения занимает весь первый год. Неспособность продолжать терапию приводит к существенному ухудшению состояния печени и развитию печеночной недостаточности через 1–12 мес. после прекращения лечения, что грозит смертью пациента или необходимостью трансплантации органа.
Применение D-пеницилламина связано с многочисленными побочными реакциями. Примерно у 30 % больных тяжелые побочные эффекты требуют прерывания лечения. В первые 1–3 нед. приема препарата могут появиться лихорадка, кожная сыпь, развиться лимфоаденопатия, нейтропения, тромбоцитопения и протеинурия. При возникновении таких явлений необходимо прерывание терапии. Наличие альтернативных средств не требует добавления к лечению кортикостероидов.
К поздним побочным реакциям относят токсическое поражение почек, обычно проявляющееся протеинурией или появлением других клеточных элементов в моче, что требует немедленного прекращения приема D-пеницилламина. Среди поздних реакций необходимо отметить также волчаночноподобный синдром (гематурия, протеинурия и положительная реакция на антинуклеарные антитела). При применении высоких доз препарата (что в настоящее время для лечения БВ не используется) развивается синдром Гудпасчера. Выраженная токсичность для костного мозга проявляется тяжелой тромбоцитопенией или полной аплазией. Дерматологические реакции представляют собой прогерические изменения кожи (синдром преждевременного старения), пемфигоидные (напоминающие пузырчатку) изменения, язвы, плоский лишай и афтозный стоматит.
Переносимость D-пеницилламина может быть достигнута назначением минимальных доз препарата (250–500 мг/сут) с последующим повышением на 250 мг/сут каждые 4–7 дней до максимальной дозы в 1000–1500 мг/сут, разделенной на 2–4 приема. Поддерживающая доза обычно составляет 750–1000 мг/сут, разделенная на 2–4 приема. Дозы препарата у детей — 20 мг/кг/сут (округленно 250 мг), принимаемые за 2 или 3 раза. Наиболее эффективно применение препарата за 1 ч до или через 2 ч после приема пищи, поскольку он подавляет всасывание. Изменение этих правил допустимо, если оно отвечает требованиям больного и сохраняет его готовность продолжать лечение.
За исключением развития побочных эффектов, описанных выше, другой важной особенностью терапии D-пеницилламином является возможное снижение уровня церулоплазмина в сыворотке крови после начала лечения.
Адекватность терапии проверяется измерением количества меди, выделяемой за сутки с мочой во время лечения. После начала терапии этот показатель может иметь наивысшее значение — более 1000 мкг (16 ммоль)/сут. При длительной (поддерживающей) терапии количество выделяемой с мочой меди обычно колеблется в пределах 200–500 мкг (3–8 ммоль)/сут. В дополнение к этому в случае эффективности лечения при оценке уровня меди, не связанной с ЦПН, отмечается снижение этого показателя.
Количество меди, выделяемой с мочой за сутки, менее 200 мкг (3,2 ммоль) может указывать либо на неэффективность терапии, либо на избыточное лечение с излишним удалением меди. При неэффективности лечения уровни меди, не связанной с ЦПН, повышены (более 15 мкг/дл, или более 150 мкг/л), в то время как при избыточной терапии они очень низки (менее 5 мкг/дл, или менее 150 мкг/л).
Триентин
Триентин (триэтилентетрамин дигидрохлорид, или 2,2,2-тетрамин), известный также под официальным названием «триен», является представителем семейства хелаторов с полиаминоподобной структурой. Химически он отличается от пеницилламина. В нем отсутствуют сульфгидрильные группы и медь хелатируется с формированием стабильного комплекса с четырьмя составляющими молекулами азота в плоском кольце.
Триентин был представлен в 1969 г. как альтернатива пеницилламину. Данных о его фармакокинетике немного. Он плохо всасывается в ЖКТ, абсорбируемая часть метаболизируется и инактивируется. Примерно 1 % введенного триентина и около 8 % биотрансформированного метаболита триентина — ацетилтриена в конечном итоге выводятся с мочой. Ацетилтриен — менее эффективный хелатор, чем триентин. Уровни меди, цинка и железа в моче повышаются параллельно уровню выводимого триентина.
Как и пеницилламин, триентин усиливает выделение меди почками. Данные о силе воздействия этих агентов противоречивы, и подбор дозы может устранить разницу. Оба препарата могут воздействовать на различные запасы меди в организме.
Триентин представляет собой эффективное средство для лечения БВ и особенно показан при непереносимости пеницилламина, а также больным с клиническими признаками потенциальной его интолерантности (при любом заболевании почек в анамнезе, застойной спленомегалии, вызвавшей тяжелую тромбоцитопению, тенденции к аутоиммунным процессам). В некоторых работах отмечалось усиление неврологической симптоматики после начала лечения триентином, но эти явления встречаются реже, чем при применении пеницилламина. Триентин доказал также свою эффективность как средство первичной терапии даже у пациентов с декомпенсированным заболеванием печени.
Побочных эффектов при терапии триентином немного. Не сообщается о наличии гиперчувствительных реакций, хотя у одного пациента была выявлена фиксированная кожная реакция на введение препарата. Указания на панцитопению также редки. Поскольку триентин одновременно с медью хелатирует железо, необходимо избегать совместного введения этого препарата и препаратов железа, так как их комплекс токсичен. Последствием избыточной терапии может стать обратимая сидеробластическая анемия, вызывающая дефицит меди. В целом можно сказать, что побочные реакции, наблюдаемые при терапии пеницилламином, уменьшаются при замене его триентином, и их рецидива при длительном приеме препарата не отмечается. При использовании препарата пациентами с первичным билиарным циррозом сообщалось о развитии у них геморрагического гастрита, отсутствии вкусовых ощущений и появлении кожных высыпаний. В недавних исследованиях были упоминания о том, что применение триентина, подобно пеницилламину, может вызвать у больных БВ избыточное отложение железа в печени.
Обычно применяемая доза — 750–1500 мг/сут, разделенная на 2–3 раза, поддерживающая — 750 или 1000 мг. У детей зависимость дозы от массы тела не установлена, но обычно это доза 20 мг/кг/ сут, приближающаяся к 250 мг/сут, разделенная на 2–3 приема. Триентин вводится за 1 ч или через 2 ч после еды. Эффект его таблетированной формы может быть нестабилен при высокой температуре окружающей среды, что представляет проблему для лиц, путешествующих в страны с жарким климатом.
Адекватность терапии триентином оценивается определением содержания меди в суточ-ной моче во время лечения. Оно должно состав-лять примерно 200–500 мкг (3–8 ммоль)/сут при поддерживающей терапии, но может быть гораздо выше в начале лечения. В дополнение к этому определение уровня меди, не связанной с церулоплазмином, при эффективной терапии может указать на нормализацию ее концентрации в кровообращении.
Показатель выделяемой меди в моче ниже 200 мкг/сут свидетельствует либо о невосприимчивости к лечению, либо об избыточной терапии и слишком активном удалении меди из организма. При несостоятельности лечения уровень меди, не связанной с ЦПН, повышен (более 15 мкг/дл, или более 150 мкг/л), в то время как при избыточной терапии этот показатель очень низок (менее 5 мкг/дл, или менее 50 мкг/л).
Цинк
Это вещество было впервые использовано для лечения БВ Schouwink в Голландии в начале 1960-х годов. Механизм его действия отличается от пеницилламина и триентина. Цинк вмешивается в захват меди из ЖКТ и индуцирует энтероцитный металлотионеин — белок, богатый цистеином, который представляет собой эндогенный хелатор металлов. Металлотионеин обладает бульшим сродством к меди, чем к цинку, и, таким образом, в основном связывает медь в энтероците и ингибирует ее выход в портальную циркуляцию. Связанная медь не абсорбируется и выводится из организма с фекалиями. Поскольку медь попадает в ЖКТ также со слюной и секреторной продукцией желудка, терапия цинком может генерировать отрицательный баланс для меди и снижать ее накопление в организме. Цинк может эффективно действовать, индуцируя повышение уровня металлотионеина. При его применении отмечено очень небольшое количество побочных реакций. Главной из них является раздражение слизистой оболочки желудка, что может зависеть от воздействия соли металла. В некоторых работах сообщается о случаях поражения печени в начале лечения. Один из таких случаев закончился смертельным исходом. Цинк может обладать иммуносупрессивным эффектом и уменьшать хемотаксис лейкоцитов. Может произойти повышение уровня сывороточной липазы и/или амилазы без клинических или радиологических проявлений панкреатита. Неврологическая патология встречается редко. Является ли безопасной высокая доза цинка для пациентов с нарушениями функции почек, пока не установлено.
Хотя в целом цинк сейчас служит средством поддерживающей терапии, он использовался как средство первой линии в основном у асимптомных или малосимптомных пациентов. Создается впечатление, что он эффективен так же, как пеницилламин, но гораздо лучше переносится больными. Это подтверждено исследованиями больших групп взрослых пациентов с БВ.
Принимаемая доза рассчитывается в миллиграммах простого цинка. Для взрослых и старших детей она составляет 150 мг/сут на 3 приема (допускается 2-разовый прием). Используемая соль металла не меняет эффективность препарата, но может повлиять на его переносимость. В отношении побочных реакций со стороны ЖКТ отмечается, что ацетат и глюконат цинка лучше переносимы, чем сульфат, но у разных больных это может варьировать. Для маленьких детей (масса тела менее 50 кг) доза составляет 75 мг/сут в 3 приема. Для детей младше 5 лет она на данный момент полностью не установлена. Прием цинка во время еды уменьшает его всасываемость и эффективность лечения.
Адекватность терапии цинком оценивается клиническим и биохимическим улучшением и с помощью измерения количества меди в суточной моче, которое должно быть ниже 75 мкг (1,2 ммоль) при стабильном приеме препарата. В дополнение к этому при успешном лечении нормализуется уровень меди, не связанной с церулоплазмином.
Антиоксиданты
Антиоксиданты, в основном витамин Е, могут применяться как средство адъювантной терапии. При БВ наблюдается снижение содержания витамина Е в сыворотке крови и в печени. Периодически сообщается об уменьшении симптоматики при добавлении витамина Е к основному лечению, но точных исследований по этой теме не проводилось.
Диета
Прежде всего следует избегать приема пищи с высоким содержанием меди (моллюски, орехи, шоколад, грибы и различные внутренние органы животных), по крайней мере в течение первого года терапии. Диетическое ограничение поступления меди может отсрочить начало заболевания и дает возможность контролировать его течение. Тем не менее диета не может служить единственным методом лечения БВ. Требуется колодезную воду или воду, поступающую в дом по медным трубам, проверять на наличие в ней меди, но муниципальные водные запасы в целом проверять нет необходимости. Если содержание меди в воде повышено, рекомендуется применять водоочистительные системы. В домах с медными водопроводными трубами нужно сливать застоявшуюся воду перед ее использованием в кулинарных или других целях. Для хранения и приготовления пищи нежелательно использовать медные контейнеры или медную посуду.
Тетратиомолибдат аммония (ТМ)
ТМ — это очень мощный препарат, понижающий уровень меди. Он действует посредством двух механизмов: нарушения захвата меди в кишечнике (при приеме с пищей) и связывания меди в плазме (при употреблении между приемами пищи). В низких дозах ТМ удаляет медь из металлотионеина, но при применении высоких доз образует нерастворимый медный комплекс, откладывающийся в печени. В США ТМ остается экспериментальным препаратом и в коммерческую сеть не поступает. Недавние исследования показали некоторые его преимущества, так как при приеме не отмечено дегенерации нервной системы. Потенциальные побочные реакции включают угнетение костного мозга, токсическое повреждение печени и излишне активное выведение меди, вызывающее неврологическую дисфункцию. За счет массированного выведения меди из организма ТМ обладает также антиангиогенным действием.
Лечение в особых клинических ситуациях
Бессимптомные пациенты
Для бессимптомных или пресимптомных пациентов, выявленных при семейном скрининге, эффективным средством лечения для предотвращения развития клинической картины или прогрессирования заболевания служат хелаторы (например, D-пеницилламин) или цинк. Детям младше 3 лет предпочтительно назначать цинк.
Поддерживающая терапия
После адекватного курса лечения хелатирующим препаратом стабильные пациенты могут быть переведены на более низкую дозу (как было указано выше) или на терапию цинком. В основном такие пациенты получают лечение в течение 1–5 лет. Во время терапии у больных будет отсутствовать клиническая симптоматика с нормальным уровнем аминотрансфераз и неизмененной синтетической функцией печени. Концентрация меди, не связанной с церулоплазмином, обычно находится в пределах нормы, а суточное выделение меди с мочой составляет 200–500 мкг (3–8 ммоль). Преимущества длительного лечения цинком заключаются в том, что препарат более селективен в удалении меди, чем пеницилламин или триентин. Цинк обладает также меньшим количеством побочных действий. Убедительных исследований на изменение первичной терапии для взрослых больных с печеночной формой БВ не проведено, существуют только ограниченные данные по педиатрической практике. Независимо от того, насколько хорошим кажется состояние пациента, лечение не должно прекращаться. Прерывание терапии чревато трудноизлечимой декомпенсацией заболевания печени.
Острая печеночная недостаточность.
При острой печеночной недостаточности, вызванной БВ, для сохранения жизни пациентов показана трансплантация печени. Для определения возможности выживания после трансплантации Nazer и соавт. предложили прогностическую шкалу, основывающуюся на показателях билирубина, АсАТ в сыворотке крови и уровне протромбинового времени. Больные с 7 и более баллами по этой шкале имеют очень высокую вероятность летального исхода. Балльные системы были разработаны как для взрослых, так и для детей с острой печеночной недостаточностью и БВ. Обе системы имеют хорошее предсказательное значение, но, к сожалению, стандартно не применяются.
До трансплантации с целью защиты почек от вызванного медью повреждения канальцев может возникнуть необходимость в проведении плазмафереза и гемофильтрации, а также обменной трансфузии и гемофильтрации или диализа. Альбуминовый диализ доказал свою способность к стабилизации состояния пациентов с острой печеночной недостаточностью и может отсрочить, но не отменить трансплантацию печени. В данной ситуации может быть применено устройство ультрафильтрации рециркуляторной системы молекулярных адсорбентов.
Беременность.
У беременных женщин с БВ лечение должно продолжаться в течение всего срока беременности. Прерывание терапии в этот период вызывает развитие острой печеночной недостаточности. Накопленный опыт показывает, что применение хелаторов (пеницилламина и триентина) и солей цинка связано с положительным исходом беременности для матери и плода. Частота родовых негативных последствий у детей пролеченных пациенток низка. Вместе с тем редкость таких явлений затрудняет их сравнение с показателями во всей популяции. Доза солей цинка сохраняется неизменной во время всей беременности. Доза хелаторов должна быть минимизирована, особенно в последнем триместре, для того чтобы обеспечить лучшее заживление раны, если потребуется проведение кесарева сечения. Снижение дозы может составлять 25–50 % от первоначальной величины. Наблюдение за пациентками во время беременности должно проводиться часто.
Женщинам, получающим D-пеницил-ламин, не следует кормить ребенка грудью, так как препарат выводится с молоком матери и может повредить новорожденному. Данных о содержании триентина и цинка в молоке матери очень мало.
Трансплантация печени
Трансплантация печени представляет собой единственный эффективный метод лечения пациентов с БВ и острой печеночной недостаточностью. Он показан также всем больным с декомпенсированным заболеванием печени, не ответившим на медикаментозное лечение. Трансплантация корректирует метаболические дефекты в печени при БВ и может способствовать нормализации внепеченочного метаболизма меди. Выживание в течение года после операции колеблется в пределах 79–87 %, и те пациенты, которые пережили этот ранний период, сохраняют хорошие показатели выживаемости и в длительные сроки. Хотя большинство больных при трансплантации получают трупные донорские органы, возможно проведение пересадки печени и от живого донора. Особенно успешной является операция, когда донором служит гетерозиготный член семьи больного.
Менее определенные показания к трансплантации печени имеются для больных с выраженной неврологической симптоматикой. У некоторых пациентов с психическими или неврологическими симптомами частота последних после трансплантации печени уменьшается.
Цели терапии и динамическое наблюдение
Целью наблюдения за ходом лечения является подтверждение клинического и биохимического состояния пациента, его согласия на продолжение терапии, своевременное выявление побочных эффектов. Частота визитов может варьировать, но не должна быть реже 2 раз в год. Более частое наблюдение необходимо во время первичной фазы лечения, особенно для тех лиц, которые испытывают усиление симптоматики или появление побочного действия препаратов, а также для тех, кто может не выполнять назначений врача. Физикальный осмотр направлен на выявление заболевания печени и неврологических расстройств. При склонности пациента не выполнять врачебные рекомендации требуются повторные исследования на наличие колец Кайзера — Флейшера, так как первичное или повторное их появление может свидетельствовать об обострении заболевания. При физикальном осмотре пациентов, получающих пеницилламин, необходимо внимательно следить за появлением кожных изменений. Тщательный сбор анамнеза должен быть направлен на выявление жалоб психического характера, особенно типичных для депрессии.
Лабораторное исследование включает определение биохимических параметров печени, в том числе ее синтетической функции, с применением маркеров метаболизма меди (содержание меди церулоплазмина в сыворотке крови). Оценка содержания меди, не связанной с ЦПН, может оказаться наиболее важным показателем эффективности терапии. Количество меди, выделяемой за сутки с мочой во время лечения, отражает общий обмен меди. У пациентов, получающих D-пеницилламин или триентин, этот показатель должен составлять 200–500 мкг/сут (3–8 ммоль/сут), при приеме цинка не должен превышать 75 мкг/сут (1,2 ммоль/сут).
Для пациентов, получающих хелатирующую терапию, повышенный уровень меди в моче может означать невыполнение назначений врача, вследствие чего возможно ухудшение состояния печени. Низкий уровень микроэлемента в моче у данной категории больных может указывать на избыточность дозы, особенно если это сопровождается очень низким содержанием меди, не связанной с церулоплазмином. У этих больных может обнаруживаться также нейтропения, анемия, гиперферритинемия. У лиц, прервавших лечение или самостоятельно перешедших на субтерапевтические дозы, может наблюдаться низкий уровень суточного выделения меди с мочой, но высокий показатель меди, не связанной с церулоплазмином. Соблюдение рекомендаций по приему цинка может оцениваться измерением его содержания в сыворотке крови или количества в суточной моче, которое должно составлять порядка 2 мг. Всем пациентам, получающим хелаторы, необходимо проводить клинические анализы крови, а для подтверждения безопасности лечения — общие анализы мочи.
Заключение
Болезнь Вильсона — одно из первых заболеваний печени, для которого был найден эффективный метод терапии. До того как 50 лет назад еще не были разработаны методы лечения БВ, она представляла собой фатальное заболевание. Первым хелатирующим препаратом стал british anti-lewisite — британский антилюизит (димеркаптопропанол), представленный в 1951 г. Идентификация и тестирование в 1956 г. Джоном Уолшем (John Walsh) орального препарата D-пеницилламина революционизировали лечение БВ. Другим вариантом терапии стало применение солей цинка для блокирования кишечного всасывания меди, тетратиомолибдата для хелатирования меди и также блокирования ее кишечного всасывания. Наиболее эффективным лечением БВ, которое позволяет сохранить жизнь пациенту, служит ортотопическая трансплантация печени.