Журнал «Почки» 01(2012)
Вернуться к номеру
Клініко-морфологічні кореляції при первинних проліферативних гломерулонефритах
Авторы: Дядик О.О., Ярова Н.Ф. - Донецький національний медичний університет ім. М. Горького; Іванова М.Д. - Національний медичний університет імені О.О. Богомольця, м. Київ; Ткаченко Л.І. - КЛПУ Донецького обласного клінічного територіального медичного об’єднання МОЗ України
Рубрики: Кардиология, Нефрология
Версия для печати
Резюме. Із метою встановлення клініко-морфологічних кореляцій при первинних проліферативних гломерулонефритах (ППГН), зокрема особливостей тубулоінтерстиціальних змін, було проведено прижиттєву патоморфологічну діагностику нирок (ПМДН) у співставленні з клініко-лабораторними даними у 122 хворих. У 67 встановлено діагноз мезангіопроліферативного ГН (МПГН), у 55 — мезангіокапілярного ГН (МКГН) I типу із тубулоінтерстиціальним компонентом різного ступеня вираженості. Клініко-морфологічні кореляції свідчили, що активні тубулоінтерстиціальні зміни при ППГН (r = –0,37, р < 0,005) корелювали зі зниженням питомої ваги сечі (37 % при МКГН та 73 % при МПГН) (r = –0,53, p < 0,001), наявністю лейкоцитурії (64 % при МПГН та 91 % при МКГН) (r = 0,57, p < 0,001), протеїнурії понад 1 г/добу (помірної та значної: 42 та 16 % при МПГН, при МКГН — 30 та 58 % відповідно) (r = 0,48, p < 0,05), зниженням швидкості клубочкової фільтрації (ШКФ) (r = –0,69, p < 0,001); хронічні тубулоінтерстиціальні зміни при ППГН показали кореляцію з рівнем протеїнурії понад 2,5 г/л (r = 0,5,
p < 0,001) та ШКФ менше 60 мл/хв (21 та 42 % при МПГН та МКГН відповідно) (r = –0,65, p < 0,001).
Резюме. С целью установления клинико-морфологических корреляций при первичных пролиферативных гломерулонефритах (ППГН), в частности особенностей тубулоинтерстициальных изменений, была проведена прижизненная патоморфологическая диагностика почек (ППДП) в сопоставлении с некоторыми клинико-лабораторными параметрами у 122 пациентов. У 67 установлен диагноз мезангиопролиферативного ГН (МПГН), у 55 — мезангиокапиллярного ГН (МКГН) I типа с тубулоинтерстициальным компонентом разной степени выраженности.
Клинико-морфологические корреляции свидетельствовали, что активные тубулоинтерстициальные изменения при ППГН
(r = –0,37, р < 0,005) коррелировали со снижением относительной плотности мочи (37 % при МКГН и 73 % при МПГН)
(r = –0,53, p < 0,001), наличием лейкоцитурии (64 % при МПГН и 91 % при МКГН) (r = 0,57, p < 0,001), протеинурии более 1 г/сутки (умеренной и выраженной — 42 и 16 % при МПГН, при МКГН —
30 и 58 % соответственно) (r = 0,48, p < 0,05), снижением скорости клубочковой фильтрации (СКФ) (r = –0,69, p < 0,001); хронические тубулоинтерстициальные изменения при ППГН показали корреляцию с уровнем протеинурии более 2,5 г/л (r = 0,5, p < 0,001) и СКФ меньше 60 мл/мин (21 и 42 % при МПГН и МКГН соответственно) (r = –0,65, p < 0,001).
Summary. We aimed to estimate clinical and morphological correlations in primary proliferative glomerulonephritis (PPGN), particularly tubulointerstitial changes. For that reason we performed life-time kidney biopsy compared with clinical parameters in 122 patients. In 67 patients we diagnosed mesangioproliferative glomerulonephritis (MPGN) and in 55 mesangiocapillary glomerulonephritis type I (MCGN) with tubulointerstitial component of different levels of expression.
Clinical and morphological correlations demonstrated the active tubulointerstitial changes in PPGN (r = –0.37, р < 0.005) to be associated with decreased urine specific gravity (37 % in MPGN and
73 % in MCGN) (r = –0.53, p < 0.001), leukocyturia (64 % in MPGN and 91 % in MCGN) (r = 0.57, p < 0.001), proteinuria above 1 g/day (moderate and intensive: 42 and 16 % in MPGN, respectively, and 30 and 58 % in MCGN, respectively) (r = 0.48,
p < 0.05), decreased glomerular filtration rate (GFR) (r = –0.69,
p < 0.001). Chronic tubulointerstitial changes in PPGN correlated with proteinuria level more than 2.5 g/l (r = 0.5, p < 0.001) and GFR less than 60 ml/min (21 and 42 % in MPGN and MCGN, respectively) (r = –0.65, p < 0.001).
Ключові слова: мезангіопроліферативний гломерулонефрит, мезангіокапілярний гломерулонефрит, клініко-морфологічні кореляції, тубулоінтерстиціальний компонент.
Ключевые слова: мезангиопролиферативный гломерулонефрит, мезангиокапиллярный гломерулонефрит, клинико-морфологические корреляции, тубулоинтерстициальный компонент.
Key words: mesangioproliferative glomerulonephritis, mesangiocapillary glomerulonephritis, clinical and morphological correlations, tubulointerstitial component.
Вступ
За даними National Kidney Foundation (2010), гломерулярні захворювання становлять до 19 % серед причин розвитку хронічної хвороби нирок (ХХН). Провідне місце серед них займають саме первинні проліферативні гломерулонефрити (ППГН) [1, 2]. Незважаючи на те що захворюваність на гломерулонефрит (ГН) у цілому знижується, його окремі клінічні форми характеризуються необоротним прогресуючим перебігом та розвитком хронічної ниркової недостатності (ХНН) [3]. Тому визначення прогностичних факторів, насамперед тих, що відображають морфологічні зміни за даними прижиттєвого морфологічного дослідження нирок (ПМДН), що є стандартом діагностики ГН, є надзвичайно актуальним [4].
На сьогодні вже встановлено, що супутнє ураження канальців, інтерстицію та внутрішньониркових судин значно ускладнює патоморфоз, перебіг та прогноз ППГН. Такий морфологічний субстрат визначається як тубулоінтерстиціальний компонент (ТІК) ГН. Саме його наявність призводить до значного прискорення прогресування захворювання та посідає перше місце серед ППГН як причина розвитку хронічної ниркової недостатності [5].
Для клінічної практики дуже важливим є прикладний аспект морфологічної діагностики, значимість якого випливає з клініко-морфологічних кореляцій. Саме встановленню цих взаємозв’язків присвячена ця робота, що базується на власному досвіді авторів.
Матеріали і методи
ПМДН за матеріалами пункційної нефробіопсії проведено у 122 хворих на ППГН, які лікувалися в обласному та міському нефрологічному відділеннях у м. Донецьку з 2006 по 2011 рік. Серед обстежених хворих були 63 жінки (52 %) і 59 чоловіків (48 %) віком від 17 до 58 років (38 ± 4 роки).
Діагноз ППГН установлювався на підставі загальноприйнятих морфологічних критеріїв змін у ниркових біоптатах [6]. Нами було діагностовано в 67 випадках мезангіопроліферативний гломерулонефрит (МПГН) та в 55 випадках мезангіокапілярний гломерулонефрит (МКГН) I типу, у всіх випадках зустрічався ТІК різного ступеня вираженості.
Клінічний діагноз ГН верифікували згідно з протоколами, затвердженими МОЗ України. Для клініко-морфологічних зіставлень використовували дані лабораторних досліджень, зокрема показники артеріального тиску, добової протеїнурії, рівні еритроцитурії та циліндрурії, креатиніну та сечовини крові із розрахунком швидкості клубочкової фільтрації (ШКФ) за формулою Cockroft — Gault, кліренсу креатинину (до 2010 року) та GFR-EPI для значень понад 30 мл/хв та MDRD для значень, менших 30 мл/хв, за калькулятором за Stephen Z. Fadem.
Клініко-лабораторними еквівалентами тубулоінтерстиціальних змін вважали підвищений АТ, наявність протеїнурії, еритро-, циліндрурії, зниження питомої ваги сечі та ШКФ нижче референтних значень.
Черезшкірну біопсію нирок проводили під ультразвуковим контролем на апараті AJ-5200 фірми Dornier (Німеччина) із застосуванням голок Unicut (16- або 17-gauqe) фірми Angiomed (Німеччина). При відборі хворих на біопсію нирки для зменшення ризику ускладнень виключалися пацієнти із загальноприйнятими протипоказаннями до її проведення.
У біоптатах нирок було не менше 8–10 клубочків. Біоптати фіксували 10% нейтральним забуференим формаліном та заливали в парафін, зрізи завтовшки 3–4 мікрони забарвлювали гематоксиліном та еозином, використовували гістохімічні методи — PAS-реакцію, імпрегнацію зрізів сріблом за Джонсом — Моурі, забарвлення за методом PTAH (Phosphotungstic Acid-Hematoxilin) (Маллорі з модифікацією) для виявлення на світлооптичному рівні імунних комплексів, встановлення їх локалізації та розмірів. У всіх випадках проводили імуногістохімічне дослідження (ІГХД) — забарвлення моноклональними та поліклональними антитілами до IgA, IgG і IgM, фракцій комплементу С3, C1q, у частині випадків вивчали стан епітелію канальців, використовуючи цитокератини АЕ1/АЕ3, 18 (СК18), проводили фенотипування клітинних інфільтратів CD3, CD20, CD45, CD68; вивчали маркери сполучної тканини за допомогою a-гладеньком’язового актину (a-SMA), віментину, десміну. Інтенсивність забарвлення IgA, IgG, IgМ, фракцій комплементу С3, C1q позначали як відсутню, слабку, помірну та виражену (як 0, +, ++, +++ та при бальному підрахунку від 0 до 3 балів відповідно) згідно з візуально-аналоговою шкалою. Компоненти екстрацелюлярного матриксу та склерозу (фіброзу) вивчали за допомогою маркерів гладеньком’язових структур — a-SMA, десміну, віментину. У кожному випадку ІГХД клітинних інфільтратів (CD3, CD20, CD45, CD68) вивчали 30 полів зору при збільшенні 400. У кожному випадку ІГХД із маркерами до a-SMA, віментину, десміну вивчали у 30 полях зору при збільшенні 200. Візуалізацію первинних антитіл проводили за допомогою високочутливої полімерної системи детекції DAKO Advance. Мікроскопічне дослідження проводили на мікроскопі Olуmpus BX 40, морфометричну обробку — на мікроскопі Olympus AX70 Provis (Olympus, Японія) із цифровою відеокамерою Olympus DP50 за допомогою програми аналізу зображення Analysis 3.2 Pro (SoftImaging, Німеччина) згідно з рекомендаціями виробника програмного забезпечення.
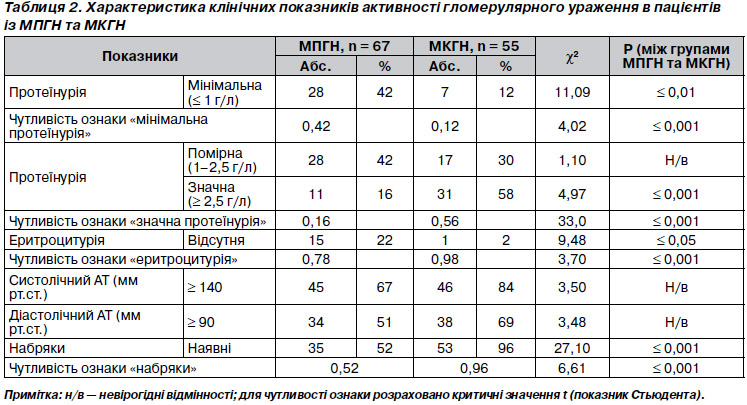
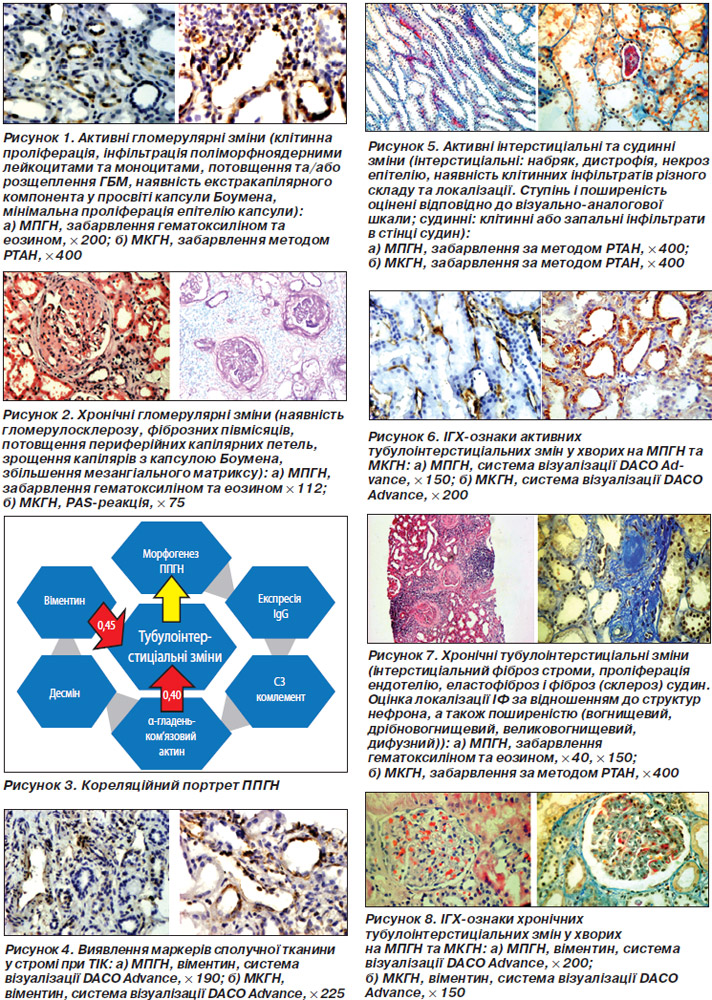
Розрізняли активні і хронічні (неактивні) гломерулярні зміни. До активних відносили: клітинну проліферацію (втягнення в патологічний процес менше ніж 50 % клубочків — позначали як вогнищеву, 50 % клубочків і більше — як дифузну (ступінь її позначали як слабкий, помірний, виражений), інфільтрацію поліморфноядерними лейкоцитами (ПЯЛ) та моноцитами, потовщення та/або розщеплення гломерулярної базальної мембрани та наявність екстракапілярного компоненту (клітинні півмісяці, ексудат (фібрин) у просвіті капсули Боумена, мінімальна проліферація епітелію капсули). Хронічні гломерулярні зміни визначали за наявності гломерулосклерозу, фіброзних півмісяців, потовщення периферійних капілярних петель, зрощення капілярів із капсулою Боумена, збільшення мезангіального матриксу.
Для характеристики канальців проводилося вивчення не менше 10 полів зору при малому збільшенні (ґ 0). Дистрофічні зміни епітелію канальців визначали як слабковиражені за наявності до 25 % змінених канальців, помірні — при ураженні від 25 до 50 % канальців, виражені — при ушкодженні більше ніж 50 % канальців. Враховувався вид дистрофії — гіаліново-краплинна, вакуольна й жирова. Визначалися наявність і поширеність некротичних змін в епітелії канальців, наявність циліндрів, білкових мас і злущених клітин у просвіті канальців, враховували стан тубулярної базальної мембрани, у тому числі й наявність депозитів у ній.
Розрізняли активні і хронічні (неактивні) інтерстиціальні зміни. Активні інтерстиціальні зміни включали набряк і наявність клітинних інфільтратів. Останні оцінювали за складом і локалізацією, а також ступенем і поширеністю відповідно до візуально-аналогової шкали. Склеротичні зміни у стромі включали її фіброз (склероз). Як і у випадку з активними інтерстиціальними змінами, оцінювалася локалізація фіброзу за відношенням до структур нефрона, а також поширеність його — вогнищевий (дрібновогнищевий, великовогнищевий) і дифузний.
Розрізняли активні і хронічні (неактивні) інтраренальні судинні зміни. Активні судинні ураження включали клітинні або запальні інфільтрати в стінці судин. Хронічні (неактивні) зміни включали проліферацію ендотелію, еластофіброз і фіброз (склероз) судин.
Обсяг проведених досліджень наведений у табл. 1.
Для співставлення клініко-морфологічних параметрів використовували розподіл на групи за морфологічним діагнозом ППГН, за обсягом проведеного ІГХД та за окремими клініко-лабораторними показниками.
Для кількісного аналізу отриманих під час дослідження даних використано методи статистичного аналізу. Розрахунки здійснювали з використанням ліцензійних пакетів статистичного аналізу — Statistica 8.0 (StatSoft), MedStat (Альфа) на персональному комп’ютері НР Pavilion dv7. Аналіз кореляції коефіцієнта лінійної регресії поданий у p-значеннях. Значення кореляції коефіцієнта (r) таке: r = 0–0,25 — незначна кореляція або відсутність її; r = 0,25–0,50 — вірогідна помірна кореляція; r = 0,5–0,75 — середній або добрий рівень кореляції; r = 0,75–1 — рівень кореляції від доброго до відмінного.
Коли розподіл не відрізнявся від нормального, для порівняння середніх двох вибірок використовували критерій Стьюдента. При порівнянні частоти виявлення якісних ознак для двох вибірок використовували метод визначення c2. Вірогідними вважали відмінності при р Ј 0,05. У порівняльній характеристиці отриманих даних доказової медицини використовували розрахунок чутливості та специфічності [7].
Результати та їх обговорення
Клініко-морфологічна характеристика гломерулярного ураження нирок наведена в табл. 2 і на рис. 1.
Як видно з табл. 2, показники активності гломерулярного ураження при ППГН мали вірогідні відмінності (р Ј 0,05) залежно від морфологічного субстрату ГН за трьома характеристиками: наявністю еритроцитурії, рівнем протеїнурії, меншим за 1 г/л та тим, що перевищував 2,5 г/л, і наявністю набряків. Еритроцитурія, як і масивна протеїнурія та набряки, частіше зустрічалась при МКГН. Артеріальний тиск значуще не відрізнявся залежно від морфологічного субстрату ППГН, але тенденція до збільшення АТ, як систолічного, так і діастолічного, при МКГН простежується досить чітко.
Оцінка параметрів за ознакою «чутливість» у групах, що демонстрували вірогідні відмінності, показала її дуже високу прогностичну значимість у диференціації клініко-лабораторних проявів МПГН та МКГН. Слід відзначити, чім більш вираженими були клінічні прояви ППГН, тим вища чутливість властива МКГН. Проте в усіх випадках документована статистично вірогідна різниця (р Ј 0,01) між показниками чутливості при МПГН та МКГН. Враховуючи, що наведені ознаки є абсолютно специфічними для ГН, оцінку параметра «специфічність» не проводили.
У табл. 3 і на рис. 2 наведена характеристика клінічних показників при хронічних проявах ППГН.
Як видно з табл. 3, показник «хронічність» при ППГН мав вірогідні відмінності (р Ј 0,05), ШКФ спостерігали в діапазоні 89–30 мл/хв, тобто в тих її значеннях, що мають потенційну спроможність для відновлення функції. Цей факт є надзвичайно важливим для обґрунтування індивідуалізації терапії ГН.
Показник «чутливість» мав вірогідні відмінності (р Ј 0,01) у групах ШКФ 60–89 мл/хв та ШКФ 30–59 мл/хв. Проте чутливість була вищою для МПГН у перший групі і для МКГН — у другій. Така залежність цілком зрозуміла, адже при МКГН спостерігаються більш виражені ураження гломерул та зниження функції клубочкової фільтрації.
Кореляційний аналіз взаємозв’язків морфологічних параметрів «активні зміни» та клінічних ознак активності ППГН продемонстрував позитивну кореляцію 0,76, та в групі «хронічні зміни» — хронічний ППГН за клініко-лабораторними ознаками — 0,79. Вірогідні відмінності документовано для МПГН та МКГН (р Ј 0,01) для активних змін у парах «значна протеїнурія — дифузна проліферація» (r = 0,55, р Ј 0,01), «значна протеїнурія — інфільтрація ПЯЛ» (r = 0,58, р Ј 0,01); «значна протеїнурія — наявність CD 3» (r = 0,49, р Ј 0,05), «наявність набряків — наявність екстракапілярного компонента» (клітинні півмісяці, ексудат, фібрин) (r = 0,48, р Ј 0,01). У групі хронічних змін зниження ШКФ менше 30 мл/хв свідчить про наявність гломерулосклерозу (r = 0,79, p Ј 0,01), зниження ШКФ менше 30 мл/хв — наявність a-SMA (r = 0,52, р Ј 0,01). Інші показники не мали вірогідних відмінностей при кореляційному аналізі.
Наявність ТІК клінічно характеризувалась появою циліндрурії, абактеріальної лейкоцитурії, що відображали активність процесу, та зниженням питомої ваги, що відображала розвиток ХХН–ХНН (табл. 4, 5).
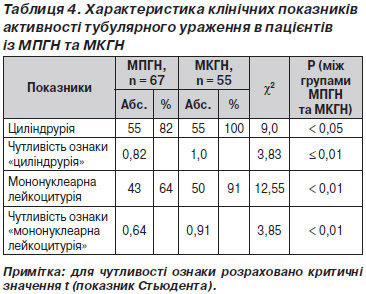
Як видно з табл. 4, при активності ТІК за наявності лейкоцитурії й бактеріурії спостерігали вірогідну відмінність (р Ј 0,05–0,01) у пацієнтів із МПГН та МКГН. При цьому чутливість цього тесту набагато вища для МКГН.
У табл. 5 наведені дані хронічності тубулоінтерстиціальних змін при ППГН.
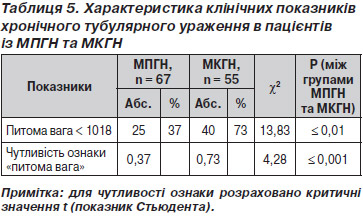
Хронічні прояви ППГН із ТІК супроводжувалися зниженням питомої ваги (р Ј 0,01), що суттєво впливало на рівень ШКФ. Чутливість ознаки була вірогідно вищою (р Ј 0,01) при МКГН, що відображає прогностичну значущість цього показника в прогресуванні ГН.
Слід відзначити, що за морфологічними даними всі відібрані пацієнти мали ТІК різного ступеня вираженості, проте клінічно наявність ТІК була документована лише в 56 % хворих із ППГН, із них у 42 % (28 пацієнтів) — із МПГН і 78 % (43 хворих) — із МКГН. Таким чином, морфологічні ознаки ТІК передували розвитку відповідної клінічної картини. Більше того, за результатами нефробіопсії стало можливим виділити вираженість ТІК (табл. 6).
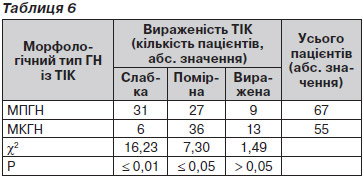
Як видно з табл. 6, при МПГН вірогідно частіше (р Ј 0,01) виявляли слабку вираженість ТІК, тоді як помірний ступінь ураження тубулоінтерстиціального апарату й судин (р Ј 0,05) був більш характерним для МКГН.
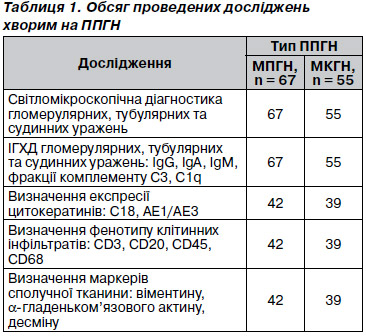
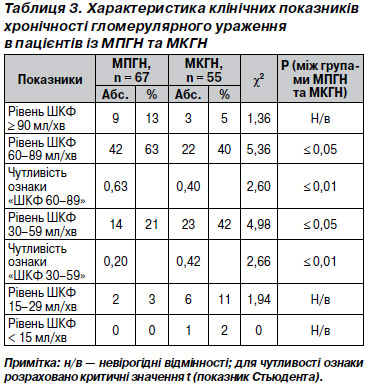
Кореляційний аналіз активних і хронічних проявів ТІК продемонстрував цілу низку вагомих зв’язків. На їх підставі був розроблений кореляційний портрет (рис. 3), що поєднує ступінь вираженості експресії IgG, фракції комплементу С3 в інтенсивно ушкодженому тубулярному епітелії проксимальних канальців, кількість a-SMA, наявність десмину та віментину (рис. 4). Можна очікувати зміни цієї кореляційної плеяди на тлі ефективної терапії за рахунок зменшення кількості a-SMA.
Згідно з отриманими нами даними, розвиток та ступінь ІФ, його поширеність при МКГН (I типу) тісно пов’язаний не тільки із вираженістю гломерулярних ушкоджень, а й із появою та активністю міофібробластів, зникненням епітеліальних маркерів, що свідчить про розвиток феномену епітеліально-мезенхімальної трансформації в ниркових структурах. Сучасне ІГХД дозволяє встановлювати особливості морфогенезу як гломерулярних, так й тубулоінтерстиціальних змін, досліджувати склад клітинних інфільтратів, особливості морфогенезу ІФ. Відокремлення низки морфологічних параметрів, наприклад таких як ІФ, фенотипування клітин інфільтрату, особливості експресії фракцій комплементу, імуноглобулінів, є дуже важливим щодо встановлення прогноз-позитивних та прогноз-негативних параметрів перебігу та наслідку ППГН і визначення адекватної патогенетичної терапії в конкретного хворого.
Нами встановлено, що інтерстиціальний набряк негативно корелював із рівнем ШКФ (r = –0,41, p < 0,005); інтерстиціальні інфільтрати виявили аналогічний рівень кореляції з ШКФ (r = –0,62, p < 0,001), а загальна активність корелювала зі зниженням питомої ваги (r = –0,53, p < 0,001), наявністю лейкоцитурії (r = 0,57, p < 0,001), наявністю протеїнурії понад 1 г/добу (r = 0,48, p < 0,05), зниженням швидкості клубочкової фільтрації менше 89 мл/хв (r = –0,69, p < 0,001).
Цифри склеротичних та фібротичних (неактивних) змін також показали сильну кореляцію з функцією нирки. ІФ негативно корелював із рівнем ШКФ (r = –0,59, p < 0,001); тубулярна атрофія корелювала з рівнем питомої ваги сечі (r = 0,41, p < 0,005) і ШКФ (r = –0,57, p < 0,001); судинний гіаліноз/фіброз також мав кореляцію з рівнем питомої ваги (r = 0,42, p < 0,001) та ШКФ (r = –0,59, p < 0,001); нарешті хронічні зміни тубулоінтерстиціального апарату показали кореляцію з рівнем протеїнурії понад 2,5 г/л (r = 0,5, p < 0,001) та ШКФ (r = –0,65, p < 0,001).
Протеїнурія корелювала лише з судинним гіалінозом/фіброзом, і це була негативна статистично значима кореляція (r = –0,44, p < 0,005). Інші клінічні параметри (АД, рівень гемоглобіну крові, еритроцитурія тощо), що вивчалися протягом дослідження, не показали кореляції з гістологічними даними.
Депозиція IgG у стромі між канальців, тубулярній базальній мембрані та в зонах склерозу позитивно корелювала зі зниженням питомої ваги сечі (r = 0,54, p < 0,001) та ШКФ (r = –0,46, p < 0,005). Депозиція IgM в епітелії канальців, ділянках клітинних інфільтратів позитивно корелювала з активними змінами та рівнем протеїнурії понад 1 г/л (r = 0,56, p < 0,005), проте депозиція IgA не виявила суттєвих кореляційних зв’язків із клінічними ознаками активності і хронічності ППГН (рис. 5–8).
Депозиція фракції комплементу С3 у стромі між канальцями позитивно корелювала з наявністю лейкоцитурії (r = 0,34, p < 0,005), а в ділянках склерозу — негативно з рівнем зниження питомої ваги сечі (r = –0,45, p < 0,005). Депозиція фракції комплементу С1q в епітелії канальців і стромі між канальців виявила позитивну кореляцію з циліндрурією (r = 0,32, p < 0,005).
F.R. Bobetal (2008) навів дослідження, що дозволили встановити кореляцію тубулоінтерстиціальних уражень при різних формах гломерулонефритів із деякими клінічними показниками. Авторам вдалось установити стійку сильну кореляцію інтерстиціального інфільтрату, ІФ, атрофії канальців та гіалінозу судин із рівнем креатиніну сироватки крові. Автори зазначають, що коли йдеться про канальцевий апарат, співставлення сильніше корелюють із проксимальними канальцями, що, імовірно, свідчить про їх більш агресивне ураження. Проте автори не знайшли сильної кореляції між морфологічними змінами в канальцях та клубочках та рівнями АТ, гемоглобіну крові тощо.
Нами встановлено позитивний кореляційний зв’язок між наявністю Т-лімфоцитів (CD3) і вираженістю ТІК за рівнем протеїнурії, лейкоцитурії та зниженням питомої ваги (r = 0,46, p < 0,005), В-лімфоцитів (CD20) та хронічністю змін і зниженням питомої ваги сечі (r = –0,37, p < 0,005) та макрофагів (CD68) і активністю інтерстиціальних змін та зниженням ШКФ (r = –0,34, p < 0,005).
Кореляції між значеннями ІГХД (наявність a-SMA, віментину, десміну) шукали з гістологічними запальними змінами або склеротичними/фібротичними змінами. Стосовно активних запальних змін позитивна кореляція була знайдена з наявністю інтерстиціальних інфільтратів (r = 0,40, p < 0,05) і зниженням питомої ваги сечі (r = 0,35, p < 0,05), але не було знайдено кореляції з інтерстиціальним набряком.
Стосовно склеротичних/фібротичних змін, a-SMA корелював із хронічністю (r = 0,35, p < 0,05) та рівнем ІФ (r = 0,43, p < 0,05). Проте a-SMA продемонстрував слабку кореляцію із канальцевою атрофією (r = 0,27, p < 0,1) та ураженням судин (r = 0,28, p < 0,1).
Також a-SMA корелював з ознаками хронічності ТІК (r = 0,56, p < 0,01). Проте не було кореляції a-SMA з будь-яким клініко-біологічним параметром (рівні АТ, протеїнурія, сироватковий креатинін, ШКФ), хоча протеїнурію вважають одним із основних факторів ініціювання тубулоінтерстиціальних змін при ГН. Білок у просвіті канальців є причиною руйнування епітелію канальців та оголення антигенів (як MHC-II), адгезивних молекул (як інтегрини) та продукції ними медіаторів (як TGF-b), що призводить до ініціювання запалення [8].
Рівні інтерстиціального віментину корелювали здебільшого зі склеротичними/фібротичними змінами на рівні інтерстицію, такими як: ІФ (r = 0,45, p < 0,05), атрофія канальців (r = 0,31, p < 0,05), гіаліноз/фіброз судин (r = 0,3, p < 0,05), і загальними ознаками хронічності (r = 0,4, p < 0,01).
Щодо запальних змін була знайдена кореляція інтерстиціального інфільтрату (r = 0,43, p < 0,05), але вірогідних кореляцій з іншими запальними змінами (наприклад, інтерстиціальний набряк або загальні ознаки хронічності) знайдено не було.
Була виявлена позитивна кореляція вираженості віментину в епітеліальних тубулярних клітинах (r = 0,35, p < 0,05). Слід також зазначити, що на рівні клітин канальців сильнішою є кореляція для проксимальних канальців (r = 0,38, p < 0,01), ніж для дистальних (r = 0,26, p < 0,1).
Негативною була кореляція між рівнем віментину в інтерстиції та рівнем ШКФ (r = –0,38, p < 0,01). Кореляції з протеїнурією були статистично незначущими (r = –0,29, p < 0,1). Також була наявна сильна позитивна кореляція між локалізацією віментину та a-SMA в інтерстиції (r = 0,65, p < 0,001). Зв’язок ступеня вираженості інтерстиціального інфільтрату та рівня креатиніну було встановлено Bajema I.M., Hagen E.C., Hermans J. et al. при МКГН та інших ПГН [9]. На думку інших авторів, основним чинником, що викликає ниркову недостатність при ГН, є тубулярна атрофія [10].
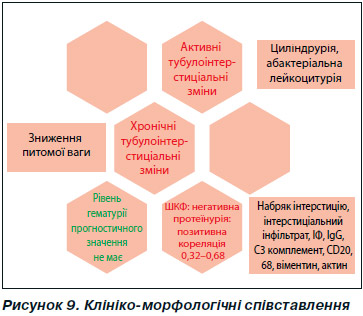
Таким чином, нами були встановлені деякі статистичні кореляції між інтерстиціальними гістологічними елементами хронічності та активності, ІГХ-маркерами та деякими клінічними ознаками, особливо тими, що характеризують функцію нирки (рис. 9).
Krzysztof Okon та інші (2007) встановили, що інтерстиційні та тубулярні параметри мали сильну кореляцію з рівнем креатиніну [11]. Одним із найважливіших оцінюваних показників був об’єм інтерстицію (ОІ), вираженість якого корелювала зі ступенем ниркової недостатності, хоча тубулоінтерстиціальні та судинні фактори також відіграють значну роль. Таким чином, зміна ОІ має найбільший вплив на функцію нирки, навіть беручи до уваги й інші фактори [11].
Сукупний аналіз отриманих даних дозволив запропонувати алгоритм дій, наведений на рис. 9.

Висновок
Таким чином, були встановлені вірогідні статистичні кореляції між інтерстиціальними гістологічними елементами хронічності та активності, ІГХ-маркерами та деякими клінічними ознаками, особливо тими, що характеризують функцію нирки.
Інтерстиціальні гістологічні зміни, особливо ступінь склеротичних та фібротичних змін, корелюють з наявністю інтерстиційних міофібробластів, які виявляються шляхом ІГХД (a-SMA та віментину) та відіграють важливу роль у фіброгенезі. Найбільш вагомими були такі встановлені кореляції: активні тубулоінтерстиціальні зміни при ППГН корелювали зі зниженням питомої ваги сечі (r = –0,53, р < 0,001), наявністю лейкоцитурії (r = 0,57, р < 0,001), наявністю протеїнурії понад 1 г/добу (r = 0,48, р < 0,05), зниженням ШКФ менше 89 мл/хв (r = –0,69, р < 0,001); хронічні тубулоінтерстиціальні зміни при ППГН показали кореляцію з рівнем протеїнурії понад 2,5 г/л (r = 0,5, р < 0,001) та ШКФ менше 60 мл/хв (r = –0,65, р < 0,001).
Конфлікт интересів: не заявлений.
Адреса для контактів: sloni@au.ru (Іванова М.Д.)
Рецензенти:
зав. каф. патоморфології ДонНМУ ім. М. Горького,
д.м.н., професор І.В. Василенко,
професор каф. патоморфології ДонНМУ ім. М. Горького,
д.м.н. Т.І. Шевченко
- Riviera F., Lopez-Gomez J.M., Perez-Garcia R. Spa–nish registry of Glomerulonephritis. Frequency of renal pathology in Spain 1994–1999 // Nephrol. Dial. Transplant. — 2002. — 17. — 1594-160.
- Colvin R.B. Diagnostic Pathology Kidney Diseases. — 2011. — 365 p.
- Thomas D.B. Focal Segmental Glomerulosclerosis: A Morphologic Diagnosis in Evolution // Archives of Pathology & Laboratory Medicine. — February 2009. — Vol. 133, № 2. — Р. 217-223.
- Дядик О.О. Інформаційні характеристики морфогенезу мезангіокапілярного гломерулонефриту на підставі гістологічного та імуногістохімічного дослідження ниркових біоптатів / О.О. Дядик, М.Д. Іванова, О.В. Хмара // Медична інформатика та інженерія. — 2010. — № 3. — С. 48-53.
- McGrogan A., Franssen C.F.M., Vries C.S. The incidence of primary glomerulonephritis worldwide: a systematic review of the literature // Nephrol. Dial. Transplant. — 2011. — V. 26, № 2. — Р. 414-430.
- Дядик О.О. Застосування сучасних морфологічних методів прижиттєвого дослідження нирок у хворих на гломерулонефрит / О.О. Дядик, І.В. Василенко, Т.В. Шатохіна [та ін.]: Матеріали III з’їзду нефрологів України (м. Луганськ, 15–16 жовтня 2009 р.). — 2009. — С. 90-92.
- http://www.surveysystem.com/sscalc.htm
- Joseph Jenkins, Sergey V. Brodsky, Anjali A. Satoskar, Gyongyi Nadasdy, Tibor Nadasdy. The Relevance of Periglomerular Fibrosis in the Evaluation of Routine Needle Core Renal Biopsies // Arch. Pathol. Lab. Med. — 2011. — 135. — 117-122.
- Bajema I.M., Hagen E.C., Hermans J., Noеl L.H. et al. Kidney biopsy as a predictor for renal outcome in ANCA-associated necrotizig glomerulonephritis // Kidney Int. — 1999. — 56. — Р. 1751-1758.
- Jonhson R.J. New insights into the pathogenesis of proteinuria / R.J. Jonhson // Am. J. Kidney Dis. — 2000. — Vol. 36. — № 1. — P. 214-219.
- Krzysztof Okon, Wladyslaw Sulowicz, Olgierd Smolenski, Antoni Sydor, Barbara Chruoeciel, Agnieszka Kirker-Nowak, Zbigniew Rosiek, Krzysztof Syslo, Jerzy Stachura. Interstitial, Tubular and Vascular Factors in Progression of Primary Glomerulonephritis // Pol. J. Pathol. — 2007. — 58, 2. — Р. 73-78.