Газета «Новости медицины и фармации» Гастроэнтерология (419) 2012 (тематический номер)
Вернуться к номеру
Состояние энтерохромаффинных клеток желудка при эрозивном гастрите
Авторы: Т.Д. Звягинцева, профессор, Я.К. Гаманенко, к.м.н. - Харьковская медицинская академия последипломного образования, кафедра гастроэнтерологии
Версия для печати
Эрозивный гастрит относится к достаточно распространенным заболеваниям органов пищеварения и подразумевает определенный спектр дифференциальной диагностики. В литературе широко обсуждается вопрос о роли хеликобактерной инфекции в развитии эрозивных поражений гастродуоденальной зоны. Согласно результатам современных исследований, контаминация слизистой оболочки желудка (СОЖ) Helicobacter pylori (НР) составляет от 66 до 85 % при локализации эрозий в желудке. Тем не менее большинство исследователей не считают данный микроорганизм основным патогенетическим фактором развития хронического эрозивного процесса [1, 5].
В настоящее время является важным изучение роли гормональных факторов в патогенезе эрозивного поражения желудка. Этот интерес обусловлен не только непосредственным влиянием ряда гормонов на репаративные процессы СОЖ, но и участием их в биоритмологических, иммуномодулирующих процессах СОЖ. Кроме того, сама гастродуоденальная зона представляет собой составную часть гастроэнтеропанкреатической гормональной системы, способной синтезировать ряд гормонов, обладающих как органным, так и системным действием. К таким гормонам относят мелатонин, обладающий уникальными адаптативными возможностями, пусковым механизмом, приводящим на начальных этапах к возникновению десинхроноза, за которым следует возникновение органической патологии в СОЖ. Следовательно, сам факт нарушения продукции мелатонина может стать причиной формирования различных висцеральных нарушений, включая эрозивные поражения СОЖ [2, 3, 6].
В настоящее время доказано, что нарушение в межклеточных механизмах энтерохромаффинных клеток (ЕС-клеток) связано с нарушением функциональной морфологии диффузной эндокринной системы (ДЭС). Процессы клеточного обновления ЕС-клеток регулируются ДЭС, поэтому нарушение ее функциональной морфологии может создать предпосылки для воспалительных изменений СОЖ при ХЭЖ [4, 7, 8].
Характер влияния ДЭС на клеточный гомеостаз ЕС-клеток при заболеваниях пищеварительного тракта продолжают изучать. Решение данной проблемы важно тем, что основные процессы повреждения связаны с нарушениями регенераторной функции СОЖ, обусловленными гиперплазией ЕС-клеток, что создает условия для развития и прогрессирования ХЭЖ.
Цель исследования — изучить причины возникновения эрозивного гастрита, основываясь на показателях морфофункциональной активности ЕС-клеток СОЖ и функционирования ДЭС.
Материалы и методы
Нами изучены морфофункциональные особенности ЕС-клеток у 64 пациентов с хронической эрозией желудка (ХЭЖ) в стадии обострения в возрасте от 21 до 40 лет (средний возраст составил 28,30 ± ± 1,75 года), среди них 49 мужчин (76,6 %) и 15 женщин (23,4 %).
Больные были распределены на 2 группы: в I группу вошли 19 (29,7 %) пациентов, у которых ХЭЖ диагностированы впервые, во II группу — 45 (70,3 %) больных с ХЭЖ до 5 лет (во ІІ группе выделены 2 подгруппы: ІІа — 30 (66,7%) человек, в терапии которых применялся препарат группы мелатонина, ІIб — 15 (33,3 %) человек, у которых использовалась антихеликобактерная терапия без применения мелатонина). Все пациенты были адекватно подобраны по возрасту, эндоскопическим, морфологическим и гистохимическим признакам.
Обе группы больных с ХЭЖ обследовали в динамике по единой программе, включавшей клинические методы исследования, фиброгастродуоденоскопию, общее морфологическое и гистохимическое исследование с определением морфофункциональной активности ЕС-клеток. Для оценки характера изменений показателей морфофункциональной активности ЕС-клеток мы сравнивали их с показателями контрольной группы практически здоровых людей. Морфологические изображения, поступающие через оптическую систему микроскопа Nikon Eclipse (увеличение 400, объектив 40, окуляр 10, фильтр 0,8), регистрировали цифровой цветной видеокамерой Nikon DХМ1200, вмонтированной в тубус микроскопа, и передавали в компьютер Pentium-4 с последующим микрофотографированием.
Материал для гистологического исследования забирали из антрального отдела желудка. Для определения НР применяли гистологический метод исследования с окраской по методу Шубича и толуидиновым синим. Степень обсемененности СОЖ НР оценивали по классификационным критериям, предложенным Л.И. Аруином [1].
Для окрашивания ядер ЕС-клеток применили гематоксилин-эозин и толуидиновый синий. При метахроматическом окрашивании светоабсорбционный максимум окрашенного метахроматически образования отличается от абсорбционного максимума красителя. При окраске толуидиновым синим зернышки ЕС-клеток окрашиваются в фиолетово-красный цвет, в то время как другие образования воспринимают оригинальный синий цвет красителя. Обзорные препараты, окрашенные гематоксилин-эозином, использовали для общей оценки состояния ЕС-клеток. Для более углубленного изучения ядерной структуры ЕС-клеток использовали энтерохромаффинную реакцию, для которой характерно выявление в протоплазме зернышек. При применении данного метода энтерохромаффинные клетки окрашиваются в темно-красный цвет. Относительно химического состава зернышек, по новейшим исследованиям, наиболее вероятным является присутствие в них 5-гидрокситриптамина [8].
Для определения уровня морфофункциональной активности ЕС-клеток использовали следующие формулы:

Показатели, характеризующие клеточный гомеостаз ЕС-клеток СОЖ антрального отдела желудка, определяли до проведения комплексной терапии и через 7 ± 4 дня от начала лечения.
Результаты исследования и их обсуждение
В зависимости от уровня концентрации и функционального состояния ЕС-клеток мелатонин проявляет многофазовое действие в механизме возникновения ХЭЖ. Данные факты позволили предположить, что степень тяжести клинического течения ХЭЖ может изменяться в зависимости от нарушения морфофункциональной активности ЕС-клеток СОЖ.
При морфологическом исследовании гастробиоптатов у пациентов I и II групп исчезали участки фиброза, уменьшались просветы желудочных желез, демаркационный вал и инфильтрация периэрозивной зоны. Следовательно, можно констатировать морфологическое подтверждение эпителизации ХЭЖ. Однако в группе сравнения морфологическая картина у 53,4 % больных осталась практически неизмененной, а у 27 % отмечалось усиление полиморфноклеточной инфильтрации в СОЖ.
Проводя контроль эрадикации, мы отметили, что в I группе больных эрадикация HР была достигнута в 82,3 %, во II группе она была выше 85 %, а в группе сравнения — 74,3 %. Таким образом, комбинированная терапия, проводимая курсом длительностью 12 дней, оказывала значимое антихеликобактерное действие, сохраняющееся через 1 месяц после окончания лечения.
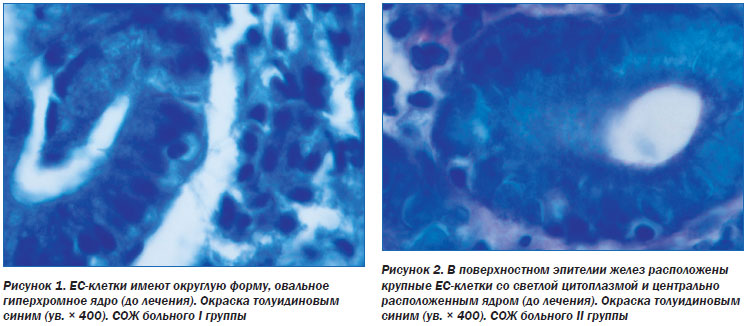
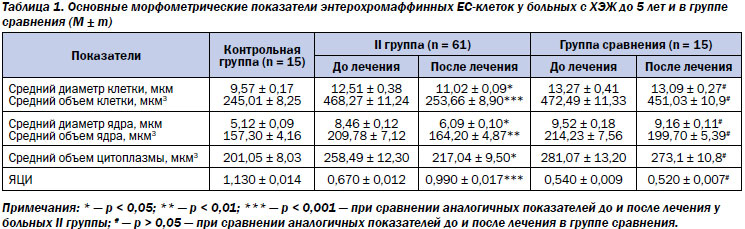
При комплексном изучении морфометрических показателей активности ЕС-клеток у больных I группы они равномерно распределены по всему слою СОЖ среди эпителиальных клеток желез. У больных II группы выявлено усиление деструктивных процессов с увеличением силы воспаления, вплоть до гибели (апоптоза) эндокриноцитов и прилегающих к ним эпителиальных клеток. Наряду с этим отмечено интенсивное выведение из клетки секреторного материала путем растворения секреторных гранул и диффузии секрета через клеточную мембрану. Установлено явное преобладание эндокриноцитов с полигональным ядром и сильно вакуолизированной цитоплазмой (рис. 1, 2). Следовательно, мы наблюдали высокий уровень функциональной активности оставшихся малочисленных эндокриноцитов.
Судя по гистологической картине СОЖ больных II группы, можно предположить, что резкое увеличение потребности в синтезе мелатонина приводит к исчерпанности морфофункциональной возможности ЕС-клеток. Это может быть следствием недостаточной «протекции» в виде эндогенного мелатонина, что является основанием для использования экзогенного мелатонина в комплексной терапии ХЭЖ, так как в оптимальном варианте патогенетическая терапия должна не только быть направлена на эрадикацию бактерий, но и воздействовать на патогенетические механизмы хронизации самого процесса.
Для оценки эффективности влияния комплексной терапии на морфофункциональное состояние клеток ДЭС у больных с ХЭЖ нами проанализирована динамика показателей активности ЕС-клеток только у пациентов II группы и в группе сравнения, так как морфофункциональная картина больных I группы была идентична показателям контрольной группы, что свидетельствует о достаточном мелатонинсинтезирующем уровне ЕС-клеток (табл. 1).
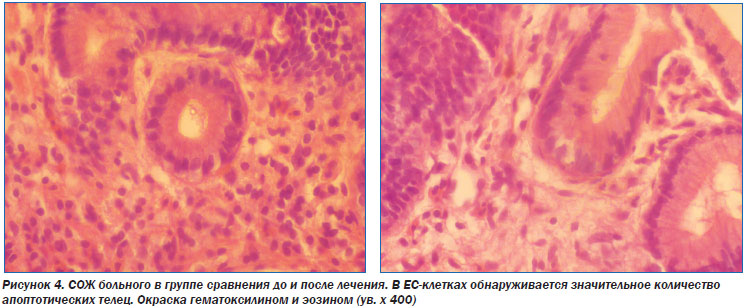
У больных II группы ЕС-клетки расположены более компактно. Отмечается присутствие ЕС-клеток с крупным ядром и эозинофильной цитоплазмой, что также свидетельствует об активном синтезе нейромедиаторов. Выраженность апоптоза намного меньше, чем в группе сравнения (не получавших мелатонин). Это можно объяснить тем, что при использовании комбинированной терапии формируется необходимый уровень мелатонинсинтезирующей функции с удовлетворением потребностей организма за счет вводимого нами мелатонина (рис. 3). После проведенного курса терапии у больных II группы отмечено восстановление морфофункциональной активности ЕС-клеток.
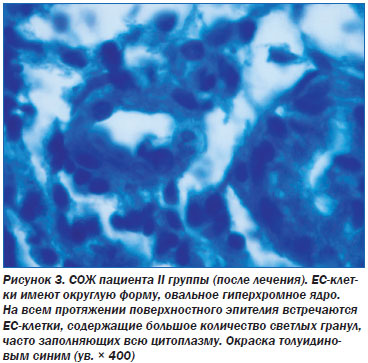
У пациентов группы сравнения в воспалительном инфильтрате на месте погибших ЕС-клеток появляются обширные поля-пустоты, сохраняется высокий уровень функциональной активности оставшихся малочисленных ЕС-клеток. Этот факт может рассматриваться как серьезная причина задержки репаративной регенерации в СОЖ (рис. 4).
Выводы
1. Результат морфологического исследования показал, что снижение цитопротективных свойств и регенераторной функции СОЖ обусловлено гиперплазией ЕС-клеток, что создает условия для развития воспаления и прогрессирования ХЭЖ. Изменение функциональной морфологии ДЭС свидетельствует о патогенетической роли нарушений местного гормонального гомеостаза в формировании воспалительно-дистрофических процессов в СОЖ при ХЭЖ.
2. Развитие ХЭЖ сопровождается изменением морфофункциональных показателей ЕС-клеток. Это, с одной стороны, свидетельствует о сложных эндогенных механизмах развития ХЭЖ, с другой — открывает новые возможности в коррекции развития патологических процессов и в оптимизации их лечения.
3. При использовании в комплексной терапии препаратов группы мелатонина показатели функциональной морфологии ЕС-клеток восстанавливаются в значительно большей мере, чем при применении стандартной антихеликобактерной терапии.
1. Аруин Л.И. Helicobacter pylori и хронизация гастродуоденальных язв // Клиническая медицина. — 2003. — № 2. — С. 60-64.
2. Звягинцева Т.Д., Гаманенко Я.К., Проценко Е.С., Ремнева Н.А. Морфофункциональные особенности ЕС-клеток слизистой оболочки желудка при хронических эрозиях желудка // Гастроэнтерология. — Днепропетровск, 2008. — Вып. 41. — С. 41-50.
3. Осадчук А.М., Коган Н.Ю., Кветной И.М. Показатели пролиферации и апоптоза в патогенезе и прогнозировании течения заболеваний желудка, ассоциированных с H.pylori // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 2007. — № 4. — С. 20-24.
4. Осадчук А.М., Исламова Е.А., Кветной И.М. Роль диффузной эндокринной системы и клеточного гомеостаза эпителиоцитов слизистой оболочки желудка в возникновении и течении язвенной болезни двенадцатиперстной кишки // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 2009. — № 4. — С. 19-24.
5. Свінціцький А.С., Ревенок К.М., Соловйова Г.А., Бардах Л.Б. Сучасні уявлення про патогенез ерозій шлунка // Сучасна гастроентерологія. — 2005. — № 4(24). — С. 5-8.
6. Kedinger M., Lefebvre O., Duluc I. et al. Cellular and molecular partners involved in gut morphogenesis and differentiation // Phil. Trans. Ray. Soc. Lond. — 2002. — Vol. 65, № 19. — P. 847-856.
7. Raikhlin N.T., Kvetnoy I.M., Tolkachev V.N. Melatonin may be synthesized in enterochromaffin cells // Nature. — 2003. — Vol. 255, № 7. — P. 344-345.
8. Talley N.J. Review article: 5-hydroxytryptamine agonists and antagonists in the modulation of gastrointestinal motility and sensation: clinical implications // Aliment. Pharmacol. Ther. — 2004. — Vol. 6, № 8. — P. 27-31