Газета «Новости медицины и фармации» Гастроэнтерология (419) 2012 (тематический номер)
Вернуться к номеру
Сучасні підходи до діагностики та лікування печінкової енцефалопатії у хворих на цироз печінки
Авторы: Є.С. Сірчак, к.м.н. доцент, О.М. Москаль, к.м.н., Е.Й. Архій, д.м.н., професор - Ужгородський національний університет
Версия для печати
У терапії хворих на цироз печінки (ЦП) одне з центральних місць посідають питання лікування і профілактики ускладнень, зокрема печінкової енцефалопатії (ПЕ), що виникає в результаті глибоких метаболічних порушень. За даними аналізу різних досліджень, ПЕ зустрічається у 50–80 % хворих на ЦП, із них виражені клінічні ознаки неврологічних і психічних порушень визначаються тільки у 40–46 % хворих, а у 70–78 % спостерігається латентна (клінічно прихована) форма перебігу ПЕ [19, 23].
Частота латентної ПЕ у хворих на ЦП досягає 50–80 %, тобто є найбільш частим ускладненням захворювання печінки незалежно від його етіології. Однак у літературі є статистичні відомості, що дозволяють приблизно визначити найближчий прогноз хворого з ПЕ [16, 18]. Виживання хворих із ПЕ 0–I стадій при своєчасній госпіталізації та терапії наближається до 100 %. Проте воно значно погіршується з прогресуванням стадії енцефалопатії: при II стадії виживання становить 60–75 %, при III–IV — у середньому 30 % і лише 10–20 % пацієнтів залишаються живими після першого епізоду печінкової коми [2, 15].
Печінкова енцефалопатія у хворих на ЦП може розвинутися у зв’язку із впливом тригерних факторів, до яких зараховують такі: шлунково-кишкові кровотечі, інфекції, в тому числі бактеріальний асцит/перитоніт, прийом седативних препаратів, транквілізаторів, алкоголю, надлишкове вживання тваринних білків, хірургічне втручання з приводу інших захворювань, парацентез із видаленням великої кількості асцитичної рідини [15, 17].
У розвиток ПЕ при ЦП закладені два основних механізми: печінково-клітинна недостатність та шунтування крові. Майже у кожного хворого з порушеннями функції гепатоцитів наявне внутрішньопечінкове шунтування крові [6, 26].
В основі ураження нервової системи при ЦП лежать порушення дезінтоксикаційної функції печінки і/або амінокислотний (АК) дисбаланс. Крім цього, розвитку ПЕ сприяє підвищення проникності гематоенцефалічного бар’єра (ГЕБ). У крові накопичуються продукти окислення АК — феноли, аміни, індоли, які при попаданні в надмірній кількості в центральну нервову систему (ЦНС), проявляють виражену токсичну дію [12, 20]. Також підвищення рівня білірубіну і жовчних кислот у хворих на ЦП проявляє безпосередній токсичний вплив на клітини мозку. За сучасними уявленнями, в більшості випадків головну роль відіграє дія на мозок ендогенних нейротоксинів, що отримали назву медіаторів ПЕ, серед яких основна роль належить аміаку [1].
Отже, ПЕ є результатом дії ендогенних нейротоксинів, що за нормою інактивуються в печінці. При ураженні печінки в крові збільшується вміст приблизно 20 речовин, які потенційно здатні спричинити мозкову дисфункцію. Серед церебротоксичних речовин головне місце посідає аміак — кінцевий продукт білкового метаболізму, а також аміак, що надходить з кишечника у загальний кровоплин по портокавальних анастомозах, минаючи печінку. У подальшому аміак у неіонізованій формі легко проникає через ГЕБ, спричинюючи токсичний вплив на ЦНС.
До групи ендогенних нейротоксинів належать також меркаптани, коротко- та середньоланцюгові жирні кислоти, похідні фенолу, індолу. Меркаптани є продуктами бактеріального гідролізу сірковмісних АК (метіонін, цистеїн, цистин) і локалізуються переважно у товстій кишці. За нормою їх знешкодження відбувається у печінці. При печінко-клітинній недостатності зростає концентрація меркаптанів у крові, і саме вони стають причиною особливого солодкуватого «печінкового» запаху з роту.
Іншою важливою причиною ПЕ є АК дисбаланс, що призводить до синтезу несправжніх нейротрансмітерів [22, 28]. При ЦП відмічається збільшення рівня ароматичних АК — фенілаланіну, тирозину і триптофану, також зниження вмісту АК з розгалуженим бічним ланцюгом — валіну, лейцину, ізолейцину [10, 14]. Згідно з гіпотезою глії, ендогенні нейротоксини та АК-дисбаланс, що виникають внаслідок печінково-клітинної недостатності та/або портосистемного шунтування крові, призводять до набряку та функціонального порушення астроглії, яке, у свою чергу, призводить до збільшення проникності через ГЕБ, зміни активності іонних каналів, порушення процесів нейротрансмісії та забезпечення нейронів макроергічними сполученнями. Ці зміни проявляються симптомами ПЕ [21, 24, 25].
Печінкова енцефалопатія багато в чому визначає психопатологічні особливості пацієнтів із ЦП, якість їх життя і в 20–30 % випадків обумовлює летальний наслідок. Клінічна картина ПЕ характеризується прогресуючим наростанням когнітивних порушень (зниження пам’яті, уваги, концентрації, інтелекту, здібності до рахунку), розладами свідомості, мови [11, 27]. Наростає сонливість, порушується нормальний ритм сну, настає загальмованість, апатія, дезорієнтація в просторі. Зміни особистості проявляються ейфорією, грайливим настроєм, іноді дратівливістю, втратою інтересу до себе. Мова стає сповільненою, невиразною, з багатотонним голосом, розвивається дисфазія. Спостерігається акцентуація особистості, страх, неадекватність поведінки. Вже на ранніх стадіях ПЕ порушується соціальна і домашня адаптація пацієнтів, що знижує якість їх життя [7].
Для оцінки ступеня порушення функції ЦНС при ПЕ прийнято використовувати психометричні тести [11]. Латентна ПЕ діагностується лише за допомогою спеціальних психометричних тестів. Перша стадія ПЕ характеризується розвитком диссомнії: сонливість удень і безсоння вночі. У II стадії ПЕ сонливість наростає, прогресують порушення інтелекту, розвиваються порушення тонкої моторики. Третя стадія ПЕ характеризується приєднанням дезорієнтації в часі і просторі з подальшим прогресуванням порушення свідомості. Четверта стадія ПЕ — власне кома, при якій у пацієнтів на тлі глибокого порушення свідомості відсутні реакції на больові подразники.
Згідно з одним із визначень, ПЕ — це потенційно оборотне порушення функції мозку, що обумовлене метаболічними розладами і виникає внаслідок гострої або хронічної печінково-клітинної недостатності і/або портосистемного шунтування крові. Синдром ПЕ об’єднує комплекс неврологічних і психоемоційних розладів, що виявляються патологічними нервово-м’язовими і нейрофізіологічними порушеннями, зміною свідомості, поведінки, зниженням інтелекту, порушенням мови [4].
Одним із проявів ураження головного мозку при ПЕ є когнітивні розлади (КР). Когнітивні (синоніми — вищі мозкові, вищі психічні, вищі коркові, пізнавальні) функції — це найбільш складні функції головного мозку, за допомогою яких здійснюється процес раціонального пізнання світу і забезпечується цілеспрямована взаємодія з ним [4, 5].
До основних 5 когнітивних функцій зараховують гнозис, праксис, мову, пам’ять та інтелект. Гнозис — сприйняття інформації, здатність поєднувати елементарні відчуття в цілісні образи. Пацієнт із тяжкими порушеннями гнозису (агнозія) бачить предмет, може його описати, але не пізнає його. Пам’ять — здатність відображати, зберігати і багато разів відтворювати отриману інформацію. Необхідно підкреслити, що суб’єктивні скарги хворих на пам’ять не відповідають дійсним її порушенням, виявленим за допомогою спеціальних методів дослідження. Інтелект — здатність до аналізу інформації, виявлення схожості і відмінностей, загального і приватного, головного і другорядного; здатність до абстрагування, рішення задач, побудови логічних висновків. Мова — здатність розуміти звернену мову і виражати свої думки вербальним способом (словами). Праксис — довільна, цілеспрямована рухова дія, здатна засвоювати й утримувати різноманітні рухові навички, в основі яких лежать автоматичні серії рухів. Особи з тяжкими порушеннями праксиса (апраксія) не можуть виконувати ту або іншу дію внаслідок втрати навичок, незважаючи на відсутність парезу [5].
Згідно з класифікацією Н.Ш. Яхно (2005), виділяють легкі, помірні та тяжкі КР. Легкі КР виявляються у зниженні однієї або декількох когнітивних функцій порівняно з початково вищим рівнем (індивідуальна норма), що не впливає на побутову, професійну і соціальну діяльність, у тому числі на найбільш складні її форми. Помірні когнітивні порушення — це розлади однієї або декількох когнітивних функцій, що виходять за рамки середньостатистичної вікової норми, але не викликають дезадаптації, хоча можуть призводити до труднощів у складних і не звичних для пацієнта ситуаціях. Тяжкі КР — це розлади когнітивних функцій, що призводять до повної або часткової втрати незалежності й самостійності пацієнта, тобто викликають професійну, соціальну та/або побутову дезадаптацію [9].
Для клінічної діагностики КР поряд із лабораторно-інструментальними методами дослідження широко застосовується психометричне тестування хворих. Як зазначено вище, психометричне тестування також проводиться для виявлення латентної ПЕ у хворих на ЦП та об’єктивізації психічних розладів при І та ІІ стадіях захворювання. З цією метою застосовують тести, що направлені на визначення швидкості пізнавальної діяльності, наприклад тест зв’язку чисел, символьно-цифровий тест, тести для визначення швидкості й точності тонкої моторики (тест копіювання ліній — (лабіринт)), тести на визначення емоційної сфери (шкала депресії Бека) [8].
Слід зазначити, що ПЕ при ЦП на відміну від енцефалопатії іншого ґенезу (наприклад, у хворих на фоні атеросклерозу судин головного мозку та інші) є оборотним процесом і обумовленим нейротоксичним впливом багатьох метаболітів, що слід ураховувати при комплексній терапії даної категорії пацієнтів [8].
Отже, незважаючи на сучасні досягнення гепатології, проблеми своєчасної діагностики й оптимізації лікування початкових проявів ПЕ, як і раніше, залишаються надзвичайно актуальними. У цьому аспекті визначений інтерес являє комплексний та своєчасний підхід до діагностики ПЕ вже на початкових етапах її формування з метою профілактики прогресування уражень ЦНС із використанням психометричних тестів та визначенням основних показників АК-дисбалансу, що може проявлятися у хворих на ЦП. Також важливе значення має включення в комплексне медикаментозне лікування хворих на ЦП ефективних засобів детоксикації з урахуванням основних патогенетичних механізмів формування ПЕ [13].
Мета роботи — дослідити діагностичні можливості застосування нейропсихометричних тестів для визначення ступенів тяжкості печінкової енцефалопатії у хворих на цироз печінки та їх динаміку під впливом комплексної терапії із застосуванням пребіотиків, пробіотиків та гепатопротектора гепадиф.
Матеріали та методи
Під нашим спостереженням перебували 65 хворих на цироз печінки, які лікувалися у гастроентерологічному відділенні, хірургічній клініці і відділенні анестезіології та інтенсивної терапії ЗОКЛ ім. Андрія Новака м. Ужгорода.
Серед обстежених хворих чоловіків було 38 (58 %), віком 52,5 ± 8,7 року, жінок — 27 (42 %), віком 47,7 ± 5,6 року.
Діагноз ЦП встановлювався з урахуванням скарг, анамнестичних, лабораторних (біохімічний аналіз крові, визначення маркерів вірусів гепатиту В і С) та інструментальних методів дослідження (УЗД органів черевної порожнини, ФЕГДС верхніх відділів шлунково-кишкового тракту).
Порушення функції ЦНС визначали у хворих на ЦП, які були в свідомості та орієнтовані, за допомогою таких тестів [3]:
1. Шкала MMSE (Mini-Mental State Examination) — коротка шкала оцінки психічного статусу, використовується в усьому світі для оцінки стану когнітивних функцій. Вона є достатньо надійним методом первинного скринінгу когнітивних порушень, зокрема деменцій. Результат тесту отримують шляхом сумації балів за кожним із пунктів. Максимальний показник у цьому тесті — 30 балів, що відповідає найбільш високим когнітивним здібностям. Чим менший результат тесту, тим більше виражений когнітивний дефіцит.
2. Шкала самооцінки (Ч.Д. Спілбергера та Ю.Л. Ханіна) — дозволяє шляхом самооцінки визначити рівень тривожності на даний момент (реактивна тривожність як стан) і особистої тривожності (як стала характеристика людини). Реактивна тривожність характеризується напруженням, нервозністю, неспокоєм. Особиста тривожність характеризується схильністю сприймати велике коло ситуацій станом тривоги. Результати оцінюються таким чином: до 30 — низька, 31–45 — помірна, 46 і більше — висока тривожність.
3. Шкала депресії Бека (BDI). Цей опитувальник складається з 21 групи тверджень. Хворим пропонують прочитати уважно і обвести кружком номер (0, 1, 2 або 3) твердження, що найкращим чином відображає їх самопочуття протягом останнього тижня, включаючи сьогодення. Дозволяє охарактеризувати емоційну сферу пацієнтів.
4. Тест копіювання ліній (лабіринт) — оцінюється конструктивна апраксія. Даний тест цікавий ще й тим, що дає уявлення про здатність пацієнта орієнтуватися на місцевості.
5. Тест зв’язку чисел — за допомогою цього тесту оцінюється спроможність до здійснення когнітивних рухів. При виконанні тесту пацієнт з’єднує лінією числа від 1 до 25, що надруковані відповідним чином на аркуші паперу. Оцінюється час, витрачений на виконання завдання.
6. Символьно-цифровий тест — застосовується для оцінки швидкості й точності рухів. Пацієнтові пропонують набір цифр від 1 до 9, кожна з яких асоціюється з відповідним символом, і дають завдання заповнити порожній бланк символами, яким відповідає кожна з цифр. Оцінюється загальне число правильно внесених символів відповідно до цифр протягом 90 секунд. Результат виражається у відсотках.
7. Методика «Числовий квадрат» — застосовується для оцінки об’єму розподілу та переключення уваги. У квадраті з 25 клітинами у випадковому порядку розташовані числа від 1 до 40, причому 15 чисел пропущено. Пацієнт за 90 секунд має закреслити у числовому ряду числа, які відсутні у квадраті. Підраховується кількість правильних відповідей.
8. Тест Мюнстерберга на сприйняття. Серед буквеного тексту розташовані слова (25 слів). Завдання пацієнта таке: проглядаючи рядок за рядком, щонайшвидше знайти ці слова. На виконання завдання дається 2 хвилини. Методика направлена на визначення вибірковості уваги. Оцінюється кількість виділених слів і кількість помилок, тобто пропущених і неправильно виділених слів.
9. Методика «Розстановка чисел». Протягом 2 хвилин хворі повинні розставити у вільних клітинках бланка для заповнення в зростаючому порядку числа, які розташовані у випадковому порядку в 25 клітинках квадрата бланка стимульного матеріалу. Оцінка проводиться за кількістю правильно записаних чисел. Середня норма — 22 і вище. Методика призначена для оцінки довільної уваги.
10. Методика «Пам’ять на числа» призначена для оцінки короткочасної зорової пам’яті, її об’єму і точності. Завдання полягає в тому, що пацієнту демонструється протягом 20 секунд таблиця з дванадцятьма двозначними числами, які потрібно запам’ятати і після того, як таблицю заберуть, записати на бланк. Оцінка короткочасної зорової пам’яті проводиться за кількістю правильно відтворених чисел. Норма дорослої людини — 7 і вище.
11. Методика «Пам’ять на образи» призначена для вивчення образної пам’яті. Суть методики полягає в тому, що хворому експонується таблиця з 16 образами протягом 20 секунд. Образи необхідно запам’ятати і протягом 1 хвилини відтворити на бланку. Оцінка результатів тестування проводиться за кількістю правильно відтворених образів. Норма — 6 правильних відповідей і більше.
Крім цього, для визначення порушень функцій ЦНС хворим на ЦП проводили електроенцефалографічне (ЕЕГ) дослідження та визначення вмісту аміаку у сироватці крові.
Усі хворі на ЦП на фоні дієтичного харчування (стіл № 5 за М.І. Певзнером) отримали базисне лікування із застосуванням гепатопротекторів, сечогінних засобів, дезінтоксикаційної та вітамінотерапії, b-адреноблокаторів та лактулози.
Результати досліджень та їх обговорення
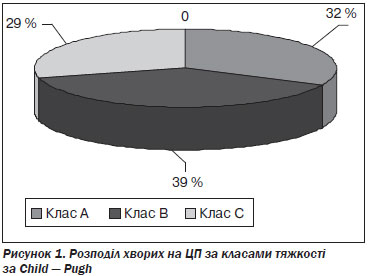
Після проведення клініко-лабораторних обстежень хворих на ЦП розподілили за класами тяжкості за Child — Pugh, ураховуючи рівень білірубіну, альбуміну, протромбіновий індекс та наявність або відсутність асциту і печінкової енцефалопатії. До класу А ввійшов 21 (32 %) хворий (стадія компенсації), до класу В — 25 (39 %) хворих (стадія субкомпенсації), до класу С — 19 (29 %) хворих (стадія декомпенсації). Результати наведені на рис. 1.
Неврологічний статус, стан психічних та когнітивних функцій у хворих на ЦП оцінювали в момент надходження до лікарні та після проведеного курсу терапії (через 1 місяць) за допомогою психометричного тестування, а також ЕЕГ-дослідження та визначення рівня аміаку в сироватці крові.
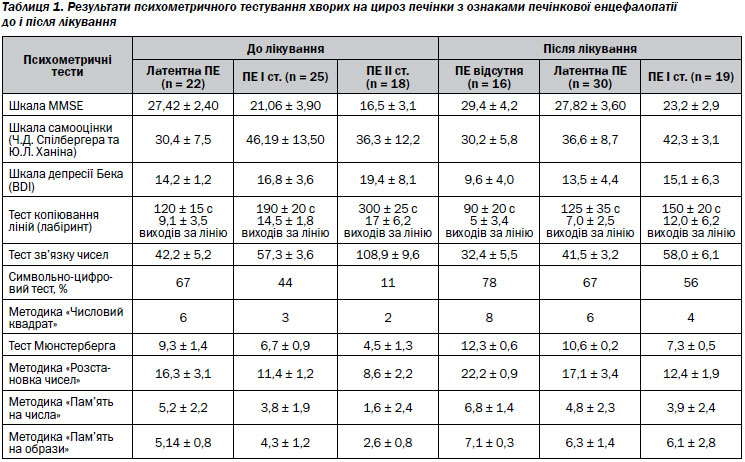
При надходженні до стаціонару у хворих на ЦП спостерігали скарги на головний біль, головокружіння, порушення пам’яті та уваги, утруднення при виконанні практичних навичків, дратівливість, періодичну апатію, тривожність. Результати нейропсихометричного тестування хворих на ЦП до та після лікування наведені в табл. 1.
Аналізуючи отримані результати, бачимо, що серед хворих на ЦП спостерігається порушення інтелекту у вигляді деменції легкого ступеня у пацієнтів із ПЕ І ст. (21 бал), деменції помірного ступеня вираженості у пацієнтів із ПЕ ІІ ст. (16 балів) за шкалою ММSE. Після комплексної терапії за даними шкали оцінки інтелекту ММSE виявлені достатньо суттєві покращення (27 балів у пацієнтів із латентною ПЕ І ст. та 23 бали у пацієнтів із ПЕ І ст.).
За шкалою самооцінки (Ч.Д. Спілбергера та Ю.Л. Ханіна) в обстежених пацієнтів виявлено помірну реактивну тривожність. На нашу думку, це пов’язано з тим, що хворі були збентежені перебуванням у лікарні, станом свого здоров’я. Рівень особистої тривожності серед хворих на ЦП був вищим за норму у хворих на ПЕ І та ІІ ст. і оцінювався як високий.
При дослідженні емоційної сфери за результатами BDI виявлена помірна депресія у хворих на ЦП із ПЕ І і ІІ ст. і м’яка депресія — у хворих із латентною ПЕ, а також більш виражені ознаки помірної і низької депресії, ніж тривожності. Для визначення феноменології депресії при ПЕ у хворих на ЦП всі питання за BDI були згруповані залежно від симптоматики, яку вони оцінювали. Під час аналізу результатів тестування за BDI виявлена істотна частка відповідей на питання, що характеризують когнітивні, апатичні (№ 13, 15, 17) та соматичні прояви депресії (№ 16, 18, 19).
У хворих із ПЕ значною мірою страждає оптико-просторова діяльність, одним із варіантів порушення якої є конструктивна апраксія, що може оцінюватися за тестом визначення швидкості й точності тонкої моторики рук, так званому тесту копіювання ліній (лабіринт). При проведенні тесту копіювання ліній виявили явно виражену конструктивну апраксію у хворих на ЦП, при цьому показники становили 200 та 300 секунд, а число виходів за межі ліній — 9–17. Тести на здатність рухатися по лінії цікаві тим, що дають уявлення про здатність пацієнта орієнтуватися на місцевості. На фоні лікування препаратом гепадиф хворі виконали тест копіювання ліній із меншою кількістю виходів за лінію, що характеризує покращення швидкості й точності тонкої моторики рук.
Швидкість пізнавальної діяльності досліджувалася за допомогою тесту зв’язку чисел і символьно-числового тесту. При проведенні тесту зв’язку чисел із отриманих результатів виявилось, що жоден із хворих не справився із завданням (тобто латентна ПЕ спостерігалася після закінчення тесту від 15–30 секунд). Хворі давали відповіді в 3 рази повільніше, ніж за нормою (до 15 секунд). На фоні комплексної терапії скоротився час проведення тестів, а також кількість допущених помилок.
Після проведення методики «Числовий квадрат» отримали такі результати: хворі до лікування дали від 6 до 2 правильних відповідей. Саме ця методика викликала у хворих найбільшу кількість запитань. Хоча всі тести проводилися з інтервалом 15–20 хвилин, однак для того, щоб хворі відпочили і сконцентрували увагу, умови цього тесту доводилося роз’яснювати декілька разів.
Характеризуючи отримані дані, встановили, що достатньо виражені розлади у вигляді порушення пам’яті, уваги у хворих із ПЕ зменшуються або зовсім зникають на фоні терапії з використанням пребіотиків, пробіотиків та комбінованого гепатопротектора. На прикладі методик Мюнстерберга (тест на вибірковість уваги) та «Розстановка чисел» (тест на довільну увагу) спостерігається покращення концентрації уваги, особливо у пацієнтів із ІІ та І ст. печінкової енцефалопатії.
Для оцінки короткочасної зорової пам’яті, її об’єму і точності використовували тест «Пам’ять на числа», а тест «Пам’ять на образи» — для дослідження образної пам’яті, причому пам’ять на числа страждає більше, ніж пам’ять на образи. Після лікування спостерігали значне покращення пам’яті на образи та меншою мірою — покращення пам’яті на числа.
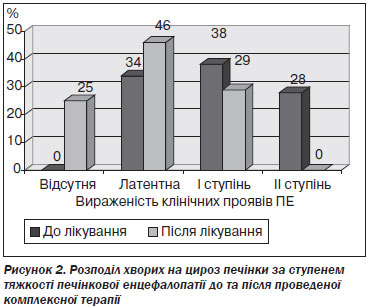
Після узагальнення результатів проведених тестів у всіх хворих на ЦП виявили субклінічні та клінічні прояви ПЕ до лікування. Зміна частоти виявлення кількості пацієнтів із скаргами на когнітивні та емоційні порушення до і після лікування та їх розподіл за ступенем тяжкості печінкової енцефалопатії наведені на рис. 2.
Виявлені зміни когнітивної сфери, неврологічного статусу й емоційного стану розвинулися на фоні досить виражених змін показників ЕЕГ та підвищення концентрації аміаку в сироватці крові.
У хворих на ЦП до лікування рівень аміаку сироватки крові становив 43,7 ± 0,7 мкмоль/л (за нормою 26,3 ± ± 0,8 ммоль/л), а після проведеної терапії спостерігали його зменшення до 31,9 ± 1,1 мкмоль/л.
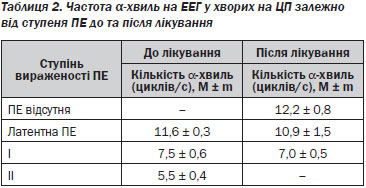
При енцефалографічному обстеженні у хворих на ЦП після лікування було виявлено зменшену кількість a-хвиль, а також патологічні D- та Q-хвилі (табл. 2).
Отже, отримані дані свідчать про значні зміни когнітивної сфери, неврологічного статусу й емоційного стану у хворих на цироз печінки з проявами печінкової енцефалопатії. У роботі продемонстровано, що у пацієнтів із ПЕ спостерігаються виражені зміни неврологічної симптоматики, що виникають унаслідок дисметаболічних порушень і токсичного впливу аміаку при цирозі печінки. Також відомо, що при ЦП до патологічних змін і набряку нейроглії приєднується й ішемія нейронів головного мозку, що клінічно проявляться комплексом неврологічних і в першу чергу когнітивних та психологічних порушень.
Використання нейропсихометричних тестів для виявлення когнітивних, психологічних та рухових розладів у хворих на ЦП є ефективним методом діагностики порушень ЦНС, що підтверджується і при визначенні ЕЕГ-даних пацієнтів. Але встановлення клінічного діагнозу ПЕ не повинне ґрунтуватися тільки на результатах якогось одного тесту, вибіркова інтерпретація даних лише окремих психометричних тестів має орієнтовний характер. Разом із кількісною обробкою результатів необхідно проводити і їх якісний аналіз. Крім того, слід індивідуально підходити до інтерпретації результатів дослідження у пацієнтів із вираженими мовними порушеннями, руховими розладами, порушеннями слуху і зору.
Оцінка когнітивних функцій при ПЕ різного ступеня тяжкості вимагає також особливого підходу, оскільки у таких пацієнтів, як правило, спостерігаються явища зворотного когнітивного порушення, що редукуються у міру зникнення афектної симптоматики. Для об’єктивізації дійсного рівня ПЕ у хворих на ЦП необхідно обстежувати їх у динаміці, на фоні комплексної дезінтоксикаційної терапії.
На наш погляд, комплексна терапія з використанням пребіотиків, пробіотиків та комбінованих гепатопротекторів виявилася ефективним методом лікування хворих на цироз печінки. Поряд із покращенням загальної симптоматики у досліджених пацієнтів спостерігали і значну позитивну динаміку клінічних проявів ПЕ зі зниженням когнітивних розладів, покращенням психоемоційного стану, рухових порушень у хворих на ЦП, що підтверджується позитивною динамікою проведеного комплексного нейропсихометричного тестування та ЕЕГ-дослідження.
Висновки
1. У хворих на цироз печінки з проявами печінкової енцефалопатії виявляються значні зміни когнітивної функцій та нейропсихічного статусу.
2. Комплексне використання нейропсихометричних тестів є ефективним методом діагностики клінічних ознак печінкової енцефалопатії у хворих на цироз печінки на ранніх етапах її формування.
3. Комплексна терапія із застосуванням пребіотиків, пробіотиків та комбінованих гепатопротекторів — ефективний метод лікування клінічних ознак печінкової енцефалопатії у хворих на цироз печінки.
1. Богомолов П.О. Коррекция печеночной энцефалопатии: патофизиологические основы применения пребиотиков / П.О. Богомолов, А.В. Петраков // Consilium medicim. — 2006. — № 7. — С. 42-47.
2. Буеверов А.О. Трудные вопросы диагностики и лечения печеночной энцефалопатии / А.О. Буеверов, М.В. Маевская // Клинические перспективы гастроэнтерологии, гепатологии. — 2005. — № 1. — С. 9-15.
3. Визначення нейропсихічних порушень у хворих на цироз печінки із проявами печінкової енцефалопатії та методи їх корекції / В.І. Русин, Є.С. Сірчак, М.М. Івачевський, О.І. Петричко // Науковий вісник Ужгородського університету, серія «Медицина». — 2011. — Вип. 40. — С. 137-144.
4. Маньковский Н.Б., Карабань Н.В., Карасевич Н.В., Карабань И.Н. Влияние препаратов с ноотропной активностью на нейропсихологический статус пациентов с болезнью Паркинсона // Здоров’я України. — 2008. — № 4(185). — С. 22-23.
5. Бачинська Н.Ю., Демченко О.В., Полєтаєва K.M. та ін. Застосування препарату Прамістар у хворих похилого віку із синдромом помірних когнітивних порушень судинного генезу // Здоров’я України. — 2008. — № 20. — С. 47-49.
6. Иванов А.Г. Диагностические критерии эффективности криофереза в комплексной терапии печеночной энцефалопатии // Клинические перспективы гастроэнтерологии, гепатологии. — 2007. — № 5. — С. 23-26.
7. Иванов А.Г. Медицинские аспекты качества жизни у больных циррозом печени / А.Г. Иванов, В.А. Зорина // Материалы 12-го Международного Славяно-Балтийского научного форума «Санкт-Петербург — Гастро-2010» // Гастроэнтерология Санкт-Петербурга. — 2010. — № 2–3(117). — С. 35.
8. Кузнецова С.М. Дисциркуляторная энцефалопатия в вопросах и ответах: практикум для специалистов // Здоров’я України. — 2010. — № 11–12 (240–241). — С. 66.
9. Кушнір Г.М. Клінічні й патогенетичні особливості цефалгічного синдрому у осіб із стабільною артеріальною гіпотензією / Г.М. Кушнір, А.А. Мікляєв // Международный неврологический журнал. — 2009. — № 5(27). — С. 25-27.
10. Линевский Ю.В. Возможности флавоноидных изомеров силимарина в лечении заболеваний печени / Ю.В. Линевский, К.Ю. Линевская, К.А. Воронин // Новости медицины и фармации. — 2009. — № 304. — С. 37-38.
11. Мурашко Н.К. Междисциплинарная проблема: цереброваскулярные мишени при артериальной гипертензии / Н.К. Мурашко, Л.П. Босенко, В.В. Яворский // Здоров’я України. — 2010. — № 3(232). — С. 54-56.
12. Мунтяну В.И., Буторов И.В., Бодруг Н.И., Гуцу В.В. Опыт применения «Сорбилакта» при печеночной энцефалопатии // Сучасна гастроентерологія. — 2006. — № 6(32). — С. 36-39.
13. Передерий В.Г. Сравнительная эффективность применения гепатопротекторов при хронических диффузных заболеваниях печени / В.Г. Передерий, В.В. Чернявский, В.П. Шипулин // Сучасна гастроентерологія. — 2008. — № 3. — С. 81-83.
14. Харченко Н.В., Анохіна Г.А., Опанасюк Н.Д. та ін. Печінкова енцефалопатія: особливості медикаментозного та дієтичного лікування // Сучасна гастроентерологія. — 2010. — № 6(56). — С. 68-72.
15. Полунина Т.Е. Печеночная энцефалопатия. Алгоритм дифференциальной диагностики и тактика ведения / Т.Е. Полунина, И.В. Маев // Здоров’я України. — 2010. — № 2. — С. 21.
16. Радченко В.Г. Латентная печеночная энцефалопатия: возможности терапии / В.Г. Радченко, А.Н. Суворов, Л.А. Тетерина // Материалы 12-го Международного Славяно-Балтийского научного форума «Санкт-Петербург — Гастро-2010» // Гастроэнтерология Санкт-Петербурга. — 2010. — № 2–3(261). — С. 77-78.
17. Хазанов А.И., Плюснин С.В., Васильев А.П. и др. Различные формы большой печеночной недостаточности: клинические особенности и исходы // Российский журнал гастроэнтерологии, гепатологии и колопроктологии. — 2008. — № 2. — С. 18-27.
18. Роль скрытой печеночной недостаточности в патогенезе послеоперационного желчного перитонита // Клінічна хірургія. — 2008. — № 2. — С. 12-14.
19. Скрыпник И.Н. Роль и место Актовегина в комплексной терапии заболеваний органов пищеварения // Здоров’я України. — 2010. — № 13–14 (242–243). — С. 34-36.
20. Степанов Ю.М. Место «Эссенциале форте Н» в терапии неалкогольных стеатогепатитов / Ю.М. Степанов, А.Ю. Филиппова // Сучасна гастроентерологія. — 2006. — № 6. — С. 61-63.
21. Сулима Д.Л. Оценка клинической эффективности искусственной вентиляции легких у больных с печеночной недостаточностью при хронических вирусных гепатитах // Клинические перспективы гастроэнтерологии, гепатологии. — 2008. — № 6. — С. 17-22.
22. Хлынов И.Б. Эффективность и безопасность нутритивной поддержки при печеночной энцефалопатии / И.Б. Хлынов, М.В. Чикунова, Т.В. Лисовская // Клинические перспективы гастроэнтерологии, гепатологии. — 2009. — № 4. — С. 36-39.
23. Данилюк С.В., Лысенко Г.И., Вакуленко Е.Ф. и др. Целесообразность и эффективность включения эссенциальных фосфолипидов в комплексное лечение больных циррозом печени с начальными проявлениями печеночной энцефалопатии // Новости медицины и фармации. — 2009. — № 294. — С. 14-17.
24. Шалаева И.В. Нарушение обмена аминокислот // Новости медицины и фармации. — 2009. — № 304. — С. 100-101.
25. Шипулин В.П. Натуральный лейкоцитарный интерферон альфа в лечении хронического вирусного гепатита: европейский клинический опыт // Здоров’я України. — 2007. — № 4(161). — С. 24-25.
26. De Alwis N.M. Non-alcoholic fatty liver disease: the mist gradually clears // N.M. De Alwis, C.P. Day // J. Hepatol. — 2008. — № 48 (Suppl. 1). — P. 1004-1012.
27. Donato F., Gelatti U., Limina R.M., Fattovich G. Souther Europe as an example of interaction between various enviror mental factor: a systemic revoew of the epidemiologic evidence // Oncogene. — 2006. — № 25. — Р. 3756-3770.
28. Szalay Ferenc Nem-alkoholos steatohepatitis (NASH) — az ъj jбrvбny // Magyar Belorvosi Archivum. — 2007. — № 3. — Р. 207-209.