Газета «Новости медицины и фармации» Неврология (420) 2012 (тематический номер)
Вернуться к номеру
Роль антидепрессантов в лечении хронического болевого синдрома
Важнейшей причиной обращения пациентов за медицинской помощью является боль. Она сопутствует большинству заболеваний и патологических состояний. С одной стороны, боль — приспособительная реакция, направленная на мобилизацию защитных сил организма, однако интенсивная острая или хроническая боль сама становится мощным патогенным фактором, приводящим к резкому ограничению активности, нарушению сна, значительно снижая качество жизни пациента.
17–19 мая в г. Ужгороде состоялась VI научно-практическая конференция «Карпатськi читання», в рамках которой была проведена школа клинических нейронаук, посвященная вопросам диагностики и лечения болевых синдромов в неврологии и инсультологии.
С докладом «Постинсультный болевой синдром» выступил В.Н. Мищенко (Институт неврологии, психиатрии и наркологии, г. Харьков).
В современном мире сосудистые заболевания головного мозга — огромная медико-социальная проблема. Это обусловлено высоким уровнем заболеваемости, смертности и инвалидности населения. В структуре сосудистых заболеваний ведущее место принадлежит мозговому инсульту — 150–200 случаев на 100 тысяч населения. Ежегодно около 16 млн больных впервые заболевают мозговым инсультом, а около 7 млн людей умирают вследствие него. Лишь 10–20 % лиц, перенесших инсульт, возвращаются к труду, а 20–43 % больных требуется посторонняя помощь.
Достаточно частое последствие мозгового инсульта — постинсультная боль, которую отмечают от 11 до 53 % пациентов. Самыми распространенными типами хронической боли после инсульта являются костно-мышечная боль — в 40 % случаев, боль в области плечевого сустава — 20 %, головная боль — 10 %, центральная постинсультная боль (ЦПИБ) — 10 %, болезненная спастичность — 7 %.
Центральная постинсультная боль представляет собой болевой синдром, который развивается после острой цереброваскулярной катастрофы. Он характеризуется болью и чувствительными нарушениями в тех частях тела, которые соответствуют области головного мозга, поврежденной сосудистым очагом. Центральную постинсультную боль относят к группе хронических болевых расстройств, которые объединены в понятие «центральная нейропатическая боль» (Henriett K., Nanna B. еt al., 2009).
Центральная нейропатическая боль возникает как прямое следствие повреждения или заболевания, поражающего центральную соматосенсорную систему, а также в результате патологического воздействия на спиноталамокортикальные пути центральной нервной системы.
Наиболее частыми причинами центральной нейропатической боли являются: ишемический и геморрагический инсульты, рассеянный склероз, травма спинного мозга, сосудистые мальформации, сирингомиелия, объемные образования головного и спинного мозга, эпилепсия, инфекционное поражение головного мозга (энцефалит). Среди всех нозологических форм поражения нервной системы распространенность нейропатической боли при мозговом инсульте составляет 8–10 % (Яхно Н.Н., Кукушкин М.Л., Давыдов О.С., 2008 г.).
Концепцию центральной постинсультной боли впервые выдвинул Edinger в 1891 году. Через 15 лет Дежерин и Русси в своей знаменитой работе «Таламический синдром» привели описание центральной постинсультной боли. Она характеризовалась как сильная, стойкая, приступообразная, часто нестерпимая, возникающая на стороне гемиплегии, при которой лечение обезболивающими средствами не давало эффекта. При патоморфологическом исследовании у 3 из 8 пациентов были выявлены очаги в таламусе и в заднем бугре внутренней капсулы. В 1911 году Head и Holmes подробно описали снижение чувствительности и болевые ощущения у 24 пациентов с инсультом, клинические симптомы которого свидетельствовали о поражении зрительного бугра и сопровождались центральной болью. В 1938 году Riddoch дал описание клинических проявлений боли таламического и экстраталамического происхождения.
С позиции патофизиологии центральная нейропатическая боль возникает при повреждении ЦНС с вовлечением ноцицептивных структур, что приводит к изменению ноцицептивных нейронов, а также к снижению активности антиноцицептивных нисходящих влияний. Возможным механизмом развития центральной постинсультной боли является функциональный дисбаланс между латеральными и медиальными отделами ноцицептивной системы, а также нарушение контроля корковых и таламических структур над поступающей болевой информацией. ЦПИБ может возникать при поражении соматосенсорных путей головного мозга на любом уровне, включая продолговатый мозг, таламус и кору головного мозга.
Таким образом, в патофизиологии центральной постинсультной боли играют важную роль:
1. Центральная сенситизация, являющаяся причиной хронической боли.
2. Нарушение в виде гипервозбудимости и активности в спиноталамическом тракте.
3. Очаг в латеральном таламусе, который прерывает подавляющие пути и вызывает растормаживание медиального таламуса (теория растормаживания).
4. Изменения в таламусе, поскольку он играет роль генератора боли и в нем происходит потеря тормозящих ГАМК-содержащих нейронов и активизация микроглии.
По данным MacCoulan et al., 1997 г., частота развития центральной постинсультной боли зависит от локализации мозгового инсульта. Как правило, она возникает при латеральном инфаркте продолговатого мозга (синдром Валленберга) и при поражении задневентральной части таламуса.
Таламический инфаркт характеризуется триадой симптомов: антероградной амнезией, нарушением восприятия информации и пространственными нарушениями. При инфаркте в зоне кровоснабжения парамедианных таламико-субталамических артерий наблюдается острое нарушение сознания. Возможна гиперсомния: больные пробудимы, но могут впадать в глубокий сон вскоре после прекращения стимуляции. Они испытывают апатию, безразличие, отсутствие мотивации. Выявляется глазодвигательный вертикальный парез.
При больших размерах очага инфаркта в парамедиальном таламусе присоединяется афазия, преходящая или стойкая деменция. Очаги, симметрично расположенные в парамедиальном таламусе, вызывают синдром расторможенности, включающий в себя маниакальный делирий, инфантильность или синдром Kluver — Bucy.
Для клинической картины ЦПИБ характерно ее возникновение сразу после инсульта или через несколько месяцев после него. Боль возникает в правой или левой половине тела, хотя у некоторых больных может быть локальной: в одной руке, ноге или области лица. Носит хронический, тяжелый, стойкий характер. Иногда возникает спонтанно либо обусловлена действием раздражителя. Пациенты характеризуют ее как жгучую, ноющую, леденящую, сдавливающую, пронизывающую, стреляющую, мучительную, изнуряющую. Обязательным симптомом ЦПИБ является нарушение чувствительности: температурной, болевой, реже тактильной или вибрационной, по типу гипестезии или гиперестезии. Боль значительно влияет на качество жизни пациентов, нарушает сон, ухудшает эффективность реабилитации.
Нейропатический болевой синдром характеризуется симптомокомплексом специфических чувствительных расстройств, таких как аллодиния (появление боли в ответ на неболевой стимул), гипералгезия (повышенная чувствительность к болевому стимулу), гиперестезия (повышенный ответ на тактильный стимул), гипестезия (выпадение тактильной чувствительности), гипалгезия (снижение болевой чувствительности), ощущение онемения, ползания мурашек.
Среди диагностических критериев центральной постинсультной боли выделяют обязательные и вспомогательные.
К обязательным диагностическим критериям ЦПИБ относятся:
1. Локализация боли соответственно очагу поражения в центральной нервной системе.
2. Анамнез, свидетельствующий об инсульте, и появление боли одновременно с инсультом либо позднее.
3. Подтверждение наличия патологического очага в ЦНС при визуализации либо негативные или позитивные чувствительные симптомы, которые ограничены областью, соответствующей очагу.
4. Другие причины боли, такие как ноцицептивная или периферическая нейропатическая боль, исключают либо считают маловероятными.
Вспомогательные диагностические критерии:
1. Отсутствие причинной связи с движением, воспалением или другими видами местного повреждения тканей.
2. Болевые ощущения носят жгучий, ноющий, давящий, покалывающий характер. Возможна боль, напоминающая укус насекомого, электрический разряд, болезненный холод.
3. Наличие аллодинии или дизестезии при воздействии холода или прикосновении.
В оценке клинических случаев на предмет соответствия критериям ЦПИБ используется следующая система:
1. Исключение других потенциальных причин боли. Другие явные причины боли отсутствуют.
2. Боль имеет четкую и анатомически обоснованную локализацию. Она локализуется унилатерально очагу в ЦНС на теле и/или лице либо унилатерально на теле с контралатеральным вовлечением лица.
3. Анамнез, свидетельствующий об инсульте. Неврологическая симптоматика развилась внезапно; боль появилась одновременно с инсультом либо позднее.
4. Выявление четких и анатомически обоснованных нарушений при клиническом неврологическом осмотре. При данном осмотре пациента выявляют нарушение чувствительности (с положительным или отрицательным знаком) в болезненной области. Боль локализуется в зоне чувствительных нарушений, а ее расположение может быть анатомически обосновано локализацией очага поражения в ЦНС.
5. Выявление соответствующего сосудистого очага при помощи методов нейровизуализации. При проведении КТ или МРТ визуализируют патологический очаг, который может объяснить локализацию нарушений чувствительности.
Таким образом, диагноз ЦПИБ основывается на данных анамнеза болезни, результатах клинико-неврологического обследования. Учитываются сведения о начале боли, ее характере, наличии дизестезии или аллодинии, чувствительных нарушений. Используется визуально-аналоговая шкала для оценки боли, а также данные нейровизуализации (КТ или МРТ головного мозга).
Согласно рекомендациям Европейской федерации неврологических обществ по фармакотерапии нейропатического болевого синдрома (2010 г.), в лечении ЦПИБ используют следующие группы лекарственных препаратов: антидепрессанты, антиконвульсанты (агонисты Са каналов — габапентин, прегабалин; блокаторы Na каналов — карбамазепин), опиоидные анальгетики, местные лекарственные препараты (лидокаин и др.), антагонисты NMDA-рецепторов (кетамин, мемантин, амантадин), а также нейростимуляцию.
На основании большого опыта врачей, занимающихся этой проблемой, а также данных плацебо-контролируемых исследований установлено, что наи-более эффективным подходом при лечении ЦПИБ является назначение антидепрессантов.
Механизм действия антидепрессантов заключается в блокаде обратного нейронального захвата моноаминов (серотонина, норадреналина) в ЦНС. Наибольший анальгетический эффект отмечен у амитриптилина. Выраженными анальгетическими свойствами обладают дулоксетин, венлафаксин, пароксетин. Развитие анальгетического эффекта при лечении антидепрессантами пациентов с болевыми синдромами связывают с увеличением тонической активности антиноцицептивной системы, которое происходит в результате серотонин- и норадренергического торможения ноцицептивных нейронов вследствие угнетения обратного захвата моноаминов пресинаптическими окончаниями. Это приводит к накоплению медиаторов в синаптической щели и увеличению эффективности моноаминергической синаптической передачи. Помимо собственно обезболивающего действия, антидепрессанты потенцируют влияние наркотических анальгетиков, повышая их сродство к опиоидным рецепторам.
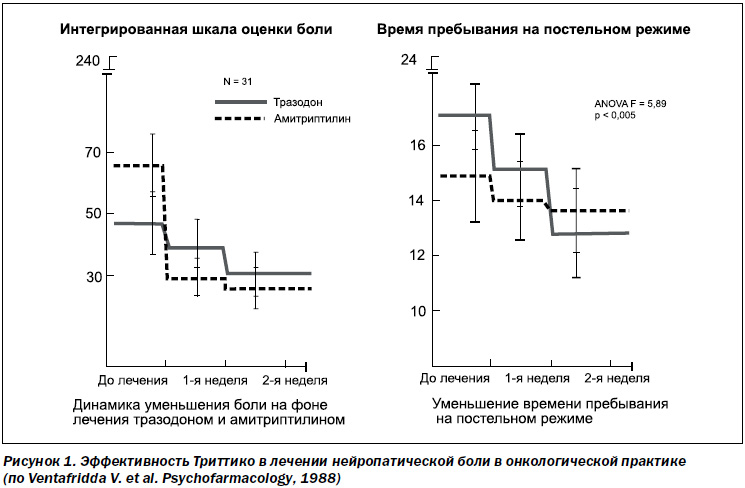
Было проведено 17 исследований по изучению эффективности и безопасности 10 антидепрессантов в лечении нейропатического болевого синдрома. В ходе этих исследований было установлено, что нет существенной разницы в эффективности антидепрессантов с различным механизмом действия. Венлафаксин и дулоксетин, относящиеся к группе ингибиторов обратного захвата серотонина и норадреналина, продемонстрировали эффективность в лечении диабетической полинейропатии. Тразодон (Триттико) в дозировке 50–300 мг/сут показал в ряде исследований свою эффективность в лечении болевого синдрома при таких состояниях, как фибромиалгия (Molina-Barea R. еt al., 2008), диабетическая нейропатия (Wilson R.C., 1999), мигренозные боли (Brewetton T.D. et al., 1988), хроническая боль (Ventafridda V. еt al., 1988, рис. 1).
Так, в дозе до 225 мг/сутки Триттико не уступал по анальгетическому эффекту амитриптилину в лечении боли в онкологической практике. При этом прием Триттико обеспечивал тяжелым онкологическим пациентам достоверно меньшее время пребывания в стационаре, возможность вести активный образ жизни без боли и побочных эффектов, которые возникают при приеме амитриптилина (рис. 1).
Тразодон — это современная альтернатива амитриптилину в комплексном лечении пациентов с хроническим болевым синдромом.
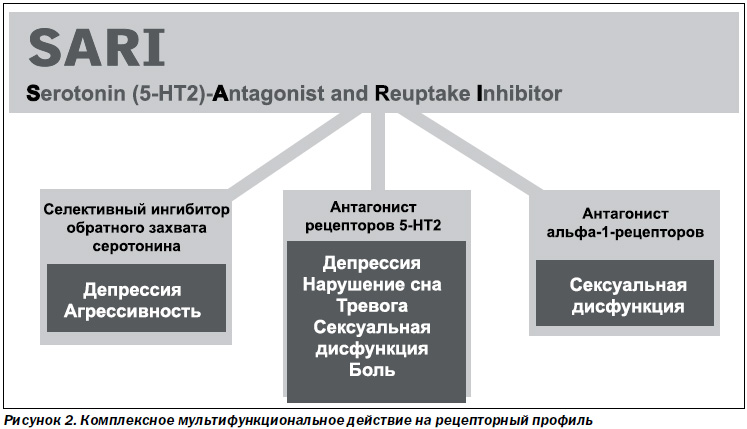
Коллегией Всемирного конгресса по нейропсихофармакологии (Канада, Монреаль, 2002 г.) тразодон (Триттико) определен как атипичный антидепрессант с преимущественным седативным и анксиолитическим действием, первый и единственный представитель антагонистов рецепторов к серотонину 2-го типа и ингибиторов обратного захвата серотонина (SARI) в Украине. По своим фармакологическим показателям тразодон относится к группе антагонистов серотониновых рецепторов (5-НТ) и селективных ингибиторов обратного захвата серотонина (СИОЗС). Из всех свойственных ему видов лекарственного воздействия блокада серотониновых рецепторов выражена сильнее по сравнению с угнетением обратного захвата серотонина. Тразодон (Триттико) действует как антагонист на серотониновые рецепторы 2А-подтипа и как частичный агонист 5-НТ1А-рецепторов. Это обусловливает его применение при депресии, нарушении сна, при тревоге, сексуальных дисфункциях. Препарат также обладает выраженным влиянием на альфа-1-адренергические рецепторы и менее мощно ингибирует обратный захват серотонина (Stephen M., Stahl M., рис. 2).
Таким образом, тразодон благодаря уникальному комплексному мультифункциональному действию на рецепторный профиль обеспечивает мощный антидепрессивный и анксиолитический эффект в сочетании с восстановлением нарушений сна, в том числе обусловленных приемом СИОЗС.
Тразодон (Триттико) имеет мощный доказанный антидепрессивный эффект, что очень важно для постинсультных больных. По данным разных авторов, частота развития постинсультной депрессии колеблется от 25 до 79 %. Причем важно отметить, что ее развитие возможно как в ранние, так и в поздние сроки после инсульта, хотя максимальная частота депрессивных эпизодов регистрируется в восстановительном периоде ишемического инсульта.
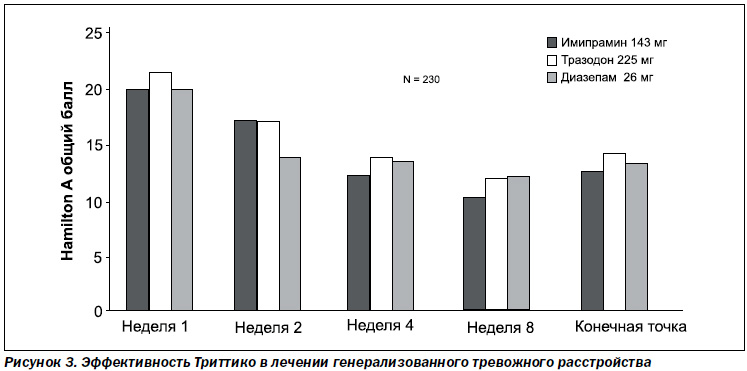
Для тразодона (Триттико) характерен выраженный противотревожный эффект, причем начиная с первых дней терапии. В двойном слепом плацебо-контролируемом рандомизированном исследовании, в котором приняли участие 230 пациентов, была показана эффективность и хорошая переносимость тразодона при генерализованном тревожном расстройстве. Пациенты были разделены на 3 группы. 1-я группа принимала имипрамин 143 мг/сут, 2-я группа — тразодон 225 мг/сут и 3-я группа — диазепам 26 мг/сут. После 8 недель терапии умеренное или существенное улучшение своего состояния отметили 73 % пациентов из группы имипрамина, 69 % — из группы тразодона, 66 % — из группы диазепама и только 47 % принимавших плацебо (рис. 3).
Исследование подтвердило, что тразодон обладает высокой эффективностью и значительно лучшей переносимостью в сравнении с другими препаратами.
Доказана эффективность Триттико в лечении больных с лобно-височной деменцией. Применение препарата в максимальной дозе 250 мг/сут (титрование дозы начинают с 50 мг) в течение 9 недель приводит к заметному улучшению симптомов: уменьшению возбуждения, раздражения, депрессии, нормализации пищевого поведения.
Для препарата Триттико характерна отличная переносимость, сопоставимая с СИОЗС, что очень важно для больных, перенесших инсульт, и обеспечивает высокую приверженность к данной терапии. Препарат не вызывает антихолинергического эффекта, ажитации, расстройства сна, сексуальной дисфункции, ортостатической гипотензии, прибавки в весе, изменений на ЭКГ, ингибирования агрегации тромбоцитов. Могут быть незначительные нарушения со стороны ЖКТ, такие как тошнота, рвота, диарея, возможна сонливость.
Дозирование Триттико производят следующим образом. В течение 1–3-го дня назначают 50 мг перед сном (1/3 табл.), что обеспечивает улучшение сна. На 4–6-й день доза составляет 100 мг перед сном (2/3 табл.), что вызывает анксиолитический эффект. С 7-го по 14-й день для антидепрессивного эффекта дозу увеличивают до 150 мг перед сном (1 табл.). И с 15-го дня для закрепления антидепресивного эффекта сохраняют дозу 150 мг либо увеличивают до 300 мг (2 табл.).
Таким образом, Триттико (тразодон) является первым и единственным представителем класса SARI в Украине, который имеет крупнейшую мировую доказательную базу и зарекомендовал себя как эффективный антидепрессант для устранения симптомов депрессии, тревоги, нарушений сна, а также в лечении пациентов с хроническим болевым синдромом.
Подготовила Татьяна Чистик