Газета «Новости медицины и фармации» 15 (425) 2012
Вернуться к номеру
Лечение хронической ишемической болезни сердца: в фокусе молсидомин
Лечение сердечно-сосудистых заболеваний является актуальной проблемой современной системы здравоохранения. Так, согласно официальным данным Министерства здравоохранения Украины, количество ее жителей, имеющих кардиоваскулярные заболевания, достигло цифры 25 млн, а смертность от недугов этой группы в 2009 г. составила 65,2 % от общей смертности. Следует отметить, что лидирующие позиции среди этой группы заболеваний занимает ишемическая болезнь сердца (ИБС), удельный вес которой в структуре смертности составляет около 65 % (687,3 чел. на 100 тыс. населения).
На сегодняшний день известно, что у больных ИБС манифестные проявления этого заболевания могут отмечаться задолго до развития серьезного сердечно-сосудистого события, каковым является инфаркт миокарда. Как правило, к таким проявлениям ИБС относят приступы стенокардии, с жалобами на которые пациенты обращаются в первую очередь к врачам амбулаторного звена. Именно поэтому особенно важным представляется точная диагностика, квалифицированное лечение и оптимизация профилактических меропрятий данного заболевания в амбулаторных условиях.
Стенокардия — клинический синдром, проявляющийся дискомфортом или болью в грудной клетке сжимающего, давящего характера, которая локализуется чаще всего за грудиной и может иррадиировать в левую руку, шею, нижнюю челюсть, эпигастральную область.
Похожая на стенокардию боль может быть симптомом некардиальных заболеваний или патологических состояний, в том числе с вовлечением в патологический процесс пищевода, грудной клетки или легких. Среди них состояния, повышающие потребление кислорода, — гипертермия, гипертиреоз, интоксикация симпатомиметиками. Снижают поступление кислорода анемия, гипоксемия, пневмония, бронхиальная астма, хроническая обструктивная болезнь легких, легочная гипертензия, синдром ночного апноэ, гиперкоагуляция, полицитемия, лейкемия, тромбоцитоз.
Первым и важнейшим шагом в диагностике ИБС является детальное описание болевого синдрома. Оценивается пять характеристик боли: характер, локализация, длительность, факторы, провоцирующие и купирующие боль.
К неинвазивным инструментальным методам диагностики относятся:
1. Регистрация ЭКГ в покое.Во время ишемии миокарда на ЭКГ фиксируются изменения конечной части желудочкового комплекса — сегмента ST и зубца Т (транзиторное горизонтальное или косонисходящее снижение сегмента ST и уплощение или инверсия зубца Т). Иногда отмечается подъем сегмента ST, что свидетельствует о более тяжелой трансмуральной ишемии миокарда. В отличие от инфаркта миокарда при стенокардии отклонения сегмента ST быстро нормализуются после купирования симптомов. Кроме того, на ЭКГ могут быть выявлены гипертрофия левого желудочка, блокады ножек пучка Гиса, нарушения ритма или проводимости. При диагностике стабильной стенокардии ЭКГ покоя рекомендуется регистрировать вне болевого приступа, а также (по возможности) во время болевого эпизода.
2. Нагрузочные ЭКГ-пробы.Это более чувствительные и специфичные методы, чем регистрация ЭКГ в покое, для идентификации ишемии. Нагрузочные тесты провоцируют ишемию миокарда посредством повышения потребности миокарда в кислороде (тредмил-тест, велоэргометрия, добутаминовая проба) или снижения доставки кислорода к миокарду (пробы с дипиридамолом и аденозином). При этом выявление ишемии может осуществляться различными методами на основе специфических нарушений перфузии и метаболизма миокарда, региональной сократимости или с учетом ЭКГ-изменений и клинических симптомов.
3. Пробы с дозированной физической нагрузкой.Во время пробы с дозированной физической нагрузкой пациент выполняет возрастающую нагрузку на тредмиле или велоэргометре, при этом постоянно регистрируют частоту сердечных сокращений и ЭКГ через равные промежутки времени (1–3 мин), контролируют артериальное давление. В дополнение к регистрации ЭКГ при физической нагрузке этот стресс-тест играет важную роль в выявлении «немой» ишемии и оценке прогноза у лиц со стабильной стенокардией, а также в изучении дальнейшего развития заболевания и эффективности лечения. Проба с физической нагрузкой считается положительной в отношении ИБС, если при ней воспроизводятся типичные для пациента боль или стеснение в груди и возникают характерные для ишемии изменения на ЭКГ.
4. Холтеровское мониторирование (ХМ) ЭКГ.У больных ИБС использование холтеровского мониторирования наиболее обоснованно для диагностики безболевой ишемии миокарда. Это единственный метод, позволяющий определить ее тяжесть, оценить болевые и безболевые ишемические изменения ЭКГ, которые возникают в разное время суток в амбулаторных условиях.
С помощью ХМ у больных ИБС возможна регистрация суточных ритмов ишемической активности. Использование ХМ позволяет обнаружить ишемию миокарда у больных, которые не в состоянии выполнять тесты с физической нагрузкой (физический статус, заболевание периферических сосудов, выраженная легочная патология), а также в некоторых особых условиях, например во время психоэмоционального стресса.
5. Эхокардиография (ЭхоКГ).Ее проведение целесообразно при подозрении на поражение клапанов или при гипертрофической кардиопатии, которые могут вызывать симптомы, сходные с ИБС, а также для определения функции левого желудочка. У отдельных больных ЭхоКГ может выявить некоторые последствия ИБС, такие как нарушение региональной сократимости миокарда, митральная регургитация.
Данные допплеровского ЭхоКГ-исследования обычно предоставляют точную количественную информацию о наличии и степени сопутствующих поражений. Например, если речь идет о гипертрофии, можно установить, является ли она концентрической или асимметричной, уточнить ее локализацию — в области межжелудочковой перегородки, верхушки левого желудочка или свободной стенки.
После проведения диагностических мероприятий важной задачей врача амбулаторного звена является выбор оптимальной терапии, направленной на снижение частоты ангинозных приступов, профилактику острого инфаркта миокарда, улучшение качества жизни пациента.
С этой целью используются следующие группы препаратов:
- липидоснижающие (антиатеросклеротические): статины, фибраты, никотиновая кислота, ПНЖК;
- антитромбоцитарные: ацетилсалициловая кислота, клопидогрель, тиклопидин, варфарин, дипиридамол;
- метаболические: триметазидин, ранагазин, L-карнитин, дихлорацетат;
- антиангинальные препараты, влияющие на гемодинамику: органические нитраты, b-блокаторы и антагони-сты Са.
Антиангинальные препараты (препараты, предупреждающие приступы стенокардии) за счет профилактики ишемии миокарда значительно улучшают самочувствие больного и повышают переносимость физической нагрузки. Для оптимизации лечения больных ИБС со стабильной стенокардией в Институте кардиологии им. А.Л. Мясникова была предложена методика ступенчатого медикаментозного лечения этой категории больных в амбулаторных условиях. Суть ее состоит в следующем: 1) назначение медикаментозных препартов проводится в виде 3 ступеней с возрастающим антиангинальным эффектом за счет комбинирования препаратов с разными механизмами действия; 2) ступень лечения выбирается в соответствии с функциональным классом (ФК) стенокардии у больного; 3) круг используемых препаратов ограничивается наиболее эффективными, хорошо переносимыми и доступными; 4) лечение должно проводиться в пределах диапазона установленных разовых и суточных доз препаратов; 5) если в течение недели на избранной ступени лечение неэффективно, необходимо перейти на следующую, более высокую ступень; 6) при возникновении побочных явлений, связанных с приемом конкретного препарата, его отменяют, заменяя другим в пределах избранной ступени; 7) длительность лечения, переходы на другую ступень и перерывы в лечении определяются ФК, клиническим течением заболевания, эффективностью и переносимостью лечения.
Схема ступенчатого назначения антиангинальных препаратов больным со стабильной стенокардией различных ФК в амбулаторных условиях (Б.А. Сидоренко и соавт., 1986) представлена в табл. 1.
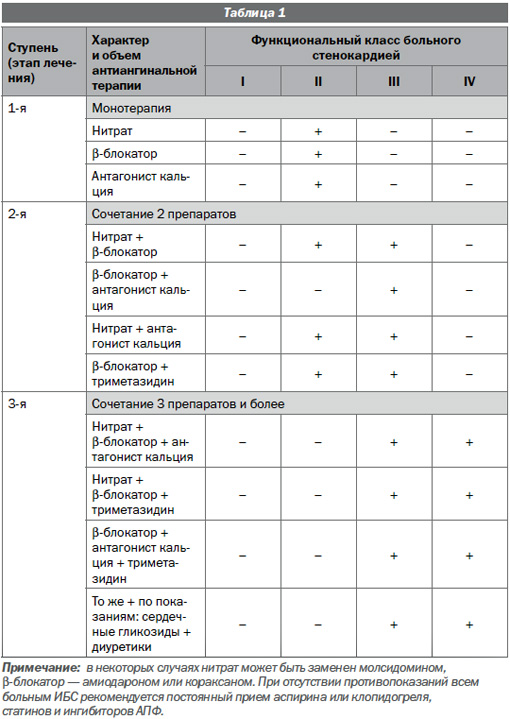
Для профилактики приступов стенокадии наиболее часто в режиме монотерапии назначают органические нитраты, обладающие благоприятной комбинацией вазодилатирующих эффектов, помогающих устранять дисбаланс между снабжением миокарда кислородом и его потребностью в кислороде у больных ИБС. Кроме того, нитраты снижают пред- и постнагрузку левого желудочка, сосудистое сопротивление, в том числе коронарных артерий, АД, обладают антитромбоцитарной активностью.
Однако их применение сопряжено с рядом отрицательных эффектов. Так, при длительном приеме нитратов возможно развитие толерантности к ним, проявляющееся либо укорочением периода действия препарата, либо полным исчезновением эффекта. Это связано с появлением дефицита внутриклеточных SH-групп и нейрогормональной активацией ренин-ангиотензиновой системы с последующим выбросом катехоламинов в кровь. Нередки церебральные симптомы — резкая головная боль, чувство распирания, пульсации головы, шум в ушах и голове. Иногда появляется сердцебиение, вызванное рефлекторной синусовой тахикардией. У ряда пациентов возможен синдром отмены, сопровождающийся обострением ИБС в виде учащения приступов стенокардии, возникновения инфаркта миокарда и даже внезапной смерти.
В связи с данными проблемами постоянно ведутся поиски альтернативной терапии при ИБС, применение которой смогло бы обойти данный феномен. Согласно результатам исследований предупредить снижение антиангинального эффекта нитратов можно с помощью их прерывистого применения. Однако такая стратегия имеет существенные недостатки. Во-первых, далеко не всегда удается достичь 8–12-часового перерыва в приеме нитратов в связи с возможным возникновением приступов стенокардии в это время, во-вторых, резкое прекращение приема нитратов даже на сравнительно непродолжительный период может спровоцировать синдром отмены, который может обусловить серьезные осложнения, и, в-третьих, даже такая прерывистая стратегия не всегда способна предупредить развитие толерантности (Cowan J.C., 1992). В связи с этим перспективным направлением в лечении при ИБС со сформировавшейся толерантностью к органическим нитратам является применение сиднониминов (Воронков Л.Г., 2009).
Молсидомин (N-этоксикарбонил-3-морфолиносиднонимин) является антиангинальным препаратом, принадлежащим к группе сиднониминов, впервые синтезированным в Японии Y. Masuda с коллегами в 70-х годах ХХ ст. В печени препараты этой группы ферментативно трансформируются в активный метаболит SIN-1, который впоследствии вовлекается в двухступенчатую реакцию. Вначале SIN-1 проходит каталитическое превращение в SIN-1A. SIN-1A имеет в своем составе фармакологически активную группу NO, которая выделяется при его взаимодействии с кислородом.Побочным продуктом этой реакции является образование стабильного метаболита SIN-1C. Эта цепь трансформаций с образованием NO обеспечивает терапевтический эффект сиднониминов (Bohn H., Schonafinger K., 1989).
Клинические и экспериментальные данные свидетельствуют о том, что молсидомин (Сиднофарм) действует подобно глицерил тринитрату, как и ГТН, но его антиангинальный эффект длится дольше. В связи с этим сиднонимины и нитраты объединяют в одну группу препаратов — донаторов NO. Однако в отличие от традиционных нитратов молсидомин (Сиднофарм) не индуцирует формирование толерантности, что подтверждается многочисленными экспериментами (Jansen W. et al., 1987; Vinel J.-P. et al., 1990; Messin R. et al., 2008). Этот эффект объясняется тем, что метаболиты этого препарата образуют NO только лишь при взаимодействии с кислородом, без участия ферментов и кофакторов (Foye W.O. et al., 2008).
После приема внутрь препарат почти полностью абсорбируется в желудочно-кишечном тракте. Его биодоступность составляет около 65 %, максимальная концентрация в плазме крови достигается через 30–60 мин при пероральном приеме и составляет 4,4 мкг/мл. Эффект молсидомина (Сиднофарм) сравнительно длительный и наблюдается в течение 4–6 ч (Rosenkranz B. et al., 1996). Препарат начинает действовать спустя 10 мин после приема per os и даже быстрее при его сублингвальном применении (Guerchicoff S. et al., 1978). ЦГМФ-опосредованная вазодилатация при приеме этого препарата затрагивает преимущественно вены как мелкого, так и крупного калибра, что приводит к значительной редукции преднагрузки на сердце, уменьшению сердечного выброса и напряжению стенки левого желудочка. Это приводит к снижению потребления миокардом кислорода и увеличению соотношения доставляемого и потребляемого кислорода. Наблюдаемый эффект способствует предотвращению миокардиальной ишемии, что клинически проявляется в виде урежения частоты приступов стенокардии, повышения толерантности к физической нагрузке и уменьшения депрессии сегмента ST (Bassenge E., 1982).
Подобно нитроглицерину Сиднофарм (молсидомин) также способствует дилатации коронарных артерий. Этот эффект становится более выраженным при повышении дозы. Следовательно, при таком применении Сиднофарм (молсидомин) улучшает коллатеральный кровоток, что вдобавок к увеличению субэндокардиальной перфузии дополнительно снижает напряжение стенки левого желудочка и, следовательно, способствует уменьшению потребления кислорода миокардом. Однако в отличие от традиционных нитратов Сиднофарм (молсидомин) практически не оказывает влияния на периферическое сопротивление. Этот эффект начинает проявляться только после приема сверхвысоких доз. В целом Сиднофарм (молсидомин) вызывает опосредованное повышение частоты сердечных сокращений и уменьшение сердечного выброса, что позволяет при необходимости вносить значительные изменения в назначаемую дозу (Bassenge E., 1982).
Также, кроме NO, SIN-1 образует пероксинитрит ONOO–, который усиливает антиагрегантные свойства NO. Так, при проведении экспериментов in vitro установлено, что SIN-1 ингибирует агрегацию тромбоцитов (Darius H. et al., 1984). Кроме того, было выявлено, что Сиднофарм (молсидомин) влияет на соотношение тромбоксана А2 и простациклина в сторону повышения уровня последнего, что также способствует угнетению агрегации тромбоцитов (Bassenge E., Kukovetz W.R., 1984). Следует добавить, что нарушения в континууме простациклин/тромбоксан А2 отмечаются при повреждении эндотелия. Это можно наблюдать при многих заболеваниях, в том числе ИБС.
Одним из примечательных эффектов Сиднофарма (молсидомина) является его способность снижать уровень некоторых провоспалительных маркеров. В частности, продемонстрировано, что применение этого препарата в течение 1 года в дозе 16 мг/сут способствовало редукции уровня такого провоспалительного маркера, как sICAM-1, что свидетельствует о меньшей активации эндотелия при применении Сиднофарма (молсидомина) (van Hove C. et al., 2005). Как известно, уровень провоспалительных маркеров позитивно ассоциирован со степенью активности атеросклеротического процесса. Снижение их концентрации может свидетельствовать не только о вазодилатирующем эффекте Сиднофарма (молсидомина), но и о его патогенетическом действии относительно ИБС, а именно торможении дальнейшего атеросклеротического повреждения эндотелия.
Так, в одном из доклинических исследований показано, что этот препарат в невысоких дозах в отсутствие поступления холестерина в большей степени увеличивал толщину свободной от макрофагов субэндотелиальной зоны, состоящей из гладкомышечных клеток, чем простое отсутствие поступления холестерина. Кроме того, применение Сиднофарма (молсидомина) способствовало нормализации продукции супероксида и экспрессии мРНК экстрацеллюлярной супероксиддисмутазы в атеросклеротических бляшках на аорте (De Meyer G.R. et al., 2003). Видимо, благодаря таким особенностям сиднониминов результаты проспективного многоцентрового рандомизированного исследования, проведенного J.-M. Lablanche и соавторами (1997), показали значительное улучшение результатов ангиографии у пациентов после коронарной баллонной ангиопластики, проходивших 6-месячный курс лечения Сиднофармом (молсидомином), в сравнении с теми, кто принимал дилтиазем. Следует добавить, что вышеописанные изменения уровней тромбоксана А2 и простациклина также могут свидетельствовать о положительном влиянии Сиднофарма (молсидомина) на эндотелий.
В исследовании P.A. Majid et al. (1980) при сравнении с плацебо показано, что прием Сиднофарма (молсидомина) (по 2 мг 3 раза в сутки) значительно снижает частоту приступов стенокардии и количество принимаемых таблеток нитроглицерина у пациентов со стабильной стенокардией. Кроме того, при применении этого препарата наблюдалось статистически значимое уменьшение депрессии сегмента ST во время проведения тредмил-теста, которое в среднем длилось около 6 ч.
Сравнение эффективности и безопасности Сиднофарма (молсидомина) пролонгированного действия (16 мг 1 раз в сутки) и обычных таблеток (8 мг 2 раза в сутки) показало отсутствие существенных различий относительно побочных эффектов у участников исследования всех возрастных групп. Однако при применении пролонгированной формы более выраженный антиангинальный эффект наблюдался у лиц в возрасте ≥ 75 лет, в то время как у пациентов < 75 лет наблюдалась более высокая антиишемическая эффективность непролонгированных форм. При этом ни у одного из пациентов не отмечалось развития толерантности к Сиднофарму (молсидомину) (Messin R. et al., 2001).
Таким образом, представленные данные об эффектах Сиднофарма (молсидомина) раскрывают причины успешности его применения при кардиоваскулярных заболеваниях, а именно — для профилактики приступов стенокардии у пациентов с ИБС. Вопрос применения препарата у этой категории пациентов становится еще более актуальным при формировании резистентности к органическим нитратам.
Подготовила Татьяна Чистик
Список литературы находится в редакции
