Газета «Новости медицины и фармации» 15 (425) 2012
Вернуться к номеру
Почему мы не победим ВИЧ/СПИД-пандемию
Авторы: М.В. Супотницкий, кандидат биологических наук
Версия для печати

Принципиальное отличие ВИЧ/СПИД-пандемии от пандемических процессов, в борьбе с которыми были достигнуты успехи в ХХ столетии, заключается в том, что она вызвана вирусом из семейства ретровирусов. Ретровирусы представляют собой древние инструменты эволюции. Вызываемые ими эпидемии (эпизоотии) составляют основной механизм прерывистой эволюции видов. Этот механизм реализуется эндогенизацией ретровирусов в геноме выживших видов и наращиванием их генома посредством образования новых копий ретроэлементов; усложнением генома путем образования новых экзонов из интронов и/или увеличения количества генов, подвергающихся альтернативному сплайсингу. Эволюционное прошлое иммунной системы многоклеточных организмов свидетельствует о закреплении за ней путем естественного отбора резервуарной роли по отношению к ретровирусам. Благодаря клеткам иммунной системы происходит размножение и накопление экзогенных ретровирусов до какой-то критической массы, которая позволяет некоторым из них эндогенизироваться в зародышевой линии отдельных особей инфицированного вида и в дальнейшем передаваться вертикально, меняя его эволюционную траекторию. ВИЧ/СПИД-пандемия среди вида Homo sapiens — частное проявление этого процесса в эволюции таксона приматов. Инфекционный и эпидемический процессы, вызванные ВИЧ, представляют собой многокомпонентные нециклические процессы, не имеющие механизмов терминации. Для борьбы с ними не применим опыт, накопленный в ХХ столетии при ликвидации натуральной оспы или при осуществлении контроля над вспышками гриппа, чумы и других циклических инфекций. Приведенные в статье данные показывают необходимость разработки самостоятельной стратегии борьбы с нециклическими многокомпонентными эпидемическими процессами.
Ситуация с распространением ВИЧ/СПИД-пандемии на территории России и Украины с каждым годом ухудшается. В то же время со стороны эпидемиологического сообщества обеих стран не наблюдается никаких попыток переосмыслить общепринятое понимание этой пандемии как типовой медицинской проблемы. В качестве примера успешности ее преодоления нам приводят результаты борьбы с натуральной оспой и с другими инфекциями, способными к самоограничению и контролируемыми вакцинацией. Учебные пособия, по которым ведется подготовка будущих врачей, не дают им понимания даже того, что ВИЧ/СПИД-пандемия чем-то отличается от других пандемических процессов. Цель настоящей работы — показать, что проблема ВИЧ/СПИД-пандемии не просто выходит за рамки подходов, позволивших добиться успехов в снижении инфекционной заболеваемости в ХХ в., но и имеет принципиально иной характер.
Прежде всего, в понимании сложности проблемы ВИЧ/СПИД-пандемии игнорируется то, что вызвавший ее вирус иммунодефицита человека (ВИЧ) представляет собой ретровирус — т.е. он относится к семейству РНК-вирусов, образующих с помощью фермента обратной транскриптазы ДНК-копию своего генома (провирус), интегрирующуюся с геномом человека в единую молекулу ДНК. Ни один из других ранее открытых вирусов, вызывающих пандемии и эпидемии (натуральной оспы, гриппа и др.), такой способностью не обладает. До завершения проекта «Геном человека» в 2000 г. это обстоятельство принималось во внимание только как особенность самого ВИЧ. Но после того как геном человека был расшифрован, стало ясно, что, структуры, подобные провирусу ВИЧ, обобщенно называемые ретроэлементами, занимают не менее 42 % генома человека, т.е. почти его половину1. Все они, как и ВИЧ, экспрессируют (либо экспрессировали раньше) обратную транскриптазу и распространяются (распространялись) по геному в два этапа: образование РНК-транскрипта и его транскрибировавание обратно в ДНК-транскрипт, встраивающийся в хромосому (N. Bannert, R. Kurth, 2004).
Чтобы понять, насколько близко друг от друга по структуре и механизму функционирования находятся ВИЧ и ретроэлементы генома человека, сопоставим их организацию.
ВИЧ имеет три основных структурных гена, кодирующих вирусные протеины в следующем порядке: 5'-gag-pol-env-3':
- ген gag— кодирует белки, формирующие «сердцевину» вируса (необходимы для внутриклеточной сборки вируса и его высвобождения из клетки);
- ген pol— кодирует ферментную систему вируса (обратную транскриптазу — p66/51; интегразу — p31/33; рибонуклеазу — p31/33);
- ген env— определяет способность вируса выходить за пределы клетки и инфицировать другие клетки. Кодирует белки предшественника оболочки вируса — gp160, расщепляющиеся на gp120 и gp41.
Имеются последовательности, необходимые для реализации механизма обратной транскрипции:
- прямые повторы на 5'- и 3'-концах РНК (LTR действует как единица промоции, необходим для транскрипции всего вирусного генома и начала транскрипции отдельных вирусных генов);
- последовательность из 80–120 нуклеотидов, соседствующая с 5'-концевым прямым повтором (U5);
- последовательность из 170–1200 нуклеотидов, соседствующая с 3'-концевым прямым повтором (U3);
- последовательность из 15–20 нуклеотидов (Р), в пределах которой клеточная тРНК спаривается с ретровирусной РНК, что создает праймер для синтеза первой цепи ДНК;
- сегмент Рu, находящийся непосредственно перед повтором U3 и являющийся сайтом для праймирования второй цепи ДНК.
У ВИЧ шесть регуляторных генов:
- tat (transactivator of transcription) — кодируемый им белок является наиболее активным регулятором, обеспечивающим усиление в 1000 раз репликации вируса и регулирующим экспрессию клеточных генов;
- rev (regulator of expression of virus proteins)— кодируемый им белок избирательно активирует синтез структурных белков вируса, обеспечивает экспорт из ядра длинных молекул вирусной РНК. На поздних стадиях ВИЧ-инфекции он замедляет синтез регуляторных белков;
- nef (negative regulatory factor) — при взаимодействии с LTR кодируемый им белок замедляет транскрипцию вирусных генов. Синхронная функция nef и tat регулируют репликацию вируса таким образом, чтобы она не приводила к гибели клетки-хозяина. Экстрацеллюлярный белок Nef увеличивает миграцию моноцитов, тем самым способствуя распространению по организму ВИЧ и прогрессированию болезни;
- vif (virion infectivity factor)— кодируемый им белок необходим для образования функционально полноценных вирусов в определенных типах клеток на поздней стадии инфекции. Белок Vif включается в состав новых вирусов;
- vpr— кодируемый им белок вызывает остановку клеточного цикла, способствует входу в ядро прединтеграционного комплекса. Vpr включается в новые вирусы в большом количестве, способен в некоторой степени усиливать экспрессию генов ВИЧ и нарушать экспрессию отдельных клеточных генов;
- vpu для ВИЧ-1(vpx для ВИЧ-2) — кодируемый им белок разрушает комплекс gp120/CD4; снижает экспрессию CD4; способствует высвобождению вируса; усиливает продукцию вируса в клетке.
Длинные концевые повторы, или LTR (long terminal repeats), — это прямые повторяющиеся последовательности на концах ДНК-копии генома ретровирусов. Каждый такой повтор состоит из трех элементов: U3-R-U5, длина которых составляет соответственно 170–1250, 10–80 и 80–100 т.п.н.; 3'-конец U5 сам содержит короткий инвертированный повтор, гомологичный последовательности на 5'-конце элемента U3, т.е. сама последовательность LTR фланкирована короткими инвертированными повторами; LTR участвуют в интеграции ДНК-копии генома ретровируса в геном клетки-хозяина, кроме того, область U3 каждого LTR несет промотор, причем промотор левого LTR участвует в транскрипции ДНК провируса, а промотор правого — последовательности ДНК клетки-хозяина вблизи сайта интеграции ретровируса. LTR фланкируют сложные элементы генома и участвуют в процессе их транспозиции (K. Khodosevich et al., 2002).
Ретротранспозируемые элементы (ретроэлементы) генома человека делят на две большие группы: способные к автономному существованию и неавтономные.
Выделены два класса автономных ретроэлементов:
- LTR-элементы (LTR-elements) — составляют до 8,3 % генома человека. К ним относятся ретротранспозоны (retrotransposons), эндогенные ретровирусы (endogenous retroviruses, ERVs), человеческие эндогенные ретровирусы (human endogenous retroviruses, HERVs) и повторяющиеся элементы эндогенных ретровирусов человека (repeat elements with HERV origin), такие как SINE-R ретропозоны (SINE-R retroposons);
- не-LTR (non-LTR)— очень древние ретроэлементы. Широко представлены в геноме простейших организмов. В геноме человека на них приходится 33,9 % ДНК. Это короткие вставочные элементы (short interspersed elements, SINE; их еще называют короткими ретропозонами) с преобладанием Alu- и MIR-повторов и длинные терминальные вставочные повторы (long-terminal interspersed elements, LINE), представленные автономными L1- и L2-последовательностями.
Неавтономные ретротроэлементы не кодируют белков. К ним относятся Alu-повторы (в геноме человека их более миллиона); псевдогены, образовавшиеся в результате обратной транскрипции; и SVA-элементы (аббревиатура от заглавных букв SINE-R, VNTR и Alu, описаны как «композитные ретропозоны»). Для своей транспозиции они нуждаются в активности автономных ретроэлементов. Например, SVA-элементы ретротранспозируются с помощью L1-транспозонов (E.M. Ostertag, H. Kazazian, 2001). Классификация и взаимосвязь ретроэлементов приведены на рис. 1.
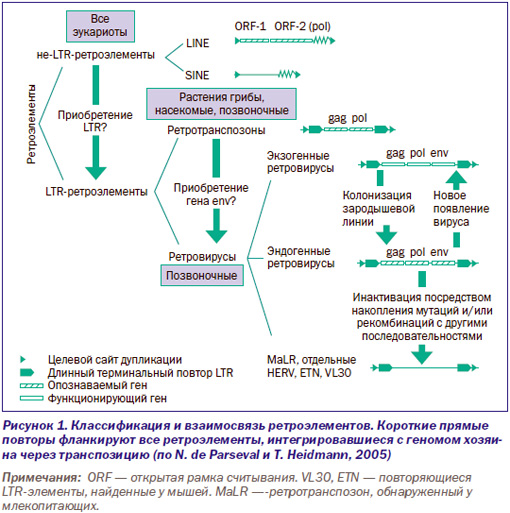
Границы между эндогенными и экзогенными ретровирусами, между ретротранспозонами и ретровирусами, между LTR- и не-LTR-элементами можно провести только на момент времени, воспринимаемый человеком. По мере масштабирования времени в пределы, вмещающие геологические эпохи, границы между ними становятся менее ясными. Геном человека представляет собой единственную правдивую летопись, в которую вписаны все события, совершавшиеся в ходе его эволюции. Рассмотрим их на примере трех ретроэлементов из представленных на рис. 2.
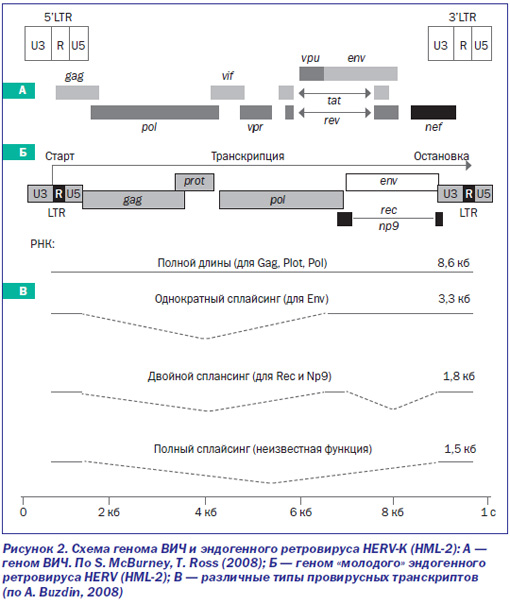
Эндогенные ретровирусы.«Молодые» HERV структурно почти ничем не отличаются от интегрировавшейся с геномом человека ДНК копии ВИЧ, за исключением мутаций, блокирующих их способность образовывать вирусные частицы (например, в гене env) и, соответственно, передаваться горизонтально, как это происходит при ВИЧ-инфекции.
«Молодыми» эндогенные ретровирусы считаются, если им менее 5–6 млн лет, т.е. они интегрировались с геномом гоминоидов уже после дивергенции каких-то предковых видов приматов на гоминоидов и современных обезьян. Эндогенизация экзогенных ретровирусов (типа современного ВИЧ) происходит через их проникновение в зародышевую линию. Процесс носит случайный характер, и о нем мало что известно. По крайней мере, представители 31 семейства HERV, обнаруженные в геноме современного человека, интегрировались с геномом его эволюционных предков в результате самостоятельных инфекционных процессов (R. Belshaw et al., 2005). Наиболее молодое семейство эндогенных ретровирусов — HERV-K, оно проникло в геном современного человека 100 тыс. лет назад. Провирус локализован в хромосоме 19 (19p13.11) и не полностью зафиксирован в человеческих популяциях. Провирус весьма распространен среди людей, живущих в Африке, Азии и Полинезии. HERV сохраняют свою активность в геноме человека, например HERV-К10 способен формировать ретровирусные частицы. Индукция его мРНК возможна в клетках рака молочной железы человека путем добавления прогестерона и эстрадиола. Рассмотрение механизмов активации HERV не входит в задачу данной работы.
Показательна история эндогенного ретровируса семейства ERV9 (рис. 3).
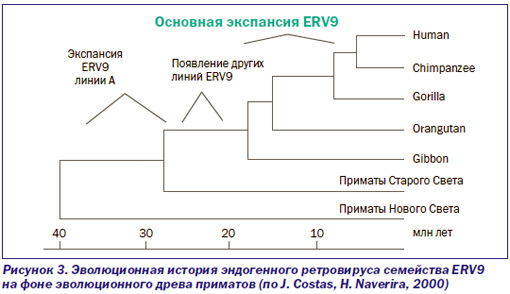
Экспансия ERV9 (линия А ретровируса) в геноме предковых видов современных приматов Старого Света началась 38–30 млн лет назад. Но наиболее активно экспансия ERV9 по геному приматов осуществлялась в период их дивергенции от гиббонов на высшие виды обезьян (16–6 млн лет назад). Максимум транспозиционной активности семейством ERV9 достигнут 8–6 млн лет назад, затем это ретровирусное семейство «угасло». В геноме современного человека сохранились более сотни дефектных ERV9 и по крайней мере 4 тыс. одиночных LTR (solitary LTRs), возникших благодаря гомологичной рекомбинации между 5'- и 3'-LTR полноразмерных ERV9, рассеянных по геному приматов в эволюционном прошлом (P. Lopez-Sanchez et al., 2005).
Ретровирусы могут возвращаться в эволюционную линию. Семейство HERV-K (HML-2) впервые интегрировалось с геномом приматов, предков современного человека, около 30 млн лет назад. Отдельные провирусы, сохранившиеся с первого «пришествия» этого семейства, у современного человека, напоминают о себе вирусоподобными частицами, продуцируемыми клетками злокачественной опухоли — тератокарциномы (human teratocarcinoma cells). HERV-K (HML-2) вернулся в геном приматов Старого Света 6 млн лет назад. Зародышевую линию человека семейство инфицировало 100 тыс. лет назад (HERV-K113) (Turner et al., 2001). Каким образом HERV управляют генами своего нового хозяина, показано на схеме (рис. 4).
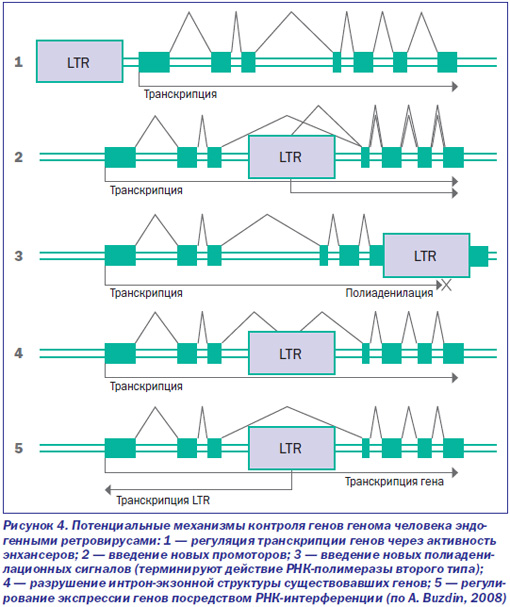
Так как область U3 каждого LTR несет промотор, то LTR не только фланкируют сложные элементы генома и участвуют в процессе их транспозиции, но и включаются в управление генами, прилегающими к области U3 HERV (табл. 1).
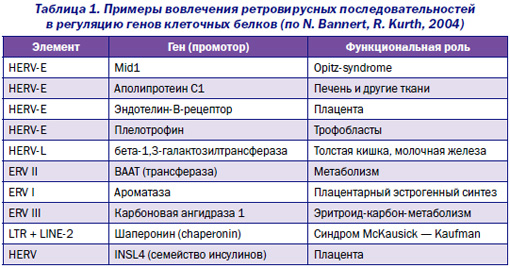
Интересна роль эндогенных ретровирусов в размножении плацентарных животных и человека. В плаценте оболочечные белки эндогенных ретровирусов выполняют роль белков слияния. Они экспрессируются в синцитиотрофобластном слое (syncytiotrophoblast layer), образованном посредством слияния мононуклеарных цитотрофобластов, и образуют участки синцития в тех участках плаценты, где начинается взаимодействие матери и плода (K. Dunlap et al., 2006). Эти данные свидетельствуют о том, что хотя информация, определяющая целостное развитие эмбриона человека, и содержится в зиготе, но только как некая потенция, которая не реализуется без участия эндогенных ретровирусов матери.
Прежде чем мы перейдем к пониманию роли транспозируемых элементов в эволюции человека, отмечу, что большинство из «недавно» проявивших активность ретроэлементов составляют L1 и Alu. Пик их размножения в эволюционно предшествующих человеку видах имел место 60 млн лет назад (Р. Deininger, М. Batzer, 2002). Их активности предшествовала активность ДНК-транспозонов. Основная масса ДНК-транспозонов (85 %; примерно 291 тыс. элементов) распространились среди млекопитающих — эволюционных предков человека еще в Меловом периоде (135–66 млн лет назад), когда происходило вымирание рептилий. Исследователи не обнаружили в геноме приматов ДНК-транспозоны «моложе» 37 млн лет (J.K. Pace II, С. Feschotte, 2007).
Ретротранспозоны L1.Обнаруженные в геноме современного человека L1-ретротранспозоны имеют свою собственную эволюционную историю, насчитывающую не менее 100–150 млн лет (A.V. Furano, 2000; K. Han et al., 2005); т.е. в известном нам виде они существовали у класса млекопитающих еще во времена господства рептилий. Образуют 16 различных семейств (L1PA16–L1PA1). Их активность в геноме человека значительно большая, чем HERV. Вставочная история L1-элементов генома человека в основном написана семейством Ta-1, составляющим до 90 % их популяции. Это семейство содержит значительно большее количество полноразмерных транспозонов, чем другие. Эффективно дуплицируя сами себя, L1 играют ключевую роль в увеличении генома вида посредством размножения нетранспозируемых Alu- и SVA-элементов и образования ретропсевдогенов.
Кроме увеличения генома, L1 способны управлять генами. Отдельные L1 имеют антисмысловые промоторы Pol II, которые влияют на экспрессию находящихся в непосредственной близости генов. Другие L1 могут выполнять функции энхансеров и регулировать гены, находящиеся на некотором расстоянии от них. Случайно вставившись в последовательность гена, L1 может блокировать его экспрессию и вызвать генетическую болезнь. Такой же эффект может иметь место в результате дупликации или делеции гена после неправильной гомологичной рекомбинации, спровоцированной активностью L1 (E.M. Ostertag, H. Kazazian, 2001).
Примером участия L1-ретро-транспозонов в эволюции человека является образование секретируемых форм человеческого трансмембранного белка аттрактина (attractin). L1-ретро-транспозируемый элемент обеспечил преждевременный стоп-кодон и полиаденилационный сайт, ответственные за синтез усеченного растворимого аттрактина. Обе формы, трансмембранный и растворимый белки, вовлекаются в клеточные взаимодействия в течение воспалительного процесса. Таким образом, вставки L1-ретроэлементов в данном конкретном случае создали для вида Homo sapiens более тонкие механизмы регуляции воспалительных ответов (W. Tang et al., 2000).
Alu-ретроэлементы.Среди других семейств ретроэлементов Alu наиболее многочисленны в геноме современного человека. Они представлены более чем 1,4 млн копий, которые соответствуют 10 % всей массы генома человека. Их число продолжает расти, и они встраиваются во все новые сайты генома с частотой примерно одно новое встраивание на 100–200 новорожденных (Г. Аст, 2005).
Alu-ретроэлементы играют основную роль в процессе образования экзонов в интронных областях благодаря существованию у них участков (motifs), имеющих сходство с сайтами сплайсинга, или же они образуют такой сайт посредством вариаций отдельных нуклеотидов, интегрировавшихся в интрон Alu-элементом. Вставки Alu-экзонов также вводят преждевременные терминальные кодоны или рамки считывания, а сами Alu-элементы генома человека действуют как очень большой резервуар альтернативных экзонов.
Приведенные выше данные должны показать врачам, что ВИЧ/СПИД-пандемия — это не первая пандемия, в которой участвуют ретровирусы. Они сопровождали человека на протяжении всей его эволюции. Кроме того, такие эпидемии составляют основной механизм прерывистой эволюции видов, для которой характерно чередование длительных периодов стабильности, когда основные черты вида сохраняются неизменными, и коротких периодов быстрых изменений (в геологических масштабах времени), в ходе которых вид преобразуется — либо целиком превращается в другой вид, либо делится на новые виды, либо «отпочковывает» их от себя. Этот эволюционный механизм реализуется после массовых ретровирусных эпизоотий, заканчивающихся эндогенизацией ретровирусов в геноме выживших видов, и наращиванием генома вида-хозяина путем образования новых собственных копий ретроэлементов; его усложнения путем образования новых экзонов из интронов и/или увеличения количества генов, подвергающихся альтернативному сплайсингу.
К отдельным механизмам этого процесса мы вернемся ниже, а сейчас перейдем к основной надежде наших врачей в борьбе с ВИЧ — к многократно обещанной нам ВИЧ-вакцине. Создатели таких вакцин пытаются нас лукаво приучить к мысли, что раз они уже получили иммуноглобулины, узнающие поверхностные белки ВИЧ, то дело осталось за малым — научить их блокировать ВИЧ-инфекцию. Вот поэтому мы сначала углубимся в эволюционную историю системы иммуноглобулинов человека.
Суперсемейство иммуноглобулинов (Ig-SF) представляет собой огромное семейство белков адгезии, название которого более известно по названию одного из факторов иммунной системы позвоночных — иммуноглобулиновых антител, эволюционно появившихся в этом семействе последними. По данным, обобщенным В.Г. Галактионовым (2005), J. Klein и H. Nicjladis (2005), прародителем V-генов2 Ig-SF был ген белка Thy-1. Он образовался не менее 2 млрд лет назад в результате дивергенции какого-то другого более древнего гена белка, послужившего прототипом V- и С-доменов легкой цепи иммуноглобулинов.
Но прежде чем возникло основное свойство Ig-SF — разнообразие специфического взаимодействия с высокомолекулярными структурами, должно было произойти другое важное эволюционное событие — фрагментация V-гена. Ждать его после появления гена белка Thy-1 пришлось всего 1,5 млрд лет. Главным «виновником» формирования современного Ig-SF вновь оказался ретровирус, внедрившийся в единый V-ген предков позвоночных животных около 450 млн лет назад. Это событие привело к расщеплению V-гена на собственно V-ген, и D- и J-сегменты. Геномные участки, оказавшись самостоятельными, подвергались обычным генетическим процессам, в первую очередь транслокациям, тандемным дупликациям, рекомбинациям и случайным мутациям, инициируемым ретроэлементами.
Сначала многообразие таких структур увеличивалось за счет транслокаций (например, члены Ig-SF, имеющие V2-C2- и V1-C1-комбинации доменов) и тандемных дупликаций, включающих не только отдельные С- и V-гены, но и генные блоки V-C, в том числе те, которые усложнены включением D- и J-сегментов (V-D-J-C) или (V-J-C). В результате сформировался кластерный тип контроля над специфичностью антиген-распознающих молекул. Однако подобный тип формирования Ig-SF имел пределы, обусловленные величиной генома и невозможностью бесконечного наращивания кластерного типа организации генов.
Очередная ретровирусная атака какого-то предкового вида первых позвоночных привела к интродукции в их геном генов рекомбиназ ретровирусов RAG-1 и RAG-2, процесс реорганизации V-, D-, J-генных сегментов иммуно-глобулинов и Т-клеточных рецепторов ускорился. Случайность объединения V-, D-, J-генных сегментов определила множественность синтезируемых V-доменов и возможность дальнейшей эволюции системы специфического иммунитета. Сколько потребовалось миллионов лет для реализации такой «случайности», неизвестно, но уже не приходилось ждать миллиарды лет — эволюционный маховик начал раскручиваться. Возникло множество V-генов (у млекопитающих в настоящее время их более 500). С закреплением путем естественного отбора механизма V(D)J-рекомбинации, стало возрастать количество структур, способных к специфическому узнаванию «своего» (гомофильное узнавание) и «чужого» (гетерофильное узнавание). Дупликации и перестановки экзонов генов Ig-SF дали естественному отбору больше альтернатив в выборе конкурентоспособных многоклеточных структур. Эволюция живых существ теперь могла идти не только по пути наращивания структур, устроенных по одному образцу, но и по пути их дифференциации. Как частный вывод из этой истории участия ретровирусов в создании Ig-SF может быть высказано предположение, что иммунная система человека отвечает на инфекцию, вызванную ретровирусами, совсем не так, как, например, на вирус натуральной оспы (ВНО).
Основное объяснение неудач у создателей ВИЧ-вакцин — это то, что «вирус постоянно меняется». Но давайте внимательно посмотрим, каким образом он меняется и кто его меняет у так называемых умеренных прогрессоров (moderate progressors) ВИЧ-инфекции. R. Shankarappa et al. (1999) у таких пациентов в пределах асимптоматической стадии ВИЧ-инфекции выделяют три фазы дивергенции и три фазы роста разнообразия ВИЧ. Под дивергенцией (divergence)они понимают различия между нуклеотидной последовательностью исходного вируса и последовательностью вируса, полученного от ВИЧ-инфицированного человека через какое-то время после инфицирования. Под разнообразием (diversity)— различия в нуклеотидных последовательностях ВИЧ в данной временной точке.
На ранней фазе инфекции развиваются оба процесса;промежуточная фаза характеризуется непрерывным увеличением дивергенции ВИЧ, но стабилизацией или даже снижением его разнообразия; поздняя фаза проявляется снижением темпа или даже стабилизацией процессов дивергенции и формирования разнообразия вируса (рис. 5).
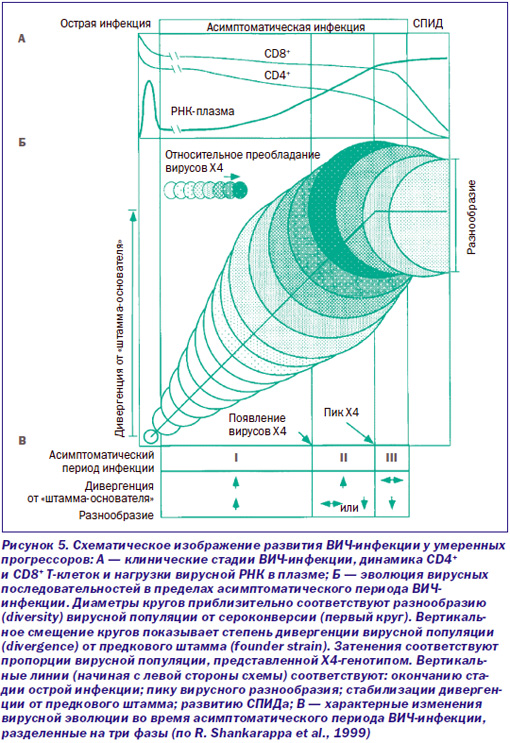
Следовательно, именно активность иммунной системы человека способствует дивергенции и увеличению разнообразия ВИЧ и появлению наиболее опасных Т-тропных вариантов ВИЧ (T-tropic или X4), элиминирующих Т-клетки-хелперы, после чего болезнь входит в стадию СПИДа. Основным местом размножения ВИЧ становятся макрофаги с заблокированной им системой апоптоза, дивергенция вируса замедляется, его разнообразие поддерживается в основном за счет ошибок при обратной транскрипции.
Но каким образом активность иммунной системы человека способствует дивергенции и увеличению разнообразия ВИЧ на стадии бессимптомной инфекции? Дело тут в том, что у ВИЧ-инфицированного человека нейтрализующие антитела играют совершенно иную роль, чем у человека, инфицированного ВНО, возбудителями сибирской язвы или чумы. До 90 % всех обнаруживаемых у ВИЧ-инфицированного человека антител направлены на консервативный участок домена V3 поверхностного гликопротеина gp120. Домен V3 состоит из тримера гетеродимеров (trimer of heterodimers), сформированных двумя гликопротеинами, gp120 и gp41. Гликопротеин gp120 представляет собой высокогликозилированный белок, приблизительно половина массы которого составляют карбонгидраты, присоединенные к N-концу молекулы (P. Poignard et al., 2001). Анализ последовательностей различных изолятов ВИЧ позволил установить у gp120 вариабельные (V1-V5) и консервативные (С1-С5) регионы (рис. 6).
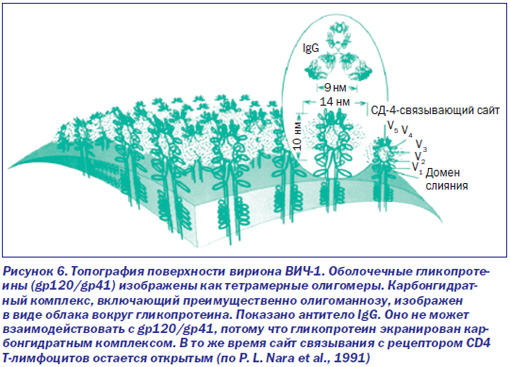
Консервативность отдельных консервативных доменов гликопротеина ВИЧ не имеет ничего общего с консервативным белком L1 ВНО, антитела к которому блокируют инвазию ортопоквирусов в клетки (Su H. et al., 2005). Относительно консервативный сайт связывания гликопротеина ВИЧ с рецептором клетки CD4 «заглублен» и малодоступен для антител. А консервативный корецепторный сайт является наиболее недоступным для антител на мономерном gp120 (M.B. Zwick et al., 2004).
Казалось бы, шанс для разработчиков ВИЧ-вакцин дает консервативный участок домена V3 gp120. Его консервативность обусловлена ролью в процессе проникновения ВИЧ в клетку. Корецепторы CCR5 и CXCR4 посредством V3-домена gp120 катализируют слияние вируса с мембраной клетки-мишени (E.A. Berger et al., 1999). Но с иммунологической точки зрения он оказался более сложным явлением, чем простой линейный эпитоп с такой же аминокислотной последовательностью или консервативный белок L1 ВНО. Оказалось, что домен представляет собой «шарнир», у которого консервативный участок V3 может оставаться неизменным в ходе инфекционного процесса, но конформация самого домена многократно меняется из-за большого количество замен аминокислот молекулы gp120 как впереди, так и позади консервативного участка. В результате «поворачивания шарнира» валентность его взаимодействия со специфическим антителом снижается (X. Wei et al., 2003). Скорость появления как ВИЧ-нейтрализующих антител, так и избегающих их вирусов сильно варьируют у разных лиц, сам же цикл многократно повторяется на протяжении жизни ВИЧ-инфицированного и больного СПИДом (S. Frost et al., 2005). Данный феномен нейтрализационной резистентности известен уже не менее 30 лет и характерен для инфекционных процессов, в которых участвуют ретровирусы. Ранее он был описан для близкородственных ВИЧ ретровирусов — вируса кошачьей лейкемии, вызывающего лейкемию у кошек (K.Nicolaisen-Strouss et al., 1987), и вируса висны, поражающего ЦНС овец (J.S. Stanley, 1987).
Но может быть, тот относительно короткий период бессимптомного течения ВИЧ-инфекции, когда консервативный участок V3 доступен для нейтрализующих антител, станет решающим для блокирования ВИЧ-инфекции, если, например, путем добавления к вакцине иммуномодуляторов увеличить их количество? Это действительно прогрессивная идея, содержащаяся во всех учебниках по иммунологии, ее приверженца никто не заподозрит в ненаучности или в отсутствии здравого смысла. Такие антитела к различным белкам ВИЧ у мышей и добровольцев можно получать годами за счет денег налогоплательщиков и в иммуноблоте доказывать их специфическое взаимодействие с каким-либо белком ВИЧ, выдавая эти эксперименты за «создание и испытание кандидатных вакцин против ВИЧ/СПИДа» (например, см. работу И.Г. Сидоровича с соавт., 2010).
Но на пути реализации и этой «прогрессивной» идеи есть препятствие — блокирования ВИЧ-инфекции нейтрализующими антителами в условиях in vivo не происходит и не может происходить в принципе. Их «нейтрализующее действие» проявляется феноменом антителозависимого усиления инфекции (ADE). Суть феномена заключается в следующем. Фагоцитирующие клетки экспрессируют на своей поверхности Fc-рецептор (FcR), предназначенный для взаимодействия с Fc-областью иммуноглобулина G (S.M. Tirado, K.S. Yoon, 2003). Fc-область вирус-специфических антител взаимодействует с Fc-рецептором и/или рецепторами комплемента на поверхности фагоцитирующих клеток, стимулируя поглощение этими клетками интактного вируса, т.е. антитела образуют мост между вирусом и Fc-рецептором (рецепторами факторов комплемента) на поверхности фагоцитирующей клетки, облегчая ему взаимодействие со специфическим рецептором. Феномен наблюдается в двух вариантах: а) комплемент-опосредованное антителозависимое усиление инфекции (complement-mediated ADE; C-ADE); б) не зависящее от комплемента и связан-ное с Fc-рецептором усиление инфекции (Fc-receptor-mediated ADE; FcR-ADE). У ВИЧ-инфицированных людей соблюдается определенная очередность проявления вариантов развития ADE. На ранней стадии инфекции феномен реализуется через V3-петлю gp120 (по типу FcR-ADE). По типу C-ADE феномен проявляется перед клиническим прогрессированием ВИЧ-инфекции, в его реализации задействован иммунодоминантный регион gp41 (G. Fust, 1997; H.I. Thomas et al., 1996).
В результате совпадения обоих явлений: проявления ADE на ранней стадии инфекционного процесса и шарнирного строения консервативного участка V3-петли gp120 возникает феномен «инфекционно-эволюционных качелей». В низких концентрациях нейтрализующие ВИЧ антитела усиливают инфицированность фагоцитирующих клеток. Когда их количество достигает какого-то порога, «шарнир поворачивается» и валентность антител по отношению к консервативному участку V3-петли gp120 снижается, но при этом формируется новый консервативный эпитоп, в отношении которого иммунная система немедленно начинает вырабатывать новые «нейтрализующие» антитела, те, в свою очередь, вызывают феномен ADE. Цикл повторяется, клеточный тропизм ВИЧ, его антигенные свойства и вирулентность меняются, запускается механизм дивергенции и роста разнообразия ВИЧ (рис. 4). P. Nara et al. (1991) считают, что этот механизм лежит в основе способности ВИЧ приобретать тропность то к макрофагам, то к В- и Т-клеткам.
Данная схема подтверждается клинической практикой. H. Zhang et al. (2005) обнаружили, что увеличение генетического разнообразия вируса субтипа С у детей зависит от антител с широким нейтрализующим действием. Чем выше титр таких антител, тем больше на данный момент времени вирусы различаются между собой.
На пути разработчиков вакцин стоит еще и феномен антигенного импринтинга, или первичного антигенного греха (phenomenon of original antigenic sin, OAS3). Суть феномена заключается в следующем. Отдельные карбонгидратные антигены, антигены со структурной и функциональной гомологией (в их числе иммунодоминантные регионы gp41 и gp120 ВИЧ), индуцируют мало отличающиеся иммунные ответы. Когда в процессе повторной антигенной стимуляции таким антигеном активизируются В-клетки памяти, «запомнившие» предыдущий антиген (например, введенный человеку в результате вакцинации), имеющий аналогичную структурную и функциональную гомологию, то выработка антител происходит в отношении предыдущего антигена, хотя реально иммунная система с ним не контактирует. Выработка же специфических антител к новому для иммунной системы антигену тормозится из-за подавления «наивных» В-клеток активизировавшимися В-клетками памяти. Как заметили J.M. Kim et al. (2009), в данном случае В-клетки памяти формируют «слепое пятно» (blind spot) иммунной системы4.
P. Nara et al. (1991) вышли на феномен OAS при ВИЧ-инфекции случайно. Первоначальной целью их экспериментов было расширение иммунного ответа на ВИЧ-вакцину на основе gp120 таким образом, чтобы нейтрализации антителами подвергались вирусы различного географического происхождения. Введя экспериментальным животным gp120, полученный из штамма ВИЧ-1 IIIB, они исследовали кинетику, напряженность и продолжительность штаммоспецифического иммунного ответа. Через 175 сут. они начали вторую серию опытов по иммунизации животных gp120 штамма ВИЧ-1 RF, имеющего другое географическое происхождение. После примирующей иммунизации (7–14 сут.) исследователи неожиданно для себя, так как они основывались «на представлениях о штаммоспецифическом гуморальном ответе на ВИЧ», обнаружили рост титров антител к gp120 штамма IIIB. Проведенный этими авторами ретроспективный анализ научной литературы показал, что феномен OAS уже был описан для других ретровирусных инфекций, в частности, вызываемых вирусом висны у овец (O. Narayan et al., 1978) и вирусом инфекционной анемии у лошадей (Y. Kono et al., 1971).
Продолжение следует
