Газета «Новости медицины и фармации» 16 (426) 2012
Вернуться к номеру
Симпозиум 104 «Диабетическая нефропатия»
Авторы: А.И. Дядык, Е.В. Щукина, Н.Ф. Яровая, Л.С. Холопов, И.Н. Цыба - Донецкий национальный медицинский университет им. М. Горького
Версия для печати
Проводит: Донецкий национальный медицинский университет им. М. Горького.
Рекомендован: семейным врачам, терапевтам, эндокринологам, нефрологам, урологам.
Сахарный диабет. Номенклатура, эпидемиология
По определению Американской ассоциации диабета (ADA), сахарный диабет (СД) — это группа метаболических заболеваний, характеризующихся гипергликемией, развивающейся в результате нарушения секреции инсулина, инсулиновой резистентности или комбинации этих дефектов.
Выделяют несколько классов СД: СД 1-го типа (инсулинозависимый), СД 2-го типа (инсулинонезависимый), специфические типы СД, обусловленные генетическими дефектами или воздействием лекарственных препаратов или химических веществ, и гестационный СД.
По мнению некоторых авторов, СД следует рассматривать как сосудистое заболевание, так как он характеризуется метаболическими нарушениями с широким спектром макро- и микрососудистых осложнений, определяющих у большинства больных морбидность и летальность. J. Cin и соавт. определяют СД 2-го типа как воспалительное состояние с инсулиновой резистентностью и патологической эндотелиальной сосудистой реактивностью. F. Nakhoul и соавт. рассматривают СД 2-го типа как прототип комплексного полигенного заболевания с существенным наследственным компонентом.
Особое место среди различных вариантов диабета занимает СД 2-го типа, частота которого составляет 90–95 % среди всех случаев СД, а распространенность неуклонно возрастает во всех странах. Резкое прогрессирующее увеличение количества больных СД 2-го типа специалисты рассматривают как неинфекционную эпидемию.
В 2006 году президент Международной ассоциации диабета заявил, что «СД является одной из тяжелых катастроф здоровья человека, какие существовали в мире. Эпидемия СД превысит финансовые возможности всех стран мира, если правительства не будут осуществлять адекватное финансирование по профилактике метаболического синдрома, СД и его осложнений. В настоящее время примерно 10 % медицинского бюджета приходится на лечение СД и его осложнений».
СД представляет серьезную медицинскую и социально-экономическую проблему для нашей страны. По состоянию на 1 января 2008 года в Украине было зарегистрировано 1 094 126 больных СД, что составляет 2354,7 случая на 100 тыс. населения. Ежегодный прирост показателей распространенности СД в Украине составляет 4,4 %.
Серьезными проблемами являются запоздалая диагностика СД и его осложнений, что существенно снижает лечебные возможности, а также неадекватное отношение многих больных к своему заболеванию. Качественное ведение больных СД требует больших усилий единой команды эндокринологов, кардиологов, нефрологов, неврологов, окулистов, хирургов, что, бесспорно, повысит эффективность лечения. И, наконец, достижение благоприятных результатов лечебных мероприятий станет реальным, если пациенты с СД станут активными участниками лечебной команды.
Характер течения СД определяют особенности и тяжесть микрососудистых (диабетическая нефропатия, ретинопатия) и макрососудистых осложнений (прежде всего кардиоваскулярных), а также автономных нейропатий.
Диабетическая нефропатия (ДН)— одно из серьезнейших осложнений СД 1-го и 2-го типов, характеризующееся развитием почечной недостаточности и ее неуклонным прогрессированием до терминальной стадии, что требует проведения терапии, замещающей почки, — гемодиализа, перитонеального диализа или трансплантации почки. В связи с неуклонным ростом распространенности СД 2-го типа наблюдается прогрессирующее увеличение числа больных с ДН. В настоящее время среди больных, получающих терапию, замещающую почки, лица с ДН составляют около 40–60 %.
Эпидемиология ДН
Несмотря на современные лечебные подходы, у 25–30 % больных СД 1-го типа и у 40–45 % больных СД 2-го типа через 20–40 и 10–15 лет соответственно развивается ДН. Причем развитие ДН наблюдается в более ранние сроки у лиц с неадекватным контролем гликемии, артериальной гипертензией (АГ) и дислипидемией.
Важно отметить, что развитие ДН у больных СД существенно отягощает кардиоваскулярный прогноз. Так, в крупных контролируемых рандомизированных исследованиях (КРИ) было показано прогрессирующее увеличение риска развития инфаркта миокарда, инсультов и кардиоваскулярной летальности у больных СД 2-го типа при развитии ДН (особенно при персистирующей умеренной или большой протеинурии и нарушенной функции почек).
Патогенез ДН
За последние десятилетия достигнуты существенные успехи в понимании механизмов развития ДН и других осложнений СД. Однако целый ряд вопросов требует дальнейшего изучения и уточнения. Так, не получил аргументированного объяснения широкий спектр метаболических нарушений, возникающих при СД и ведущих к развитию микро- и макроваскулярных осложнений, и в частности ДН. Так, ДН развивается только у части больных СД 1-го и 2-го типов, но у другой категории больных СД с плохим контролем гликемии, АГ и дислипидемией ДН не развивается. В то же время адекватная ренопротекторная терапия далеко не всегда предупреждает развитие и прогрессирование ДН. Остается недостаточно изученным риск развития ДН у конкретного больного СД.
Однозначно патогенез ДН имеет комплексный характер, включая генетическую предрасположенность, сложные взаимодействия метаболических и гемодинамических факторов.
В пользу генетической предрасположенности свидетельствует более высокая частота развития ДН у лиц, у которых были кровные родственники с ДН. Высказывается предположение о наличии нефропатического гена, ответственного за развитие ДН.
Первоначальным звеном в развитии ДН считают персистирующую гипергликемию. Непосредственное воздействие экстрацеллюлярной глюкозы на почечные структуры (мезангиальные, тубулярные, интерстициальные и сосудистые клетки) ведет к стимуляции факторов роста и цитокинов, таких как ангиотензин II (А II), трансформирующий фактор роста b, моноцитарный хемоаттрактантный протеин 1, интерлейкины-1, -6, фактор некроза опухоли a, оказывающих на различные почечные структуры целый комплекс неблагоприятных эффектов.
К ним относят повышение сосудистой эндотелиальной проницаемости, пролиферацию мезангиальных и эндотелиальных клеток, увеличение синтеза мезангиального матрикса, продукции свободных кислородных радикалов, индукцию ангиогенеза, развитие капиллярной вазопатии, снижение прекапиллярной резистентности и, в конечном итоге, формирование гломерулярной капиллярной гипертензии. Повышение гломерулярного капиллярного давления также связывают с инсулиновой резистентностью и гиперинсулинемией (СД 2-го типа), со снижением резистентности афферентных артериол и/или увеличением резистентности эфферентных артериол.
Гломерулярную гипертензию отягощает системная АГ, наблюдаемая в 70–80 % случаев при ДН, которая независимо от характера первоначальных патофизиологических процессов усугубляет эндотелиальные, мезангиальные и подоцитарные повреждения, способствует развитию фокально-сегментарного и глобального гломерулосклероза. Это, в свою очередь, ведет к снижению числа функционирующих нефронов и дальнейшему повышению гломерулярного капиллярного давления, формируя порочный круг почечных поражений.
Активация ренин-ангиотензиновой системы (РАС) играет важную роль в развитии и прогрессировании ДН. Подтверждением этому служат результаты многочисленных клинических и экспериментальных исследований, продемонстрировавшие замедление развития ДН и ее прогрессирования под влиянием ингибиторов ангиотензинпревращающего фермента (ИАПФ) или антагонистов рецепторов А ІІ.
Активация системной и локальной РАС, наблюдаемая при СД, ведет к развитию и/или прогрессированию ДН тремя различными путями дополнительно к системному гипертензивному эффекту:
— прямая стимуляция рецепторов ангиотензиногена II первого типа, генерированного по классическому пути (ренин-ангиотензинпревращающий фермент);
— активация энзиматического действия проренина, ведущая к увеличению ангиотензина;
— непосредственная активация рецепторов проренина/ренина с последующим увеличением продукции фибротических цитокинов (трансформирующего фактора роста b).
Среди многочисленных факторов, обусловливающих повышение гломерулярной проницаемости (простагландины, предсердный натрийуретический пептид, инсулин, активация протеиназ и др.) и ведущих к развитию микроальбуминурии (МАУ)/протеинурии, оксид азота (NO) является одним из важных. Установлено увеличение экспрессии эндотелиальной NO-синтазы почечным эндотелием у больных СД, что прямо коррелировало с тяжестью сосудистых поражений и уровнем протеинурии.
Представлены доказательства, что дисфункция сосудистого эндотелия, развивающаяся в условиях персистирующей гипергликемии, определяет скорость прогрессирования ДН и тяжесть ее клинических проявлений.
В ряде исследований показано неблагоприятное влияние на течение ДН дислипидемий, часто наблюдаемых у больных СД (особенно при развитии ДН).
ДН первоначально характеризуется гиперфильтрацией, обусловленной вызванным гипергликемией снижением артериальной резистентности, ведущей к повышению гломерулярного фильтрационного давления.
Существенное нарушение гломерулярного барьера, развивающееся у больных ДН, ведет к прохождению через гломерулярный фильтр протеинов, иммуноглобулинов, факторов роста, компонентов комплемента и железа, что инициирует самоповреждающий процесс прогрессирования гломерулосклероза, тубулоинтерстициального воспаления и фиброза, ведущий к развитию и прогрессированию почечной недостаточности.
ДН в течение длительного времени рассматривали как синоним гломерулосклероза, который считался первоначальным и главным проявлением почечного поражения. В последние годы получены убедительные доказательства вовлечения в патологический процесс тубулоинтерстициального аппарата у больных СД, на ранних этапах которого развивается гипоксия тубулоинтерстициального аппарата, обусловленная персистирующей гипергликемией, патологическими изменениями эритроцитов, оксидативным стрессом, автономной нейропатией почек, что ведет к дистрофическим изменениям эпителиальных тубулярных клеток, их апоптозу и интерстициальному фиброзу.
Дисфункция и/или потеря тубулярных и перитубулярных клеток снижает продукцию 1,25-дигидроксивитамина D3 и эритропоэтина, а следовательно, — локальные трофические эффекты этих гормонов, что усугубляет поражение почечной паренхимы и ведет к снижению почечной функции и развитию анемии.
Активация мезангиальных клеток играет важную роль в развитии диабетического гломерулосклероза. Первоначальным, наиболее характерным гломерулярным повреждением при СД является экспансия экстрацеллюлярного мезангиального матрикса, что предшествует интерстициальному поражению. Высказывается точка зрения, что экспансия мезангиального матрикса должна рассматриваться как центральный механизм в развитии ДН.
В последние годы особое внимание в патогенезе ДН уделяется патологическим процессам в подоцитах. По данным прижизненного морфологического исследования почек показана отчетливая связь снижения числа подоцитов с уровнями протеинурии и прогрессированием ДН. При клиническом улучшении (снижении уровней МАУ/протеинурии) у больных с ДН наблюдается уменьшение подоцитурии. Приведенные данные служат основанием считать убедительной концепцию, что повреждение подоцитов играет центральную роль в развитии и прогрессировании ДН.
Морфологическая картина почек при ДН
Морфологическая картина почек при ДН у больных СД 1-го типа признана уникальной и характеризуется утолщением гломерулярной базальной мембраны в сочетании с утолщением тубулярных базальных мембран, экспансией мезангиального матрикса, гломерулярным склерозом, экспансией интерстиция и его фиброзом.
Длительное время морфологическая картина почек у больных с ДН считалась однозначной при СД 1-го и 2-го типов. Однако в ряде крупных исследований, посвященных прижизненному морфологическому исследованию почек у больных СД, было показано, что структурные изменения в почках при СД 2-го типа имеют гетерогенный характер. Так, J. Zhou et al. проанализировали 110 биоптатов почек больных СД 2-го типа с наличием протеинурии. Были выявлены две группы: одна (60 человек), характеризующаяся классическими диабетическими изменениями, наблюдаемыми при СД 1-го типа, и вторая (50 человек), характеризующаяся гетерогенными морфологическими изменениями, включающими различные варианты гломерулонефритов. Важно отметить, что в сравниваемых группах клинические проявления не имели каких-либо существенных различий.
Очевидно, наличие нетипичных для ДН морфологических изменений приблизительно у половины больных СД 2-го типа обусловлено особенностями его патогенеза, отличными от такового при СД 1-го типа. Кроме того, СД 2-го типа обычно развивается после 30–40 лет, часто ассоциируется с ожирением, АГ, повышенными уровнями триглицеридов, снижением холестерина липопротеидов высокой плотности (ЛПВП), ранним развитием атеросклероза и высокой частотой развития кардиоваскулярных осложнений и хронической сердечной недостаточности, что может оказывать существенное влияние на характер морфологических изменений в почках.
Клиническая картина ДН
ДН рассматривается как клинический синдром, характеризующийся МАУ или протеинурией, прогрессирующим снижением скорости клубочковой фильтрации (СКФ), особенно после развития протеинурии, развитием или усугублением АГ. Протеинурия обычно прогрессирует от минимальной до умеренной или большой. В осадке мочи выявляется минимальная или умеренная гематурия (преимущественно измененные эритроциты) и цилиндрурия.
Клиническая картина ДН при СД 1-го типа
Естественное течение ДН детально изучено у больных СД 1-го типа и классически представлено 5 стадиями. Гипертрофией нефронов и гиперфильтрацией, обусловливающей повышение СКФ на 20–40 %, характеризуются 1–2-я стадии. На этих стадиях, длящихся 5–15 лет, отсутствуют МАУ/протеинурия, гематурия, цилиндрурия, отеки и АГ. Гиперфильтрация, устанавливаемая обычно у больных СД 1-го типа на начальных стадиях заболевания, ассоциируется с плохим метаболическим контролем. По мере улучшения гликемических показателей и начальных патологических процессов в почках (3-я стадия, называемая некоторыми авторами скрытой ДН — incipient nephropathy) снижаются уровни СКФ до нормы и увеличивается экскреция альбумина с мочой до 30–300 мг/сутки, что обозначается как МАУ. Продолжительность 3-й стадии широко варьирует в зависимости от индивидуальных особенностей течения ДН, качества контроля гликемии, артериального давления (АД), дислипидемии, а также применения ингибиторов ренин-ангиотензиновой системы и обычно составляет несколько лет. Обозначаемая некоторыми авторов как явная ДН (overt nephropathy), 4-я стадия ДН характеризуется развитием протеинурии от минимальной до большой (в последнем случае формируется нефротический синдром), микрогематурии, цилиндрурии, а также развитием или усугублением АГ. На этой стадии наблюдается снижение СКФ, интенсивность которого характеризуется широкой индивидуальной вариабельностью — от 2 до 10 мл/мин/год. 5-я стадия характеризуется развитием тяжелой почечной недостаточности, достигающей терминальной, с присущими ей клиническими проявлениями (уремическая интоксикация, анемия, плохо контролируемая АГ, нарушение кислотно-щелочного равновесия, электролитного дисбаланса и др.).
Клиническая картина ДН при СД 2-го типа
Описанная выше динамика клинико-лабораторных показателей наблюдается только у небольшой части больных ДН при СД 2-го типа, что обусловлено особенностями почечного поражения (морфологическая картина описана выше) и возрастными различиями начала СД.
Многие авторы склонны выделять две клинические стадии ДН у больных СД 2-го типа: скрытая и явная ДН. Для первой стадии, протекающей субклинически, характерно развитие МАУ (суточные потери альбумина 30–300 мг/сутки). Вторая стадия ДН характеризуется наличием протеинурии (от минимальной до большой), микрогематурией, цилиндрурией, развитием или усугублением АГ (последняя часто носит тяжелый характер и нередко трудно корригируется антигипертензивными препаратами). Нам представляется более корректным обозначать эти две стадии ДН как микроальбуминурическую и протеинурическую.
Клиническая картина ДН у больных СД 2-го типа характеризуется существенным разнообразием, что объясняется многими факторами, включающими широкий спектр возрастных групп (от 30 лет и старше), особенностями течения СД и коррекцией гликемии, стадией ДН, наличием других макро- и микрососудистых осложнений СД, сопутствующих заболеваний и патологических состояний (эссенциальная АГ, ишемическая болезнь сердца с различными клиническими проявлениями, сердечная недостаточность, хроническое обструктивное заболевание легких и др.).
Микроальбуминурическая стадия ДН характеризуется развитием МАУ (наличие низких уровней альбумина в моче — 30–300 мг/сут, невыявляемых рутинными лабораторными методами). Британские авторы показали, что у больных СД 2-го типа риск развития МАУ составляет 2 % в год, а риск прогрессирования МАУ в протеинурию — 2,8 % в год. Причем риск выше у лиц с плохим гликемическим контролем и наличием АГ. Адекватный контроль гликемии и АГ замедляют развитие МАУ и/или ее прогрессирование в протеинурию. Как мы отмечали выше, обозначать эту стадию как «скрытая ДН» представляется некорректным, что аргументируется существенным снижением СКФ у высокого процента больных не только с МАУ, но и с нормальной альбуминурией (менее 30 мг/сут).
Так, в крупномасштабном исследовании DEMAND (Developing Education on Microalbuminuria in type 2 Diabetes) оценено функциональное состояние почек у 11 573 больных СД 2-го типа с разными уровнями альбуминурии. Средние величины СКФ у больных с нормоальбуминурией оказались ниже 60 мл/мин в 20,5 % случаев; у лиц с МАУ — в 30,7 % и в 35,0 % случаев — у больных с макроальбуминурией.
Развитие протеинурической стадии ДН свидетельствует о тяжелом диабетическом поражении почек и характеризуется неуклонным прогрессированием снижения их функции у подавляющего большинства больных до терминальной стадии почечной недостаточности с присущими ей клиническими проявлениями.
Уровни протеинурии варьируют от минимальных до высоких (чаще наблюдается умеренная или большая протеинурия), наличие последних ассоциируется с увеличением скорости снижения функции почек. У лиц с большой протеинурией (суточные потери белка 3,0–3,5 г) развивается нефротический синдром с присущими ему кардинальными симптомами, включающими гипо- и диспротеинемию, отеки, дислипидемию.
Задержку жидкости и формирование отеков отмечают уже на ранних этапах ДН. Интенсивность отеков нарастает при развитии нефротического синдрома.
В клинической картине у больных с ДН часто представлены потливость, ортостатическая гипотензия, диарея, ретинопатия, периферическая нейропатия и импотенция.
Анемия у больных с ДН развивается уже на ранних этапах почечной недостаточности и нарастает по мере усугубления почечной дисфункции. Ведущей причиной развития анемии является снижение продукции эритропоэтинов, которые продуцируются в перитубулярных фибробластах почечной коры. Перитубулярные и интерстициальные поражения, присущие ДН, обусловливают дефицит эритропоэтинов, развитие, персистенцию и прогрессирование анемии.
Отдельного обсуждения требует проблема кардиоваскулярных осложнений (КВО), развивающихся при СД и, в частности, при ДН.
Кардиоваскулярные осложнения являются ведущей причиной морбидности и летальности у больных СД. Около 65 % летальных исходов при СД 2-го типа обусловлены различными КВО. В крупномасштабных КРИ показано нарастание риска развития инфарктов мио-карда, инсультов и кардиоваскулярной летальности у больных СД 2-го типа при развитии ДН, почечной недостаточности и ее прогрессировании. Риск КВО увеличивается при неадекватном контроле гликемии, АГ, дислипидемии, а также при ожирении.
Важной представляется проблема взаимосвязи СД и АГ. Больные эссенциальной АГ per se имеют более высокий риск развития de novo СД 2-го типа, что особенно присуще пациентам с АГ, получавшим в качестве гипотензивной терапии b-адреноблокаторы и/или диуретики (преимущественно тиазидовые). При СД 1-го типа причиной АГ является развитие ДН.
По данным различных авторов, распространенность АГ у больных с впервые диагностированным СД 2-го типа составляет 45–80 %. АГ выявляется в 2–3 раза чаще у больных СД 2-го типа, чем у лиц без диабета. Распространенность АГ существенно повышается с возрастом, длительностью СД, развитием ДН. Наличие последней (особенно протеинурической стадии) тесно ассоциируется с развитием АГ и ее усугублением.
Сосуществование СД с АГ значимо повышает риск развития кардиоваскулярных микро- и макрососудистых осложнений. Наличие АГ у больных СД повышает кардиоваскулярную летальность в 7,2 раза, а при СД с ДН и АГ кардиоваскулярная летальность увеличивается в 37 раз по сравнению с больными СД без АГ и ДН.
Наличие эссенциальной АГ у больных СД 2-го типа ассоциируется с высоким риском развития или усугубления ДН. При этом формируется так называемый порочный круг, что показано на рис. 1.
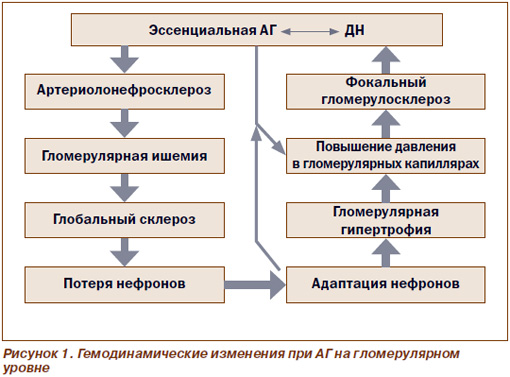
Как показано на рис. 1, наличие эссенциальной АГ при СД 2-го типа ведет к развитию артериолонефросклероза с последующими изменениями в почечных структурах, приводящими в конечном счете к развитию фокального гломерулосклероза, обусловливающего развитие или усугубление АГ.
Дислипидемии при ДН
Развивающаяся при СД 1-го типа дислипидемия характеризуется нормальными уровнями холестерина липопротеидов низкой плотности (ЛПНП) и ЛПВП и повышенными значениями триглицеридов. Развитие триглицеридемии первоначально обусловлено плохим гликемическим контролем. При персистенции неадекватного контроля гликемии возможно снижение уровней холестерина ЛПВП и повышение значений холестерина ЛПНП.
СД 2-го типа обычно ассоциируется со снижением холестерина ЛПВП, повышенными значениями триглицеридов и нормальными уровнями холестерина ЛПНП. Однако при этом ЛПНП характеризуются меньшими размерами, высокой плотностью и повышенной атерогенностью.
В эксперименте получила подтверждение гипотеза, что липиды могут непосредственно индуцировать почечные повреждения и прогрессирование почечной недостаточности. В ряде эпидемиологических исследований продемонстрирована ассоциация повышенных уровней холестерина и триглицеридов с ускорением прогрессирования почечной недостаточности у больных с ДН. Одним из объяснений этому служат экспериментальные исследования, продемонстрировавшие, что под влиянием липидов происходит активация мезангиальных клеток и рекрутирование макрофагов за счет продукции хемокинов. Активированные мезангиальные клетки и аккумулированные макрофаги высвобождают кислородные радикалы, ведущие к окислению ЛПНП, которые стимулируют провоспалительные и профибротические цитокины. Центральным компонентом этого процесса является фагоцитоз липопротеидов макрофагами и мезангиальными клетками, что ведет к продуцированию пенистых клеток, выявляемых в склерозированных участках гломерул и в участках интерстициального фиброза.
Лечебная тактика при ДН
Учитывая многоплановые патологические процессы, присущие СД и его осложнениям (в частности, ДН), лечебные подходы должны базироваться на комплексном подходе, направленном на контроль гликемии, превентирование развития ДН и ингибицию ее прогрессирования, превентирование развития КВО, своевременное и адекватное их лечение. Качество лечебных мероприятий при СД может быть обеспечено только при мультидисциплинарном подходе.
Ренопротекция и кардиопротекция
Ренопротекция — комплекс лечебных подходов, направленных на превентирование развития ДН и ингибицию ее прогрессирования.
Термином «кардиопротекция» объединяют лечебные подходы, целью которых является снижение присущего СД (в частности, ДН) высокого риска сердечно-сосудистых осложнений.
По современным представлениям, все больные с ДН (I–V стадии хронического повреждения/заболевания почек) относятся к группе высокого и очень высокого сердечно-сосудистого риска. Показано, что применение у них кардиопротекторных подходов приводит к снижению этого риска; в силу этого кардиопротекция при ДН рассматривается как обязательный компонент лечебной стратегии.
Оптимальный лечебный режим при ДН для осуществления органопротекции (рено-, кардиопротекции, вазопротекции в широком смысле слова, т.е. церебро- и ретинопротекции, а также превенирование развития атеросклероза периферических артерий и нейропатий) включает комплекс немедикаментозных и лекарственных лечебных подходов.
Немедикаментозные подходы к ведению больных с ДН — изменение образа жизни
Изменению образа жизни отводят важное место в достижении оптимального лечебного эффекта у больных ДН. Этот подход не требует существенных финансовых затрат (ввиду чего общедоступен). Вместе с тем изменение привычного для больного образа жизни требует осознанного понимания необходимости его осуществления и тесного сотрудничества с врачом. Приверженность больного к рекомендованной терапии существенно повышается, если врач доступно, настойчиво и профессионально грамотно разъясняет необходимость выполнения лечебных рекомендаций.
Основные положения изменения образа жизни больных ДН включают:
— отказ от курения (уменьшение риска почечного и сердечно-сосудистого поражения);
— ограниченное употребление углеводов в пище (≈ 130 г/сут) улучшает гликемический контроль. Количество насыщенных жиров в пище должно быть < 7 % от всего калоража (снижает уровень холестерина ЛПНП и повышает значения холестерина ЛПВП);
— снижение избыточной массы тела. Оптимальные значения массы тела 18,5–24,9 кг/м2, окружность талии у мужчин < 102 см и у женщин < 88 см (улучшает контроль гликемии, снижает инсулиновую резистентность, скорость прогрессирования почечного повреждения и риск развития КВО). Показано постепенное снижение массы тела (450–500 г в неделю) за счет уменьшения калоража на 500–2000 ккал/сут;
— ограниченный прием поваренной соли с пищей. С целью профилактики развития АГ показано ограничить прием поваренной соли < 6,0 г/сут. Лицам с АГ рекомендуется более существенное ограничение поваренной соли — < 3,0 г/сут с целью улучшения коррекции АД под влиянием антигипертензивной терапии;
— ограниченное поступление белка с пищей (0,8–1,0 г/кг м.т./сут) независимо от уровней протеинурии. При выраженной почечной недостаточности (III–V стадии) рекомендовано более значительное ограничение поступления белка с пищей (0,6–0,7 г/кг м.т./сут);
— физические нагрузки. Лицам без АГ (с целью снижения риска ее развития), а также больным с АГ (для улучшения контроля АД) рекомендуются динамические физические занятия умеренной интенсивности (ходьба, плаванье, велосипед) 4–7 раз в неделю длительностью 30–60 минут. Интенсивность физических нагрузок должна базироваться на самочувствии пациента, частоте пульса и уровнях АД;
— больным как с нормальным АД, так и с АГ рекомендовано ограниченное употребление алкоголя (не более 200 г некрепленого вина в сутки).
Контроль гликемии у больных сахарным диабетом
Ведущее место в ведении больных с СД 1-го и 2-го типов с наличием ДН и без таковой занимает строгий контроль гликемии. Целевые уровни глюкозы капиллярной плазмы натощак — ≤ 6,5 ммоль/л (рекомендации Европейской ассоциации по изучению диабета — ЕАSD) или 3,9–7,2 ммоль/л (рекомендации ADA) и целевые значения гликозилированного гемоглобина — менее 6,5 % (рекомендации ЕАSD) или менее 7,0 % (рекомендации ADA). Постпрандиальная (через 2 часа после еды) гликемия — менее 10,0 ммоль/л (рекомендации ADA).
Целевые уровни глюкозы должны быть индивидуализированы в зависимости:
— от продолжительности диабета;
— наличия коморбидности;
— наличия кардиоваскулярных заболеваний или микроваскулярных осложнений;
— более или менее строгий гликемический контроль может быть приемлем в зависимости от индивидуальных особенностей больного.
Гликемический контроль при СД 1-го типа
Ведущим компонентом в контроле гликемии при СД 1-го типа является инсулин. ADA рекомендует применять инсулин не менее 3 раз в сутки. Больным, получающим инсулин, необходима регулярная оценка риска гипогликемии. Такие больные должны быть информированы, как самостоятельно распознавать и купировать эпизоды гипогликемии.
Гликемический контроль при СД 2-го типа
Большинству больных СД 2-го типа рекомендуется прием метформина. При необходимости для достижения целевых уровней гликозилированного гемоглобина дополнительно применяется инсулин. Кроме того, дополнительно возможно использование короткодействующих препаратов сульфонилмочевины (например, гликлазида).
Метформин — инсулин-сенсибилизирующий бутанид и ингибитор печеночной продукции глюкозы, обладающий антигипергликемическими свойствами. Представлены доказательства, что его длительное применение ассоциируется со снижением кардиоваскулярного риска, благоприятным воздействием на метаболизм липидов, факторы свертывания и функцию тромбоцитов. В эксперименте показано уменьшение диастолической дисфункции левого желудочка сердца под влиянием метформина. Имеется убедительная доказательная база о безопасности использования метформина у больных с ДН при коррекции дозировки препарата в соответствии с состоянием почечной функции. В табл. 1 показаны рекомендуемые дозировки метформина в зависимости от значений СКФ.
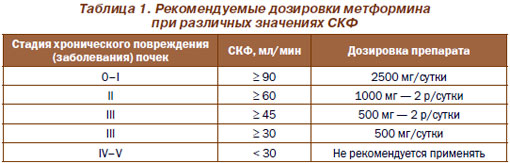
Адекватный гликемический контроль способствует снижению почечного поражения при ДН у больных СД 1-го и 2-го типов — замедлению прогрессирования МАУ в макроальбуминурию. Отсутствуют убедительные доказательства снижения протеинурии и риска развития терминальной стадии почечной недостаточности при строгом гликемическом контроле (гликозилированный гемоглобин менее 7,0 %).
Лечение артериальной гипертензии
АГ, обусловленная ДН и недиабетическим повреждением (заболеванием) почек, составляет около 5 % в структуре АГ, занимая по частоте 2-е место после эссенциальной АГ.
По данным различных авторов, развитие АГ наблюдается на различных этапах течения ДН и выявляется на 2–5-й стадиях хронического повреждения почек в 85–100 % случаев.
Развитие АГ сопряжено с целым рядом негативных гемодинамических изменений на гломерулярном уровне: отчетливо повышается резистентность афферентных артериол, в меньшей мере — эфферентных артериол. Вследствие этих процессов снижается почечный кровоток, возрастает интрагломерулярное капиллярное давление, развивается гиперфильтрация, ведущая к гипертрофии нефронов.
АГ сегодня рассматривается в качестве одного из важнейших факторов риска развития и прогрессирования почечной недостаточности у больных с ДН. Показано, что при некорригируемой АГ умеренной и выраженной степени темп снижения СКФ может достигать 10–12 мл/мин/год.
Больным с ДН показан строгий контроль АД с целью замедления прогрессирования почечного поражения, снижения риска КВО, сердечно-сосудистой и общей летальности.
У больных с ДН целевые уровни систолического АД должны быть менее 130 мм рт.ст., диастолического — менее 80 мм рт.ст.
При АГ у больных с ДН могут применяться все базисные классы антигипертензивных препаратов. Учитывая часто наблюдаемую резистентность АГ (особенно при развитии почечной недостаточности), обычно необходимо использовать различные комбинации антигипертензивных средств, нередко включая три и более класса.
Антигипертензивная терапия у лиц с ДН должна обязательно включать (при отсутствии непереносимости или противопоказаний) ИАПФ или антагонисты рецепторов ангиотензина II (АРА II) — сартаны, учитывая их рено- и кардиопротекторные эффекты. Мнения относительно комбинированного использования ИАПФ и АРА II неоднозначны. Очевидно, до окончания крупного КРИ VANEPHRON-D, посвященного оценке эффективности самостоятельного приема лосартана против комбинации лосартана с лизиноприлом, комбинацию ИАПФ и АРА II можно считать приемлемой у больных ДН с уровнями протеинурии более 1,0 г/сутки, при отсутствии антипротеинурического эффекта при самостоятельном использовании ИАПФ и АРА II.
Необходимость применения ИАПФ или АРА II мотивируется способностью этих классов препаратов ингибировать неблагоприятное влияние активации РАС на почки, включая констрикцию эфферентных артериол, развитие интрагломерулярной гипертензии, дисфункцию эндотелия гломерулярных капилляров, стимуляцию интрагломерулярного хемотаксиса макрофагов и фибро-бластов, активацию симпатической нервной системы, а также увеличение пролиферации гладкомышечных клеток сосудов, активацию подоцитов и провоспалительных цитокинов, развитие гломерулярного склероза и интерстициального фиброза.
Ингибиция РАС под влиянием ИАПФ или АРА II нивелирует или снижает вышеперечисленные неблагоприятные эффекты активации РАС (в частности, А II), что проявляется антигипертензивным эффектом, снижением почечной вазоконстрикции и интрагломерулярной гипертензии, уменьшением активности симпатической нервной системы, замедлением развития МАУ и прогрессированием ее в макроальбуминурию (протеинурию), замедлением развития гломерулосклероза и интерстициального фиброза, почечной недостаточности и ее прогрессирования.
В качестве компонентов комбинированной антигипертензивной терапии применяются блокаторы кальциевых каналов, оказывающие ренопротекторное действие (недигидропиридиновые — верапамил, дилтиазем — проявляют более выраженный ренопротекторный эффект, чем дигидропиридиновые), а также b-адреноблокаторы. Нередко (особенно при развитии почечной недостаточности) показано применение диуретиков (предпочтительно петлевых — фуросемида, торасемида). В ряде сообщений, опубликованных в последние годы, отмечается увеличение натрийуреза и повышение антигипертензивного эффекта при комбинации петлевых и тиазидовых диуретиков, а также при самостоятельном применении последних. Калийсберегающие диуретики не показаны лицам со сниженной почечной функцией из-за высокого риска развития гиперкалиемии (особенно при комбинации с ИАПФ или с АРА II).
Учитывая персистирующую активацию симпатической нервной системы больных с СД, в качестве одного из компонентов антигипертензивной терапии при необходимости приемлемо использование симпатолитических препаратов центрального действия (моксонидин).
Лечебные подходы, направленные на превентирование/снижение микроальбуминурии/протеинурии
Как мы отмечали ранее, ДН характеризуется развитием почечной недостаточности и ее неуклонным прогрессированием терминальной стадии. При этом часто прогрессирование почечного повреждения в значительной мере определяется не столько особенностями первоначального почечного поражения, сколько наличием факторов риска, к каковым наряду с АГ относится протеинурия.
Протеинурия сегодня рассматривается как один из ведущих факторов риска прогрессирования ДН. Описанное нами повышение гломерулярной проницаемости, развивающееся при ДН, способствует поступлению в просвет проксимальных канальцев различных факторов, проявляющих токсические и провоспалительные эффекты, включающих комплемент, липопротеиды, железосодержащие компоненты и повышенное количество белка, что ведет к перегрузке тубулярных эпителиальных клеток. Мембраностабилизирующий комплекс С5b-9, депонируясь в проксимальном тубулярном эпителии, приводит к повреждению канальцев. Перегрузка транспортной системы проксимальных канальцев белком ведет к индукции хемокинов, оксида азота и факторов роста. При этом активированные клетки проксимальных канальцев приобретают свойства воспалительных клеток. В конечном итоге индуцируются тубулярные повреждения, происходит гиперплазия тубулярного эпителия и развивается тубулоинтерстициальный фиброз.
В многочисленных исследованиях показано, что уровни протеинурии прямо коррелируют с повышенным риском прогрессирования почечного поражения. Так, у больных с минимальной протеинурией (суточные потери белка менее 1,0 г) наблюдается снижение СКФ приблизительно на 3–4 мл/мин/год. В то же время при большой протеинурии (суточные потери белка с мочой 3,0–3,5 г/сут) имеет место более быстрое снижение клубочковой фильтрации (около 7–14 мл/мин/год).
В крупных КРИ показано отчетливое снижение уровня протеинурии у больных ДН под влиянием ИАПФ или АРА II, а также замедление развития МАУ и прогрессирования ее в макроальбуминурию. Причем антипротеинурический эффект мало зависел от интенсивности снижения АД.
Приведенные данные послужили основанием для рекомендаций, касающихся применения ИАПФ или АРА ІІ больным с СД как с наличием АГ, так и без таковой с целью превентирования развития ДН и КВО, а также у больных с ДН с целью снижения прогрессирования МАУ в макроальбуминурию/протеинурию и снижения уровня последних при их развитии и ингибиции прогрессирования почечной недостаточности.
Антагонисты альдостерона
Как показано выше, в качестве стандартной терапии СД с ДН и без таковой рекомендовано применение ИАПФ или АРА II, что мотивируется их антигипертензивным эффектом и превентированием развития МАУ и протеинурии, почечной недостаточности и ее прогрессирования. Однако после первоначального снижения протеинурии у части больных в последующем наблюдается ее повышение, несмотря на блокаду РАС. Такое вторичное повышение протеинурии связывают с феноменом высвобождения альдостерона при блокировании РАС ИАПФ или АРА II, в связи с чем представляется рациональным блокирование рецепторов альдостерона.
Приведены убедительные доказательства того, что альдостерон оказывает непосредственное (независимое от уровней АД) повреждающее действие на почки, включающее апоптоз подоцитов и повышение их адгезивных способностей, а также нарушение пролиферации подоцитов и снижение их количества, что ведет к повреждению гломерулярной базальной мембраны и ее адгезии к боуменовой капсуле, результатом чего является развитие гломерулосклероза. Минералоглюкокортикоидные рецепторы представлены и в других почечных клетках, включая мезангиальные клетки и почечные фибробласты.
В последние годы продемонстрирована способность альдостерона промотировать инсулиновую резистентность и играть определенную роль в патогенезе метаболического синдрома и СД. Гиперальдостеронизм ассоциируется с нарушением панкреатических b-клеток и повышенной продукцией провоспалительных адипокинов из жировой ткани, что результируется в системное воспаление и нарушение толерантности к глюкозе. Показано, что кардиоваскулярные и почечные повреждения, ассоциированные с инсулиновой резистентностью, в определенной мере обусловлены неблагоприятными эффектами альдостерона.
В ряде клинических исследований показана способность антагонистов альдостерона оказывать антигипертензивный и антипротеинурический эффекты, замедлять развитие и прогрессирование гломерулосклероза и интерстициального фиброза.
Так, A. Meiraker et al. показали дополнительный ренопротекторный эффект (снижение уровней протеинурии) спиронолактона (25 мг/сут) при его комбинации с ИАПФ или АРА II у больных с ДН. Отмечено снижение уровня протеинурии на 32 % при дополнительном назначении спиронолактона к базисной терапии. Причем этот эффект не зависел от фоновых уровней альдостерона плазмы и его изменений в ходе терапии, а также от динамики АД. Авторы данного исследования отметили широкую индивидуальную вариабельность эффекта спиронолактона. По их мнению, при недостаточном ренопротекторном ответе возможно увеличение дозы спиронолактона до 50 мг/сут.
В последние годы интенсивно изучается клиническая эффективность непосредственной ингибиции ренина у больных с эссенциальной АГ, а также АГ при СД и ДН. Показано, что ингибиция ренина алискиреном оказывает хороший антигипертензивный эффект. В ряде исследований продемонстрирован стойкий антипротеинурический эффект алискирена.
Анемия при ДН и ее коррекция
Одним из серьезных клинических проявлений ДН является анемия, наблюдаемая при развитии почечной недостаточности и прогрессирующая по мере усугубления почечной функции. Частота развития анемии при ДН и ее тяжесть выше, чем при недиабетической нефропатии, при сравнимой выраженности почечной недостаточности. Во II стадии хронического повреждения/заболевания почек анемия наблюдается в 8–27 % случаев и возрастает до 67–100 % при IV–V стадиях.
Патофизиология развития анемии при диабетической и недиабетической нефропатии представляется многофакторной. В качестве ведущего фактора рассматривают нарушение продукции эритропоэтина в почках. Также определенную роль в развитии анемии играют дефицит эндогенного железа и нарушение депонирования его в тканях.
Анемия у больных с ДН считается весомым неблагоприятным фактором, ухудшающим качество жизни, повышающим сердечно-сосудистую и почечную летальность у додиализных больных и у больных, получающих диализное лечение.
Ведущее место в лечение анемии у больных с ДН отводится эритропоэзстимулирующим препаратам (ЭСП) — эритропоэтинам, используемым в комбинации с препаратами железа.
ЭСП рекомендуют назначать больным с анемией при уровнях гемоглобина менее 100 г/л. Для больных, получающих ЭСП, в качестве целевого следует рассматривать уровень гемоглобина 110 г/л. Приемлемыми являются уровни гемоглобина в пределах 100–120 г/л.
Больным с уровнем гемоглобина менее 110 г/л, не получающим ЭСП, рекомендуют использовать препараты железа для поддержания уровней ферритина более 100 нг/мл и насыщения трансферрина более 20 %.
Больным, получающим ЭСП, рекомендуют применять препараты железа для поддержания уровней ферритина более 100 нг/мл и насыщения трансферрина более 20 %.
В ряде крупных КРИ продемонстрированы эффективность и безопасность ЭСП, используемых в комбинациях с препаратом железа.
Дислипидемия при ДН и ее коррекция
Нарушение метаболизма липидов при СД (в том числе ДН) является частым осложнением СД как с наличием ДН, так и без таковой. Дислипидемия непосредственно сама по себе не вызывает развития ДН, но способствует ее прогрессированию.
У больных СД 2-го типа дислипидемия характеризуется снижением уровней холестерина ЛПВП, ассоциируемым с повышением уровней триглицеридов. Кроме того, у части больных наблюдаются и другие варианты дислипидемий, представленные повышением общего холестерина, холестерина ЛПНП, триглицеридов и снижением холестерина ЛПВП.
Распространенность и выраженность гипер- и дислипидемий увеличивается при развитии дисфункции почек и ее прогрессировании. По данным эпидемиологических исследований, у больных с диабетической и недиабетической нефропатиями при почечной недостаточности (II–V стадий) наблюдается дислипидемия.
Ведущие механизмы развития перечисленных изменений липидного профиля включают увеличение синтеза атерогенных липидов в печени и замедление их выведения из циркуляции вследствие нарушений рецептор-зависимого и рецептор-независимого катаболизма.
У больных СД с ДН и без таковой гипер- и дислипидемия ассоциируются с существенным нарастанием сердечно-сосудистого риска. Так, при повышении уровней холестерина ЛПНП всего на 1,0 ммоль/л (начиная с величины 2,0 ммоль/л) сердечно-сосудистый риск увеличивается примерно в 2 раза.
Ряд экспертов отмечает, что повышение уровней холестерина ЛПНП, триглицеридов и снижение значений холестерина ЛПВП могут быть факторами, способствующими прогрессированию гломерулярного склероза и интерстициального фиброза.
Лечебная тактика у больных СД с дислипидемией представлена в рекомендациях Европейской ассоциации кардиологов и Европейской ассоциации атеросклероза (2011), а также в стандартах Американской ассоциации диабета (2011) и включает следующие положения:
— всем больным с СД 1-го типа при ДН (при микроальбуминурической или протеинурической стадиях) рекомендуется снижение холестерина ЛПНП на 30 % в первую очередь статинами, а при необходимости — комбинацией различных гиполипидемических средств независимо от фоновых значений холестерина ЛПНП;
— больным СД 2-го типа при наличии кардиоваскулярных заболеваний или ДН (при микроальбуминурической или протеинурической стадиях) и пациентам без кардиоваскулярных заболеваний и ДН, которые старше 40 лет, с одним или более факторов кардиоваскулярного риска или наличием маркеров органного поражения, рекомендуются целевые уровни холестерина ЛПНП < 1,8 ммоль/л и ЛПВП < 2,6 ммоль/л.
Список литературы находится в редакции


