Газета «Новости медицины и фармации» Гастроэнтерология (434) 2012 (тематический номер)
Вернуться к номеру
Панкреатология и «скелет в шкафу»
Авторы: Н.Б. Губергриц, П.Г. Фоменко - Донецкий национальный медицинский университет им. М. Горького
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
В статье проанализированы современные данные о патогенезе, диагностике и лечении метаболической остеопатии при панкреатической недостаточности. Представлены данные о частоте изменений со стороны костей при хроническом панкреатите и об основных средствах лечения остеопатии.
Панкреатическая недостаточность, гиповитаминоз D, нарушения метаболизма кальция, остеопатия.
В панкреатологии тоже есть свой скелет в шкафу
— это остеопороз.
При панкреатической недостаточности кости увядают,
как деревья в пустыне.
M. Gulzow, немецкий панкреатолог
Значительное место в формировании клинического синдрома недостаточности питания (мальнутриции) при заболеваниях поджелудочной железы (ПЖ), протекающих с панкреатической недостаточностью, занимают гиповитаминозы. К сожалению, практические врачи почти не знакомы с их проявлениями, патогенетическим значением. В то же время гиповитаминозы, с одной стороны, приводят к тяжелым клиническим последствиям, с другой стороны — усугубляют панкреатическую недостаточность, т.к. для продукции ферментов ПЖ необходим целый ряд витаминов. В этом отношении существен тот факт, что лечение гиповитаминозов в настоящее время не является особенно сложным. Мы имеем целый ряд препаратов витаминов, причем достаточно эффективных. Важно вовремя диагностировать тот или иной гиповитаминоз и вовремя назначить соответствующее лечение.
Одним из таких гиповитаминозов, который диагностируют поздно или вообще не диагностируют, является гиповитаминоз D, который приводит к нарушению метаболизма кальция и серьезным изменениям со стороны костей. Это и есть настоящий скелет в шкафу, который панкреатологи обнаруживают в самый неожиданный и неподходящий момент: при очень выраженных костно-деструктивных изменениях, когда даже правильное лечение не может существенно помочь пациенту. До этого гиповитаминоз D и легкие изменения со стороны костей протекают бессимптомно. Попробуем в настоящей статье показать необходимость ранней диагностики и раннего назначения лечения в этой ситуации.
Начнем с различных гиповитаминозов как проявлений мальнутриции при панкреатической недостаточности. В патогенезе разнообразных клинических проявлений мальнутриции при заболеваниях ПЖ большое значение имеют полигиповитаминозы. Причем при этих заболеваниях развиваются все три патогенетические формы гиповитаминозов: алиментарная, резорбционная и диссимиляционная. Алиментарная форма обусловлена ограничениями диеты, которые в панкреатологии носят довольно жесткий характер. В частности, при хроническом панкреатите (ХП) недостаточное содержание витаминов в пище может быть связано с ситофобией, нерациональным подбором продуктов питания, ограничениями видов кулинарной обработки пищи. Например, при преимущественно углеводном питании (при отсутствии панкреатогенного сахарного диабета) с течением времени развивается недостаточность витаминов В1, В2 и С, т.к. при таком питании требуется повышенное количество этих витаминов. При дефиците белков в пище нарушается обмен витаминов группы В, С и витамина А; повышенное содержание белков в пище приводит к дисбалансу витаминов группы В, особенно В6 [12]. При заболеваниях ПЖ преобладает резорбционная форма витаминной недостаточности, которая связана с разрушением витаминов в полости пищеварительного тракта и, что особенно важно, с нарушением их всасывания [12]. В частности, при патологии ПЖ преобладает нарушение всасывания жирорастворимых витаминов — A, D, E, K. Полигиповитаминоз A, D, E, K развивается при панкреатической недостаточности быстро, даже в отсутствие ее классических клинических проявлений (полифекалия и др.). Так, описан случай подобного полигиповитаминоза, который развился у больного ХП за 5 лет от начала заболевания [30].
Диссимиляционная форма гиповитаминозов возникает при нарушениях интермедиарного обмена веществ, которые приводят к витаминному дисбалансу. Это возможно при дисбалансе различных компонентов пищи, что как раз и характерно для питания больных с заболеваниями ПЖ. Кроме того, такая форма гиповитаминозов развивается при повышенном расходе витаминов. Диссимиляционная форма чаще формируется при алкогольном ХП, когда имеют место не только нарушение поступления витаминов с пищей и гиповитаминозы вследствие панкреатической недостаточности, но и алкогольное поражение печени, участвующее в нарушении обмена почти всех витаминов [12].
Различные патогенетические варианты приводят к тому, что чаще при мальнутриции у больных с ХП развиваются гиповитаминозы А (в 67 % случаев), Е (в 71 % случаев), С (в 39 % случаев) [32, 39]. При панкреатической недостаточности нарушается всасывание магния, марганца, цинка, железа, селена, витаминов группы В и др. [27].
Дефицит витаминов и дефицит микроэлементов тесно связаны между собой. Например, для активации тиамина необходимо достаточное содержание магния в тканях [32]. При панкреатической недостаточности снижается всасывание цинка в тонкой кишке [27], особенно при алкогольном ХП. Дефицит цинка и/или витамина А формирует порочный круг недостаточности образования ряда жизненно важных веществ, изменяет многие физиологические процессы и доставку микронутриентов к органам. Дело в том, что дефицит цинка может вести к недостаточному образованию белков, ответственных за активацию витамина А внутри клетки [17]. Дефицит цинка, магния и меди участвует в нарушении толерантности к глюкозе [1, 11, 17]. Таким образом, панкреатогенный сахарный диабет может быть не только результатом поражения паренхимы ПЖ, но и проявлением трофологической недостаточности. В эксперименте показано, что недостаточность цинка вызывает повреждение ацинарных клеток, подавляет синтез панкреатического протеина, гормональную стимуляцию секреции бикарбонатов, способствует прогрессированию недостаточности липидов [4, 5].
Дефицит селена является следствием панкреатической недостаточности и при этом вносит вклад в ее прогрессирование. При дефиците селена развиваются дегенерация и фиброз паренхимы ПЖ, он способствует повреждению органа свободными радикалами. Следовательно, дефицит цинка и селена приводит к развитию своеобразного нутриционного вторичного панкреатита на фоне уже имеющегося ХП алкогольной этиологии. Прогрессированию нутриционного компонента патогенеза ХП способствует сама панкреатическая недостаточность как таковая, так как в условиях белково-энергетической недостаточности снижается продукция гормонов и ферментов ПЖ [4, 5].
Развитие гиповитаминозов и недостаточности макро- и микроэлементов при ХП становится более вероятным при алкоголизме. Он может быть причиной недостаточности большинства витаминов группы В (тиамина, рибофлавина, пиридоксина, фолатов, ниацина, пантотеновой кислоты, биотина), витаминов А и С. Кроме того, алкоголизм способствует дефициту цинка, селена и магния. Недостаточность тиамина при алкогольном ХП может сформироваться еще до развития мальнутриции, при этом появляются клинические проявления полинейропатии, бери-бери, синдрома Вернике — Корсакова [4, 5]. Дефицит рибофлавина также характерен для алкоголиков, причем этот гиповитаминоз может усугублять недостаточность ПЖ, так как способствует снижению продукции белков, амилазы, химотрипсиногена и трипсиногена. В связи с тем, что рибофлавин является предшественником двух ферментов, участвующих в метаболизме пиридоксина и фолиевой кислоты, недостаточность рибофлавина может быть причиной их вторичного дефицита [4, 5]. Хотя недостаточность пиридоксина при алкогольных заболеваниях ПЖ является вторичной, она развивается приблизительно в половине случаев, так как в патогенезе гиповитаминоза участвует также недостаточное поступление витамина В6 с пищей, его повышенное разрушение и сниженный синтез [4, 5].
Дефицит фолиевой кислоты, особенно у алкоголиков, приводит к гипоплазии слизистой оболочки тонкой кишки и, следовательно, к усугублению мальабсорбции [4, 5].
При алкогольном ХП мальнутриция может быть обусловлена не только внешнесекреторной недостаточностью ПЖ, но и нарушениями моторики органов пищеварения в результате прямого токсического влияния этанола на стенку кишки. Хроническое злоупотребление алкоголем приводит к уменьшению кишечной активности дисахаридаз (в основном лактазы), результатом чего является нарушение толерантности к лактозе и утяжеление диареи. Кроме того, при алкоголизме развивается дефицит фолатов, роль которых в прогрессировании мальнутриции описана выше.
Гиповитаминоз В12 развивается у 40 % больных ХП и связан с нарушением его всасывания. Это нарушение всасывания может наблюдаться даже при отсутствии этиологических факторов мальабсорбции витаминов (синдрома избыточного бактериального роста в кишечнике, илеальной дисфункции). Причина высокой частоты гиповитаминоза В12 при ХП состоит в том, что связь этого витамина с белком разрушается трипсином в двенадцатиперстной кишке. При снижении продукции трипсина всасывание В12 уменьшается из-за пребывания его в постоянной связи с белком и из-за нарушения энтерогепатической циркуляции витамина [4, 5].
При панкреатической мальнутриции значительно изменяется минеральный обмен: наблюдается дефицит натрия, калия, железа, кальция, магния, селена, цинка, меди, марганца, фтора, йода и т.д. [10, 13, 15, 16, 18].
Гиповитаминоз D занимает особое место в патогенезе панкреатической недостаточности. Витамин D (кальциферол) с пищей поступает в виде предшественников (рис. 1). Основной из них — 7-дегидрохолестерол, который после воздействия ультрафиолета в коже превращается в холекальциферол (витамин D3). Второй предшественник — эргостерин — после облучения превращается в витамин D2 (эргокальциферол). Витамин D (D1) представляет собой смесь витаминов D2 и D3 [6].
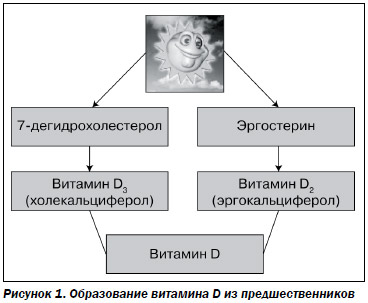
Витамин D3 (холекальциферол) транспортируется в печень, где происходит его гидроксилирование в позиции 25 — образуется 25-гидрооксихолекальциферол (кальцидиол), концентрацию которого в крови считают информативным индикатором уровня витамина D в организме [37].
Кальцидиол транспортируется в почки и там гидроксилируется в позиции 1 — образуется 1,25-дигидрооксихолекальциферол. Образование активной формы витамина D в почке контролируется паратгормоном [6, 9].
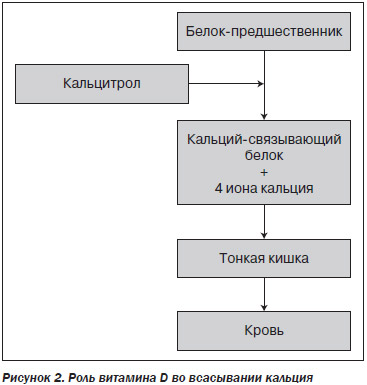
Далее витамин D поступает с током крови в слизистую кишечника (рис. 2) и участвует во всасывании кальция. Наиболее интенсивно Ca2+ всасывается в верхних отделах тонкой кишки, используя систему активного транспорта. Одновременно с активным транспортом Ca2+ существует и пассивный, то есть зависимая от градиента концентрации диффузия в дистальных отделах тонкой кишки. Витамин D и его метаболиты оказывают стимулирующее влияние на всасывание Ca2+. Установлено, что витамин D индуцирует образование в слизистой оболочке тонкой кишки особого белка-предшественника, способного образовывать с Ca2+ прочный комплекс — Ca2+-связывающий белок. Одна молекула этого белка связывает 4 молекулы Ca2+. Ca2+-связывающий белок образуется в бокаловидных клетках и локализуется в зоне гликокаликса щеточной каемки слизистой оболочки тонкой кишки. При дефиците витамина D этот белок не образуется и транспорт Ca2+ нарушается [14].
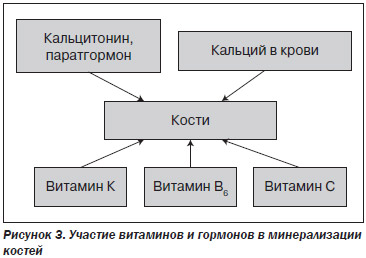
Из крови кальций поступает в кости (рис. 3). Этот процесс регулируется витамином D, паратгормоном, кальцитонином, витаминами В6, К и С. В частности, витамин К необходим для карбоксилирования костного белка остеокальцина и образования его активной формы, а остеокальцин, в свою очередь, участвует в процессе костной минерализации. Витамин B6 является кофактором фермента, отвечающего за образование поперечных «сшивок» в молекулах коллагена, участвует в ряде сложных реакций, необходимых для витамин-К-зависимого карбоксилирования остеокальцина. Витамин С необходим для образования коллагена, который составляет 90 % органического костного вещества (при дефиците витамина С полноценный коллаген не образуется) [28].
Таким образом, недостаточность витамина D может наблюдаться при его дефиците в пище (обычно при искусственном вскармливании), недостаточном солнечном облучении («болезнь подвалов»), заболеваниях печени, почек, недостаточной продукции паратгормона, патологии тонкой кишки. Кроме того, гиповитаминоз D формируется при панкреатической недостаточности, так как этот витамин — жирорастворимый, а для полноценного гидролиза жира необходимо достаточное количество панкреатической липазы. В соответствии с этим описан гиповитаминоз D при различных заболеваниях печени и почек [6, 9], гипопаратиреозе [28], целиакии [20], воспалительных заболеваниях кишечника [33, 29], муковисцидозе [37], ХП [22, 23, 25, 34, 35, 42]. Большая доля в общей структуре причин остеопороза приходится на постменопаузальный остеопороз.
При дефиците витамина D снижается содержание кальция и фосфора в костной ткани (матрикс кости растет, а отложение кальция задерживается). Зона кальцификации в эпифизах нечеткая, прерывистая, деформированная. В итоге наблюдается деформация скелета: рахитические четки, саблевидные, Х-образные или О-образные голени, килевидная (птичья) грудная клетка. Эти симптомы характерны для рахита — дефицита витамина D в детском возрасте. Проявления гиповитаминоза D у взрослых будут описаны ниже [6].
Суточная потребность в витамине D [6, 14]:
— взрослые — 100 МЕ (2,5 мкг холекальциферола);
— беременные и кормящие — 400–500 МЕ (10–12,5 мкг холекальциферола);
— дети — 500 МЕ (12,5 мкг холекальциферола).
Источники: печень рыб; икра; мясо жирных рыб; печень млекопитающих и птиц, яйца (желток).
Суточная потребность в кальции [6, 14]:
— взрослые — 0,8–0,9 мг/кг массы тела (800–1100 мг);
— дети до 7 лет — от 1000 мг в сутки, 14–18 лет — 1400 мг;
— беременные — 1500 мг, кормящие — 1800–2000 мг.
Из содержащегося в пище количества всасывается 25–40 %.
Источники: молоко, молочные продукты (творог, твердые сыры), рыба, яйца, зеленые овощи, орехи.
Из инструментальных методов диагностики нарушений со стороны костей при гиповитаминозе D различной этиологии прежде всего используют денситометрию поясничного отдела позвоночника с определением минеральной плотности костной ткани (МПКТ) и относительных показателей — Т (отклонение МПКТ пациента от показателей здоровых молодых людей) в единицах SD (standard deviation) и Т в процентах. Более доступными методами оценки плотности костной ткани являются рентгенография, компьютерная томография.
В соответствии с МПКТ по результатам денситометрии ВОЗ рекомендует выделять нормальную костную массу, когда значение МПКТ отклоняется менее чем на 1,0 SD от стандартного среднего значения для взрослых молодых людей; низкую костную массу (остеопению), когда значение МПКТ находится между –1,0 и –2,5 SD по сравнению с нормой; остеопороз, когда значение МПКТ отклоняется на –2,5 SD и более от нормы; тяжелый (установившийся) остеопороз, когда значение МПКТ отклоняется на –2,5 SD и более от нормы и сочетается с одним или несколькими переломами, обусловленными повышенной ломкостью костей (при незначительных травмах) [31].
При заболеваниях ПЖ вышеперечисленные изменения костей встречаются часто, однако эта частота недооценивается. Так, Л.С. Бабинец (2006) [2] обнаружил, что остеодефицит различной степени имеет место у 75 % больных ХП, причем остеопенический синдром I степени был диагностирован у 20 %, II степени — у 14 %, III степени — у 17 % больных, а остеопороз — в 24 % случаев. Эти данные были получены на основании денситометрии. Важно, что степень снижения МПКТ и уровня кальция в крови отчетливо зависела от степени внешнесекреторной недостаточности ПЖ по результатам фекального эластазного теста. Интересно, что оба показателя были достоверно снижены по сравнению с нормой уже при легкой панкреатической недостаточности, то есть при показателе фекальной эластазы-1 150–200 мкг/г. Параллельно отмечалось уменьшение содержания в крови фосфора, магния и цинка, а также железа, церулоплазмина. Все эти изменения сопровождались достоверным повышением активности щелочной фосфатазы крови, которая также нарастала по мере увеличения степени панкреатической недостаточности. Повышение активности щелочной фосфатазы свидетельствует о прогрессировании костных нарушений. Важно, что при наличии у больных ХП нарушений состава кишечной флоры показатели МПКТ, Т в единицах SD и Т в процентах снижались достоверно более значимо, чем у больных ХП с нормальным составом кишечной флоры [3]. Следовательно, при развитии энтеропанкреатического синдрома с присоединением к первичной панкреатической недостаточности вторичной энтерогенной прогрессировали трофологические нарушения.
Остеопения и остеопороз при заболеваниях ПЖ развиваются в связи с гиповитаминозом D и следующим за ним нарушением всасывания кальция. При панкреатогенной мальнутриции уровень кальция снижается и в крови, и в костях. Так, при алкогольном ХП содержание кальция в лучевой и локтевой костях снижено на 4,0 %, в головке плечевой кости — на 1,5 %, в шейке бедра — на 4,7 %, в диафизе бедра — на 3,0 %, в пяточной кости — на 8,2 % [7].
На XXXIX встрече Европейского клуба панкреатологов (Ньюкасл, Великобритания, 2007) активно обсуждались вопросы трофологической недостаточности при ХП, и в этом отношении привлекло внимание исследование H. Dujsikova et al. [21], посвященное изучению изменений костей при снижении внешнесекреторной функции ПЖ у больных ХП. Остеопения или остеопороз (рис. 4) были обнаружены с помощью двойной энергетической рентгеновской абсорбциометрии (учитывали показатель МПКТ) у 41 % больных (84 % из них — мужчины). Остеопороз с риском перелома (МПКТ < 2,5 SD) выявлен у 11 % обследованных больных (такие изменения имели место только у мужчин). У большинства больных с нормальными показателями МПКТ уровень активной формы витамина D (25-ОН витамин D) в крови оставался нормальным и составлял 67,4 нмоль/л, но все же у 11 % пациентов выявлен гиповитаминоз D. При сниженной МПКТ показатели витамина D в крови удерживались на нижней границе нормы — 48,6 нмоль/л (норма — 50–300 нмоль/л), но гиповитаминоз D встречался значительно чаще — в 31 % случаев. В группе больных со сниженной МПКТ в 10 % случаев обнаружена гипокальциемия. У пациентов с остеопатиями в 36,8 % случаев выявляли измененные показатели пропептида проколлагена I типа (маркер формирования костной ткани) и в 42,1 % случаев — телопептида проколлагена I типа (маркер деструкции костной ткани). У больных с отсутствием костных нарушений эти показатели были изменены соответственно в 21,4 и 17,8 % случаев. Авторы сделали вывод, что гиповитаминоз D является причиной костных нарушений при панкреатической недостаточности.
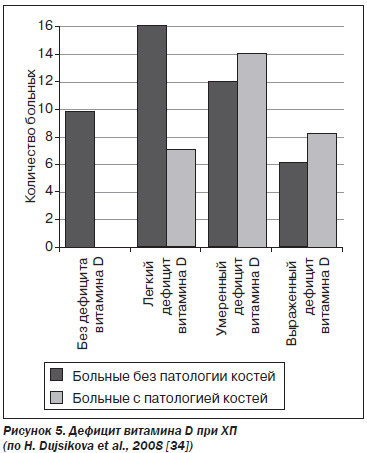
Те же авторы опубликовали результаты своих дальнейших исследований [34]. Они обследовали 73 больных ХП. Нарушение минерализации костей выявлено у 29 (39 %) пациентов. У 19 (26 %) больных выявлена остеопения, у 4 (5 %) больных — остеопороз и у 6 (8 %) больных — остеомаляция.
Чем более выраженным был дефицит витамина D, тем чаще развивалась остеопатия (рис. 5).
Уровень витамина D в крови и связь гиповитаминоза D с нарушением минерализации костей изучали также N. Duggan et al. (2008) [41]. Они обследовали 32 больных с ХП (оценивали уровень кальцидиола в крови, проводили антропометрию, денситометрию). 74 % пациентов имели снижение МПКТ (у 11 больных — остеопороз, у 8 больных — остеопения). У 92 % пациентов диагностирована недостаточность витамина D (уровень кальцидиола в крови ниже 80 нмоль/л), в том числе у 48 % больных выявлен тяжелый гиповитаминоз D (уровень кальцидиола в крови ниже 50 нмоль/л). Были найдены корреляции между МПКТ и уровнем витамина D в крови (r = 0,045), МПКТ и возрастом больных (r = –0,27), МПКТ и временем между диагностикой ХП и выявлением нарушений со стороны костей (r = +0,06). 74 % больных были курильщиками в момент исследования или в прошлом (средний показатель пачко-лет — 28,3), найдена отрицательная корреляция между показателем пачко-лет и МПКТ (r = –0,58).
От себя хотим добавить, что результаты приведенных выше работ указывают на необходимость значительно более раннего и более частого назначения Креона, витамина D и содержащих его поливитаминов в адекватных дозах, чтобы не допустить таких тяжелых костных изменений у больных. Так как на практике сложные и дорогостоящие исследования минерального и витаминного обмена малодоступны, необходимо шире использовать определение фекальной эластазы-1 для своевременной диагностики внешнесекреторной недостаточности ПЖ.
При тяжелом гипо- или даже авитаминозе D у взрослых, как видно из приведенных выше данных, развивается остеомаляция. Она проявляется изменениями только диафизов костей, поскольку эндохондральное окостенение прекращается с закрытием эпифизов. При остеомаляции в процессе развития остеопороза происходит чрезмерное образование соединительной ткани вокруг трабекул. В генезе остеомаляции важное значение имеет также снижение синтетической функции остеобластов [12].
Крайним выражением панкреатической остеопатии являются патологические переломы. K. Cho et al. (2008) [24] доказали, что риск патологических переломов зависит от функционального состояния ПЖ. Были обследованы 30 больных (средний возраст — 78 лет) с патологическими переломами. Повышенное содержание С-пептида отрицательно коррелировало с уровнями амилазы, витамина D, паратгормона в крови, с показателями нутритивного статуса, с минеральной плотностью костей. У части больных выявлено снижение результатов фекального эластазного теста.
Практическому врачу важно знать, что гиповитаминозы, в том числе гиповитаминоз D, развиваются не только при сниженной массе тела, но и у больных с избыточной массой тела и даже с ожирением. S.N. Duggan et al. (2008) [26] обследовали 27 больных с ХП. Они доказали, что у пациентов с избыточной массой тела гиповитаминозы имеют место в 90,1 % случаев, у пациентов с ожирением — в 100 % случаев. Частота гиповитаминоза D среди всех обследованных больных составила 92,0 %, гиповитаминоза Е — 21,0 %, гиповитаминоза А — 17,0 %, частота дефицита мышечной массы — 79,3 %.
Поскольку изменения со стороны костей при ХП связаны с длительной гипокальциемией, то возможно формирование вторичного гиперпаратиреоидизма [7].
Вышеописанные нарушения костей характерны именно для заболеваний ПЖ, сопровождающихся мальнутрицией. При остром панкреатите и выраженных обострениях ХП возникают совсем другие изменения костей — участки жирового некроза, которые могут располагаться не только в мягких тканях, но и внутри костей. В дальнейшем эти участки подвергаются кальцификации. Очаги жирового некроза ведут к развитию в наиболее нагружаемых участках скелета аваскулярного некроза. Оссификация внутри кости проявляется в виде обширных конгломератов или в виде точечных вкраплений, разбросанных по всей длине кости, причем реакция надкостницы минимальна. Дымчатость и смазанность контуров костномозгового канала при этом по мере стихания клинической картины панкреатита сменяется уплотнением костной ткани. При раке ПЖ бывают особенно выражены очаги жирового некроза в костной ткани в сочетании с полиартритом. Любой вариант костных нарушений при ХП чаще имеет место у алкоголиков [7].
Ряд гиповитаминозов и дефицит различных минеральных веществ существенно влияют на тяжесть панкреатита. А.Н. Казюлин (2007) [8] в монографии по различным, в том числе клиническим, аспектам витамина D приводит следующие данные:
— у больных с неблагоприятным течением острого и хронического панкреатита выявлены нарушения показателей витаминов A и Е, b-каротина, b-криптоксантина и ликопина — маркеры тяжести течения панкреатита (F.J. Curran et al., 2000);
— потребление витамина E отрицательно коррелирует с риском развития ХП (р = 0,03) даже при употреблении алкоголя (G. Uomo et al., 2001);
— назначение витаминов С, Е, А, сульфаденозил-метионина и селена больным с наследственным панкреатитом и L-метионина, b-каротина, витаминов C, E и селена при болевой форме ХП способствовало существенному сокращению числа дней с болевым синдромом на фоне стандартного лечения, включавшего препараты панкреатина (G. De las Heras Castano et al., 2000);
— в панкреатических островках и протоковом эпителии синтезируется 25-(OH)-D3-1альфа-гидралаза, которая участвует в продукции биологически активной формы витамина D 1,25-(OH)2-D3. Таким образом, витамин D может воздействовать на панкреатическую функцию и, возможно, на риск развития рака ПЖ (F.A. Wenger et al., 2001);
— на модели химически-индуцированной аденокарциномы ПЖ выявлено, что ее частота при назначении витамина А уменьшается на 35,7 % (F. Pettersson et al., 2000).
При проведении проспективных исследований в США в когорте пациентов (мужчин — 46 771, женщин — 75 427) в рамках The Health Professionals Follow-up Study и The Nurses’ Health Study выявлено дозозависимое снижение риска рака ПЖ при потреблении витамина D в дозах 600 МЕ и более в день [43].
В проспективном исследовании показано, что имеет место обратная связь между уровнем фолатов, витамина B6, витамина В12 в крови и риском рака ПЖ. В исследовании, включавшем 81 922 человека, не имевших рака на момент включения, у лиц с самым высоким потреблением метионина риск рака ПЖ был существенно ниже по сравнению с лицами с низким потреблением метионина (E. Schernhammer et al., 2007 (цит. по А.Н. Казюлину, 2007) [8]).
Из приведенных выше данных становится очевидным, что для профилактики развития тяжелого панкреатита и рака поджелудочной железы необходимо обеспечивать нормальный нутритивный статус.
Однако в этом отношении врач встречает целый ряд ограничений [8]:
— трудность постоянного приема витаминов и микроэлементов;
— невозможность рутинного мониторинга статуса витаминов и микроэлементов;
— невозможность индивидуального подбора комбинации и доз конкретных микронутриентов;
— часто встречаемая в популяции непереносимость некоторых витаминов (в лекарственной форме);
— отсутствие адекватного всасывания компонентов препаратов у лиц с экзокринной панкреатической недостаточностью и синдромом мальабсорбции;
— разрушение витаминов при неконтролируемом синдроме избыточного бактериального роста, часто имеющем место у больных ХП.
А.Е. Шестопалов (2006) [19] предлагает следующие методы нутритивной поддержки у больных с патологией ПЖ:
— внутрикишечная детоксикация (кишечный лаваж, энтеросорбция);
— коррекция метаболизма и восстановление барьерной функции слизистой оболочки тонкой кишки (глутамин, антигипоксанты, антиоксиданты, омега-3 жирные кислоты);
— иммунокоррекция (омега-3 жирные кислоты, глутамин);
— энтеральное питание — глюкозо-электролитный раствор, олигомерные, полисубстратные смеси;
— адекватная заместительная терапия (Креон);
— витамины и другие микронутриенты (Дуовит).
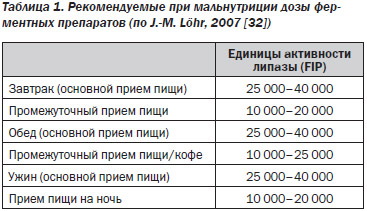
Поскольку причиной остеопатии при заболеваниях ПЖ (ХП, муковисцидоз и др.) является панкреатическая недостаточность, то больным прежде всего следует назначить адекватную дозу ферментного препарата (Креона) (табл. 1).
Для обеспечения оптимального рН действия липазы необходимо провести деконтаминацию двенадцатиперстной кишки, так как синдром избыточного бактериального роста имеет место в 35 % случаев ХП. Препаратом выбора является Альфа нормикс (рифаксимин) по 400 мг 2–3 р/д 7 дней (курсы повторять минимум три месяца подряд). Препарат оказался эффективным во всех случаях синдрома избыточного бактериального роста при ХП [40]. Преимуществами Альфа нормикса являются: отсутствие системного действия и побочных эффектов; быстрое восстановление нормальной флоры; препарат не создает резистентных штаммов, уменьшает содержание специфического липополисахарида в крови [38].
Однако только назначением ферментных и антибактериальных средств невозможно справиться с трофологической недостаточностью при ХП с выраженным снижением внешнесекреторной функции ПЖ. Необходимы поливитаминные, минеральные комплексы.
Совсем недавно были опубликованы результаты рандомизированного контролируемого исследования эффективности антиоксидантов для облегчения боли у больных с ХП. 127 больных были разделены на 2 группы. 56 больных получали антиоксидантный комплекс, который включал 600 мг селена, 0,54 г аскорбиновой кислоты, 9000 ЕД b-каротина, 270 ЕД a-токоферола, 2 г метионина. 71 пациент получал плацебо. Лечение длилось 6 месяцев. После окончания исследования количество дней в месяц с болью у больных, получавших антиоксиданты, составило 3,2 ± 4,0, а у больных, получавших плацебо, — 7,4 ± 6,8 (р < 0,001). Количество таблеток анальгетиков в месяц в группе больных, получавших антиоксиданты, составило 4,4 ± 5,8, а в группе больных, получавших плацебо, — 10,5 ± 11,8 (р = 0,001). 32 % больных, получавших антиоксиданты, полностью избавились от боли (в группе плацебо — 13 %, р = 0,009). Антиоксиданты способствовали значительному улучшению показателей антиоксидантной защиты и снижению интенсивности перекисного окисления липидов [36].
В заключение нам представляется очень уместным вспомнить слова немецкого панкреатолога M. Gulzow, одно из высказываний которого мы уже использовали в эпиграфе: «У панкреатита стальные кулаки, оставляющие не синяки, а рассекающие до кости. Но у панкреатологии теплые и нежные ладони, залечивающие любые раны».
1. Анохина Г.А. Магниевая недостаточность, пути коррекции / Г.А. Анохина // Актуальні питання захворювань органів травлення. — Івано-Франківськ, 2007. — С. 12-16.
2. Бабінець Л.С. Порушення екскреторної функції підшлункової залози як фактор формування мінеральної недостатності при хронічному панкреатиті / Л.С. Бабінець // Укр. морфол. альманах. — 2006. — № 2. — С. 7-10.
3. Бабінець Л.С. Роль мікробіоценозу кишечника в формуванні полінутрієнтної та трофологічної недостатності у хворих на хронічний панкреатит / Л.С. Бабінець // Вісн. наук. дослідж. — 2006. — № 1. — С. 12-14.
4. Буклис Э.Р. Коррекция трофологического статуса у больных циррозом печени / Э.Р. Буклис // Лечение циррозов печени. — М., 2003. — С. 16-26.
5. Буклис Э.Р. Трофологическая недостаточность при болезнях органов пищеварения / Э.Р. Буклис // Клин. перспективы гастроэнтерологии, гепатологии. — 2004. — № 2. — С. 10-15.
6. Бышевский А.Ш. Биохимия для врача / А.Ш. Бышевский, О.А. Терсенов. — Екатеринбург: Уральский рабочий, 1994. — 383 с.
7. Зулкарнеев Р.А. Изменения в опорно-двигательной системе при хроническом панкреатите / Р.А. Зулкарнеев // Казанский мед. журн. — 1992. — Т. 73, № 5. — С. 368-371.
8. Казюлин А.Н. Витамин D / А.Н. Казюлин. — М.: ГОУ НТЦ АМТ, 2007. — 74 с.
9. Кулизький Н.В. Кальцій, фосфор та паращитовидні залози — стан системи та шляхи його корекції / Н.В. Кулизький // Укр. журн. нефрології та діалізу. — 2007. — № 2. — С. 66-73.
10. Маев И.В. Хронический панкреатит / И.В. Маев, А.Н. Казюлин, Ю.А. Кучерявый. — М.: Медицина, 2005. — 504 с.
11. Метаболизм магния и терапевтическое значение его препаратов: Пособие для врача / М.А. Школьникова, С.Н. Чупрова, Л.А. Калинин [и др.]. — М.: Медпрактика-М, 2002. — 28 с.
12. Немцов В.И. Полигиповитаминозы в клинической практике: Ч. 1 / В.И. Немцов // Новые СПб. врачеб. ведомости. — 2004. — № 1. — С. 33-42.
13. Парфенов А.И. Целиакия. Эволюция представлений о распространенности, клинических проявлениях и значимости этиотропной терапии / А.И. Парфенов. — М.: Анахарсис, 2007. — 376 с.
14. Парфенов А.И. Энтерология / А.И. Парфенов. — М.: Медицинское информ. агентство, 2009. — 880 с.
15. Ревуцкий Б.И. Электролиты крови и соков пищеварительных желез у больных хроническими заболеваниями органов пищеварения / Б.И. Ревуцкий // Терапевт. архив. — 1970. — Т. 52, № 12. — С. 57-62.
16. Савощенко И.С. Колебания электролитов в сыворотке крови у больных хроническим панкреатитом под влиянием диетотерапии / И.С. Савощенко, С.А. Тужилин, В.А. Трангейзер // Терапевт. архив. — 1966. — Т. 38, № 1. — С. 83-87.
17. Цинк в педиатрической практике: учеб. пособие / Л.А. Щеплягина [и др.] / Под ред. Л.А. Щеплягиной. — М.: Медпрактика-М, 2001. — 84 с.
18. Шелагуров А.А. Нарушение электролитного обмена у больных панкреатитами / А.А. Шелагуров, К.К. Ергалиева // Клин. медицина. — 1971. — № 8. — С. 81-85.
19. Шестопалов А.Е. Клинико-фармакологические аспекты применения мультивитаминных комплексов для парентерального введения: обзор литературы. Часть 1 / А.Е. Шестопалов, А.В. Дмитриев, В.Б. Зингеренко // Вестн. интенсивной терапии. — 2006. — № 3. — С. 50-55.
20. Body composition and bone mineral density in untreated patients with celiac disease / D. Gonzales, R. Mazure, C. Mautalen [et al.] // Bone. — 1995. — Vol. 16. — P. 231-234.
21. Bone changes in patients with chronic pancreatitis / H. Dujsikova, J. Tomandl, A. Sevcikova, P. Dite // Pancreatology. — 2007. — Vol. 7. — P. 270.
22. Bone mineral density in patients with pancreatic insufficiency and steatorrhea / C.E. Moran, E.G. Sosa, M.D. Martinez [et al.] // Am. J. Gastroenterol. — 1997. — Vol. 92. — P. 867-871.
23. Bone mineral metabolism, bone mineral density and body composition in patients with chronic pancreatitis and pancreatic exocrine insufficiency / A.B. Haaber, A.M. Rosenfalck, B. Hansen [et al.] // Int. J. Pancreatol. — 2000. — Vol. 27. — P. 21-26.
24. Cho K. Elevated plasma C-peptide and pancreatic exocrine insufficiency in elderly patients with osteoporotic hip fractures / K. Cho, T. Cederholm, J. Lokk // Pancreatology. — 2008. — Vol. 8, № 3. — P. 373.
25. Deficiency of fat-soluble vitamins in treated patients with pancreatic insufficiency / S.K. Dutta, M.P. Bustin, R.M. Russel, B.S. Costa // Ann. Intern. Med. — 1982. — Vol. 97. — P. 549-552.
26. Duggan S.N. Measuring malnutrition in chronic pancreatitis: weight, BMI and albumin are not enough / S.N. Duggan, S.M. Egan, K.C. Conlon // Pancreatology. — 2008. — Vol. 8, № 3. — P. 352.
27. Dutta S.K. Zinc metabolism in patients with exocrine pancreatic insufficiency / S.K. Dutta, F. Procaccino, R. Aamodt // J. Am. Coll. Nutr. — 1998. — Vol. 17. — P. 556-563.
28. Favus M.J. Primer on the metabolic bone diseases and disorders of mineral metabolism / M.J. Favus. — Philadelphia: Lippincott-Raven, 1996. — 477 p.
29. 25-Hydroxyvitamin D absorption in patients with Crohn’s disease and with pancreatic insufficiency / H. Vogelsang, R. Schцfl, W. Tillinger [et al.] // Wien Klin. Wochenschr. — 1979. — Vol. 17. — P. 678-682.
30. The identification of nutritional deficiencies in a patient with a 5 year history of chronic alcohol-induced pancreatitis / S.N. Duggan, S.M. Egan, H. O’Grady [et al.] // Pancreatology. — 2007. — Vol. 7. — P. 269.
31. Khosla S. Clinical practice: Osteopenia / S. Khosla, L.J. Melton // N. Engl. J. Med. — 2007. — Vol. 356, № 22. — P. 2293-2300.
32. Lцhr J.-M. Exocrine pancreatic insufficiency / J.-M. Lцhr. — 1st ed. — Bremen: UNI-MED, 2007. — 71 p.
33. Metabolic bone assessment in patients with inflammatory bowel disease / V. Abitol, C. Roux, S. Chaussade [et al.] // Gastroenterology. — 1995. — Vol. 108. — P. 417-422.
34. Occurrence of metabolic osteopathy in patients with chronic pancreatitis / H. Dujsikova, P. Dite, J. Tomandl [et al.] // Pancreatology. — 2008. — Vol. 8, № 6. — P. 583-586.
35. Prospective evaluation of endoscopic ultrasonography and endoscopic retrograde cholangiopancreatography in patients with chronic abdominal pain of suspected pancreatic origin / M.J. Wiersema, R.H. Hawes, G.A. Lehman [et al.] // Endoscopy. — 1993. — Vol. 25. — P. 555-564.
36. A randomized controlled trial of antioxidant supplementation for pain relief in patients with chronic pancreatitis / P. Bhardwai, P. K. Garg, S. K. Maulik [et al.] // Gastroenterology. — 2009. — Vol. 136, № 1. — P. 149-152.
37. Reduced serum 25 hydroxyvitamin D concentration and disordered mineral metabolism in patients with cystic fibrosis / T.J. Hahn, A.E. Squires, L.R. Halstead [et al.] // J. Pediatr. — 1979. — Vol. 94. — P. 38-42.
38. Scarpignato C. Альфа Нормикс (Рифаксимин): экспериментальная и клиническая фармакология селективного кишечного антибиотика / C. Scarpignato, I. Pelosini // Гастро News Онлайн. — 2008. — № 4. — С. 3-15.
39. Serum-b-Carotin: ein einfacher statistischer Laborparameter fьr die Diagnostik der Steatorrhoe / B. Lembcke, K. Geibel, S. Kirchhoff, P.G. Lankisch // Dtsch. Med. Wochenschr. — 1989. — Bd. 114, № 7. — S. 243-247.
40. Trespi E. Intestinal bacterial overgrowth during chronic pancreatitis / E. Trespi, A. Ferrieri // Curr. Med. Res. Opin. — 1999. — Vol. 15, № 1. — P. 47-52.
41. Vitamin D deficiency and low bone mineral density are common in patients with chronic pancreatitis / N. Duggan, M. Egan, I. Khan, C. Conlon // Pancreatology. — 2008. — Vol. 8, № 3. — P. 352.
42. Vitamin D3 in patients with various grades of chronic pancreatitis, according to morphological and functional criteria of the pancreas / S.T.W. Mann, H. Stracke, U. Lange [et al.] // Dig. Dis. Sci. — 2003. — Vol. 48. — P. 533-538.
43. Vitamin D intake and the risk for pancreatic cancer in two cohort studies / H.G. Skinner, D.S. Michaud, E. Giovannucci // Cancer Epidemiol. Biomarkers Prev. — 2006. — Vol. 15, № 9. — P. 1688-1695.