Газета «Новости медицины и фармации» Гастроэнтерология (434) 2012 (тематический номер)
Вернуться к номеру
Патология поджелудочной железы, первичная и вторичная панкреатическая недостаточность при заболеваниях кишечника
Авторы: Н.Б. Губергриц, Г.М. Лукашевич, О.А. Голубова, П.Г. Фоменко - Донецкий национальный медицинский университет им. М. Горького
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
В статье представлен обзор литературы и собственные данные о патогенезе панкреатита и вторичной панкреатической недостаточности при различных заболеваниях тонкой и толстой кишки. Особое внимание уделено панкреатической недостаточности при целиакии, при воспалительных заболеваниях кишечника. Обоснованы основные направления терапии панкреатита и внешнесекреторной недостаточности поджелудочной железы при патологии кишечника.
Поджелудочная железа, панкреатит, панкреатическая недостаточность, целиакия, воспалительные заболевания кишечника.
В настоящее время в литературе, касающейся внешнесекреторной недостаточности поджелудочной железы (ПЖ), основное внимание уделяется первичной недостаточности, т.е. такой, которая развивается вследствие поражения паренхимы железы различными патологическими процессами. Конечно, чаще это панкреатиты, муковисцидоз, крупные кистозные образования. При таких заболеваниях уменьшается объем функционально полноценной паренхимы ПЖ, вследствие чего она не способна продуцировать должное количество ферментов и бикарбонатов. Изучены многие аспекты первичной панкреатической недостаточности, хотя ряд вопросов требует дальнейшего исследования. В то же время вторичной панкреатической недостаточности уделяется мало внимания в литературе и на практике. Тем не менее количество больных, имеющих вторичную недостаточность ПЖ, очень велико, так как эта недостаточность развивается вследствие целого ряда заболеваний других органов пищеварения (при холестазе, гипоацидности, хронической абдоминальной ишемии, патологии тонкой и толстой кишки). Кроме того, вторичная панкреатическая недостаточность негативно влияет на состояние больного, затрудняет диагностику и лечение основного заболевания, делает терапию менее эффективной. В связи с этим мы решили разобрать патогенез, некоторые аспекты диагностики, дифференциальной диагностики и лечения вторичной панкреатической недостаточности, развивающейся у пациентов с различной патологией тонкой и толстой кишки.
Воспалительно-дистрофические и атрофические изменения слизистой двенадцатиперстной кишки (ДПК), тощей и подвздошной кишки при целиакии и других заболеваниях приводят к недостаточной активации панкреатических протеаз из-за снижения продукции энтерокиназы, а также к уменьшению выработки дуоденальной и тонкокишечной слизистой холецистокинина-панкреозимина под влиянием компонентов химуса. В результате снижается стимуляция внешней секреции ПЖ, развивается энтерогенная панкреатическая недостаточность.
Панкреатические ферменты участвуют не только в полостном, но и в мембранном пищеварении, так как они абсорбируются на мембране щеточной каймы энтероцитов. Недостаточность мембранного пищеварения развивается и при дефиците кишечных ферментов в случае патологических изменений слизистой оболочки тонкой кишки, и при дефиците ферментов ПЖ [9].
Попадание в толстую кишку остатков недостаточно переваренной пищи в связи с дефицитом панкреатических ферментов стимулирует пролиферацию в ней бактериальной флоры, за счет которой происходит их расщепление (дисбиоз толстой кишки) с возможным последующим ретроградным проникновением соответствующей бактериальной флоры в тонкую кишку (в норме содержащую незначительное количество микроорганизмов) через баугиниеву заслонку. Формированию цекоилеального рефлюкса способствует повышение давления в полости толстой кишки в связи со скоплением в ней газообразных продуктов расщепления недостаточно усвоенной пищи. Синдром избыточного обсеменения бактериальной флорой тонкой кишки может наблюдаться и при значительном снижении желудочной секреции (гастриты, резекция желудка). Продукты бактериального расщепления недостаточно усвоенной пищи (индол, скатол, фенол, крезол, сероводород, углекислый газ, водород, аммиак и др.) и эндотоксины бактерий могут усиливать перистальтическую активность кишечника с ускорением пассажа пищи по нему, что уменьшает время контакта панкреатических ферментов с пищевыми веществами в сфере полостного и мембранного пищеварения. В результате ухудшается их переваривание (еще один компонент патогенеза энтерогенной панкреатической недостаточности). Важную роль в патогенезе этой недостаточности играет снижение рН в просвете кишки при синдроме избыточного бактериального роста (СИБР), из-за чего имеющиеся в этом просвете панкреатические ферменты (как собственные, так и поступившие с ферментными препаратами) частично или даже полностью инактивируются. Продукты бактериального расщепления пищи в кишечнике могут вести к органическим изменениям его слизистой (дистрофия, воспаление), в результате чего может ухудшаться всасывание конечных продуктов расщепления пищевых веществ под влиянием ферментов ПЖ и тонкой кишки. Этому также способствуют образующиеся в избытке при бактериальном обсеменении начальных отделов тонкой кишки деконъюгированные желчные кислоты, которые оказывают повреждающее действие на ее слизистую оболочку. В связи с нарушением гидролиза жиров страдает всасывание жирорастворимых витаминов (А, D, Е, К). На почве дефицита витамина D и избыточного выведения кальция может развиваться остеопороз, появляться боли в костях [3].
Примером дуодено- и энтерогенной панкреатической недостаточности может служить целиакия.
Впервые снижение внешней секреции ПЖ при целиакии описано D.A. Dreiling в 1957 г. Частота панкреатической недостаточности при целиакии варьирует по данным различных авторов в зависимости от применявшихся ими функциональных тестов. Так, P.T. Regan et al. (1980) выявили панкреатическую недостаточность у половины больных целиакией, причем в 10 % случаев эта недостаточность была тяжелой [50]. A. Carrocio et al. (1991) обнаружили, что при целиакии в 22,7 % случаев снижена продукция трипсина и/или липазы по результатам секретин-церулеинового теста [20]. А позже те же авторы выявили уменьшение содержания химотрипсина в кале у 37 % больных целиакией [52].
Кроме описанного выше нарушения регуляции внешней секреции ПЖ, при целиакии в развитии панкреатической недостаточности имеют значение и другие факторы: трофологическая недостаточность, возможность развития аутоиммунного или другого варианта (алкогольного, идиопатического) панкреатита, увеличение количества D-клеток в слизистой тонкой кишки (соматостатин подавляет внешнюю секрецию ПЖ), снижение продукции гастрина, панкреатического полипептида [6].
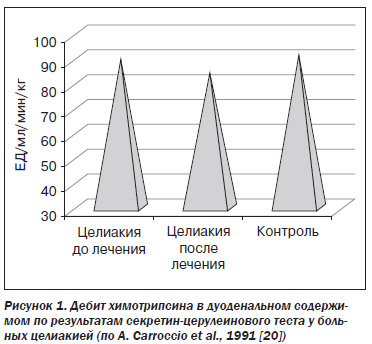
Доминирующее значение снижения стимуляции внешней секреции ПЖ в патогенезе панкреатической недостаточности при целиакии подтверждается результатами работы A. Carrocio et al. (1991) [20]. При введении стимуляторов секреции ПЖ парентерально дебит химотрипсина у больных и до, и после лечения не имел достоверных отличий от такового у здоровых (рис. 1).
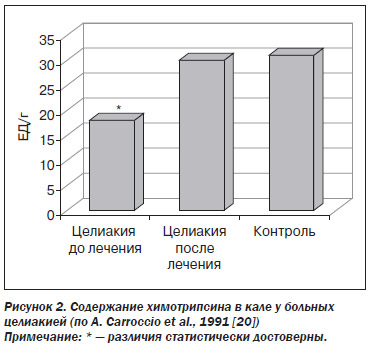
То есть ПЖ больных способна производить нормальное количество ферментов, но оно снижено при пищевой стимуляции, которая реализуется через выработку секретина и холецистокинина-панкреозимина слизистой ДПК. Действительно, содержание химотрипсина в кале у тех же больных без применения парентеральных стимуляторов было достоверно уменьшено (рис. 2) [20].
Нарушение регуляции внешней секреции ПЖ при целиакии объясняют еще двумя механизмами. Учитывая, что атрофия слизистой тонкой кишки является гиперрегенераторной, характеризуется повышением митотической активности в криптах, то предполагают увеличение количества не только энтероцитов, но и D-клеток. Причем продукция ими соматостатина повышается только в слизистой оболочке тонкой кишки, что изменяет паракринную регуляцию внешней секреции ПЖ. Соматостатин влияет на продукцию секретина и холецистокинина-панкреозимина дуоденальной слизистой. Данный механизм, наряду со снижением продукции этих интестинальных гормонов из-за атрофии слизистой ДПК, также имеет существенное значение в развитии панкреатической недостаточности при целиакии [5, 20]. Однако повышенная продукция соматостатина имеет и другие последствия. Из-за гиперпродукции этого гормона уменьшается уровень гастрина, причем снижение носит функциональный характер, так как количество G-клеток в желудке не уменьшается [5].
В связи с этим необходимо отметить, что гастрин и холецистокинин относятся к одному семейству гастроинтестинальных гормонов и имеют некоторые общие детерминанты, а рецепторы к холецистокинину реагируют и на гастрин [2, 21, 51]. Следовательно, при изменениях уровня гастрина в крови с большой вероятностью изменяется панкреатическая секреция [4]. Кроме того, холецистокининовые рецепторы реагируют и на соляную кислоту. Вообще выделяют три типа холецистокининовых рецепторов. ССК-А-рецепторы участвуют в нутритивной стимуляции высвобождения холецистокинина, т.е. стимулируются жирами химуса; ССК-В-рецепторы принимают участие в секреции панкреатических ферментов при орошении полости ДПК растворами соляной кислоты и некоторых аминокислот; CCK-G-рецепторы тропны к гастрину [2].
С учетом влияния гастрина на продукцию холецистокинина становится понятным, что при снижении продукции гастрина при целиакии уменьшается холецистокининовая стимуляция ПЖ, что также вносит свой вклад в развитие панкреатической недостаточности.
При целиакии повышается продукция вазоактивного интестинального пептида, что может привести к нарушениям микроциркуляции в ткани ПЖ и также к снижению ее внешней секреции [5].
Трофологическая недостаточность, характерная для целиакии, сопровождается нарушением функции всех пищеварительных желез, в том числе ПЖ, снижением толерантности к компонентам химуса, дестабилизацией клеточных мембран (повышается вероятность острого панкреатита (ОП) или обострения хронического панкреатита — ХП) [6].
Возможность развития аутоиммунного панкреатита при целиакии подтверждается данными U. Volta et al. (1997) [39]. Авторы обнаружили у 26 % больных целиакией антитела хотя бы к одной из следующих тканей: к щитовидной железе (21 %), париетальным клеткам слизистой желудка (11 %), к коре надпочечников (4 %), островковым клеткам ПЖ (3 %). Кроме того, у 21 % больных целиакия сочетается с аутоиммунными заболеваниями (сахарный диабет I типа, тиреоидит, аутоиммунный гепатит и др.).
Хотя клиника ХП при целиакии маскируется сходными проявлениями основного заболевания, у 29 % взрослых и у 26 % детей с целиакией имеет место подъем показателей амилазы и/или липазы крови, у 69 % — трипсина крови, у 19 % — эластазы лейкоцитов. Наличие ХП при целиакии способствует развитию тяжелой трофологической недостаточности [56].
Необходимо отметить, что возможны ошибки — например, гипердиагностика панкреатита при целиакии. Это может быть связано с тем, что при целиакии в ряде случаев развивается макроамилаземия, когда также выявляется значительное повышение показателей амилазы крови [33, 54].
Вообще макроамилаземия с гиперамилаземией обнаруживается при различных заболеваниях, сопровождающихся нарушениями всасывания [28, 32, 57, 59]. Предполагают, что амилаза может связываться с иммуноглобулинами в просвете кишки при различных ее заболеваниях. Вследствие повышенной проницаемости тонкой кишки образованный таким образом макроамилазный комплекс проникает в кровоток и циркулирует в нем [30, 34].
Данные об исчезновении макроамилазы из сыворотки больных целиакией после назначения аглютеновой диеты [18, 29, 34, 58] согласуются с зависимостью между образованием макроамилазы, атрофией слизистой оболочки и другими изменениями в результате мальабсорбции. Интересно, что при целиакии описывают также макролипаземию [56]. Однако не удается обнаружить хотя бы один случай гиперамилазной макроамилаземии при болезни Крона [26].
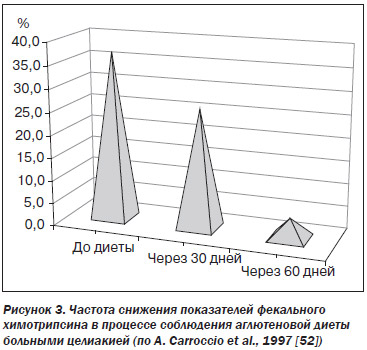
Важно, что в отсутствие ХП панкреатическая недостаточность при целиакии обратима при условии эффективного лечения основного заболевания (аглютеновая диета), что объясняется улучшением функционального состояния слизистой тонкой кишки и увеличением продукции секретина и холецистокинина-панкреозимина. A. Carrocio et al. (1997) выявили снижение уровня фекального химотрипсина у 36,9 % больных до лечения, у 26,1 % — через 30 дней от начала лечения и только у 4,3 % больных через 60 дней от его начала (рис. 3) [52].
Панкреатическая недостаточность является одной из причин недостаточной эффективности лечения целиакии. Так, Е.Ю. Губская (2008) показала, что по результатам изучения фекальной панкреатической эластазы-1 у больных с целиакией выявляется энтерогенная панкреатическая недостаточность, причем в ряде случаев эта недостаточность достигает тяжелой степени. Та же автор доказала, что в лечении целиакии целесообразно сочетать аглютеновую диету с назначением креона 25 000 три раза в день [1].
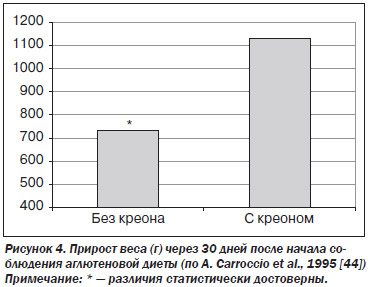
Результаты Е.Ю. Губской подтверждают и другие авторы. P.T. Regan et al. (1980) также считают, что основная причина недостаточного эффекта аглютеновой диеты при целиакии — панкреатическая недостаточность [50]. A. Carrocio et al. (1997) отметили, что больные с исходными низкими показателями фекального химотрипсина хуже набирают вес на аглютеновой диете [52]. Те же авторы показали, что чем ниже уровень исходного фекального химотрипсина, тем меньше прирост веса после назначения диеты (r = –0,56). Авторы сделали вывод, что низкий уровень химотрипсина в кале перед началом аглютеновой диеты — предиктор недостаточной эффективности лечения и необходимости коррекции ферментными препаратами [52]. Так, если прирост массы тела больных целиакией через 30 дней от начала соблюдения диеты без коррекции составил 732 ± 399 г, то при приеме ферментных препаратов — 1131 ± 461 г (p < 0,006) (рис. 4) [44].
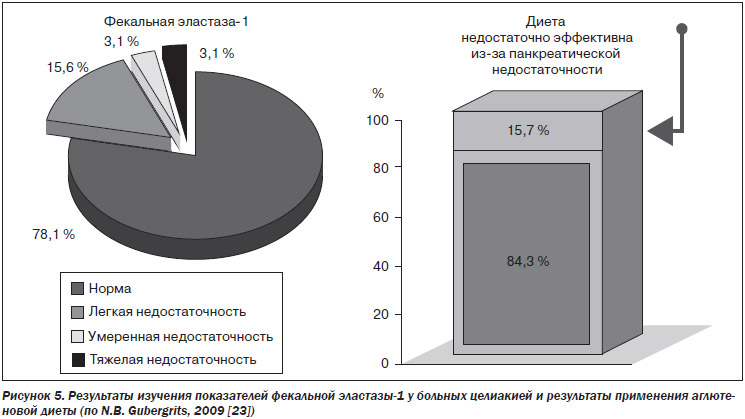
С помощью фекального эластазного теста мы также диагностировали легкую панкреатическую недостаточность у 15,6 %, умеренную — у 3,1 %, тяжелую — у 3,1 % больных целиакией. В 15,7 % случаев аглютеновая диета была недостаточно эффективной. Результат лечения у этих больных значительно улучшился при назначении креона в дозе 90–120 тыс. ЕД FIP в сутки (рис. 5) [23]. Учитывая, что СИБР присутствует у подавляющей части больных целиакией, положительный эффект имеет деконтаминация ДПК рифаксимином. Это также способствует улучшению результатов лечения креоном.
У больных с целиакией снижается не только внешнесекреторная функция ПЖ, но и сократительная функция желчного пузыря. Эти нарушения объясняют уменьшением секреции секретина, холецистокинина-панкреозимина и других кишечных гормонов слизистой ДПК и тощей кишки. Так, определение ферментов ПЖ в дуоденальном содержимом после гормональной стимуляции панкреозимином показало, что скорость секреции амилазы, липазы и трипсина у больных целиакией с синдромом нарушенного всасывания III степени снижена более чем в 2 раза по сравнению с нормой [8]. При этом наблюдали замедленную секрецию ферментов ПЖ, в результате которой ферменты поступали в просвет кишки асинхронно с химусом. В результате нарушения регуляции снижается скорость гидролиза компонентов химуса и повышается осмотическое давление в полости кишки. Возникающие нарушения кишечного пищеварения усугубляются снижением продукции ферментов [8]. Кроме того, Л.М. Крумс было показано, что при целиакии в ответ на пищевой раздражитель желчный пузырь совсем не сокращается, а после применения церулеина парентерально выделяется желчь с высокой концентрацией холевой кислоты, что свидетельствует о выраженном застое желчи из-за атонии желчного пузыря [8]. В результате дефицита желчных кислот в просвете кишки присоединяются механизмы билиогенной панкреатической недостаточности. В свою очередь, неабсорбированные в тонкой кишке жирные кислоты с длинной углеродной цепью тормозят всасывание воды и натрия, что приводит к диарее [8].
В просвете тощей кишки у больных целиакией появляется большое количество условно-патогенной, симбионтной микрофлоры и грибов. Бактериальное обсеменение вызывает у 69 % больных появление в проксимальном отделе тонкой кишки свободных желчных кислот и уменьшение доли конъюгированных желчных кислот. Преждевременная бактериальная деконъюгация желчных кислот с образованием свободных желчных кислот, обладающих детергентными свойствами, также вносит свой вклад в нарушение ассимиляции жиров, натрия и воды, усугубляя диарею [8].
Безусловно, энтерогенная панкреатическая недостаточность в сочетании с мальабсорбцией развивается не только при атрофическом дуодените и целиакии, но и при ряде других заболеваний тонкой кишки, после ее обширных резекций. При резекциях тонкой кишки, кроме описанных выше механизмов энтерогенной панкреатической недостаточности, имеют значение уменьшение поверхности абсорбции ферментов ПЖ и асинхронизм пассажа химуса, желчных кислот и панкреатических ферментов [31]. При сочетании энтерогенной недостаточности и мальабсорбции, характерном для заболеваний тонкой кишки, развиваются многочисленные симптомы мальассимиляции пищевых веществ, то есть трофологической недостаточности.
Безусловно, лечение энтерогенной панкреатической недостаточности должно быть основано прежде всего на терапии основного заболевания. Как правило, ферментные препараты оказывают достаточное влияние лишь на фоне или после проведения такого лечения. Так, при СИБР для реализации действия ферментных препаратов необходимо в первую очередь провести деконтаминацию тонкой кишки (например, рифаксимином), как было указано выше. При целиакии следует сочетать аглютеновую диету и терапию ферментными препаратами (в случае снижения результатов фекального эластазного теста). При болезни Крона, сопровождающейся и энтерогенной панкреатической недостаточностью, и потерей желчных кислот, важно проводить патогенетическую терапию основного заболевания (топические кортикостероиды — буденофальк; месалазин — салофальк и т.д.).
При заболеваниях тонкой кишки развивается не только энтерогенная панкреатическая недостаточность, но и нарушения всасывания и мембранного пищеварения. Нарушение всасывания развивается при повреждении систем активного транспорта, обеспечивающих поступление в кровь аминокислот, глюкозы, жирных кислот, витаминов, минеральных веществ и воды [7].
Нарушение мембранного пищеварения клинически проявляется плохой переносимостью пищевых веществ, содержащих те олигомеры, переваривание которых нарушено. Пищевая непереносимость (интолерантность), обусловленная недостаточностью мембранного пищеварения, развивается только при дефиците собственно кишечных (а не адсорбированных панкреатических) мембранных ферментов. Чаще всего речь идет о недостаточности кишечных карбогидраз и плохой переносимости лактозы, трегалозы, сахарозы и других дисахаридов. Нарушение мембранного пищеварения наблюдается у больных с атрофией слизистой оболочки тонкой кишки. Тем не менее чаще этот тип мальдигестии протекает без нарушений всасывания и проявляется лишь непереносимостью одного или нескольких пищевых веществ [7].
При воспалительных заболеваниях толстой кишки также может формироваться панкреатическая недостаточность. Причем в этом случае она чаще является первичной, то есть связана с развитием панкреатита. Доказано, что при неспецифическом язвенном колите (НЯК) и болезни Крона панкреатит обычно протекает субклинически, т.е. без выраженного болевого синдрома, но с постепенным снижением функции ПЖ.
Данные о частоте ОП и ХП при воспалительных заболеваниях кишечника (ВЗК) крайне разноречивы. D. Nedin et al. (2004) при наблюдении за 50 пациентами с НЯК и болезнью Крона в течение 9 лет диагностировали ОП только в 2 % случаев [36]. Несколько чаще развивается ОП у детей: при наличии НЯК — в 4,5 %, а при болезни Крона — в 5,1 % случаев [55]. Хотя и у взрослых, страдающих НЯК, некоторые авторы отмечают достаточно высокую частоту развития ОП — 14 % [12]. Частота панкреатита при НЯК и болезни Крона сходна [22]. Однако по мере увеличения длительности болезни Крона частота ХП растет. Так, Y. Oishi et al. (2004) при длительности болезни Крона до 5 лет диагностировали ХП в 5,2 % случаев, а при анамнезе более 10 лет несколько чаще — в 6,3 % случаев. Однако те же авторы не выявили зависимости структурных изменений ПЖ от тяжести течения болезни Крона либо от того, какой лекарственный препарат был назначен [10].
Считают, что частота ХП при ВЗК выше, чем частота ОП. ХП диагностируют в клинике в 15–16 % случаев. Как правило, ХП прогрессирует медленно, хотя может развиваться тяжелая внешнесекреторная недостаточность ПЖ [25].
Обратная частота, т.е. частота ВЗК при идиопатическом рецидивирующем ОП, очень мала (не более 1 %), т.е. соответствует случайному сочетанию двух заболеваний [49].
Сведения о частоте изменений протоковой системы ПЖ при ВЗК также противоречивы. По данным M. Barthet et al. (2006), частота этих изменений составляет 10,8 % и не зависит от того, переносил ли больной ОП в прошлом. Изменения просвета протоков чаще всего носят неравномерный характер, или формируются непродолжительные стенозы главного протока, его небольшое расширение (не более 4 мм). Небольшую частоту изменений протоков при ВЗК связывают с более поздним вовлечением в патологический процесс протоков ПЖ по сравнению с ее паренхимой [22]. В частности, M. Raimondo et al. (2004) показали, что с помощью эндосонографии изменения паренхимы ПЖ при ВЗК удается обнаружить в 74 % случаев, а изменения протоков с помощью эндоскопической ретроградной холангиопанкреатографии (ЭРХПГ) — только в 29 % случаев [48]. Возможно, такие различия связаны со значительно более высокой чувствительностью эндосонографии. Наличие и выраженность изменений протоков ПЖ не зависят от активности заболевания кишечника и уровня панкреатических ферментов в крови; они также не коррелируют с выраженностью панкреатической недостаточности [22, 43]. В ряде случаев сужение панкреатических протоков, неравномерность их просвета обусловлены перидуктальным воспалением. N. Ectors et al. (1997) выявили перидуктальные лимфоцитарные инфильтраты, перилобулярный фиброз и фиброз ацинусов ПЖ у больных с ВЗК [37]. Эти изменения характерны для аутоиммунного поражения ПЖ. N. Toda et al. (2005) при магнитно-резонансной холангиопанкреатографии, проведенной 79 больным НЯК, выявили изменения протоков ПЖ в 16,4 % случаев, причем сужение главного протока было обнаружено в 6,3 %, расширение — в 3,8 %, неравномерность просвета — в 6,3 % случаев [41]. Подобные изменения также могут свидетельствовать об аутоиммунном панкреатите.
При аутопсии изменения ПЖ находят в 38–53 % случаев воспалительных заболеваний толстой кишки [22]. Это еще раз свидетельствует о субклиническом течении панкреатита и о его значительно более высокой частоте, чем диагностируют в клинике.
Причинами развития ОП и ХП при воспалительных заболеваниях толстой кишки могут быть: панкреотоксические лекарственные воздействия (лекарственный панкреатит может развиться вследствие приема 5-аминосалицилатов, сульфасалазина, кортикостероидов, азатиоприна, 6-меркаптопурина); дуоденопанкреатический рефлюкс или обструкция фатерова соска в случае поражения ДПК при болезни Крона; ХП может быть аутоиммунным, как внекишечное проявление патологии толстой кишки. Кроме того, следует учитывать повышенный риск желчнокаменной болезни (ЖКБ), формирование билиарного сладжа при болезни Крона вследствие нарушения энтерогепатической циркуляции желчных кислот. В этом случае возможно развитие билиарного ХП. При ВЗК диагностируют также алкогольный, идиопатический панкреатит, ОП после ЭРХПГ, послеоперационный ОП. В частности, частота алкогольного панкреатита среди всех случаев панкреатита при болезни Крона составляет 15 %, а идиопатического панкреатита — 8 % [11]. P. Rey et al. (2004) диагностировали идиопатический ОП у больных с ВЗК значительно реже — только в 1 % случаев [49]. Идиопатический вариант панкреатита у 19,1 % больных с ВЗК связывают с повышением уровня в крови панкреатит-ассоциированного белка. Источником этого белка является ПЖ при тяжелом панкреатите, а уровень панкреатит-ассоциированного белка коррелирует с прогнозом панкреатита. Экспрессия белка в ПЖ повышена при экспериментальном тринитробензольном панкреатите. Однако патогенетическое и диагностическое значения панкреатит-ассоциированного белка до конца не выяснены [22]. Не совсем ясным, но, безусловно, интересным является тот факт, что этот белок обнаруживают в слизистой толстой кишки при НЯК (рис. 6) [13].
В ряде случаев причина панкреатита у больных с ВЗК остается неизвестной. В этом отношении нам представляется интересным исследование P. Moolsintong et al. (2005) [11]. Авторы изучили этиологию ОП у 48 больных болезнью Крона, причем выяснить ее удалось в 92 % случаев. У 21 % больных причиной ОП была ЖКБ, у 15 % диагностирован алкогольный ОП, у 17 % — лекарственный ОП, у 10 % — ОП после ЭРХПГ, у 12 % пациентов — послеоперационный ОП. Вопрос о развитии аутоиммунного панкреатита при воспалительных заболеваниях толстой кишки активно обсуждается в литературе [53]. Панкреатит, который развивается при ВЗК, имеет сходства с аутоиммунным в отношении изменений протоков ПЖ, гистологических изменений ее паренхимы. Кроме того, при панкреатите, ассоциированном с ВЗК, не развиваются псевдокисты и кальцификаты ПЖ, что также характерно для аутоиммунного панкреатита [16]. При ВЗК-ассоциированном панкреатите выявляют аутоантитела к ткани ПЖ в 20,2 % случаев, но их титр не коррелирует со степенью панкреатической недостаточности и выраженностью изменений протоков [22]. Другие авторы выявляли антитела к ПЖ чаще — в 27 [42] и даже в 39 % случаев у больных ВЗК [14]. Однако патогенетическая роль этих аутоантител не выяснена. Они могут отражать иммунную дисрегуляцию, триггером которой является повреждение слизистой толстой кишки, или могут быть лишь результатом перекрестной активности [47]. Характерное для аутоиммунного панкреатита повышение уровня IgG4 в крови имеет место редко — только в 1,3 % случаев [22]. Все же в пользу аутоиммунного поражения ПЖ при ВЗК свидетельствуют результаты экспериментальных исследований [24, 27, 35]. Введение тринитробензолсульфоновой кислоты в протоки ПЖ и толстую кишку экспериментальных животных вызывало типичные для аутоиммунного панкреатита и НЯК морфологические изменения. Возможно, существуют сходные для ПЖ и толстой кишки антигены [38]. Другое объяснение полученных в эксперименте результатов может состоять в том, что, вероятно, тринитробензолсульфоновая кислота является гаптеном, изменяющим антигенный профиль эпителия ПЖ и толстой кишки. В одной из последних международных классификаций ХП TIGAR-O в отдельной рубрике выделен аутоиммунный панкреатит в сочетании с ВЗК [19]. Однако, по последним данным, такое сочетание характерно только для I типа аутоиммунного панкреатита, т.е. для лимфоплазмоцитарного склерозирующего панкреатита [15].
Гиперамилаземию, гиперлипаземию при ОП у больных с ВЗК выявляют со сходной частотой — соответственно в 11,4 и 11,7 % случаев, причем частота гиперферментемии существенно выше у больных, имеющих в анамнезе эпизод ОП. У таких пациентов повышение активности амилазы крови определяется в 23 %, а липазы — в 26 % случаев [22].
M. Barthet et al. (2006) доказали, что показатели фекальной панкреатической эластазы-1 снижены у 30 % больных с воспалительными заболеваниями толстой кишки и у 50 % пациентов — с наличием ОП в анамнезе. Частота обнаружения аутоантител к ПЖ в последней группе больных — 16 %, а частота изменений протоков по результатам магнитно-резонансной холангиопанкреатографии при снижении показателей фекальной эластазы-1 — 20 %. По данным секретин-церулеинового теста G. Angelini et al. (1988) выявили снижение продукции бикарбонатов и ферментов ПЖ при ВЗК в 40,7 % случаев, а изолированное уменьшение дебит-часа липазы — в 66,7 % [45]. Так как результаты прямого (зондового) теста чувствительнее данных исследования фекальной эластазы-1, то с большой вероятностью можно предположить, что легкая панкреатическая недостаточность при ВЗК наблюдается существенно чаще, чем снижение результатов эластазного теста. Важно, что выраженность внешнесекреторной недостаточности ПЖ при болезни Крона коррелирует с протяженностью поражения подвздошной кишки [46]. Действительно, наиболее выраженное снижение дебит-часа липазы и амилазы в дуоденальном содержимом при болезни Крона имеет место у больных с субтотальным поражением кишечника [5].
Кроме первичной панкреатической недостаточности при болезни Крона нередко отмечается и энтерогенная панкреатическая недостаточность, патогенез которой описан выше [17, 40]. Таким образом, у больных с НЯК и болезнью Крона следует проводить фекальный эластазный тест даже при отсутствии клинических проявлений ХП и в случае снижения результатов этого теста назначать ферментный препарат.
Панкреатит и панкреатическая недостаточность довольно часто развиваются при заболеваниях тонкой и толстой кишки и нередко остаются вне поля зрения врача. Своевременная диагностика этих нарушений и адекватное лечение, безусловно, помогут улучшить прогноз и качество жизни больных.
1. Губская Е.Ю. Нарушение безглютеновой диеты и внешнесекреторная недостаточность поджелудочной железы как две основные причины неудовлетворительных результатов лечения целиакии // Сучасна гастроентерологія. — 2008. — № 4. — С. 57-60.
2. Коротько Г.Ф. Секреция поджелудочной железы / Г.Ф. Коротько. — 2-е изд. — Краснодар: [б. и.], 2005. — 312 с.
3. Линевский Ю.В. Синдром мальассимиляции и его лечение у больных хроническим панкреатитом / Ю.В. Линевский, К.Ю. Линевская, К.А. Воронин // Мистецтво лікування. — 2006. — № 4. — С. 13-15.
4. Лоранская И.Д. Изучение моторной функции желчевыделительной системы и гастродуоденальной зоны при патологии билиарного тракта / И.Д. Лоранская, В.В. Вишневская // Рус. мед. журн. — 2005. — Т. 7, № 1 (прилож.). — С. 1-7.
5. Маев И.В. Болезни поджелудочной железы. Т. 1 / И.В. Маев, Ю.А. Кучерявый. — М.: ОАО «Издательство «Медицина»: издательство «Шико», 2008. — 416 с.
6. Маев И.В. Болезни поджелудочной железы: практ. рук. / И.В. Маев, Ю.А. Кучерявый. — М.: ГЭОТАР-Медиа, 2009. — 736 с.
7. Парфенов А.И. Полиферментная заместительная терапия в лечении заболеваний кишечника // Справочник поликлин. врача. — 2008. — № 4. — С. 43-46.
8. Парфенов А.И. Целиакия. Эволюция представлений о распространенности, клинических проявлениях и значимости этиотропной терапии. — М.: Анахарсис, 2007. — 375 с.
9. Парфенов А.И. Энтерология: рук. для врачей / А.И. Парфенов. — 2-е изд., перераб. и доп. — М.: ООО «Мед. информ. агентство», 2009. — 880 с.
10. Abnormal pancreatic imaging in Crohn’s disease: prevalence and clinical features / Y. Oishi, T. Yao, T. Matsui [et al.] // J. Gastroenterol. — 2004. — Vol. 39, № 1. — P. 26-33.
11. Acute pancreatitis in patients with Crohn’s disease: clinical features and outcomes / P. Moolsintong, E.V. Loftus Jr., S.T. Chari [et al.] // Inflamm. Bowel Dis. — 2005. — Vol. 11, № 12. — P. 1080-1084.
12. Acute pancreatitis in patients with ulcerative colitis / H. Inoue, K. Shirali, H. Okano [et al.] // Dig. Dis. Sci. — 2005. — Vol. 50, № 6. — P. 1064-1067.
13. Anti-inflammatory effects of pancreatitis associated protein in inflammatory bowel disease / M. Gironella, J.L. Iovanna, M. Sans [et al.] // Gut. — 2005. — Vol. 54, № 9. — P. 1244-1253.
14. Autoimmunity to pancreatic juice in Crohn’s disease / W. Stoker, M. Otte, S. Ulrich [et al.] // Scand. J. Gastroenterol. — 1987. — Vol. 22. — P. 41-52.
15. Chari S.T. The diagnosis of autoimmune pancreatitis: a western perspective / S.T. Chari, D.S. Longnecker, G. Kloppel // Pancreas. — 2009. — Vol. 38, № 8. — P. 846-848.
16. Chronic pancreatitis caused by an autoimmune pancreatitis / K. Yoshida, F. Toki, T. Takeuchi [et al.] // Dig. Dis. Sci. — 1995. — Vol. 40. — P. 1561-1568.
17. Clinical pancreatology for practising gastroenterologists and surgeons / Ed. by J.E. Dominguez-Munoz. — Oxford [et al.]: A Blackwell Publ. Co., 2005. — 535 р.
18. Deprettere A.J. Disappearance of macroamylasemia in a celiac patient after treatment with a gluten-free diet / A.J. Deprettere, A. Eykens, V. Van Hoof // J. Pediatr. Gastroenterol. Nutr. — 2001. — Vol. 33, № 3. — P. 346-348.
19. Etemad B. Chronic pancreatitis: diagnosis, classification, and new genetic developments / B. Etemad, D.C. Whitcomb // Gastroenterology. — 2001. — Vol. 120. — P. 682-707.
20. Exocrine pancreatic function in children with coeliac disease before and after a gluten free diet / A. Carroccio, G. Iacono, G. Montalto [et al.] // Gut. — 1991. — Vol. 32. — P. 796-799.
21. Expression cloning and characterization of the canine parietal cell gastrin receptor / A.S. Kopin, Y.M. Lee, E.W. McBride [et al.] // Proc. Natl Acad. Sci. USA. — 1992. — № 89. — P. 3605.
22. Frequency and characteristics of pancreatitis in patients with inflammatory bowel disease / M. Barthet, N. Lesavre, S. Desplats [et al.] // Pancreatology. — 2006. — Vol. 6, № 5. — P. 464-471.
23. Gubergrits N.B. Pancreatic excretory insufficiency as a cause of low efficacy of celiac disease treatment // Pancreatology: abstracts of the 41st European Pancreatic Club Meeting, Szeged, Hungary. — 2009. — Vol. 9, № 4. — P. 461 462.
24. Hapten-induced model of chronic inflammation and ulceration in the rat colon / G.P. Morris, P.L. Beck, M.S. Herridge [et al.] // Gastroenterology. — 1989. — Vol. 96. — P. 795-803.
25. Huang C. Pancreatic and biliary tract disorders in inflammatory bowel disease / C. Huang, D.R. Lichtenstein // Gastrointest. Endosc. Clin. N. Am. — 2002. — Vol. 12, № 3. — P. 535-559.
26. Hyperamylasemia in inflammatory bowel disease / D. Katz, S. Bank, R.L. Greenberg [et al.] // J. Clin. Gastroenterol. — 1988. — Vol. 10. — P. 627-630.
27. Induction of chronic pancreatitis disease by trinitrobenzene sulfonic acid infusion into rat pancreatic ducts / V. Puig-Divi, X. Molero, A. Salas [et al.] // Pancreas. — 1996. — Vol. 13. — P. 417-424.
28. Klonoff D. C. Macroamylasemia and other immunoglobulin-complexed enzyme disorders // West. J. Med. — 1980. — Vol. 133. — P. 392-407.
29. Larvol L. Celiac disease and macroamylasemia / L. Larvol, J.P. Chagnon, M. Cerf // Am. J. Gastroenterol. — 1991. — Vol. 86. — P. 788. Letter.
30. Levitt M.D. Hyperamylasemia from the binding of serum amylase by an 11S IgA globulin / M.D. Levitt, S.R. Cooperband // N. Engl. J. Med. — 1968. — Vol. 278. — P. 474-478.
31. Lohr J.-M. Exocrine pancreatic insufficiency / J.-M. Lohr. — 1st ed. — Bremen: UNI-MED, 2007. — 71 p.
32. Macroamylasemia associated with malabsorption and cryoglobulinemia: clinical and biological study of a new case / J.P. Touboul, P. Hadchouel, H. Hirsch-Marie [et al.] // Med. Chir. Dig. — 1974. — Vol. 3. — P. 419-426.
33. Macroamylasemia in patients with celiac disease / A. Rabsztyn, P.H. Green, I. Berti [et al.] // Am. J. Gastroenterol. — 2001. — Vol. 96, № 4. — P. 1096-1100.
34. Malabsorption and macroamylasemia / H.J.F. Hodgson, K.B. Whitaker, B.T. Cooper [et al.] // Am. J. Med. — 1980. — Vol. 69. — P. 451-457.
35. Mucosal injury and inflammation in a model of chronic granulomatous colitis in rats / T. Yamada, R.B. Sartor, S. Marshall [et al.] // Gastroenterology. — 1993. — Vol. 104. — P. 759-771.
36. Nedin D. Pancreatitis accompanying inflammatory bowel diseases, and our observations / D. Nedin, A. Aleksandrova // Khirurgiia (Sofiia). — 2004. — Vol. 60, № 1. — P. 12-17.
37. Non-alcoholic duct destructive chronic pancreatitis / N. Ectors, B. Maillet, R. Aerts [et al.] // Gut. — 1997. — Vol. 41. — P. 263-268.
38. Okazaki K. Recent concept of autoimmune-related pancreatitis / K. Okazaki, K. Uchida, T. Chiba // Gastroenterology. — 2001. — Vol. 36. — P. 293-302.
39. Organ-specific autoantibodies in coeliac disease: do they represent an epiphenomenon or the expression of associated autoimmune disorders? / U. Volta, L. De Franceschi, N. Molinaro [et al.] // Ital. J. Gastroenterol. Hepatol. — 1997. — Vol. 29, № 1. — P. 18-21.
40. The pancreas: an integrated textbook of basic science, medicine and surgery / Ed. by H.G. Beger [et al.]. — Malden [et al.]: Blackwell Publishing, 2008. — 1006 p.
41. Pancreas duct abmormalities in patients with ulcerative colitis: a magnetic resonance pancreatography study / N. Toda, M. Akahane, S. Kiryu [et al.] // Inflamm. Bowel Dis. — 2005. — Vol. 11, № 10. — P. 903-908.
42. Pancreatic autoantibodies in Crohn’s disease: a family study / F. Seilbold, H. Mork, A. Muller [et al.] // Gut. — 1997. — Vol. 40. — P. 481-484.
43. Pancreatic duct abnormalities and pancreatic function in patients with chronic inflammatory bowel disease / B. Heikius, S. Niemela, J. Lehtola [et al.] // Scand. J. Gastroenterol. — 1996. — Vol. 31. — P. 517-523.
44. Pancreatic enzyme therapy in childhood celiac disease: a double-blind prospective randomized study / A. Carroccio, G. Iacono, G. Montalto // Dig. Dis. Sci. — 1995. — Vol. 40, № 12. — P. 2555-2560.
45. Pancreatic function in chronic inflammatory bowel disease / G. Angelini, G. Gavallini, P. Bovo [et al.] // Int. J. Pancreatol. — 1988. — Vol. 3. — P. 185-193.
46. Pancreatic function in Crohn’s disease / J. Hegnhoj, C.P. Hansen, T. Rannem [et al.] // Gut. — 1990. — Vol. 31. — P. 1076-1979.
47. Perinuclear anti-neutrophil cytoplasmic antibodies are spontaneously produced by mucosal B cells of ulcerative colitis patients / S.R. Targan, C.J. Landers, L. Cobb // J. Immunol. — 1995. — Vol. 155. — P. 3262-3267.
48. Raimondo M. Diagnosis of early chronic pancreatitis by endoscopic ultrasound. Are we there yet? / M. Raimondo, M. Wallace // JOP. — 2004. — Vol. 4, № 5. — P. 1-7.
49. Recurrent acute idiopathic pancreatitis. Look for a chronic inflammatory disease of the intestine / P. Rey, D. Andriamanantena, C. Carrere [et al.] // Presse Med. — 2004. — Vol. 33, № 20. — P. 1437-1438.
50. Regan P.T. Exocrine pancreatic insufficiency in celiac sprue: a cause of treatment failure / P.T. Regan, E.P. DiMagno // Gastroenterol. — 1980. — Vol. 78, № 3. — P. 484-487.
51. Rehfeld J.F. Cholecystokinin // The gastrointestinal system: Vol. 2. Neural and endocrine biology. Handbook of physiology / Ed. by G.M. Makhlouf. — NY: Oxford University Press, 1989. — 337 p.
52. Role of pancreatic impairment in growth recovery during gluten-free diet in childhood celiac disease / A. Carroccio, G. Iacono, P. Lerro [et al.] // Gastroenterol. — 1997. — Vol. 112, № 6. — P. 1839-1844.
53. Sahel J. Autoimmune pancreatitis: increasing evidence for a clinical entity with various patterns / J. Sahel, M. Barthet, M. Gasmi // Eur. J. Hepatogastroenterol. — 2004. — Vol. 16. — P. 1265-1268.
54. Simultaneous presence of macroamylase and macrolipase in a patient with celiac disease / T. Oita, A. Yamashiro, F. Mizutani [et al.] // Rinsho Byori. — 2003. — Vol. 51, № 10. — P. 974-977.
55. Stawarski A. Incidence of acute pancreatitis in children with inflammatory bowel disease / A. Stawarski, F. Iwanczak // Pol. Merkuriusz Lek. — 2004. — Vol. 17, № 97. — P. 33-36.
56. Unexplained elevated serum pancreatic enzymes: a reason to suspect celiac disease / A. Carroccio, L. Di Prima, C. Scalici [et al.] // Clin. Gastroenterol. Hepatol. — 2006. — Vol. 4, № 4. — P. 455-459.
57. Van Gossum A. Macroamylasemia: a biochemical or clinical problem? // Dig. Dis. — 1989. — Vol. 7. — P. 19-27.
58. Van Gossum A. Macroamylasemia disappearance after gluten withdrawal / A. Van Gossum, M. Cremer // Dig. Dis. Sci. — 1989. — Vol. 34. — P. 964-965. Letter.
59. Wilding P. Globulin-bound amylase / P. Wilding, W.T. Cooke, G.I. Nicholson // Ann. Intern. Med. — 1964. — Vol. 64. — P. 1053-1056.