Газета «Новости медицины и фармации» 19 (436) 2012
Вернуться к номеру
Современная роль корректоров метаболизма на примере мельдония при лечении хронических форм сердечно-сосудистых заболеваний
Авторы: А.В. Курята, И.Л. Караванская, ГУ «Днепропетровская медицинская академия МЗ Украины»
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
Вопрос о целесообразности и эффективности применения средств метаболической терапии в настоящее время является одним из наиболее дискутабельных как в научной медицинской среде, так и в практическом здравоохранении [1, 27, 34, 36, 47]. С одной стороны, сама концепция метаболической терапии, подразумевающая непосредственное воздействие на обменные процессы на тканевом и клеточном уровнях, попрежнему является очень интересной и перспективной, а с другой — ряд лекарственных средств, отнесенных к гетерогенной группе метаболических препаратов, к сожалению, не продемонстрировал ожидаемых результатов ни в условиях клинических испытаний, ни в реальной клинической практике [36, 49].
Cледует отметить, что ежегодно на Европейском конгрессе кардиологов вопросам кардиопротекции посвящается от 2 до 4 % докладов [10, 49].
Что же сегодня подразумевают под термином «метаболическая терапия» и какие препараты этой группы действительно заслуживают внимания специалистов, занимающихся проблемами сосудистой патологии?
Понятие «метаболическая терапия» объединяет значительное количество препаратов с различным механизмом действия, конечной целью применения которых является обеспечение цитопротекторного эффекта — улучшение энергетического метаболизма кардиомиоцита путем фармакологического управления в нем процессами образования и переноса энергии, реализуемого на уровне самого кардиомиоцита без влияния на перфузию сердечной мышцы (величину коронарного кровотока) и на гемодинамические условия ее функционирования (частоту сокращений сердца (ЧСС), пред и постнагрузку) [8, 10, 46]. Действие метаболических препаратов направлено на коррекцию и профилактику дистрофических процессов в различных органах и тканях, защиту клеточных структур от перекисного и свободнорадикального окисления, оптимизацию нейроэндокринной регуляции, повышение неспецифической иммунорезистентности [1, 9, 10, 20, 29, 31]. В целом к основным преимуществам метаболической терапии можно отнести [1, 36, 46]:
- возможность ее применения как в острых случаях (острый коронарный синдром, острое нарушение мозгового кровообращения), так и при хронических формах сердечнососудистых заболеваний;
- одновременное положительное воздействие на несколько органов и систем (сердце, мозг, сетчатка глаза, внутреннее ухо, почки, печень, мышечная система), что сопровождается улучшением не только функционального состояния органамишени, но и организма в целом;
- широкий спектр метаболических эффектов, направленных на защиту от острой ишемии, оксидативного стресса, на поддержание метаболизма на минимальном эффективном уровне в условиях хронической гипоксии;
- потенцирование действия сердечнососудистых средств (коронаролитиков за счет защиты NO и эндотелия от действия свободных радикалов; антиаритмиков — повышения электрической стабильности миокарда, тромболитиков и антиагрегантов — улучшения местной реологии);
- низкую частоту побочных эффектов и хорошую переносимость у пациентов разных возрастных групп.
Арсенал медикаментозных средств с признанным метаболическим действием из года в год пополняется [10, 30, 39]. В кардиологической практике широко применяются препараты с метаболическим действием, среди которых триметазидин, ранолазин, тиотриазолин, Lкарнитин, мельдоний, мексикор, кверцетин, корвитин, кардонат [6–8, 10, 11, 32–34, 36, 40, 44, 46], а в неврологической — реамберин, актовегин, мексидол, ноотропил, инстенон, тиоцетам c присущей им наибольшей тропностью к миокарду или нервной ткани [13, 28, 31]. Большинство средств прошли сравнительные исследования и подтвердили свою клиническую эффективность [10, 12, 36, 46].
Несмотря на достигнутые в последние десятилетия успехи в профилактике и лечении ишемической болезни сердца (ИБС), оптимизация лечения этого заболевания остается одной из наиболее актуальных проблем современной кардиологии [25]. Согласно статистике последних лет, в структуре смертности от сердечнососудистых заболеваний 63–66,8 % приходится на долю ИБС [25].
Сегодня интерес клиницистовкардиологов к концепции метаболической защиты миокарда (кардиоцитопротекции) объясняется тем, что традиционный гемодинамический подход к лечению пациентов с данным заболеванием не удовлетворяет ни врача, ни самих больных: более 60 % пациентов с ИБС оценивают качество своей жизни как неудовлетворительное или плохое; у половины больных как минимум дважды в неделю возникают приступы стенокардии покоя. Высокая медикосоциальная значимость данной проблемы связана с осложняющими течение ИБС инфарктом миокарда, сердечной недостаточностью (СН) и внезапной коронарной смертью, частота развития которых значительно превышает ожидаемую от внедрения современных схем медикаментозной терапии. Не прекращается поиск способов увеличения продолжительности и улучшения качества жизни больных ИБС, и направлен он преимущественно на оптимизацию метаболических процессов в миокарде [22, 34, 36, 45, 46]. В настоящее время речь идет не о замене гемодинамического подхода метаболическим, а о взаимодополняющем сочетании двух концепций, в основе которых лежат разные механизмы действия препаратов [1, 19].
Достаточно длительное время антиишемическую эффективность метаболической терапии отрицали и лечение ИБС рассматривали только с точки зрения улучшения гемодинамики [22, 46]. Действие традиционных лекарственных средств было направлено в основном на снижение потребности миокарда в кислороде или на увеличение его поступления. Однако препараты, влияющие на гемодинамические параметры, эффективны преимущественно тогда, когда речь идет о профилактике приступов стенокардии, но фактически не защищают клетку миокарда от метаболических изменений, составляющих основу прогрессирования патологического процесса [22, 33, 34, 46].
Как известно, в норме между доставкой кислорода к кардиомиоцитам и потребностью в нем имеется четкое соответствие, обеспечивающее нормальный метаболизм и, следовательно, функции клеток сердца. В нормальных условиях основными субстратами для выработки энергии в кардиомиоцитах служат свободные жирные кислоты (СЖК), окисление которых обеспечивает 60–80 % синтеза АТФ, и глюкоза (20–40 % синтеза АТФ) [22].
Коронарный атеросклероз приводит к развитию дисбаланса между доставкой кислорода к кардиомиоцитам и потребностью в нем, возникает нарушение перфузии миокарда и его ишемия [22]. Недостаток кислорода вызывает изменения метаболизма кардиомиоцитов. Ограниченное количество кислорода распределяется между окислением глюкозы и СЖК, причем активность обоих путей метаболизма снижается. При ишемии глюкоза расщепляется преимущественно путем анаэробного гликолиза, образующийся пируват не подвергается окислительному декарбоксилированию, а переходит в лактат, что потенцирует внутриклеточный ацидоз [22]. Остаточный аэробный синтез АТФ осуществляется в основном за счет СЖК, происходит так называемый сдвиг от окисления глюкозы к bокислению СЖК. Известно, что такой путь образования АТФ требует больших затрат кислорода и в условиях ишемии оказывается метаболически невыгодным. Избыток СЖК и ацетилКоА ингибирует пируватдегидрогеназный комплекс и приводит к дальнейшему разобщению процессов гликолиза и окислительного декарбоксилирования, активации свободнорадикального окисления (СРО). Развивающаяся после каждого эпизода транзиторной ишемии реперфузия миокарда сопровождается значительной активацией (в сотни раз) свободнорадикальных процессов и выбросом липопероксидов в кровоток. Выраженная активация процессов СРО и следующая за ним реакция тканей и систем организма получили название оксидантного стресса [1, 2, 22]. Особенно значим этот момент у пациентов пожилого возраста, у которых один из ключевых патогенетических механизмов прогрессирования ИБС и развития ее осложнений связан именно с активацией свободнорадикального окисления (преимущественная роль активации СРО в патогенезе ИБС у лиц старшего возраста обусловлена доказанной значимостью перекисных процессов в механизме старения). В связи с этим терапию метаболическими препаратами у данной категории больных целесообразно сочетать с назначением лекарственных средств, обладающих антиоксидантным эффектом [23, 42].
Клеточный ацидоз, локальное воспаление и пероксидация, нарушение ионного равновесия, уменьшение синтеза АТФ являются основой развития электрофизиологической и функциональной дисфункции миокарда [22, 26]. Клинические проявления заболевания представляют собой, по сути, верхушку айсберга, в основании которого лежат возникшие изза нарушений перфузии изменения метаболизма миокарда [22]. В связи с этим препараты, действие которых направлено на стабилизацию метаболизма миокарда, должны являться обязательным компонентом терапии ИБС [10, 22, 46].
Однако миокардиальная цитопротекторная терапия используется врачами зачастую как альтернатива другой патогенетической терапии (назначение с позиции безвредности иногда приводит к утрате смысла такого вида лечения), приводя к дискредитации препарата и самого подхода [46]. Абсолютно ясно, что в лечении нуждаются пациенты, у которых присутствуют патогенетические механизмы ишемии, на которые влияет препарат. В то же время у больных высокого риска (с сахарным диабетом (СД), многососудистым поражением коронарных артерий сердца, пожилых, перенесших инфаркт миокарда, аортокоронарное шунтирование или стентирование) целесообразно воздействовать на все звенья развития и прогрессирования ишемии миокарда [48].
Следует отметить, что в амбулаторной практике при лечении больных стабильной стенокардией распространенной ошибкой врачей является позднее назначение лекарственных средств вторичной профилактики, а также использование в целях снижения выраженности симптомов стенокардии препаратов с недоказанным влиянием на течение этого заболевания и не обладающих цитопротекторными эффектами (так называемые биодобавки) [46].
Первыми препаратами, призванными улучшить состояние энергообмена миокарда при заболеваниях сердечнососудистой системы, были средства, способствующие использованию и анаболизму макроэргических соединений (АTФ) [22]. Традиционно в данную группу включают витамины группы В (особенно B1, B6, B12 и др.), инозин (рибоксин), инозит (также считается витамином группы B) [22]. На определенном этапе развития медицинской науки эти препараты были достаточно популярны, однако опыт их клинического применения показал низкую эффективность такой терапии. В первую очередь неуспех был связан с фармакологической необоснованностью использования данного класса лекарственных средств. Очевидно, что введение АТФ извне с фармакологической точки зрения не имеет значения, так как данный макроэрг образуется в организме в несравненно больших количествах. Использование его предшественника инозина (рибоксина) также не может гарантировать увеличение пула «готового» АТФ в клетках миокарда, поскольку и доставка деривата пурина, и его проникновение в клетку в условиях ишемии достаточно затруднены. Не установлено и состояние дефицита инозита в организме. Известно, что он встречается в целых зернах, фруктах и растениях в виде гексафосфата или фитиновой кислоты, а также в других формах (в овощах, мясе), поэтому его отсутствие в организме как макроэргического соединения фосфата клинически маловероятно [2, 22].
В последние десятилетия в арсенале средств, позволяющих влиять на метаболизм миокарда в условиях ишемии, появились препараты — парциальные ингибиторы окисления жирных кислот (partial fatty acid oxidation inhibitors — pFOX), которые являются новым классом антиангинальных лекарственных средств [10, 46]. Представители этой группы препаратов тормозят скорость окисления жирных кислот внутри митохондрий (триметазидин) либо ограничивают транспорт жирных кислот через мембраны — к последним принадлежит препарат мельдоний (рис. 1).
Механизм действия мельдония заключается в снижении скорости биосинтеза карнитина из его предшественника — гаммабутиробетаина (ГББ) [10, 15, 16, 41, 47]. Препарат ингибирует активность гаммабутиробетаингидроксилазы (последнего фермента в цепочке биосинтеза карнитина в организме человека), в результате чего концентрация карнитина в тканях снижается, и карнитинпальмитоилтрансферазы, что способствует угнетению транспорта ЖК в митохондрии и восстановлению транспорта синтезированного АТФ в цитозоль. Повышение концентрации ЖК в цитозоле является своеобразным сигналом клетке о том, что окисление ЖК по какимто причинам невозможно. В ответ активируются механизмы окисления глюкозы. При приеме препарата активируются ферменты аэробного гликолиза — гексокиназа (вовлекающая в процесс окисления глюкозу, гексозы) и пируватдегидрогеназа (благодаря использованию пирувата в цикле Кребса предотвращает образование лактата и развитие ацидоза). Однако в достижении терапевтического эффекта задействован не только карнитинзависимый механизм действия, реализующийся при длительном курсовом применении. Многочисленные наблюдения свидетельствуют о так называемых быстрых эффектах, наблюдающихся после однократного введения препарата и связанных с реализацией карнитиннезависимого механизма действия (рис. 2).
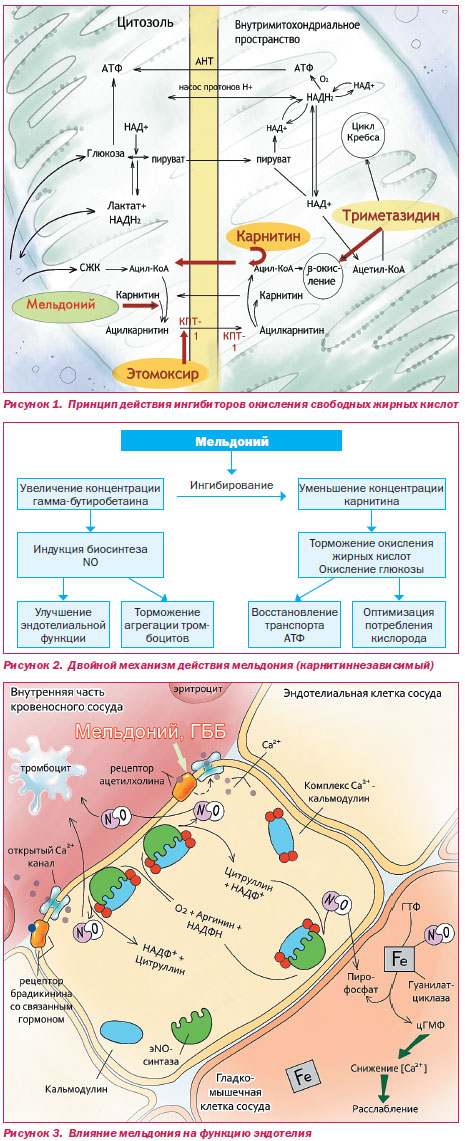
Введение мельдония сдвигает равновесие между гидроксилированием ГББ до карнитина в сторону образования физиологически активных и быстродействующих эфиров ГББ. Доказано, что эфиры ГББ являются агонистами ацетилхолиновых рецепторов, а эстераза ГББ гидролизует связанные с рецепторами эфиры подобно холинэстеразе. На фоне приема препарата улучшается эндотелиальная функция, замедляется агрегация тромбоцитов и уменьшается периферическое сопротивление. Считается, что эфиры ГББ оказывают выраженное NOзависимое релаксирующее действие, ГББ — более слабое, однако мельдоний усиливает его эффект. Однократное введение мельдония в экспериментальных условиях снижало патологическую продукцию свободных радикалов, уменьшало эндотелиальную дисфункцию, стимулируя биосинтез NO [9].
Возможно, именно таким механизмом действия препарата можно объяснить экспериментальные наблюдения, полученные электронномикроскопическим методом, а именно то, что в миокарде в случае повышенных тренировочных нагрузок под влиянием данного лекарственного препарата в 2–3 раза возрастает количество функционирующих капилляров (васкуляризация), увеличиваются количество и размеры митохондрий (гиперплазия и гипертрофия) и значительно (на 180 %) возрастает количество крипт в них. Увеличивается также количество рибосом и полисом, что указывает на способность мельдония активировать синтез белков (ферментов) и повышать дыхательную емкость миокарда (Бобков Ю.Г., 1983).
К сегодняшнему дню накопилась огромная доказательная база прежде всего в подтверждение антиишемического действия препарата как такового [6, 10, 21, 41, 44].
Мельдоний способствует биосинтезу физиологически регулируемого количества NO, что позволяет организму самому определять необходимый уровень защиты от радикалов. В результате этого препарат оказывает селективное действие именно на ишемизированную зону различных тканей, в том числе и миокарда, практически не влияя на незатронутые ишемией участки (противодействие эффекту обкрадывания) (Kirimoto T., 1996).
В многочисленных научных исследованиях показано, что применение препарата при стабильной стенокардии снижает частоту приступов последней, повышает толерантность больных к физической нагрузке и снижает среднесуточное потребление короткодействующих нитратов [41, 44].
В 2010 году были получены результаты проспективного рандомизированного двойного слепого плацебоконтролируемого клинического исследования III фазы MILSS II (проводимого в 37 исследовательских центрах), которые подтверждают и значительно дополняют существующие представления о мельдонии как о корректоре метаболизма, способствующем повышению толерантности к физической нагрузке и улучшению качества жизни больных с ИБС [44, 50]. Терапия мельдонием в течение 12 месяцев позволяет увеличить продолжительность выполнения физической нагрузки до появления приступов стенокардии на 6,5 % (p < 0,001) по сравнению с исходными показателями; разница в показателях на 12м месяце между группами мельдония и плацебо составила 10,6 % в пользу пациентов группы исследуемого препарата. Препарат хорошо переносился больными; не было выявлено статистически значимых различий между группами по параметрам безопасности (в том числе и среди пациентов пожилого возраста) [44].
Исследование фармакодинамики мельдония и накопление соответствующих клинических данных позволяют сегодня говорить о перспективном направлении в использовании данного препарата — а именно с целью лечения коронарогенной хронической сердечной недостаточности (ХСН).
До сих пор сохраняет свое значение и находит свое подтверждение в других работах положение, высказанное Н.Д. Стражеско, о том, что больной с недостаточностью кровообращения — «это обменный больной» [10]. При длительно существующих и тяжелых формах недостаточности кровообращения нарушения обмена веществ могут быть настолько значительными, что становятся необратимыми. В конечных фазах больной с заболеваниями сердечнососудистой системы погибает от нарушений тканевого обмена [8].
ХСН является наиболее частым и тяжелым осложнением заболеваний сердечнососудистой системы. Анализ отечественной и зарубежной литературы свидетельствует об огромном накоплении знаний и опыта лечения данного состояния [8]. Тем не менее проблема эффективного лечения сердечной недостаточности остается чрезвычайно актуальной в связи с ростом показателей распространенности и смертности от данной патологии [14, 25]. В настоящее время в патогенезе ХСН ведущая роль отводится гиперактивации нейрогормональных систем: симпатоадреналовой системы (САС), ренинангиотензинальдостероновой системы (РААС), блокада и ингибирование активности которых оказались настолько клинически эффективными, что препараты группы ингибиторов ангиотензинпревращающего фермента (иАПФ) и bадреноблокаторов стали стандартом лечения больных ХСН [8]. Однако современные исследования показали, что при ХСН в условиях хронической тканевой гипоксии помимо нейрогуморальных расстройств существуют и другие адаптационнодезадаптационные процессы, оказывающие существенное влияние на кардиомиоциты и миокард в целом, тем самым способствующие изменениям структуры и функции сердца как насоса и прогрессированию заболевания. Мельдоний, индуцируя биосинтез NO, оказывает непосредственное влияние на процесс регуляции адаптации. NO регулирует процесс срочной и долговременной адаптации, являясь медиатором NOэргической стресслимитирующей системы [10, 36].
Эффективность и безопасность мельдония у больных с умеренно выраженной СН на фоне ИБС были подтверждены в многоцентровом двойном слепом плацебоконтролируемом рандомизированном клиническом исследовании, выполненном в четырех медицинских центрах группой авторов I. Skarda, D. Klicare и др. Препаратом сравнения был дигоксин. Сравнительный анализ показал уменьшение клинической выраженности СН, повышение физической работоспособности миокарда у больных приблизительно в одинаковой степени. Но у 30 % пациентов, принимавших дигоксин, выполнение физической нагрузки более высокой мощности вызвало ишемию миокарда, чего не наблюдалось при лечении мельдонием. Была выше и толерантность к физической нагрузке при использовании данного препарата метаболического действия [47]. По данным исследований, проведенных И.И. Сахарчуком и соавторами (Киевский национальный медицинский университет им. А.А. Богомольца), использование мельдония более чем в 9 раз снизило частоту возникновения повторных инфарктов миокарда.