Газета «Новости медицины и фармации» Аллергология, пульмонология, антимикробная терапия (435) 2012 (тематический номер)
Вернуться к номеру
Інструкція щодо організації контролю та профілактики післяопераційних гнійнозапальних інфекцій, спричинених мікроорганізмами, резистентними до дії антимікробних препаратів
Рубрики: Аллергология , Пульмонология
Разделы: Руководства
Версия для печати
ЗАТВЕРДЖЕНО
Наказ Міністерства охорони здоров’я України
04 квітня 2012 року № 236
Зареєстровано у Міністерстві
юстиції України 06 червня
2012 року за № 912/21224
І. Загальні положення
1.1. Ця Інструкція визначає порядок організації контролю та профілактики післяопераційних гнійнозапальних інфекцій, спричинених мікроорганізмами, резистентними до дії антимікробних препаратів (далі — АМП), і спрямована на оптимізацію заходів щодо запобігання появі та поширенню в закладах охорони здоров’я (далі — ЗОЗ) резистентних штамів мікроорганізмів.
1.2. Ця Інструкція є обов’язковою для всіх ЗОЗ, у складі яких є відділення хірургічного профілю, усіх форм власності незалежно від їх відомчого підпорядкування.
1.3. Відповідальними за виконання цієї Інструкції в стаціонарі є головний лікар ЗОЗ, а у відділеннях хірургічного профілю — завідувачі відділень.
1.4. Терміни у цій Інструкції вживаються в таких значеннях:
епідеміологічний нагляд за післяопераційними інфекціями — система моніторингу за епідемічним процесом (бактеріоносійство збудників інфекцій, захворюваність, летальність), факторами та умовами, що впливають на їх виникнення, розповсюдження, аналіз та узагальнення наявної інформації для розробки профілактичних та протиепідемічних заходів;
імплантат — чужерідне тіло (протез серцевого клапана, біотрансплантат судини, штучне серце, протез голівки стегна тощо), яке імплантується в організм хірургічним шляхом;
інфекційний контроль — комплекс організаційних, профілактичних та протиепідемічних заходів, спрямованих на запобігання виникненню та поширенню внутрішньолікарняних інфекцій (у тому числі післяопераційних), що базується на результатах епідеміологічної діагностики;
критерії визначення післяопераційної інфекції — сукупність клінічних, мікробіологічних, лабораторних та інших показників, необхідних для підтвердження наявності інфекції;
післяопераційна інфекція — гнійнозапальна інфекція, яка виникла протягом 30 діб після операції у разі відсутності імплантата та протезного пристрою або протягом одного року після встановлення імплантата і протезного пристрою.
ІІ. Особливості післяопераційних інфекцій, спричинених резистентними штамами мікроорганізмів
2.1. Особливістю післяопераційних інфекцій є: проникнення в хірургічну рану резистентних штамів мікроорганізмів, обумовлене неминучими та необхідними для лікування пацієнта хірургічними втручаннями, проникнення збудників інфекції через хірургічній розріз та розвиток гнійнозапальних інфекцій.
2.2. При визначенні заходів профілактики враховуються фактори ризику виникнення післяопераційної інфекції, які поділяються на п’ять категорій: стан пацієнта, передопераційні, операційні і післяопераційні фактори, а також фактори внутрішнього середовища ЗОЗ.
Виникнення тих чи інших факторів ризику, що призводять до післяопераційної інфекції, залежить від конкретних медичних технологій, факторів внутрішнього середовища ЗОЗ та стану здоров’я пацієнта.
2.3. До збудників післяопераційних інфекцій належать резистентні до дії АМП грампозитивні та грамнегативні умовнопатогенні мікроорганізми (далі — УПМ), зокрема метицилінрезистентні Staphylococcus aureus (далі — MRSA) та ванкоміцинрезистентні ентерококи (далі — VRE). Стійкість цих мікроорганізмів призводить до їх широкого розповсюдження у відділеннях ЗОЗ хірургічного профілю.
2.4. При виборі заходів профілактики внутрішньолікарняних інфекцій (далі — ВЛІ) враховуються джерела контамінації резистентними штамами мікроорганізмів хірургічної рани, які можуть бути зовнішніми або внутрішніми.
2.4.1. Внутрішнє джерело зараження хірургічної рани являє собою власну резистентну мікрофлору хворого, що проникає з місць постійної або тимчасової колонізації організму пацієнта: носоглотки, стравоходу, шлунка, жовчних шляхів, шкіри, кишковика, сечовивідного тракту, гінекологічної сфери (головним чином VRE).
2.4.2. Зовнішніми джерелами збудників післяопераційних інфекцій є: медичний персонал і/або пацієнти — бактеріоносії резистентних штамів мікроорганізмів (головним чином MRSA), контаміновані резистентними мікроорганізмами медичні інструменти й устаткування, а також повітря та поверхні елементів медичного обладнання.
Зовнішнім джерелом інфекції можуть бути також особи (колонізовані або інфіковані збудниками післяопераційної інфекції), які допущені для догляду за пацієнтами.
2.5. При визначенні заходів профілактики ВЛІ враховуються шляхи передачі резистентних штамів мікроорганізмів при післяопераційних хірургічних інфекціях.
Передача збудника із резервуара або джерела інфекції відбувається під час інвазивної маніпуляції (операції, огляду рани, перев’язок та заміни дренажів) екзогенним (переважно контактним або, рідше, аерогенним повітрянокрапельним) або ендогенним (транслокація з місць постійної колонізації) шляхами.
2.6. Основний шлях інфікування хірургічної рани резистентними штамами мікроорганізмів — контактний.
2.7. Повітряний шлях інфікування хірургічної рани відбувається грампозитивними мікроорганізмами S.aureus і Streptococcus pyogenes.
ІІІ. Фактори ризику виникнення післяопераційних інфекцій, спричинених резистентними мікроорганізмами
3.1. При організації та проведенні заходів контролю та профілактики ВЛІ враховуються: фізичний стан пацієнта перед операцією, передопераційні, операційні та післяопераційні фактори, фактори лікарняного середовища, що впливають на інтенсивність епідемічного процесу післяопераційних гнійнозапальних інфекцій, спричинених резистентними штамами мікроорганізмів.
3.1.1. Фізичний стан пацієнта перед операцією включає наявність супутніх захворювань або стани, що супроводжуються бактеріоносійством, колонізацією резистентних штамів мікроорганізмів — збудників гнійнозапальних інфекцій. До них також необхідно віднести інші стани, що характеризуються зниженням захисних механізмів організму та сприяють колонізації та розвитку інфекції. Фізичний стан пацієнта перед операцією визначається відповідно до класифікації фізичного стану пацієнта за шкалою оцінки ризику виникнення інфекції, наведеної в додатку 1 до цієї Інструкції.
3.1.2. Передопераційні фактори включають:
тривале перебування хворого в стаціонарі перед операцією;
колонізацію пацієнта резистентними штамами мікроорганізмів;
неналежну антибіотикопрофілактику;
неналежну антисептичну обробку шкіри операційного поля і рук членів хірургічної бригади;
загальну гіпотермію (переохолодження), стрес пацієнта тощо.
3.1.3. Операційні фактори включають:
ступінь мікробної контамінації хірургічної рани резистентними штамами мікроорганізмів;
техніку хірурга щодо проведення операції та недотримання ним вимог асептики та антисептики;
тривалість хірургічної операції;
складність хірургічної операції;
адекватність гемостазу;
ступінь травматизації тканин;
наявність чужорідних тіл (імплантатів, трансплантатів) в області хірургічного втручання;
наявність некротизованих або сильно пошкоджених тканин;
наявність хірургічних дренажів, які сприяють міграції резистентних мікроорганізмів зі шкіри в рану;
травми або інші пошкодження органів шлунковокишкового тракту, кровоносних судин, сечових шляхів, пов’язані з хірургічною операцією.
3.1.4. За ступенем мікробної контамінації хірургічні рани поділяються на чотири класи:
І клас («чисті»). До них належать: нетравматичні, неінфіковані хірургічні рани без ознак запалення, які не зачіпають дихальний (респіраторний), шлунковокишковий та статевий тракти, неінфіковані сечовивідні шляхи;
ІІ клас («умовно чисті»). До них належать: рани, які зачіпають дихальний, шлунковокишковий та сечостатевий тракти за умови відсутності ознак інфекції і порушення правил асептики;
ІІІ клас («контаміновані»). До них належать: рани, у яких має місце порушення стерильності під час операції, перфорації органів шлунковокишкового тракту під час операції із значним витоком його вмісту, є вогнище гострого негнійного запалення;
ІV клас («брудні або інфіковані»). До них належать: старі травматичні рани, у яких є нежиттєздатні тканини, та рани з наявністю ознак вираженої клінічної форми гнійнозапальної інфекції або з перфорацією внутрішніх органів.
Після завершення операції всі процедури класифікуються й записуються в історії хвороби як «чисті», «умовно чисті», «контаміновані» та «брудні або інфіковані».
Оцінка класу хірургічної рани за ступенем мікробної контамінації має проводитись членом операційної бригади. Клас хірургічної рани класифікується та оцінюється як фактор ризику виникнення післяопераційної інфекції під час операції лікаремхірургом.
3.1.5. Фактори ризику внутрішнього середовища ЗОЗ включають:
тісноту й велику кількість спостерігачів (студентів) в операційній, наявність серед членів хірургічної бригади бактеріоносіїв MRSA;
необмежене пересування членів хірургічної бригади;
неналежний одяг членів хірургічної бригади;
неналежну вентиляцію повітря в операційній;
неналежну дезінфекцію медичного обладнання, устаткування та інших елементів операційного залу;
неналежну стерилізацію медичного інструментарію та хірургічного матеріалу;
порушення вимог асептики (антисептики) під час операції, огляду хірургічних ран (заміни перев’язок та дренажів);
використання неефективних засобів знезараження (антисептиків та дезінфектантів);
аварійні чи інші ситуації на водопровідній та каналізаційній мережах, що сприяють контамінації мікроорганізмами епідемічно значущих об’єктів внутрішнього середовища ЗОЗ.
3.1.6. Післяопераційні фактори ризику включають:
кількість і характер післяопераційних процедур і маніпуляцій, а також організацію й техніку перев’язок;
недотримання правил асептики під час огляду хірургічної рани;
неналежну дезінфекцію устаткування та інших елементів перев’язувальної кімнати;
наявність серед хірургічних хворих, лікарівхірургів та перев’язувальної медичної сестри бактеріоносіїв резистентних штамів УПМ (головним чином MRSA та VRE).
3.2. Екзогенні та ендогенні фактори ризику захворювання пацієнтів на післяопераційні гнійнозапальні інфекції враховуються лікаремхірургом для призначення АМП та інших заходів профілактики цих інфекцій.
ІV. Організація контролю антибіотикорезистентності
4.1. Основними напрямами боротьби з резистентністю збудників післяопераційних інфекцій до АМП є належне виконання заходів, спрямованих на недопущення в ЗОЗ розповсюдження MRSA, VRE та інших резистентних штамів мікроорганізмів.
4.2. Адміністрація ЗОЗ незалежно від форми власності та підпорядкування повинна забезпечити:
запровадження комплексу заходів, спрямованих на стримування появи та поширення резистентних збудників гнійнозапальних інфекцій;
здійснення систематичної оцінки ефективності проведених заходів та відрегулювання їх таким чином, щоб кількість післяопераційних гнійнозапальних інфекцій, спричинених резистентними штамами мікроорганізмів, зменшувалася.
4.3. Здійснення контролю та профілактики інфікування пацієнтів хірургічних відділень ґрунтується на результатах детального аналізу і оцінки епідемічної ситуації в ЗОЗ.
4.4. Контроль за післяопераційними гнійнозапальними інфекціями у хірургічних відділеннях здійснюється згідно з картою епідеміологічного спостереження, наведеною в додатку 2 до цієї Інструкції, яка заповнюється лікаремхірургом на кожного прооперованого пацієнта, та щомісяця аналізується лікаремепідеміологом ЗОЗ або іншим спеціалістом з інфекційного контролю (далі — ІК). Карти епідеміологічного спостереження зберігаються в ЗОЗ протягом одного року.
4.5. У ЗОЗ епідеміологічне спостереження за хірургічними хворими проводиться для своєчасного виявлення, обліку й реєстрації всіх випадків післяопераційних інфекцій у хірургічних хворих, визначення фонового рівня захворюваності на ВЛІ, визначення та реєстрації факторів ризику виникнення ВЛІ, а також аналізу епідемічної ситуації.
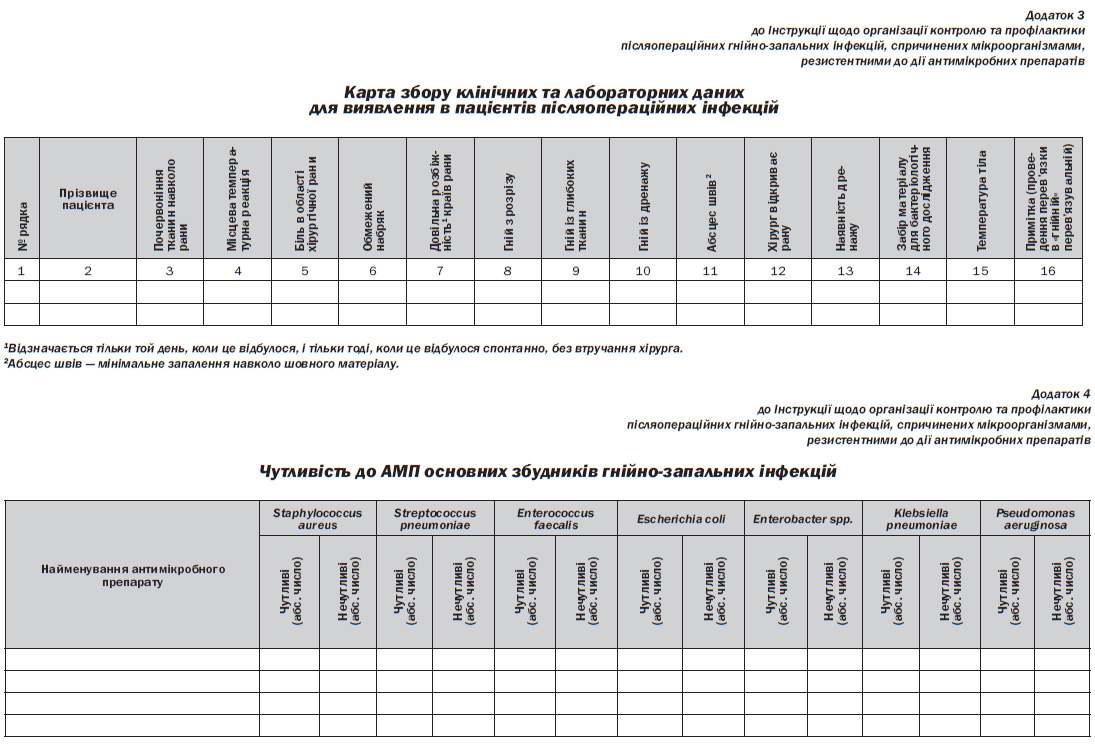
4.6. Дані щодо ознак захворювання щодня вносять до карт збору клінічних та лабораторних даних для виявлення в пацієнтів післяопераційних інфекцій за формою, наведеною у додатку 3 до цієї Інструкції, які після завершення чергування передаються завідувачу хірургічного відділення для вивчення та аналізу.
4.7. Основою системи контролю та профілактики післяопераційних гнійнозапальних інфекцій, спричинених мікроорганізмами, резистентними до дії АМП, є облік і реєстрація кожного випадку захворювання.
4.8. Облік та реєстрація післяопераційної гнійнозапальної інфекції в хірургічному відділенні ЗОЗ здійснюються згідно з анатомічною локалізацією патологічного процесу відповідно до форми звітності № 2 «Звіт про окремі інфекції та паразитарні захворювання за 20__ рік» (річна), затвердженої наказом Міністерства охорони здоров’я України від 02 червня 2009 року № 378, зареєстрованим у Міністерстві юстиції України 17 червня 2009 року за № 525/16541.
4.9. Кожен клінічний випадок ВЛІ реєструється в хірургічному відділенні ЗОЗ у формі первинної облікової документації № 060/о «Журнал обліку інфекційних захворювань», затвердженій наказом Міністерства охорони здоров’я України від 10 січня 2006 року № 1, зареєстрованим у Міністерстві юстиції України 08 червня 2006 року за № 686/12560.
4.10. Клінічний діагноз щодо післяопераційної інфекції встановлюється з урахуванням клінічних, мікробіологічних, лабораторних та інших показників, необхідних для підтвердження наявності інфекції.
4.11. Критерії визначення післяопераційних інфекцій включають дані, на підставі яких вони виявляються та класифікуються в різні комбінації клінічних ознак, а також результати лабораторних та інших видів діагностичних досліджень. Клінічні дані отримують шляхом безпосереднього спостереження за станом хворого або вивчення медичної карти пацієнта або іншої статистичної документації, які є в ЗОЗ. Лабораторні дані включають результати бактеріологічних посівів і мікроскопічних досліджень біологічного матеріалу від пацієнтів. Додаткові дані забезпечуються іншими методами діагностичних досліджень, у тому числі рентгенографічними, ультразвуковими (УЗД), ендоскопічними методами, біопсією або пункцією тощо.
4.12. У кожному ЗОЗ повинен здійснюватись комплекс заходів, спрямованих на своєчасне виявлення колонізації пацієнтів або їх інфікування резистентними до АМП штамами УПМ.
V. Раціональне використання антибіотиків
5.1. Адміністрація ЗОЗ здійснює контроль за обґрунтованістю використання антибіотиків відповідно до клінічних протоколів, що включають ванкоміцин, цефалоспорини третього покоління та протианаеробні антибіотики для боротьби з VRE, цефалоспорини третього покоління для боротьби з беталактамазами розширеного спектра (ESBL), а також хінолони та карбапенеми.
5.2. Антибіотикопрофілактика та емпірична антибіотикотерапія пацієнтам проводяться з урахуванням результатів мікробіологічного моніторингу чутливості клінічних штамів мікроорганізмів до дії АМП.
5.3. При проведенні передопераційної антибіотикопрофілактики та емпіричної антибіотикотерапії не застосовуються АМП, до яких резистентні 25,0 % і більше штамів мікроорганізмів.
5.4. Антибіотикопрофілактика проводиться за клінічним показанням при операціях за наявності факторів ризику виникнення інфекції, а також при операціях, пов’язаних з імплантацією штучних матеріалів.
5.5. Антибіотикопрофілактику призначають, ґрунтуючись на ефективності відносно найпоширеніших збудників післяопераційних інфекцій при конкретних операціях і відповідно до клінічних протоколів.
5.6. Одноразове призначення АМП безпосередньо перед операцією забезпечує адекватні концентрації в тканинах протягом всього хірургічного процесу. При тривалих операціях або великій крововтраті, а також якщо використовується антибіотик з коротким періодом напіввиведення, повторно призначаються АМП під час операції.
Введення пацієнту АМП більше ніж за дві години до початку операції або через дві години після хірургічного розрізу збільшує ризик розвитку інфекції в післяопераційному періоді.
Антибіотики ефективні, якщо рівень їх концентрації в тканинах високий перед потраплянням у нього збудників інфекції. Парентеральну антибіотикопрофілактику проводять за 30–60 хвилин до здійснення хірургічного розрізу і припиняють одразу після операції.
5.7. Початкова доза АМП для профілактики післяопераційної інфекції вводиться внутрішньовенно, розраховуючи, щоб до моменту хірургічного розрізу в сироватці і тканинах встановилася бактерицидна концентрація препарату. Терапевтичні концентрації препарату підтримуються в сироватці і тканинах протягом усієї операції.
5.8. У кардіохірургії антибіотикопрофілактика проводиться для запобігання бактеріальним ендокардитам у пацієнтів зі штучними серцевими клапанами, ревматичними ураженнями серця або іншими серцевими аномаліями.
Антибіотикопрофілактика пацієнтам проводиться для зниження ризику виникнення інфекції після операцій на відкритому серці, включаючи операції на клапанах і аортокоронарне шунтування. Поодинокі дози виявляються настільки ж ефективними, як і множинні, за умови, що протягом усієї операції забезпечуються високі концентрації препарату в крові.
5.9. У відділеннях судинної хірургії ЗОЗ передопераційна антибіотикопрофілактика проводиться для зниження ризику розвитку післяопераційної інфекції після реконструктивних операцій на черевній аорті, операцій на судинах нижніх кінцівок, що включають паховий розріз і ампутації нижньої кінцівки з приводу ішемії. Антибіотикопрофілактика проводиться також при імплантації будьяких судинних протезів, включаючи імплантати для судинного доступу при гемодіалізі.
5.10. У торакальній хірургії антибіотикопрофілактика проводиться при резекції легені з метою зниження частоти післяопераційної інфекції.
Антимікробна профілактика може запобігати виникненню емпієми після торакотомії із закритим дренажем з приводу травми грудної клітки.
5.11. У травматології та ортопедії антибіотикопрофілактика проводиться для зниження частоти як ранньої, так і пізньої післяопераційної інфекції при протезуванні суглобів та після тотальної резекції стегна. Також застосовується для зниження частоти інфекцій при лікуванні переломів стегна та іншої локалізації шляхом внутрішньої фіксації за допомогою стрижнів, пластинок, гвинтів.
Антибіотикопрофілактику в ортопедії здійснюють також за умови остеосинтезу металевими пластинами, стрижнями та при ендопротезуванні суглоба. При виконанні «чистих» операцій у хворих без високого ризику розвитку інфекції антибіотикопрофілактику не проводять.
5.12. У нейрохірургії антибіотикопрофілактика проводиться при:
тривалості хірургічної операції понад чотири години;
трансфеноїдальному (трансоральному) хірургічному доступі;
значному пошкодженні анатомічних бар’єрів під час краніотомії із резекцією фрагментів кісток черепа;
реоперації ліквореї з операційної рани;
довготривалому (понад п’ять діб) використанні зовнішнього вентрикулярного/люмбального дренажу;
застосуванні лікворошунтуючих систем;
краніотомії, що супроводжується високим ризиком виникнення інфекції;
хірургічних операціях, пов’язаних з імплантацією різних пристроїв (лікворошунтуючої системи тощо);
планових «умовно чистих» та «контамінованих» операціях.
5.13. При операціях на голові й шиї, які передбачають доступ через слизові порожнини рота або глотки, антибіотикопрофілактика проводиться для зниження частоти виникнення інфекції. Вушні краплі призначаються після встановлення тимпаностомічної трубки.
5.14. При офтальмологічних операціях антибіотикопрофілактика проводиться для зниження ризику виникнення ендофтальміту. Для профілактики залежно від факторів ризику використовують протимікробні очні краплі та/або призначають також субкон’юнктивальні ін’єкції в кінці операції.
5.15. Антибіотикопрофілактика пацієнтам з патологією ЛОРорганів проводиться в передопераційному періоді при:
операціях абсцестонзилектомії;
операціях при гострих та хронічних захворюванях вуха;
операціях при гнійнозапальних захворюваннях носа та навколоносових пазух;
операціях при флегмонах шиї;
операціях з приводу онкологічних захворювань ЛОРорганів.
5.16. При гастродуоденальних операціях антибіотикопрофілактику проводять для зменшення ризику виникнення інфекції при операціях на шлунку і дванадцятипалій кишці, якщо кислотність шлункового соку й гастроінтестинальна перистальтика знижені в результаті обструкції, кровотечі, виразки або злоякісної пухлини шлунка або через лікування блокаторами.
Антибіотикопрофілактику пацієнтам проводять також після обхідних операцій на шлунку та при ендоскопічній гастростомі.
5.17. При хірургічних операціях на жовчних шляхах антибіотикопрофілактика перед операціями призначається пацієнтам віком старше 70 років з гострим холециститом, обтураційною жовтяницею або каменями загальної жовчної протоки.
5.18. При колоректальних операціях антибіотикопрофілактика проводиться для зменшення ризику виникнення інфекцій, викликаних грамнегативними УПМ, зокрема анаеробами, такими як Bacteroides fragilis.
Перед плановими колоректальними операціями проводять механічну підготовку товстого кишківника шляхом застосування очисних клізм. Призначаються також дробові дози орального АМП, що не абсорбується, напередодні операції.
5.19. В акушерстві й гінекології антибіотикопрофілактика проводиться для зниження ризику виникнення післяопераційних гнійнозапальних інфекцій при:
вагінальній та абдомінальній гістеректомії;
кесаревому розтині в ситуаціях високого ризику, таких як активні пологи або передчасний розрив плодових оболонок;
аборті в першому триместрі в жінок високого ризику.
Пацієнткам, які переносять кесарів розтин, АМП призначають одразу після перетину пуповини. Антибіотикопрофілактика до перетискання пуповини не проводиться.
5.20. При урологічних операціях антибіотикопрофілактику пацієнтам зі стерильною сечею не проводять. Якщо посів сечі дає позитивний результат або дані посіву відсутні, пацієнту призначається АМП перед операцією для досягнення стерильності сечі.
5.21. «Брудні або інфіковані» операції, зокрема операції з приводу перфорації органів черевної порожнини, комбінованого перелому або рваної рани в результаті укусу тварини або людини, часто ускладнюються інфекцією.
5.22. Не проводять антибіотикопрофілактику пацієнтам при:
катетеризації серця;
гастроінтестинальній ендоскопії;
артеріальній пункції;
торакоцентезі;
парацентезі;
обробці неускладнених рваних ран або амбулаторному лікуванні опіків.
5.23. Не призначається в плановому порядку ванкоміцин для антибіотикопрофілактики без урахування наявності факторів ризику виникнення інфекції та клінічного стану пацієнта.
VІ. Мікробіологічний моніторинг за клінічними ізолятами
6.1. Лабораторія ЗОЗ, що здійснює мікробіологічний моніторинг чутливості збудників гнійнозапальних інфекцій до АМП, повинна забезпечуватися необхідним обладнанням, засобами вимірювальної техніки, лабораторним склом, діагностичними препаратами, виробами медичного призначення, тестштамами, дезінфекційними засобами, засобами зв’язку, комп’ютерною технікою з відповідним програмним забезпеченням.
6.2. Діагностичні препарати, поживні середовища, вироби медичного призначення, що використовуються при проведенні досліджень, повинні бути зареєстровані та дозволені для використання в Україні.
6.3. Для уніфікації досліджень, порівнянності результатів у процесі роботи використовують засоби для транспортування біологічного матеріалу, поживні середовища, системи для ідентифікації мікроорганізмів промислового виготовлення.
6.4. У лабораторіях ЗОЗ, у складі яких є відділення хірургічного профілю, використовуються стандартизовані методи визначення антибіотикорезистентності, проведення систематичного аналізу поширення штамів, резистентних до дії антибіотиків, етіологічної структури інфекцій і рівнів резистентності збудників хвороб.
6.5. Лабораторії ЗОЗ забезпечуються необхідними діагностичними препаратами для ідентифікації мікроорганізмів, визначення їх антибіотикорезистентності, тестштамами для внутрішньолабораторного контролю якості досліджень, впровадження системи мікробіологічного моніторингу за антибіотикорезистентністю.
6.6. Мікробіологічне спостереження за резистентністю збудників ВЛІ необхідно проводити для:
обґрунтування антибактеріальної терапії при лікуванні конкретної інфекційної хвороби;
обґрунтування емпіричної терапії окремих нозологічних форм інфекційних хвороб у межах лікувальних установ;
спостереження за розповсюдженням антибіотикорезистентності в окремих відділеннях хірургічного профілю ЗОЗ.
6.7. У ЗОЗ, у складі яких є відділення хірургічного профілю, зберігаються клінічні ізоляти резистентних мікроорганізмів для молекулярного типування в лабораторіях, які проводять ці дослідження, при необхідності підтвердження факту нозокоміальної передачі інфекції або щоб описати епідеміологію резистентних штамів патогенів у ЗОЗ.
6.8. Для отримання даних про частоту виділення певних мікроорганізмів, етіологічну структуру певних нозологічних форм інфекційних захворювань, які можна порівняти, усі лабораторні процедури: посів, виділення, ідентифікація, типування та визначення чутливості до АМП мікроорганізмів — проводяться за уніфікованими методами.
6.9. Лікарібактеріологи лабораторії інформують про результати ранніх етапів дослідження спеціалістів з інфекційного контролю та лікарів ЗОЗ. Результати фарбування за Грамом враховуються лікарями для раннього вибору антибіотика, а також спеціалістами з інфекційного контролю для своєчасного призначення ізоляційнообмежувальних заходів при виявленні грамнегативних диплококів у лікворі.
6.10. Лабораторія ЗОЗ доводить до відома усіх медичних працівників необхідну інформацію щодо: режиму (розкладу) роботи лабораторії; порядку роботи у вихідні та святкові дні; порядку дій медичного персоналу в разі потреби проведення термінових (невідкладних) лабораторних досліджень; термінів виконання досліджень і порядку надання попередніх (якщо це передбачено методикою дослідження) та заключних результатів досліджень; правил забору, зберігання та транспортування зразків біологічного матеріалу від пацієнтів та проб з об’єктів лікарняного середовища.
6.11. Лікарібактеріологи лабораторій ЗОЗ систематично готують аналітичні інформаційні матеріали для медичних працівників щодо чутливості до АМП збудників гнійнозапальних інфекцій, що базуються на результатах мікробіологічного дослідження клінічних ізолятів. Ці інформаційні матеріали оновлюються не рідше ніж раз на три місяці.
6.12. Спеціалісти лабораторії ЗОЗ систематично проводять навчання медичного персоналу хірургічних відділень правилам забору, зберігання та транспортування матеріалу в лабораторію і здійснюють постійний контроль за їх виконанням, правильністю оцінки результатів мікробіологічних досліджень.
6.13. Адміністрація ЗОЗ організовує та здійснює моніторинг тенденцій поширення резистентних до дії АМП мікроорганізмів — збудників післяопераційних інфекцій протягом відповідного проміжку часу та аналізує динаміку змін показників рівнів резистентності.
6.14. Ефективність мікробіологічного моніторингу за резистентністю мікроорганізмів залежить від багатьох факторів, зокрема правильності забору клінічних зразків, успішного виділення збудника інфекції, коректного визначення чутливості до антимікробних препаратів, адекватної інтерпретації отриманих даних, своєчасного впровадження практичних заходів.
6.15. Тестування антибіотикочутливості мікроорганізмів повторюється при отриманні за результатами лабораторних досліджень незвичайних фенотипів резистентності, зокрема, при:
помірному або високому рівні резистентності S.aureus до ванкоміцину;
резистентності S.pyogenes до пеніциліну або інших bлактамів;
резистентності S.maltophilia до котримоксазолу;
резистентності Н.influenzae до цефалоспоринів III покоління;
чутливості Klebsiella spp., P.aeruginosa до ампіциліну.
6.16. Для аналізу великих обсягів інформації, зібраної при проведенні мікробіологічного моніторингу за резистентністю мікроорганізмів до АМП, використовуються відповідні комп’ютерні програми з медичної статистики.
6.17. У мікробіологічних лабораторіях результати дослідження чутливості мікроорганізмів до антибіотиків щодня доводяться до відома членів комісії з ІК та медичних працівників ЗОЗ.
6.18. Мікробіологічні лабораторії ЗОЗ надають дані щодо антибіотикочутливості клінічних ізолятів, які використовуються також для визначення фонової частоти післяопераційних гнійнозапальних інфекцій, стеження за динамікою поширення резистентних штамів УПМ.
6.19. Перевищення фонового рівня захворюваності на післяопераційні інфекції свідчить про епідемічне неблагополуччя. Якщо збудниками цих інфекцій є штами мікроорганізмів, які ідентичні за біологічними властивостями, зокрема за профілем антибіотикорезистентності, то перевищення фонового рівня захворюваності свідчить про спалах хірургічної інфекції.
6.20. Профілі антибіотикорезистентності клінічних ізолятів визначаються як сполучення детермінант стійкості до антибіотиків. Для визначення профілів антибіотикорезистентності штамів мікроорганізмів, які виділені від пацієнтів, об’єктів внутрішнього середовища стаціонару, медичного персоналу, отримуються дані щодо їх чутливості з позначенням діаметрів затримки росту досліджуваних штамів мікроорганізмів навколо дисків з антибіотиками.
6.21. Усі клінічні штами УПМ, що виділені від пацієнтів при спалахах післяопераційних гнійнозапальних інфекцій, летальних випадках, резистентні до дії антибіотиків, а також такі, що вперше виділені у даному ЗОЗ або рідко зустрічаються на території, де розташований ЗОЗ, протягом 1 місяця з моменту виділення направляються для підтвердження отриманих результатів до бактеріологічної лабораторії установ та закладів Державної санітарноепідеміологічної служби України.
6.22. При виділенні штамів одного виду мікроорганізму, ідентичних за діаметрами зон затримки росту мікроорганізмів навколо дисків з аналогічними антибіотиками, профілем антибіотикорезистентності, проводять серо, біо або фаготипування для вирішення питання належності штаму до госпітального. У разі виявлення госпітального штаму вивчається його стійкість до дезінфектантів, які використовуються у ЗОЗ, із метою корекції дезінфекційних заходів.
6.23. Результати аналізу даних антибіотикорезистентності штамів мікроорганізмів, виділених від хворих та епідемічно значимих об’єктів внутрішнього середовища ЗОЗ, використовуються для оцінки ефективності заходів, що проводяться для контролю та запобігання передачі резистентних штамів мікроорганізмів.
6.24. Внесення коректив за результатами епідеміологічного аналізу в систему профілактичних та протиепідемічних заходів для запобігання передачі резистентних штамів мікроорганізмів та зниження рівня захворюваності на післяопераційні інфекції проводять у таких випадках:
виявлення змін в етіологічній структурі домінуючих видів мікроорганізмів, що викликають інфекцію, а також змін профілю їх антибіотикорезистентності;
зростання частоти висіву резистентних штамів УПМ з епідемічно значимих об’єктів внутрішнього середовища ЗОЗ;
у разі превалювання в етіологічній структурі певного виду резистентного штаму мікроорганізму;
при виникненні спалаху післяопераційних гнійнозапальних інфекцій, спричинених резистентними штамами мікроорганізмів;
у разі виявлення розвитку стійкості мікроорганізмів до дезінфектантів, які застосовуються в ЗОЗ;
у разі виявлення штамів стафілокока зі стійкістю до метициліну (оксациліну) чи ванкоміцину, або ентерококів зі стійкістю до ванкоміцину, ентеробактерій із стійкістю до гентаміцину і/або до цефалоспоринових антибіотиків III–IV поколінь, або неферментуючих бактерій із стійкістю до цефалоспоринових антибіотиків ІІІ–ІV поколінь.
6.25. Адміністрація ЗОЗ, у складі яких є відділення хірургічного профілю, забезпечує підготовку інформаційних матеріалів щодо вивчення чутливості до АМП основних збудників гнійнозапальних інфекцій, зокрема Staphylococcus aureus, Streptococcus pneumoniae, Enterococcus faecalis, Escherichia coli, Klebsiella pneumoniae, Enterobacter spp., Pseudomonas aeruginosa, виділених з біологічного матеріалу (кров, ліквор, гній з хірургічної рани), та щороку до 1 березня надає їх для аналізу та узагальнення до Державної санітарноепідеміологічної служби України за формою, наведеною у додатку 4 до цієї Інструкції.
6.26. Досліджується біологічний матеріал від пацієнтів із підозрою на гнійнозапальні інфекції. Зразки біологічного матеріалу для мікробіологічних досліджень від пацієнтів відбираються одразу після виявлення ознак гнійнозапального процесу.
6.27. Для лабораторного дослідження залежно від анатомічної локалізації патологічного процесу в пацієнтів відбираються фекалії, матеріал із зіву, шлунковий вміст (у разі зондового харчування), вміст трахеї та змив із внутрішньої поверхні інтубаційної трубки (у разі проведення штучної вентиляції легень).
6.28. Дані мікробіологічного моніторингу (видовий спектр збудників гнійнозапальних інфекцій, антибіотикорезистентність та її профілі із зазначенням діаметрів зон затримки росту виділених УПМ навколо дисків з антибіотиками) збираються і аналізуються госпітальним епідеміологом, щомісяця розглядаються на засіданні комісії з ІК ЗОЗ і доводяться до відома медичних працівників ЗОЗ.
6.29. Забір і роботу з клінічним матеріалом спеціалісти лабораторії виконують у відповідному спецодязі (халат і рукавички). При небезпеці виникнення аерозолів застосовуються додаткові захисні засоби (захисні окуляри й маски).
6.30. Забір матеріалу для дослідження здійснюється до початку антибактеріальної терапії або через певний проміжок часу після введення пацієнту АМП, необхідного для його виведення з організму.
6.31. Забір матеріалу здійснюється безпосередньо з осередку інфекції або досліджуються відповідні клінічні зразки біологічного матеріалу, що характеризують процес в органах та тканинах (наприклад, бронхіальний секрет при пневмоніях, сеча при інфекціях сечовивідних шляхів тощо).
6.32. Для уникнення забруднення проби сторонньою мікрофлорою повинні бути дотримані правила асептики та алгоритмів забору біологічного матеріалу. Забір матеріалу здійснюють під час найбільшого вмісту в ньому збудників захворювання.
6.33. Відібраний матеріал доставляється до лабораторії не пізніше ніж протягом двох годин після забору. За неможливості швидкого транспортування зразки зберігаються при температурі (6 ± 2) °С не більше 2–3 годин.
6.34. Дослідженню на чутливість до АМП підлягають чисті культури мікроорганізмів або ізольовані колонії із щільних поживних середовищ первинного посіву клінічного матеріалу. Визначення чутливості з використанням клінічного матеріалу (без виділення чистої культури) можливе тільки у виключних випадках за умови підтвердження однорідності культури і високого ступеня обсіменіння при мікроскопії мазків, забарвлених за Грамом. При такій ситуації дослідження повторюються після виділення чистої культури мікроорганізму.
6.35. Інтерпретація результатів оцінки чутливості полягає в прогнозуванні результату антибактеріальної терапії на основі даних дослідження збудника інфекції відповідно до належності досліджуваного мікроорганізму до однієї з трьох категорій:
чутливий — штам мікроорганізму пригнічується при концентраціях АМП, що створюються в органах і тканинах людини при рекомендованих лікувальних дозах. Лікування інфекції, викликаної мікроорганізмом, що належить до цієї категорії, як правило, ефективне при застосуванні АМП у рекомендованих дозах;
помірно стійкий — мінімальна інгібуюча концентрація АМП для штамів мікроорганізмів цієї категорії вища, ніж для чутливих, але знаходиться в межах, досяжних при рекомендованих режимах дозування. Лікування інфекції, викликаної мікроорганізмом, що належить до цієї категорії, може бути ефективним при застосуванні АМП у підвищених дозах або при локалізації осередку інфекції в тих органах або тканинах, де через фізіологічні особливості створюються підвищені концентрації препарату;
стійкий — штам мікроорганізму не пригнічується при концентраціях АМП, що створюються в органах і тканинах при рекомендованих режимах дозування. Ці штами мікроорганізмів мають певні механізми резистентності. Лікування інфекції, викликаної мікроорганізмом, що належить до цієї категорії, буде неефективним.
6.36. У лабораторіях ЗОЗ досліджуються та аналізуються результати чутливості до АМП клінічних ізолятів, які виділяються з місць порушення цілісності шкірних покривів та дренування хірургічних ран. При цьому особливу увагу приділяють таким ділянкам тіла (відповідно до типу резистентності мікроорганізму), які можуть бути резервуаром для передачі збудників інфекції:
штами MRSA: забору зразків (матеріалу) з ніздрів, як правило, достатньо. Для підкріплення результатів також можна додати матеріал, ізольований з горла; матеріал, отриманий шляхом аспірації за допомогою ендотрахеальної трубки; культури, отримані за допомогою гастростомії, що здійснюється через шкіру, а також ректальні або періанальні культури. Необхідно помістити мазки, взяті з кількох ділянок тіла пацієнта, до однієї й тієї самої пробірки з селективним бульйоном перед їх транспортуванням;
штами VRE: матеріал для мікробіологічного дослідження необхідно забирати з ректальної (зразки калу) та периректальної областей (змиви);
штами грамнегативних бактерій, резистентні до дії АМП: матеріал, отриманий шляхом аспірації за допомогою ендотрахеальної трубки, або мокроту необхідно дослідити у випадку наявності підозри стосовно інфікування дихальних шляхів.
6.37. Забір матеріалу для мікробіологічного дослідження у співробітників та пацієнтів хірургічного відділення проводиться за епідеміологічної необхідності для встановлення їх ролі як джерела збудника резистентних штамів УПМ.
VІI. Мікробіологічний моніторинг об’єктів внутрішнього середовища ЗОЗ
7.1. Мікробіологічний моніторинг епідемічно значимих об’єктів внутрішнього середовища відділень хірургічного профілю здійснюється лабораторіями ЗОЗ. У разі їх відсутності ці дослідження проводяться установами та закладами державної санітарноепідеміологічної служби України на добровільній основі за договорами з юридичними та фізичними особами відповідно до постанови Кабінету Міністрів України від 15 жовтня 2002 року № 1544 «Про затвердження переліку робіт і послуг у сфері забезпечення санітарного та епідемічного благополуччя населення, які виконуються і надаються за плату».
7.2. Відповідальним за організацію та здійснення санітарномікробіологічного моніторингу епідемічно значимих об’єктів внутрішнього середовища відділень хірургічного профілю у ЗОЗ є головний лікар.
7.3. У відділеннях хірургічного профілю ЗОЗ відповідальними за збір та своєчасну доставку матеріалу для бактеріологічних досліджень є завідувачі відділень та старші медичні сестри.
7.4. Дані мікробіологічного моніторингу (видовий спектр УПМ та їх антибіотикорезистентність) епідемічно значимих об’єктів внутрішнього середовища відділень хірургічного профілю ЗОЗ збираються й аналізуються, щомісяця розглядаються на засіданні комісії з інфекційного контролю ЗОЗ і доводяться до відома медичних працівників ЗОЗ.
7.5. Санітарномікробіологічні дослідження епідемічно значимих об’єктів внутрішнього середовища в операційних та інших приміщеннях відділень хірургічного профілю ЗОЗ спрямовуються на вивчення антибіотикорезистентності виділених мікроорганізмів, встановлення їх ролі у поширенні післяопераційних інфекцій, а також визначення тактики проведення заходів профілактики.
7.6. Планові санітарномікробіологічні дослідження епідемічно значимих об’єктів внутрішнього середовища (обладнання та виробів медичного призначення) в операційній та інших приміщеннях відділень хірургічного профілю проводяться лабораторією ЗОЗ не менше ніж один раз на три місяці. Контроль мікробної контамінації повітря здійснюється лише за епідемічної необхідності.
7.7. Перелік епідемічно значимих об’єктів внутрішнього середовища відділень хірургічного профілю ЗОЗ та обсяг планових санітарномікробіологічних досліджень визначаються залежно від особливостей лікувальнодіагностичного процесу на підставі результатів аналізу епідемічної ситуації в ЗОЗ та включають:
змиви з частин апаратів штучного дихання (дихальні маски, насадки, шланги кисневої підводки, маска та шланг наркозного апарата, крім одноразового використання);
воду зі зволожувачів;
конденсат дихальних контурів;
змиви з рук та медичних халатів членів хірургічної бригади та іншого медичного персоналу перед початком виконання операції або лікувальнодіагностичних процедур;
операційне поле (область хірургічного розрізу) на шкірі пацієнта;
медичні інструменти та обладнання, а також предмети догляду за хворими.
У випадку ускладнення епідемічної ситуації у хірургічному відділенні перелік об’єктів, які підлягають санітарномікробіологічному дослідженню, може бути розширений.
7.8. В амбулаторнополіклінічних закладах, медичних центрах обсяг санітарномікробіологічних досліджень епідемічно значимих об’єктів внутрішнього середовища відділень хірургічного профілю визначається адміністрацією ЗОЗ. Частота внутрішнього санітарномікробіологічного контролю якості дезінфекції та стерилізації виробів медичного призначення не може становити менше ніж два рази на рік.
7.9. Санітарномікробіологічні дослідження епідемічно значимих об’єктів внутрішнього середовища відділень у відділеннях хірургічного профілю ЗОЗ із санітарним обстеженням об’єкта фахівцями епідеміологічного відділу установ та закладів Державної санітарноепідеміологічної служби України проводяться планово один раз на два роки та за епідемічним показанням після отримання термінового повідомлення про виявлення післяопераційної інфекції.
7.10. Плановий мікробіологічний моніторинг епідемічно значимих об’єктів внутрішнього середовища відділень хірургічного профілю ЗОЗ проводиться з метою контролю за поширенням антибіотикорезистентних штамів мікроорганізмів, які щонайменше включають: S.aureus, Streptococcus spp. (у тому числі S.pneumoniae, S.pyogenes), E.faecalis, E.faecium, E.coli, Proteus vulgaris, P.mirabilis, Klebsiella spp. (у тому числі K.pneumoniae), Enterobacter spp., Citrobacter spp., P.aeruginosa, Acenotobacter spp. (у тому числі А.baumannii та A.lwoffii).
У разі виділення зазначених мікроорганізмів обов’язково визначається їх чутливість до АМП.
7.11. Лабораторіями ЗОЗ, у складі яких є відділення хірургічного профілю, мікробіологічний контроль стерильності виробів медичного призначення проводиться один раз на місяць, установами та закладами Державної санітарноепідеміологічної служби України — 1 раз на два роки планово та за епідемічної необхідності.
7.12. Мікробіологічне дослідження стерильності виробів медичного призначення (матеріалів та інструментів) одноразового використання лабораторіями установ та закладів Державної санітарноепідеміологічної служби України або ЗОЗ здійснюється лише в разі підозри на їх причетність до виникнення післяопераційної інфекції, необхідність його визначається лікаремепідеміологом під час проведення епідеміологічного розслідування причин захворювання пацієнта.
7.13. На стерильність досліджуються об’єкти внутрішнього середовища ЗОЗ, що включають: лікарські форми, які готуються в аптеках ЗОЗ (за наявності), матеріал для перев’язування, матеріали для операційних у стерильних біксах; хірургічний інструментарій із накритого стерильного столу, анестезіологічний інструментарій; інші вироби медичного призначення після стерилізації.
VІІІ. Заходи запобігання передачі резистентних мікроорганізмів
8.1. У відділеннях хірургічного профілю ЗОЗ запроваджуються заходи інфекційної безпеки, спрямовані на недопущення контактування пацієнтів, інфікованих резистентними штамами, з іншими, у яких не було виявлено колонізації або інфікування цими мікроорганізмами.
8.2. Персонал ЗОЗ використовує захисні маски відповідно до заходів інфекційної безпеки при виконанні медичних процедур, у процесі яких можливе розбризкування біологічної рідини (зокрема, при зрошенні ран, відсмоктуванні з ротової порожнини, інтубації тощо), при догляді за пацієнтами з відкритою трахеостомою та у разі секреції «фонтаном», а також за наявності ймовірності передачі штамів мікроорганізмів, резистентних до дії АМП, з надто колонізованих ділянок (наприклад, опікових і травматичних ран).
8.3. При організації та проведенні заходів профілактики післяопераційної інфекції перед тим, як приймати рішення стосовно запровадження або коригування відповідних заходів інфекційної безпеки, враховується клінічний стан кожного конкретного пацієнта, а також резистентних до дії АМП мікроорганізмів, що поширені в даному ЗОЗ.
8.4. При догляді за пацієнтами, якщо має місце контакт з неконтрольованими виділеннями, пролежневими та дренованими ранами, а також трубками/мішечками, що використовуються при стомі, медичним персоналом проводиться гігієнічна обробка рук.
8.5. Будьяке ушкодження шкіри, слизових оболонок медичного персоналу ЗОЗ, потрапляння на них біосубстратів пацієнтів кваліфікується як можливий контакт з матеріалом, який містить небезпечний інфекційний агент.
8.6. При догляді за пацієнтами відділень хірургічного профілю, колонізованими або інфікованими резистентними штамами УПМ, які не мають дренованих ран, не страждають від діареї або неконтрольованих виділень, слід встановити для них: межі допустимого палатного режиму, спілкування з іншими особами та режим використання місць загального користування на основі ризику, який вони можуть становити для інших пацієнтів, а також спроможності колонізованих або інфікованих пацієнтів дотримуватися належної гігієни рук та інших заходів, спрямованих на недопущення передачі інфекції.
8.7. При догляді за прооперованими пацієнтами після виписки із хірургічного стаціонару (або яким проведена операція в амбулаторнополіклінічних умовах) в домашніх умовах медичний персонал повинен:
дотримуватися вимог відповідних заходів інфекційної безпеки: проводити гігієнічну обробку рук, використовувати халати та рукавички при контакті з неконтрольованими виділеннями, пролежневими та дренованими ранами, нетриманні калу та трубки/мішечки, що використовуються при стомі;
обмежити кількість медичного обладнання багаторазового використання, призначеного для догляду за хворими, що ввозиться у дім пацієнта, інфікованого або колонізованого резистентними штамами мікроорганізмів. За можливості слід залишити дане обладнання вдома в пацієнта до завершення догляду за ним;
обладнання, призначене для догляду за хворими (наприклад, стетоскопи), не можна залишити вдома у пацієнта, необхідно очистити та продезінфікувати його перед тим, як забирати. Для очищення та дезінфекції використовується засіб, що забезпечує якісний рівень дезінфекції.
8.8. Пацієнти з післяопераційною інфекцією, спричиненою резистентними штамами мікроорганізмів (VRE, MRSA), підлягають (за можливості) ізоляції в окремі палати (або в одномісні палати). У цих палатах стандартні заходи безпеки поширення забезпечуються таким чином:
перев’язка та огляд хірургічних ран пацієнтів проводиться в палаті;
при вході в палату, де перебувають пацієнти з інфекцією, медичний персонал надягає маску, халат, рукавички і знімає їх при виході;
при вході та виході з палати, де знаходяться пацієнти з інфекцією, медичний персонал обробляє руки спиртовмісними або іншими шкірними антисептиками, дозволеними до використання в Україні;
предмети догляду за хворим, а також стетоскоп, термометр тощо використовують тільки для даного пацієнта з гнійнозапальною інфекцією, що спричинена мікроорганізмами, резистентними до дії АМП.
8.9. Завідувачі відділень хірургічного профілю ЗОЗ забезпечують розміщення пацієнтів (за можливості), інфікованих одним і тим самим резистентним штамом УПМ, у спеціально виділених для цього палатах.
8.10. У палатах відділень хірургічного профілю ЗОЗ пацієнтів розміщують таким чином:
за наявності одномісних палат розміщуються в них передусім пацієнти, колонізовані або інфіковані мікроорганізмами, резистентними до дії АМП, а також пацієнти, щодо яких існує підозра стосовно колонізації або інфікування цими штамами. Необхідно надавати перевагу тим пацієнтам, стан яких може спростити передачу інфекції, тобто через неконтрольовані виділення;
при відсутності одномісних палат пацієнтів, інфікованих одним і тим самим резистентним мікроорганізмом, розміщують в одній палаті або в одному блоці;
у разі неможливості розміщення пацієнтів, інфікованих одним і тим самим мікроорганізмом, разом в одній палаті необхідно розмістити їх з пацієнтами, які характеризуються низьким ризиком інфікування.
ІХ. Заходи безпеки при контактуванні з інфікованими особами
9.1. Медичний персонал відділень хірургічного профілю ЗОЗ щодня перед початком роботи одягає чистий одяг (халат або костюм, взуття, що піддається дезінфекції).
9.2. Поверхні об’єктів внутрішнього середовища палат відділень хірургічного профілю ЗОЗ, у тому числі ті, що розташовані в безпосередній близькості до пацієнта з гнійнозапальними інфекціями, можуть бути контаміновані резистентними штамами мікроорганізмів. У цих палатах медичні працівники відділень дотримуються вимог інфекційної безпеки, забезпечують гігієнічну обробку рук та одягають рукавички перед входом до палати, де перебуває інфікований пацієнт.
9.3. Медичний персонал відділень хірургічного профілю ЗОЗ стежить за чистотою своїх рук. Нігті повинні бути коротко підстрижені, без покриття лаком та накладних нігтів. Перед кожною обробкою рук знімаються браслети, годинники, обручки.
9.4. У приміщеннях відділень хірургічного профілю ЗОЗ, де медичним персоналом проводиться обробка рук, умивальник розташовується в легкодоступному місці, обладнується краном з холодною та гарячою водою та змішувачем, який приводиться в дію без доторкання рук (ліктем), струмінь води повинен бути спрямований прямо у сифон зливу для запобігання розбризкуванню води.
9.5. Члени хірургічної бригади ЗОЗ входять на територію операційного блоку через санпропускник (шлюзи), де приймають гігієнічний душ і міняють одяг на операційні костюми і медичні шапочки та проводять гігієнічну обробку (дезінфекцію) рук.
9.6. Члени хірургічної бригади ЗОЗ перед входом в «обмежену зону» операційного блоку надягають захисні медичні маски (переважно одноразового використання), які повністю закривають рот і ніс, шапочку або ковпак, які повністю закривають волосся на голові, бахіли і проходять у передопераційну, де проводять хірургічну обробку рук. Після цього члени хірургічної бригади надягають стерильні медичні халати, а потім стерильні рукавички за допомогою медичної сестри.
9.7. Члени хірургічної бригади, які торкатимуться до стерильного операційного поля, стерильних інструментів або операційного розрізу, миють руки до ліктів перед їх хірургічною обробкою заздалегідь у шлюзовому приміщенні операційного блоку стаціонару або в передопераційній.
9.8. Звичайне миття перед хірургічною обробкою призначене виключно для механічної очистки рук, при цьому з рук усуваються білкові та жирові забруднення, частково змиваються спороутворювальні бактерії, а також транзиторні мікроорганізми.
9.9. Враховуючи високу кількість мікроорганізмів (у тому числі резистентних до АМП) під нігтями, потрібна обов’язкова обробка піднігтьових зон. Для цього використовуються спеціальні палички або м’які продезінфіковані щіточки, найкраще — одноразового використання.
9.10. Хірургічна обробка рук для медичного персоналу є важливою та відповідальною процедурою, яку проводять перед будьяким хірургічним втручанням з метою попередження інфікування хірургічної рани пацієнта та одночасного захисту персоналу від інфекцій, що передаються через кров або іншим шляхом в організм пацієнта.
9.11. Медичним персоналом хірургічна обробка рук проводиться із застосуванням різних спиртових (понад 65,0 %) або інших швидкодіючих (експозиція 1,0–1,5 хв) антисептичних (дезінфекційних) засобів методом їх втирання в кисті рук та передпліччя, включаючи ліктьові суглоби. Для цього засіб наносять на руки порціями й втирають у шкіру. Перша порція засобу наноситься тільки на сухі руки. Між послідовними операціями прийнятна тривалість обробки рук також становить не менше 1,5 хв.
9.12. При виконанні техніки обробки рук медичним персоналом ЗОЗ враховується наявність так званих критичних ділянок рук, які недостатньо змочуються антисептичним засобом: великі пальці, кінчики пальців, міжпальцеві зони, нігті, навколонігтьові валики та піднігтьові зони. Ретельніше потрібно обробляти поверхні великого пальця та кінчики пальців, оскільки на них зосереджена найбільша кількість бактерій — збудників гнійнозапальних інфекцій.
9.13. За відсутності централізованого водопостачання або наявності проблеми при централізованому водопостачанні (наприклад, ремонтні роботи) відділення хірургічного профілю ЗОЗ забезпечуються закритими ємностями для води з кранами. В ємності заливають кип’ячену воду і замінюють її не рідше одного разу на добу. Перед наступним заповненням ємності ретельно миються і дезінфікуються, обполіскуються та висушуються.
9.14. Використання медичних рукавичок захищає пацієнтів та медичний персонал від розповсюдження транзиторної та резидентної мікрофлори безпосередньо через руки та опосередковано через контакти із забрудненими об’єктами оточення.
9.15. Не допускається миття або дезінфекція рукавичок для повторного використання між проведенням маніпуляцій, класифікованих як «чисті» і «брудні або інфіковані», навіть в одного пацієнта. Забороняється пересування в цих рукавичках у відділенні (відділеннях) ЗОЗ.
Дезінфекція рукавичок допускається не більше 1–2 разів виключно в ситуаціях, які вимагають частої заміни рукавичок (забір крові). У цих випадках рукавички не повинні мати проколів або бути забрудненими кров’ю чи іншими виділеннями.
9.16. Після використання медичні рукавички знімаються і занурюються в розчин дезінфектанту безпосередньо в місці (приміщенні) використання рукавичок, і проводиться гігієнічна дезінфекція рук. Після знезараження рукавички одноразового використання підлягають утилізації.
9.17. Після закінчення операції/процедури медичні працівники рукавички знімають, руки обробляють спиртовмісним засобом, а потім спеціальним засобом для догляду за шкірою рук. Якщо на руки під рукавичками потрапила кров або інші виділення, ці забруднення попередньо знімають тампоном або серветкою, змоченими антисептиком, миють руки з мийним засобом, а потім ретельно відмивають водою від мила та висушують одноразовим рушником чи серветками. Після цього руки обробляють антисептиком.
9.18. Хірургічні халати, що використовуються медичним персоналом для роботи в операційному блоці, повинні бути повітропроникні, виготовлені з матеріалів багаторазового або одноразового використання, які є ефективними бар’єрами для бактерій навіть при намоканні (тобто виготовлені із матеріалів, стійких до проникнення вологи).
9.19. Медичному персоналу відділень хірургічного профілю ЗОЗ потрібно замінювати хірургічний костюм, якщо він забруднений (контамінований) і/або просякнутий кров’ю або іншими потенційно інфекційно небезпечними біологічними рідинами.
Х. Профілактика післяопераційних гнійно-запальних інфекцій
10.1. При підготовці хірургічного хворого до операції проводяться такі заходи:
якщо хірургічна операція планова, всі виявлені бактеріальні інфекції, окрім тих, що стали причиною самої операції, мають бути проліковані до операції;
якщо волосся в області операційного поля не настільки густе, щоб перешкоджати оперативному втручанню, його не видаляють;
якщо видалення волосся необхідне, його здійснюють безпосередньо перед хірургічною операцією шляхом стрижки машинкою або з використанням електробритви (депіляторів);
потрібно належним чином контролювати рівень глюкози в сироватці крові у всіх пацієнтів, хворих на діабет, особливо уникаючи гіперглікемії в передопераційному періоді та під час операції;
якщо операція планова, хворий повинен вимитися (або бути вимитий) антимікробним милом напередодні хірургічної операції;
операційне поле і прилеглі до нього ділянки перед обробкою антисептиком повинні бути ретельно вимиті та висушені стерильною серветкою;
антисептик для передопераційної обробки шкіри області хірургічного розрізу потрібно нанести концентричними колами від центру до периферії, а за наявності гнійної рани — від периферії до центру. Підготовлена область повинна бути достатньо великою, щоб дозволити хірургу в разі потреби подовжити розріз або зробити нові розрізи для встановлення дренажів, не зачіпаючи непідготовлену шкіру пацієнта;
для ізоляції шкіри операційного поля перед операцією необхідно використовувати стерильні простирадла, рушники, серветки;
при великих операціях, що включають проведення розрізу в операційній, хворі мають бути покриті стерильними простирадлами так, щоб жодна частина тіла хворого не залишалася непокритою, виключаючи операційне поле і частини тіла, необхідні для проведення і підтримки анестезії;
якщо хірургічна операція планова, перебування хворого в стаціонарі перед операцією повинно бути нетривалим, з урахуванням необхідності адекватної підготовки пацієнта до операції.
10.2. При установці внутрішньосудинних пристроїв (наприклад, центрального венозного катетера), катетерів для спінальної або епідуральної анестезії або при введенні внутрішньовенних ліків потрібно дотримуватись принципів асептики та хірургічної техніки, а саме:
перед будьякою маніпуляцією з катетером персонал обробляє руки спиртовмісними або іншими шкірними антисептиками і надягає стерильні рукавички;
для закриття місця введення катетера використовують спеціальні стерильні пов’язки;
проводять щоденну пальпацію через непошкоджену пов’язку місця постановки катетера для визначення хворобливості. Якщо пов’язка заважає огляду і пальпації місця катетеризації, її видаляють і після огляду накладають нову;
збирання стерильного медичного обладнання в операційному блоці хірургічного стаціонару проводиться безпосередньо перед його використанням;
якщо неінфікована хірургічна рана вимагає дренування, використовуються закриті дренажні системи. Дренажі встановлюють через окремий розріз за межами основного розрізу. Дренаж потрібно прибирати якнайшвидше;
потрібно дбайливо поводитися з тканинами, підтримувати ефективний гемостаз, запобігати кровотечі, мінімізувати об’єм нежиттєздатних тканин і чужорідних тіл (тобто хірургічні шви, тканини, що обвуглилися і некротизовані) і усувати мертвий простір у місці хірургічного втручання й скорочувати тривалість операції;
при різаних ранах, які класифікуються як «брудні або інфіковані», шкірні шви в кінці операції не потрібно накладати, такі рани не повинні мати первинних хірургічних швів.
10.3. Принципи інфекційної безпеки при догляді за післяопераційною раною включають:
хірургічна рана, закрита первинним натягненням, захищається стерильною пов’язкою протягом 24–48 годин після операції;
потрібно дотримуватись вимог асептики під час догляду за операційною раною і заміни пов’язки і будьякого контакту з місцем операційного втручання або забрудненими бинтами, щоб запобігти пасивному розповсюдженню збудників інфекцій через руки;
медичний персонал може безпосередньо торкатися відкритої або свіжої рани тільки за умови, якщо на руки одягнуті стерильні рукавички;
пов’язки на зашитих ранах повинні мінятися, якщо вони намокли або якщо у хворого є симптоми або ознаки, підозрілі на наявність інфекції, наприклад, лихоманка або незвичайний біль у рані. При знятті пов’язки повинна проводитись оцінка рани на наявність ознак інфекції. За наявності будьякого виділення з хірургічної рани, підозрілої на наявність інфекції, мають бути проведені посів і бактеріоскопія цього біологічного матеріалу;
при необхідності зміни пов’язки на хірургічній рані слід використовувати стерильну медичну техніку (обладнання тощо);
потрібно навчати пацієнтів і членів їх сімей правилам догляду за хірургічною раною (якщо хворий перебуває вдома);
обмежень щодо потреби накладення пов’язки на рану прооперованому пацієнту, закриття первинним натягненням та термінів, у які дозволяється прийняття душу або ванни з неприкритою раною, немає.
ХІ. Охорона здоров’я медичного персоналу та деколонізація
11.1. Адміністрація ЗОЗ, у складі яких є відділення хірургічного профілю, здійснює відповідні заходи для своєчасного виявлення гнійнозапальних захворювань шкіри рук у медичного персоналу.
11.2. У разі виявлення випадку післяопераційної гнійнозапальної інфекції або спалаху захворювання, етіологічним чинником якого є S.aureus, медичний персонал (у разі необхідності також пацієнти) обстежується на бактеріоносійство збудника цієї інфекції. У разі виділення штаму S.aureus, який ідентичний за біологічними властивостями, в тому числі профілями антибіотикорезистентності, збуднику інфекції, медичний працівник (або пацієнт) повинен бути пролікований.
11.3. У разі виділення з носоглотки обстежених (медичного персоналу) безсимптомного бактеріоносія штаму MRSA працівник повинен бути адекватно пролікований антимікробними препаратами з урахуванням чутливості до них мікроорганізмів.
11.4. Не усувається від роботи медичний персонал відділень хірургічного профілю ЗОЗ, колонізований штамами S.aureus (ніс, руки або інші біотопи) або стрептококів групи А, якщо вони не являють епідеміологічного ризику інфікування пацієнтів.
11.5. Медичний персонал, що є бактеріоносієм штамів MRSA, до закінчення повної санації та отримання від’ємних результатів бактеріологічних досліджень не допускається до участі в проведенні хірургічних операцій. У межах хірургічного відділення медичний персонал обов’язково надягає захисні маски.
11.6. Медичний персонал відділень хірургічного профілю ЗОЗ, що є бактеріоносієм штамів MRSA, тимчасово усувається від роботи, пов’язаної з контактом із пацієнтами, доти, доки три контрольні мазки (проби) з місць колонізації протягом трьох діб після початку санації не будуть негативними. Надалі контрольні мазки беруть через десять днів, через один місяць і через три місяці.
11.7. Адміністрація ЗОЗ забезпечує консультації з лікарямиінфекціоністами та/або з іншими спеціалістами з урахуванням результатів обстеження лікарями ЛОРорганів та стоматологами стосовно проведення деколонізаційної терапії у пацієнтів або медичних працівників, що є бактеріоносіями штамів MRSA.
11.8. При деколонізації MRSA проводиться тестування чутливості даного мікроорганізму до дії АМП, що використовується для цієї мети. Потрібно забезпечувати контроль за чутливістю, щоб не допустити появи резистентності до антибіотиків, які використовуються для знищення колоній резистентних мікроорганізмів.
11.9. Деколонізація серед медичних працівників, які є бактеріоносіями штамів VRE та резистентних грамнегативних штамів УПМ, проводиться за епідемічними показаннями у разі встановлення їх можливої причетності до передачі збудників гнійнозапальних інфекцій.
ХІІ. Заходи, спрямовані на захист від контамінації резистентними мікроорганізмами об’єктів лікарняного середовища
12.1. При виявленні у пацієнтів гнійнозапальних інфекцій, спричинених резистентними штамами мікроорганізмів, у палаті проводиться поточна дезінфекція об’єктів внутрішнього середовища ЗОЗ, з якими має контакт хворий.
12.2. Дезінфекція об’єктів внутрішнього середовища ЗОЗ здійснюється з використанням тих дезінфекційних засобів, які пройшли державну реєстрацію (перереєстрацію) відповідно до Порядку державної реєстрації (перереєстрації) дезінфекційних засобів, затвердженого постановою Кабінету Міністрів України від 03 липня 2006 року № 908.
12.3. При виділенні штамів з поверхонь епідемічно значимих об’єктів внутрішнього середовища ЗОЗ або клінічних ізолятів від хворих одного виду мікроорганізму, які мають ідентичні за діаметрами зон затримки росту мікроорганізми навколо дисків з аналогічними антибіотиками, профілем антибіотикорезистентності, проводять серо, біо або фаготипування для вирішення питання належності штаму до госпітального. У разі виявлення полірезистентного штаму вивчається його стійкість до дезінфекційних засобів, які використовуються у стаціонарі, з метою корекції дезінфекційних заходів.
12.4. Моніторинг резистентності збудників гнійнозапальних інфекцій до дезінфекційних засобів проводиться за епідеміологічної необхідності лабораторіями установ та закладів державної санітарноепідеміологічної служби України.
12.5. Обов’язковій дезінфекції у відділеннях хірургічного профілю ЗОЗ підлягають об’єкти внутрішнього середовища, які можуть бути чинниками передачі резистентних штамів мікроорганізмів, до яких належать вироби медичного призначення, руки персоналу, шкіряні покриви (операційні та ін’єкційні поля) пацієнтів, предмети догляду за хворими, повітря в приміщеннях, постільна білизна, поверхні об’єктів в оточенні пацієнта, до яких часто торкаються (у тому числі спинки ліжок, тумбочок, розташованих біля ліжок, сантехнічне устаткування та ручки дверей), а також обладнання, посуд, виділення хворих та біологічні рідини (кров, мокрота тощо), медичні відходи тощо.
12.6. При проведенні у приміщеннях ЗОЗ поточної дезінфекції поверхні об’єктів, прилади, устаткування дезінфікують способом протирання. Для цього використовуються дезінфекційні засоби з мийними властивостями, що не мають подразнюючої дії та сенсибілізуючих властивостей. Не проводиться дезінфекція поверхонь об’єктів лікарняного середовища в присутності людей (пацієнтів) способом зрошування.
12.7. Заключну дезінфекцію в палатах відділень хірургічного ЗОЗ проводять за відсутності пацієнтів. Персонал, який виконує дезінфекційну обробку, повинен використовувати засоби індивідуального захисту (респіратор, рукавички, фартух). При проведенні дезінфекційних заходів використовують промаркований прибиральний інвентар.
12.8. При проведенні дезінфекційних заходів застосовуються засоби з широким спектром антимікробної дії. Обробку поверхонь об’єктів функціональних приміщень (палат) відділень здійснюють способом зрошування за допомогою розпилювальних пристроїв (установок) та методом протирання.
12.9. При проведенні у приміщеннях (палатах) відділень ЗОЗ поточної дезінфекції (у присутності людей) застосовують закриті ультрафіолетові (далі — УФ) випромінювачі (рециркулятори), антимікробні фільтри, зокрема електрофільтри, а також фільтри, що працюють за принципом фотокаталізу та іонного вітру тощо.
12.10. При проведенні заключної дезінфекції (у відсутності людей) застосовують відкриті та комбіновані УФвипромінювачі, аерозолі дезінфекційних засобів за допомогою спеціальної розпилювальної апаратури (генераторів аерозолів).
12.11. Після заключної дезінфекції у приміщеннях (палатах) відділень хірургічного профілю ЗОЗ проводиться лабораторне обстеження об’єктів внутрішнього середовища лабораторією ЗОЗ або установ та закладів Державної санітарноепідеміологічної служби України.
12.12. Операційний блок повинен бути обладнаний вентиляційними установками з переважним притоком повітря над витяжкою. В операційній слід підтримувати позитивний відносно коридорів і суміжних приміщень тиск повітря.
12.13. Загальнообмінні припливновитяжні і місцеві витяжні установки повинні вмикатися за тридцять хвилин до початку роботи і вимикатися через тридцять хвилин після закінчення роботи.
12.14. Вентиляційна система в операційній повинна забезпечувати як мінімум двадцять повітрообмінів на годину, з яких принаймні чотири повинні містити свіже повітря.
12.15. Повітря (як рециркульоване, так і свіже) має бути очищене через відповідні бактерицидні фільтри перед потраплянням в операційну. Потік повітря повинен здійснюватися на рівні стелі, витяжка — на рівні підлоги. Усі вхідні отвори повинні розташовуватися вище від підлоги і далі від витяжних отворів усіх типів.
12.16. При ефективній роботі вентиляційної системи в хірургічному стаціонарі (відділенні), яка забезпечує допустимі санітарними вимогами норми мікробного забруднення повітря, що підтверджено результатами бактеріологічних досліджень, недоцільно використовувати УФвипромінювання в операційній з метою запобігання передачі резистентних штамів УПМ збудників післяопераційних інфекцій.
12.17. Адміністрація ЗОЗ не рідше одного разу на 6 місяців повинна вживати заходів щодо проведення лабораторного контролю ступеня забруднення бактерицидних фільтрів і ефективності роботи вентиляційної системи в операційних, процедурних, перев’язувальних, палатах реанімації та інтенсивної терапії у відділеннях хірургічного профілю. Заміна бактерицидних фільтрів повинна здійснюватись у міру їх забруднення.
12.18. При виконанні ортопедичних, кардіохірургічних та інших операцій, що пов’язані з трансплантацією органів, тканин, а також з імплантацією інородних тіл в операційних залах, повітря повинно мати високий ступінь очищення.
12.19. При проведенні хірургічної операції, якщо відбулося видиме забруднення кров’ю та іншими рідинами організму поверхонь або устаткування, перед наступною операцією зазначені об’єкти потрібно дезінфікувати.
12.20. Медичному персоналу після останньої протягом дня або ночі операції необхідно проводити вологе прибирання підлоги операційної із використанням дезінфекційних засобів.
12.21. В операційній залі між хірургічними операціями слід проводити швидкодіючу дезінфекцію тих об’єктів, з якими безпосередньо стикаються пацієнти. По закінченні операцій в операційній залі проводять вологе прибирання з дезінфекцію з наступним провітрюванням. Генеральне прибирання (миття та дезінфекція) проводиться один раз на сім днів.
12.22. В оглядових, перев’язувальних, маніпуляційних хірургічних відділень не менше двох разів на добу проводять поточне вологе прибирання із застосуванням мийних та дезінфекційних засобів. Генеральне прибирання проводиться один раз на сім днів.
12.23. Вологе прибирання (із застосуванням мийних засобів) палат відділень хірургічного профілю ЗОЗ проводиться не менше двох разів на добу, з них один раз із застосуванням дезінфекційних засобів. Замість кварцювання палат проводиться їх провітрювання.
12.24. Для якісного очищення і дезінфекції внутрішнього середовища відділень хірургічного профілю ЗОЗ використовують систему двох відер, куди входять два промарковані пластикові відра, розташовані на візку (для чистого розчину та для скидання використаних мопів), та мопи. Мопи являють собою тканину з хімічних або натуральних волокон, зшитих за спеціальною технологією.
12.25. Прибиральне устаткування системи двох відер може сприяти зменшенню мікробної контамінації розчину дезінфекційного розчину, а також запобігати перенесенню резистентних штамів УПМ з одного об’єкта внутрішнього середовища ЗОЗ на інший.
12.26. Кожне відділення хірургічного профілю ЗОЗ повинно бути забезпечене комплектами інвентарю системи двох відер у необхідній кількості для прибирання санітарних кімнат, палат для хворих, приміщень адміністративного призначення і коридору.
12.27. Прибиральне устаткування системи двох відер або інший інвентар, що використовується для прибирання (відра, швабри, мопи або ганчірки), після обробки приміщення ретельно вимивають з використанням мийних засобів, ополіскують і висушують.
Комплект прибирального інвентарю зберігають у спеціально виділених для цього місцях.
12.28. Передстерилізаційне очищення виробів медичного призначення проводиться у стерилізаційному відділенні, за його відсутності — у приміщенні, де проводиться дезінфекція обладнання.
12.29. Забороняється тримати ємності з дезінфекційним розчином у приміщеннях, де постійно перебувають пацієнти. Ємності з дезінфекційним розчином ввозять на візках безпосередньо перед виконанням маніпуляцій.
12.30. У перев’язувальних приміщеннях процедурних відділень хірургічного профілю ЗОЗ необхідно мати металеві або пластмасові ємності (із решітками всередині) з дезінфекційним розчином для:
замочування інструментів багаторазового використання;
замочування м’якого інвентарю, перев’язувального матеріалу та гумових рукавичок, шприців, систем для переливання крові та розчинів, гострого та ріжучого інструментарію одноразового використання.
12.31. Дезінфекцію, передстерилізаційне очищення виробів медичного призначення проводять у спеціально виділеному приміщенні, обладнаному відповідно до вимог безпеки умов праці.
12.32. Медичний персонал відділень хірургічного профілю ЗОЗ, який проводить дезінфекцію, передстерилізаційне очищення інструментарію та обладнання, використовує засоби індивідуального захисту і працює в захисному одязі, в тому числі у фартусі із водонепроникного матеріалу, побутових рукавичках, шапочці, масці, захисних окулярах (щитках), взутті, яке не пропускає воду.
12.33. Контроль якості процесу стерилізації у стаціонарі проводиться з використанням тестів промислового виготовлення, які дозволяють перевіряти температуру, експозицію та ефективність стерилізації.
12.34. Збір використаної білизни, зберігання чистої білизни у відділеннях хірургічного профілю ЗОЗ здійснюються відповідно до санітарних норм та правил.
12.35. Використана пацієнтами відділень хірургічного профілю ЗОЗ домашня білизна віддається додому в поліетиленових пакетах без попереднього знезараження.
12.36. Сортування використаної лікарняної білизни у відділеннях хірургічного профілю ЗОЗ проводять у захисному одязі, гумових рукавичках, гумовому фартусі, шапочці, масці, взутті, яке піддається дезінфекції. Білизну після сортування складають у бавовняний мішок, який розміщують у гумовий або поліетиленовий одноразовий мішок, і в такому вигляді доставляють до пральні.
12.37. Випрану, висушену білизну складають у тканинний мішок. У хірургічні відділення ЗОЗ білизна потрапляє у мішку, з якого її витягають і розміщують на спеціальних стелажах у кімнаті для зберігання чистої білизни.
12.38. Випрану лікарняну натільну білизну для членів хірургічної бригади комплектують і стерилізують. Після стерилізації білизна має бути сухою.
12.39. Перед отриманням і видачею чистої білизни медичний персонал відділень хірургічного профілю ЗОЗ миє руки теплою водою з милом, одягає чистий халат.
12.40. Подушки, ковдри, матраци, обшиті клейонкою, в разі її цілісності обробляються дезінфекційними засобами, не обшиті клейонкою — знезаражуються в дезінфекційній камері.
XІІІ. Аналіз захворюваності на післяопераційні інфекції
13.1. Аналіз захворюваності пацієнтів на післяопераційні гнійнозапальні інфекції проводиться лікаремепідеміологом ЗОЗ (або іншим спеціалістом з інфекційного контролю) та фахівцями епідеміологічного відділу установ та закладів Державної санітарноепідеміологічної служби України.
13.2. Аналіз захворюваності пацієнтів на післяопераційні інфекції необхідно проводити за анатомічної локалізації патологічного (гнійнозапального) процесу, до них належать:
інфекції центральної нервової системи;
інфекції ока та придаткового апарату;
інфекції вуха та соскоподібного відростка;
інфекції серцевосудинної системи;
інфекції органів дихання;
інфекції органів травлення;
інфекції кістковом’язової системи і сполучної тканини;
інфекції органів сечовивідної системи;
інфекції репродуктивних органів;
інфекції шкіри та підшкірної клітковини;
інфекції м’яких тканин;
інфекція черевної порожнини;
інфекція ампутованої кукси;
інфекції та запальна реакція, зумовлені серцевими та судинними протезами, імплантатами та трансплантатами;
інфекції та запальна реакція, зумовлені протезним пристроєм, імплантатом та трансплантатом, у сечовій системі;
інфекції та запальна реакція, зумовлені протезним пристроєм, імплантатом та трансплантатом, у статевому тракті;
інфекції та запальна реакція, зумовлені внутрішніми ортопедичними протезними пристроями, імплантатами та трансплантатами;
інфекції та запальна реакція, пов’язані з іншими внутрішніми протезними пристроями, імплантатами та трансплантатами.
13.3. Оперативний (поточний) аналіз захворюваності на післяопераційні інфекції проводиться на підставі епідеміологічного діагнозу з урахуванням:
клінічної форми післяопераційних інфекцій;
терміну виникнення захворювання;
етіології захворювання; видового спектра збудників післяопераційної інфекції;
біологічних властивостей, зокрема антибіотикорезистентності збудників післяопераційних гнійнозапальних інфекцій, виділених як з клінічного матеріалу, так і з проб епідемічно значимих об’єктів внутрішнього середовища ЗОЗ;
ендогенних та екзогенних факторів ризику (у тому числі: тривалість операції, клас рани за мікробною контамінацією області хірургічного втручання, стан пацієнта як фактор ризику);
АМП, які застосовувалися; тривалості антибіотикотерапії із зазначенням найменувань препаратів;
складу хірургічної бригади; дати хірургічної операції;
дати виписки пацієнтів або переведення їх в інший ЗОЗ;
переміщення пацієнтів у межах ЗОЗ (з однієї палати в іншу, з одного відділення в інше);
тривалості перебування у хірургічному стаціонарі; тривалості антибіотикопрофілактики (антибіотикотерапії) із зазначенням найменування АМП, дози та способу введення.
13.4. Ретроспективний епідеміологічний аналіз післяопераційних інфекцій, спричинених резистентними штамами УПМ, проводиться з метою виявлення закономірності розвитку епідемічного процесу та його особливостей у конкретній ситуації, надання оцінки ефективності проведених заходів, і на цій основі розробляється адекватний комплекс заходів щодо стримування появи та поширення резистентних мікроорганізмів у відділеннях хірургічного профілю ЗОЗ. За результатами ретроспективного аналізу встановлюють:
багаторічну (не менше 3–5 років) динаміку захворюваності, її тенденції (зростання, зниження, стабілізація);
порівняльну характеристику захворюваності на післяопераційні інфекції;
структуру післяопераційних інфекцій за анатомічною локалізацією патологічного (гнійнозапального) процесу;
резистентність до АМП, штамів мікроорганізмів, які виділяються від хворих з післяопераційними гнійнозапальними інфекціями та епідемічно значимих об’єктів внутрішнього середовища ЗОЗ;
летальність від післяопераційних інфекцій з урахуванням локалізації патологічного (гнійнозапального) процесу.
13.5. Внесення корективів у систему профілактичних та протиепідемічних заходів, спрямованих на запобігання виникненню післяопераційних інфекцій, спричинених резистентними штамами мікроорганізмів, здійснюють у таких випадках:
виявлення змін у спектрі домінуючих видів резистентних мікроорганізмів, що є причиною гнійнозапальних інфекцій, а також змін профілю їх антибіотикорезистентності;
зростання частоти висіву УПМ з епідемічно значимих об’єктів внутрішнього середовища ЗОЗ;
при превалюванні в етіологічній структурі післяопераційних інфекцій та серед колонізуючих агентів певного виду резистентних штамів УПМ;
при виникненні спалаху післяопераційних інфекцій, спричинених резистентними мікроорганізмами;
при виявленні штамів стафілокока із стійкістю до метициліну чи ванкоміцину, або ентерококів із стійкістю до ванкоміцину, ентеробактерій із стійкістю до гентаміцину і/або до цефалоспоринових антибіотиків III–IV поколінь, або неферментуючих бактерій із стійкістю до цефалоспоринових антибіотиків ІІІ–ІV поколінь.
Начальник Управління громадського здоров’я
А.А. Григоренко