Газета «Новости медицины и фармации» Гастроэнтерология (429) 2012 (тематический номер)
Вернуться к номеру
Технології підсилення ендоскопічного зображення в діагностиці передракової патології слизової оболонки шлунка
Авторы: В.О. Яковенко, Універсальна клініка «Оберіг», м. Київ
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
Проблема діагностики і лікування раку шлунка є актуальною у світі. Виявлення передракових захворювань слизової оболонки шлунка (СОШ) є ефективним способом покращення результатів лікування цієї категорії хворих. У статті поданий огляд сучасних ендоскопічних методів діагностики передракових захворювань СОШ: відеоезофагогастродуоденоскопії з високою роздільною здатністю, високим збільшенням, вузькосмуговою візуалізацією і хромоендоскопією.
рак шлунка, відеоезофагогастродуоденоскопія, хромоендоскопія.
Захворюваність на рак шлунка (РШ) залишається високою у більшості країн світу. Щорічно у світі реєструється до 750–850 тис. нових випадків РШ. За даними Національного Канцерреєстру України (2011), у 2010 р. в Україні зареєстровано близько 11 тис. хворих на РШ. У структурі онкологічної захворюваності чоловічого населення рак шлунка посідає третє місце, жіночого — шосте місце, у структурі онкологічної летальності — друге місце як у чоловіків, так і у жінок. Більше половини хворих (62,2 %) не прожили 1 року після встановлення діагнозу. У той же час лише 9,3 % випадків захворювання виявлено під час профілактичних оглядів. Імовірність виявлення РШ на ранній стадії (Tis, T1), частота діагностики захворювання у 2010 р. на I–II стадіях становила 36,4 %, на ІІІ — 24,9 %, на ІV — 30,8 %. Радикальне оперативне втручання можливе тільки у 20–30 % хворих на РШ, із них тільки у третини воно буде своєчасним, 5 років переживуть лише 3–5 % хворих [1].
Однією з суттєвих причин пізньої діагностики РШ є безсимптомний початок захворювання або з симптоматикою, що відповідає клінічним проявам значно поширених захворювань верхнього відділу травного каналу, таких як функціональна диспепсія, хронічний гастрит тощо [2]. У той же час відомо, що РШ розвивається на тлі передракових захворювань протягом 15–20 років, а від появи аденокарциноми in situ до метастазування минає ще до 3 років [2]. За висловом проф. В.Т. Івашкіна, «канцерогенез — тривалий процес… Це дає лікарю час і інструмент для виявлення тих процесів, що з високою імовірністю призведуть до розвитку рака, а також шанс перервати ці зміни, запобігти розвитку рака, застати його на більш ранній стадії передраку або неінвазійного росту» [3].
До передракових змін відносять метаплазію та дисплазію слизової оболонки шлунка (СОШ) [4]. Ці стани розвиваються на тлі атрофії залоз СОШ, як правило, спричиненої хронічною інфекцією Helicobacter pylori [5]. Тривале існування атрофії та метаплазії супроводжується дисплазією — відхиленням від нормальної структури клітин в напрямку неопластичного розвитку, що проявляється клітинною атипією і порушеним диференціюванням епітелію. При цьому спостерігається певна послідовність: атрофія, метаплазія, дисплазія, РШ [6].
У хворих на РШ у 60–80 % випадків відзначається хронічна атрофія залоз СОШ. Можливість для хворого з атрофічним гастритом захворіти на РШ протягом 5–10 років називають кумулятивним ризиком. Хворі молодого віку мають найбільший кумулятивний ризик (до 30 %) [7]. Через 10 років після виявлення атрофічного гастриту РШ розвивається, приблизно, у 1 зі 150 пацієнтів, а через 15 років — РШ виникає у 10 % хворих. Щорічна частота виникнення хронічного атрофічного гастриту становить 1–3 %, далі — із частотою 0,5–3,75 % на рік розвивається дисплазія. Наявність кишкової метаплазії збільшує вірогідність РШ у 10 разів.
Своєчасна діагностика і лікування передракових змін СОШ — єдиний ефективний шлях до зниження захворюваності та смертності від РШ [2].
Важливу роль відіграють державні програми скринінгу передракових захворювань СОШ. Сучасні ендоскопічні методи підсилення ендоскопічного зображення (відеоезофагогастродуоденоскопія (ВЕГДС) з високою роздільною здатністю, високим збільшенням, вузькосмуговою візуалізацією, хромоендоскопією), прецизійна біопсія є тими інструментами, що дають нам шанс врятувати життя хворого на РШ, вчасно виявивши передракові захворювання СОШ і ранні стадії РШ, застосувавши ендоскопічну резекцію/дисекцію СОШ або економну резекцію шлунка [8].
Програма скринінгу РШ, що існує близько 50 років у Японії, забезпечила вельми позитивні результати: до 50 % випадків РШ виявлені на стадії Тis, T1, рівень смертності від РШ знизився на 68 % у чоловіків і на 37 % у жінок, п’ятирічна виживаність хворих збільшилася з 40 до 70 %. Тонкі зміни СОШ краще виявляються при ВЕГДС, ніж при рентгеноскопії. Точність ВЕГДС вища, до того ж метод дозволяє виконувати біопсію для гістологічного підтвердження злоякісності [2].
Останнім часом спостерігається креативний розвиток ендоскопічних методів діагностики та лікування. Еволюція від традиційних оптоволоконних до відеоендоскопічних досліджень дозволяє значно підвищити рівень і якість ендоскопічної діагностики. Широко застосовуються методи біопсії, хромоендоскопії, ВЕГДС із високою роздільною здатністю в режимах високого збільшення і вузькосмугової візуалізації, трансназальної гастроскопії, ендоскопічної флюоресценції, ендоцитоскопії, ендоскопічної лазерної конфокальної мікроскопії, оптичної когерентної томографії, методи ендоскопічної ультрасонографії.
Підозрілими на наявність пухлинного процесу є виявлення ділянок СОШ зі зміненим забарвленням (більш бліді або більш червоні), зі зміненими мікросудинами, з невеликим заглибленням або піднесенням — тип 0 (Паризька класифікація). Увага, що приділяється виявленню неоплазій типу 0, пов’язана з високою ефективністю їх ендоскопічного або хірургічного лікування. Фактично це єдина форма РШ, при якій є можливість стовідсоткового видужання [9].
Тип 0–I і тип 0–IIа раннього РШ розвиваються з аденоматозного поліпа або можуть бути проявом екзофітного росту пухлини, що виникає з осередків проліферації шийкового або ямкового епітелію СОШ при хронічному атрофічному гастриті. Тип 0–IIс може розвиватися на фоні виразки, що зарубцювалась або має тенденцію до рубцювання. Тип 0–III розвивається на фоні хронічної глибокої виразки шлунка [10]. За класифікацією TNM [11], карцинома in situ — це неопластичне ураження без інвазії в lamina propria — Тis; карцинома з інвазією в lamina propria і глибиною проникнення, обмеженою слизовою оболонкою — T1m; карцинома з інвазією підслизового шару — Т1sm.
Відповідно до морфологічного висновку пухлини розподіляють за групами (узгоджена Віденська класифікація) [4].
Враховуючи складність морфологічної оцінки (особливо у випадку дисплазії), її деяку суб’єктивність і провідну роль у подальшій лікувальній тактиці, доцільним є залучення другого незалежного досвідченого морфолога.
Ранній діагностиці епітеліальних пухлин шлунка сприяє хромоендоскопія й ендоскопія з високим збільшенням [12]. Хромоскопічний метод є простим, доступним і безпечним методом ранньої діагностики злоякісних уражень СОШ, що дозволяє використовувати його при масових профілактичних оглядах населення. Головне завдання хромоендоскопії — поліпшення візуалізації змін патологічної ділянки СОШ. Хромоендоскопія передбачає забарвлення епітеліальних структур під час виконання ендоскопічного дослідження з використанням:
— барвників, що абсорбуються: розчин Люголя, метиленовий синій, генціан фіолетовий, толуїдиновий синій, — проникають у цитоплазму клітини шляхом дифузії або поглинання крізь її мембрану;
— барвників, що контрастують (індигокармін, метиленовий синій), — накопичуються у ямках, щілинах і заглибленнях між епітеліоцитами слизової оболонки, тим самим посилюючи рельєф поверхні слизової оболонки піддослідної ділянки;
— барвників, що реагують: конго червоний, фенол червоний, оцтова кислота, — вступають у хімічну реакцію, взаємодіють з епітеліальними клітинами або секретом, що приводить до характерної зміни кольору;
— засобів для ендоскопічного «татуювання»: індійське чорнило, китайська туш, індигоціанін зелений, метиленовий синій, — вводяться ендоскопічною голкою в слизову оболонку для маркування [13].
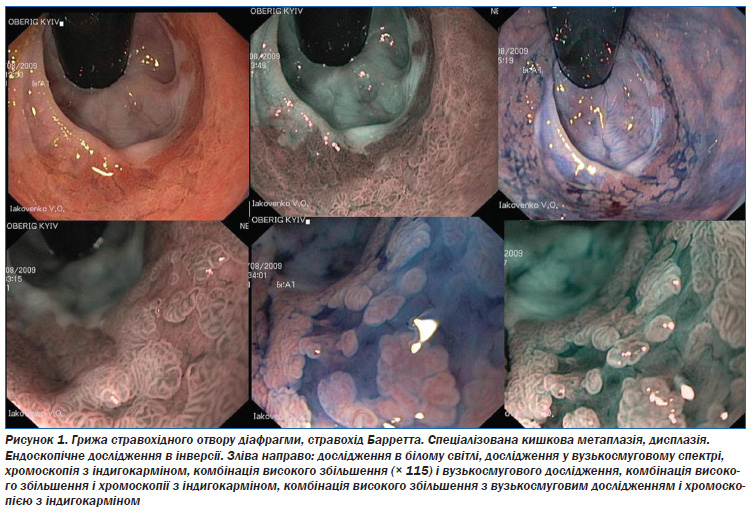
Для діагностики РШ, наприклад у групах високого ризику, застосовується забарвлення індигокарміном (рис. 1), що належить до контрастних барвників і використовуються у концентрації 0,1–0,4 %. Ним забарвлюють щілини між епітеліальними клітинами, що дає змогу побачити у першу чергу дрібні, плоскі ураження і порушення архітектоніки СОШ, а також ураження її цілісності та нерівності [13].
Оцтова кислота вступає в зворотний зв’язок з білками СОШ, підсилюючи контури поверхні слизової оболонки (рис. 2). Застосовується для діагностики циліндричної метаплазії у стравоході, кишкової метаплазії СОШ, РШ [14].
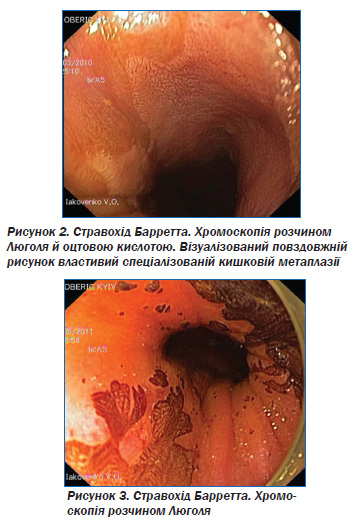
Поєднання забарвлення оцтовою кислотою і індигокарміну підсилює контурність, межі пухлини.
Забарвлення розчином Люголя дозволяє чітко візуалізувати межу патологічного утворення, оскільки барвник абсорбується тільки клітинами плоского епітелію (рис. 3) [13]. Він забарвлює глікоген, що виділяється багатошаровим пласким епітелієм, у коричневий колір. Клітини, що не містять глікогену (клітини з дисплазією і плоскоклітинний епітелій), не забарвлюються.
Використання методів підсилення ендоскопічного зображення: хромоендоскопії, вузькосмугової візуалізації, високого збільшення — дозволяє виконувати надточний забір тканин (прецизійна біопсія), що суттєво підвищує якість отриманого матеріалу з одночасним зменшенням кількості біоптатів.
Розвиток методів ендоскопічного підсилення зображення (ВЕГДС з високою роздільною здатністю, високим збільшенням, вузькосмуговою візуалізацією, автофлуоресценція, ендоцитоскопія, лазерна конфокальна ендомікроскопія, оптична когерентна томографія) знаменує еру «оптичної» біопсії.
Сучасна ендоскопія має можливість отримання найякісніших зображень СОШ завдяки застосуванню ВЕГДС із високою роздільною здатністю. Висока роздільна здатність — це такий технологічний метод, що використовує велику кількість пікселів (1 млн), забезпечує постійне високоякісне зображення [8].
Ендоскопія з високим збільшенням передбачає оптичне збільшення зображення слизової оболонки до 115 разів. Метод високого збільшення, у першу чергу, дозволяє виявити мінімальні порушення типової архітектоніки СОШ і чітко розрізнити ділянки кишкової метаплазії і дисплазії або наявність неопластичних змін за візуальними критеріями [8].
За класифікацією Sakaki ямкового рисунка рельєфу СОШ, при високому збільшенні для нормальної СОШ тіла шлунка характерні точковий (тип А) і з короткими лінійними ямками (тип В) рисунок, антрального відділу — поглиблені смуги (тип С). Зміщення типу С у тіло шлунка свідчить про атрофію СОШ. «Комірки сітки» (тип D) з’являються при кишковій метаплазії.
Вузькосмугова візуалізація (Narrow band Imaging — NBI) — це дослідження у вузькому спектрі, що суттєво доповнює можливості звичайного ендоскопічного дослідження [15]. В основі методу лежить різниця в кольорі зображення, що залежить від дифузії світла та його поглинання. Глибина проникнення світла в слизову оболонку залежить від довжини світлової хвилі: поверхневі шарі проникні для хвиль синього діапазону, середні — зеленого, глибокі — червоного. Основною речовиною, що поглинає світло, є гемоглобін. Найбільше поглинання світла спостерігається в синій частині спектра (415 нм). Завдяки цьому кровоносні судини чітко візуалізуються при освітленні світлом синьої частини спектра. Технологія вузькосмугової візуалізації реалізується за допомогою спеціальних оптичних фільтрів, що звужують спектр світла, при цьому використовується дві окремі довжини хвилі світла: синя (415 нм) и зелена (540 нм) [16]. Вузький пучок синього світла підкреслює поверхневі судини, його комбінація із зеленим світлом значно підсилює контраст зображення поверхні слизової оболонки [15].
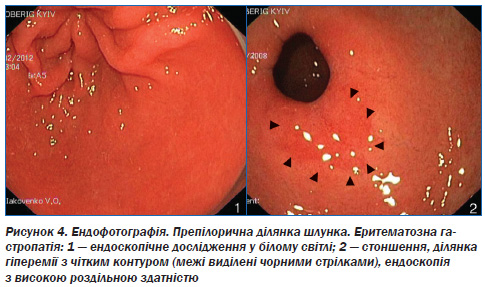
На рис. 4 подана ендофотографія пілоричної ділянки шлунка при еритематозній гастропатії. Після відмивання СОШ від слизу та розправлення порожнини шлунка повітрям виявлене стоншення СОШ із гіперемованою ділянкою з чітким контуром неправильної форми (виділена стрілками).
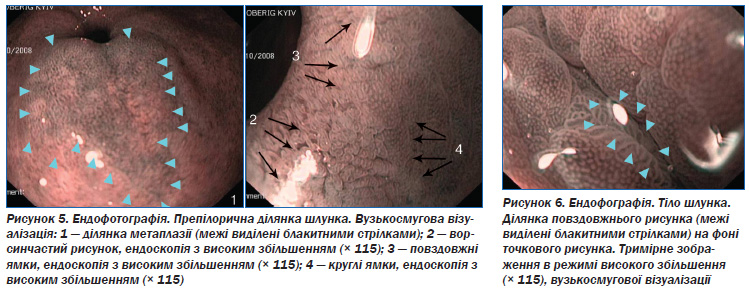
При застосуванні режимів високого збільшення (до ´ 115) і дослідження у вузькому спектрі світла (рис. 5) межі патологічно змінених ділянок СОШ ставали більш чіткими, контрастними, виявлявся специфічний ямковий рисунок поверхні СОШ (контур метаплазії виділений блакитними стрілками). У ділянці з ворсинчастим рисунком підтверджена тонкокишкова метаплазія, з повздовжнім рисунком — атрофія залоз СОШ.
Режим високого збільшення і вузькосмугової візуалізації дозволив отримати високоякісні тримірні мікрозображення СОШ в реальному часі (рис. 6). При морфологічному дослідженні біоптату СОШ із цієї ділянки виявлені ознаки гіперплазії залоз СОШ.
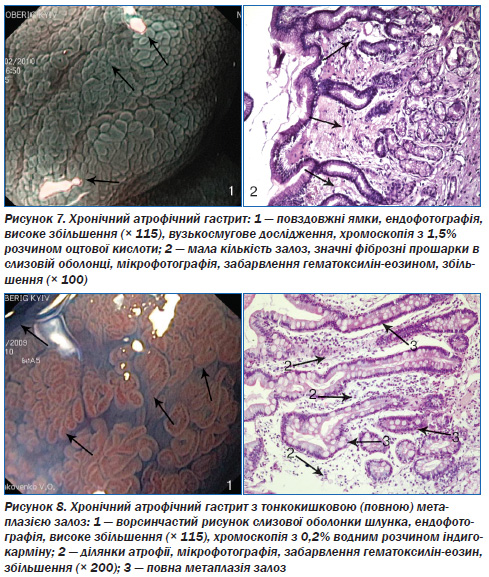
На рис. 7 — ендофотографія повздовжнього рисунка поверхні СОШ при ВЕГДС із хромоскопією 1,5 % розчином оцтової кислоти. Гістологічно — атрофія СОШ.
На рис. 8 — ендоскопічна та морфологічна картини при хронічному атрофічному гастриті з тонкокишковою метаплазією залоз СОШ. При ВЕГДС із хромоскопією 0,2 % водним розчином індигокарміну візуалізований ворсинчастий рисунок поверхні СОШ. Гістологічно підтверджена повна (тонкокишкова) метаплазія залоз СОШ.
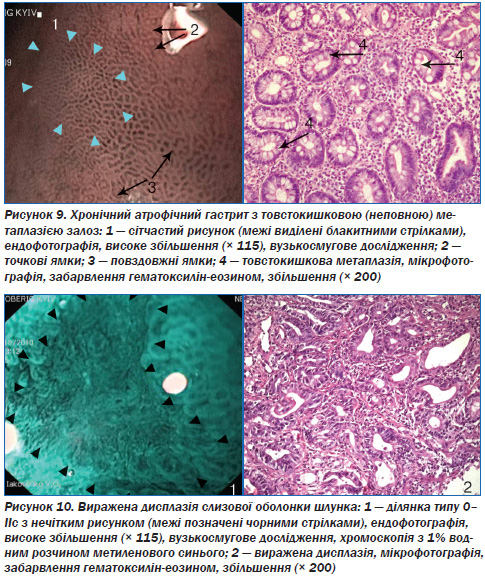
Сітчастий рисунок СОШ відповідав товстокишковій метаплазії (рис. 9)
При нечіткому рисунку СОШ (рис. 10) виявлена дисплазія залоз СОШ.
Висновок
Таким чином, використання ВЕГДС із високою роздільною здатністю, високим збільшенням, вузькосмуговою візуалізацією і хромоендоскопією є ефективним методом діагностики передракових змін СОШ.
1. Алгоритмы современной онкологии / И.Б. Щепотин, Г.В. Бондарь, В.Л. Ганул и др. — К.: Книгаплюс, 2006. — 304 с.
2. Detection of early gastric cancer: misunderstanding the role of mass screening / H. Suzuki, T. Gotoda, M. Sasako, D. Saito // Gastric Cancer. — 2006. — Vol. 9, № 4. — P. 315319.
3. Ивашкин В.Т. Современная гастроэнтерология и предопухолевые заболевания пищеварительной системы // Рос. журн. гастроэнтерол., гепатол., колопроктол. — 2002. — Т. 12, № 3. — С. 37.
4. Stolte M. The new Vienna classification of epithelia neoplasia of gastrointestinal tract: advantages and disadvantages // Virchows Arch. — 2003. — Vol. 442. — P. 99106.
5. Malfertheiner P. Maastricht guidelines: an evolving concept // Maastricht3 Guidelines for Helicobacter pylori infection / 13 United European Gastroenterology Week. — Copenhagen, 2005. — 45 p.
6. Соловйова Г.А. Хронічний гастрит: лікування банального захворювання або шлях канцерпревенції? / Г.А. Соловйова, О.Г. Курик, В.О. Яковенко // Сучасна гастроентерологія. — 2009. — № 5. — С. 98106.
7. Fox J.G. Inflammation, atrophy and gastric cancer / J.G. Fox, T.C. Wang // J. Clin. Invest. — 2007. — Vol. 117, № 1. — P. 6069.
8. American Gastroenterological Association (AGA) Institute technology assessment on imageenhanced endoscopy / T. Kaltenbach, Y. Sano, S. Friedland et al. // Gastroenterology. — 2008. — Vol. 134, № 1. — Р. 327340.
9. Endoscopic Classification Review Group. Update on the Paris Classification of superficial neoplastic lesions in the digestive tract / Endoscopic Classification Review Group // Endoscopy. — 2005. — Vol. 37. — P. 570578.
10. Endoscopic oncology: gastrointestinal endoscopy and cancer management / Ed. by D.O. Faigel, M.L. Kochman. — Totowa, New Jersey: Humana Press, 2006. — 380 p.
11. Sobin L.H. Global TNM advisory group / L.H. Sobin, F.L. Greene // Cancer. — 2004. — Vol. 100, № 5. — P. 1106.
12. Ушаева Л.А. Хромоэндоскопия в диагностике злокачественных новообразований / Л.А. Ушаева, Д.А. Балалыкин // Эндоскопическая хирургия. — 2008. — № 5. — С. 3233.
13. Значимость хромоскопии, эндосонографии и увеличительной эндоскопии в решении диагностических проблем предопухолевой патологии раннего рака желудочнокишечного тракта / Б.К. Поддубный, Ю.П. Кувшинов, О.А. Малихова, М.П. Фролова // Современнная онкология. — 2005. — Т. 7, № 3. — С. 3539.
14. Diagnosis of early gastric cancer seen as less malignant endoscopically / S. Yoshida, H. Yamaguchi, T. Hirashima et al. // Jpn. J. Clin. Oncol. — 1984. — Vol. 14, № 2. — Р. 225241.
15. Никишаев В.И. Виртуальная хромоэндоскопия — новая технология для повышения качества эндоскопического осмотра // Укр. журн. малоінвазивної ендоск. хірургії. — 2007. — Т. 11, № 3. — С. 1216.
16. Novel narrowband imaging magnifying endoscopic classification for early gastric cancer / H. Inoue, H. Minami, Y. Wada et al. // Digestive and Liver Disease. — 2010. — Vol. 42, №. 10. — P. 704708.