Газета «Новости медицины и фармации» 1-2 (442-443) 2013
Вернуться к номеру
Патология органов пищеварения при метаболическом синдроме: «курица или яйцо»?
Авторы: Губергриц Н.Б., Донецкий национальный медицинский университет им. М. Горького, Бондаренко О.А., Львовский национальный медицинский университет им. Данила Галицкого
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
В статье представлен обзор литературы об эпидемиологии и патогенезе, особенностях клиники заболеваний органов пищеварения при метаболическом синдроме. Рассмотрены вопросы связи между метаболическим синдромом и риском злокачественных опухолей. Представлены основные направления лечения.
 Эксперты ВОЗ считают, что метаболический синдром (МС) — пандемия XXI века. В перспективе он станет лидирующей причиной сердечнососудистых заболеваний [18].
Эксперты ВОЗ считают, что метаболический синдром (МС) — пандемия XXI века. В перспективе он станет лидирующей причиной сердечнососудистых заболеваний [18].
В настоящее время, согласно эпидемиологическим данным, распространенность МС в общей популяции колеблется от 14 до 25 %. В индустриально развитых странах она выше: около 25–40 % населения страдают МС. Масштабные работы по эпидемиологии МС проведены в США. Согласно критериям Национальной образовательной программы по холестерину США (National Cholesterol Education Program Adult Treatment Panel III — NCEP ATP III), 36,8 % американцев имеют МС, а по критериям Международной диабетической федерации (International Diabetes Federation — IDF) — 39,9 % [7].
В России, согласно критериям ВОЗ, метаболический синдром диагностируется у 18,6 % мужчин до 40 лет и у 44,4 % мужчин от 40 до 55 лет. У женщин МС встречается реже — у 7,3 % до 40 лет и у 20,8 % женщин от 40 до 55 лет [7].
Чаще МС встречается у лиц среднего и старшего возраста (30–40 %). Современные тенденции таковы, что в социальном сообществе доля лиц пожилого возраста увеличилась. В соответствии с этим прогрессивно растет и распространенность МС. У 45 % людей старше 60 лет выявляется МС [7].
МС служит угрозой и молодому поколению. Ожирение и избыточная масса тела у детей и подростков ассоциированы с развитием МС, сахарного диабета (СД) и сердечнососудистым риском в последующей жизни. МС выявляется у 16 % подростков. В педиатрической практике с 2007 г. применяются критерии диагностики абдоминального ожирения и МС специально у детей и подростков [7].
Согласно эпидемиологическим прогнозам, к 2025 г. прирост числа пациентов с МС составит примерно 50 %.
МС ассоциирован с многократным увеличением риска развития сердечнососудистых заболеваний и смертности. Инфаркт миокарда и мозговой инсульт в 3,0–3,5 раза чаще встречаются у больных МС. При наличии МС смертность выше в 4 раза, а при сочетании МС и сердечнососудистых заболеваний — в 5,5 раза в сравнении с лицами без МС [7].
История МС берет свое начало в первобытнообщинном строе. Именно тогда, на ранних этапах развития человека, шло формирование основного патогенетического механизма МС — инсулинорезистентности (ИР). Человек жил в системе «охотник — жертва», его питание было нерегулярным. В этих условиях возможность депонирования избыточного количества жиров и углеводов была важным приспособительным механизмом, позволяющим переживать периоды скудного питания и голодания. Требовалось своевременное выделение адекватного количества инсулина, обеспечивающего усвоение углеводов и жиров, а также депонирование жиров в жировой ткани [7].
На этих предположениях была построена теория «экономного генотипа» (Thrifty genotype), предложенная V. Neel в 1962 г. В V веке до н.э. Гиппократ отметил: «Весьма тучные от природы умирают чаще, чем худые», сделав вывод о более высокой смертности у лиц с избыточной массой тела [7].
Основоположником теории о МС признан американский врач Gerald Reaven. По его мнению, название метаболического синдрома Syndrome X (синдром X) отражает сочетание множества еще до конца не раскрытых нарушений, объединенных в один патофизиологический синдром. Именно он в 1988 г. раскрыл роль инсулинорезистентности в развитии МС, а его лекция «Роль инсулинорезистентности в человеческих болезнях» (Banting lecture 1988: «Role of insulin resistance in human disease») является самой цитируемой работой [7].
В своих работах G. Reaven доказал, что сочетание артериальной гипертензии (АГ), нарушенной толерантности к глюкозе (НТГ), гиперинсулинемии, высокого уровня триглицеридов (ГТГ) и снижения липопротеидов высокой плотности (ЛПВП) возникает в результате развития общего патогенетического механизма — снижения чувствительности тканей к инсулину [7].
В 1989 г. N.M. Kaplan охарактеризовал сочетание абдоминального ожирения, НТГ, АГ и ГТГ как «смертельный квартет», а предложенный в 1998 г. термин «синдром Z» расширил рамки «смертельного квартета» и включал синдром обструктивного апноэ сна (СОАС) [18].
МС характеризуется увеличением массы висцерального жира, снижением чувствительности периферических тканей к инсулину и гиперинсулинемией, которые вызывают развитие нарушений углеводного, липидного, пуринового обмена и АГ [18, 34].
В научном мире не прекращаются поиск и открытие новых составляющих МС. Выявлено большое число патологических состояний, ассоциированных с этим синдромом [7]:
1. Инсулинорезистентность.
2. Гиперинсулинемия.
3. Висцеральное ожирение.
4. Дислипидемия: ГТГ, ¯ ЛПВП, мелких плотных липопротеидов низкой плотности (ЛПНП).
5. Нарушение толерантности к глюкозе, или СД 2го типа.
6. Неалкогольная жировая болезнь печени (НАЖБП) (неалкогольный стеатогепатит (НАСГ) и стеатоз печени).
7. АГ.
8. Эндотелиальная дисфункция.
9. Почечная дисфункция: микро и макроальбуминурия.
10. Синдром поликистозных яичников.
11. Воспаление: Среактивного белка (СРБ), интерлейкинов (ИЛ) и других воспалительных медиаторов.
12. Гиперкоагуляция: фибриногена и ингибитора тканевого активатора плазминогена 1 (ИТАП1).
13. Атеросклероз, ведущий к увеличению сердечнососудистой заболеваемости и смертности.
МС признавали даже в качестве клинического диагноза в Международной классификации болезней (МКБ) IX пересмотра (код 277.7).
Проблема метаболических нарушений при ожирении, СД и сердечнососудистых заболеваниях побудила мировые медицинские сообщества создать диагностические критерии МС.
За время изучения МС были представлены 6 вариантов критериев диагностики МС, несколько отличающихся друг от друга по компонентам и целевым значениям.
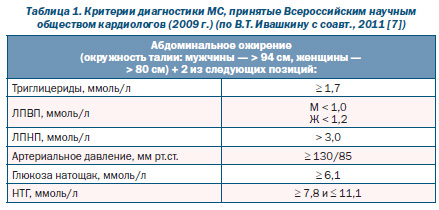
В настоящее время на практике чаще пользуются критериями NCEP ATP III (2001 г.) и IDF (2005 г.). Эти критерии просты и удобны на практике. В 2007 г. Всероссийское научное общество кардиологов приняло первые Российские рекомендации по диагностике и лечению МС, в которые вошли адаптированные диагностические критерии МС на базе критериев NCEP ATP III и IDF. В 2009 г. принят второй пересмотр Российских рекомендаций по МС, куда вошел еще один критерий — высокий уровень ЛПНП (табл. 1).
С МС встречаются врачи различных специальностей: кардиологи, эндокринологи, гинекологи, гастроэнтерологи, гепатологи, диетологи. Объяснением этому служит многообразие клинических проявлений МС.
Клинические варианты МС: гипертонический, коронарный, диабетический, печеночный, желчнокаменный, дислипидемический и смешанный вариант МС, т.е. основу клинической классификации вариантов метаболического синдрома составили ассоциированные с МС заболевания, объединенные общим этиопатогенетическим механизмом развития МС — ИР [7].
Анализируя параметры клинического статуса, В.Т. Ивашкин с соавт. (2011) [7] пришли к выводу, что больные МС имеют следующие ассоциированные заболевания:
1. АГ выявлялась у 88,3 % больных МС.
2. Ишемическая болезнь сердца в виде стабильной стенокардии регистрировалась у 35 % больных МС.
3. СД 2го типа диагностировался у 10 % больных МС.
4. НАЖБП в виде НАСГ выявлялась у 41,7 % больных МС. Стеатоз печени имел место у 100 % больных МС, что дает основание рассматривать жировую дистрофию печени как обязательную составляющую при МС.
5. Желчнокаменная болезнь (ЖКБ) в виде калькулезного холецистита и холецистэктомии в анамнезе отмечалась у 20 % пациентов МС. Кроме того, 31,7 % больных имели признаки билиарного сладжа, а 10 % — холестероз желчного пузыря, диагностированные при УЗИ брюшной полости.
6. Атерогенная дислипидемия с одновременным повышением уровня общего холестерина, ЛПНП и снижением ЛПВП выявлялась у 51,7 % больных МС.
У больных с МС чаще, чем у лиц без его проявлений, обнаруживаются изменения со стороны органов пищеварения. Однако связи МС и патологии желудочнокишечного тракта посвящены единичные исследования, а большинство работ отражает взаимоотношения отдельных компонентов МС и некоторых гастроэнтерологических нозологий. Обилие литературы по смежным вопросам свидетельствует о большом интересе к проблеме и необходимости систематизации накопленных знаний [8].
Основной признак МС — ожирение — может быть причиной сердечнососудистых, неврологических, кожных, психических заболеваний, патологии опорнодвигательного аппарата [1, 9, 15, 23, 26, 33, 37, 40, 41], то есть ожирение — это междисциплинарная проблема [20]. В то же время ожирение может быть не только алиментарноконституциональным или связанным с малоподвижным образом жизни, но и обусловленным эндокринными нарушениями, приемом некоторых лекарственных препаратов [36, 38, 39, 42]. Ожирение может провоцировать развитие разных заболеваний органов пищеварения: НАСГ, ЖКБ, гастроэзофагеальной рефлюксной болезни (ГЭРБ), функциональных нарушений пищеварительного тракта и др. [1, 3, 4, 12, 16, 22, 24, 27, 28, 31, 35]. Но эти данные, действительно, обычно носят эмпирический и несистематизированный характер.
По результатам исследований, проведенных в ЦНИИ гастроэнтерологии г. Москвы (более 500 больных с МС за период 1999–2006 гг.), составлено нозологическое дерево заболеваний органов пищеварения у больных с МС. Наиболее часто встречающиеся заболевания представлены метаболической триадой [10]:
- заболевания пищевода — 72 % случаев (ГЭРБ, в основном эндоскопически негативная, с частыми внепищеводными проявлениями; недостаточность кардии, грыжи пищеводного отверстия диафрагмы);
- заболевания печени и билиарного тракта — 64 % случаев (НАЖБП, холестероз желчного пузыря, ЖКБ);
- заболевания толстой кишки — 68 % случаев (дивертикулез толстой кишки, гипомоторная дискинезия, полипы толстой кишки).
Причина именно такого распределения не совсем понятна. Учитывая тот факт, что основную функциональную нагрузку у больных с МС выполняют печень как основной орган метаболизма и поджелудочная железа, можно было бы предполагать более высокий процент заболеваний этих органов [10].
Фундаментальные и прикладные исследования последних лет, проведенные в таких областях гастроэнтерологии, как гастроэнтерологическая физиология и патофизиология, гастроэнтерологическая эндокринология, гастронейробиология, гепатология, нутрициология, оперативная эндоскопия и др., вносят весомый вклад в повышение наших знаний о регуляции массы тела, ожирении и связанных с ними нарушениях. В настоящее время доказано, что гастроинтестинальная и гепатобилиарная системы играют важнейшую роль в регуляции массы тела и энергетического баланса [18, 20, 28].
Основные механизмы развития МС тесно связаны с дисфункцией гормонов пищевого поведения, функциональным состоянием печени, поджелудочной железы, микробной экологией толстой кишки [10]:
- гиперфагическая реакция на стресс (аномальные типы пищевого поведения и переедания, приводящие к ожирению);
- активация нейропептидов;
- активация симпатической нервной системы;
- дисфункция гормонов пищевого поведения (лептино и грелинорезистентность);
- дисфункция эндоканнабиоидной системы;
- нарушения метаболизма липидов в печени и процессов перекисного окисления липидов (ПОЛ);
- избыточное поступление свободных жирных кислот в печень, их влияние на активность симпатической нервной системы, АГ, ИР;
- нарушение высвобождения инсулина из bклеток поджелудочной железы;
- нарушение состава кишечной флоры и эндотоксинопосредованная интенсификация ПОЛ;
- микропротеинемия;
- снижение фибринолитической активности крови;
- снижение VII фактора свертываемости крови;
- гиперурикемия;
- сниженная продукция оксида азота.
Висцеральная жировая ткань, избыток которой имеет место при МС, не является инертной, а обладает аутопараэндокринной функцией [10]:
- секретирует протеин Bc1–2 — нейрональноапоптозингибирующий протеин;
- секретирует лептин (регулятор пищевого поведения);
- продуцирует фактор некроза опухолей a (медиатор ИР);
- стимулирует синтез ИЛ1 и ИЛ6;
- секретирует адипонектины:
- апелин (повышается при висцеральном ожирении, ассоциируется с гиперинсулинемией);
- висфатин (действует на инсулиновый миалгический рецептор);
- RNB4.
Для поражения желудочнокишечного тракта при МС характерны полиморбидность, т.е. сочетанные заболевания; латентное течение — отсутствие выраженных проявлений; маскированность изменений со стороны органов пищеварения сердечнососудистыми и другими проявлениями; перекрест клинических симптомов; диссонанс между выраженностью жалоб, степенью функциональных и морфологических изменений; наличие ишемических повреждений, связанных с нарушениями микроциркуляции; поздняя диагностика гастроэнтерологической патологии [8, 10, 18].
Перекрест и различной патологии органов пищеварения, и других заболеваний при МС, конечно, связан с общностью патогенеза: оксидативным стрессом, эндотелиальной дисфункцией, изменениями липидного и цитокинового спектра крови, дисбалансом между оксидом азота и сосудосуживающими факторами, коагуляцией и фибринолизом [7].
Избыточная активация липидной триады (инициация ПОЛ, фосфолипаз и детергентное воздействие жирных кислот) и стрессовых медиаторов — катехоламинов, включая гиперсекрецию глюкагона и кортизола, — ведет к прогрессирующим нарушениям метаболизма, сочетающимся со снижением резистентности слизистой оболочки пищевода, желудка, двенадцатиперстной кишки, толстой кишки, с повреждениями паренхимы поджелудочной железы, формированием жирового гепатоза, нарушением моторной функции пищеварительного тракта [5, 6, 8, 14].
Выше уже шла речь о высокой частоте ГЭРБ при МС. Во многих эпидемиологических исследованиях показана положительная корреляционная связь между ожирением и ГЭРБ: высокий индекс массы тела ассоциируется с повышением риска ГЭРБ. Причины повышенного риска развития ГЭРБ среди больных с ожирением до конца не ясны. Предполагается, что у пациентов с ожирением существует предрасположенность к возникновению диафрагмальных грыж и механическому повреждению гастроэзофагеального перехода; это повреждение возникает на фоне повышенного интрагастрального давления и увеличенного градиента давления между желудком и пищеводом, а также вследствие растяжения проксимального отдела желудка. Также хорошо известно, что одним из основных патогенетических механизмов ГЭРБ является спонтанная релаксация нижнего пищеводного сфинктера. Согласно последним исследованиям, при ожирении частота постпрандиальных спонтанных релаксаций этого сфинктера увеличивается даже при отсутствии диафрагмальных грыж, неэрозивной ГЭРБ и рефлюксэзофагита. Это подтверждает данные о том, что ожирение следует считать важным фактором риска ГЭРБ и пищевода Барретта [28].
Особенностями ГЭРБ у больных с ожирением в рамках МС являются атипичное течение заболевания с преобладанием диспептических расстройств (отрыжка съеденной пищей или воздухом, горечь во рту, тошнота, срыгивание, периодически икота, отсутствие изжоги), а также наличие внепищеводных проявлений (ночной кашель, осиплость голоса, бронхоспазм). Характерно отсутствие параллелизма между клиническими, эндоскопическими, морфологическими изменениями и наличие высокого процента осложнений ГЭРБ, например пищевода Барретта. Без коррекции массы тела сложно достичь стойкой ремиссии заболевания. По данным литературы, более чем у половины больных с МС при эндоскопическом исследовании выявляются единичные или множественные эрозии слизистой пищевода. Эндоскопически негативная ГЭРБ обнаруживается у 12 % больных. У каждого третьего пациента при гистологическом исследовании выявляют лейкоплакию пищевода или гиперкератоз [5, 6, 10, 30, 43].
МС является фактором высокого риска формирования НАЖБП и неалкогольной жировой болезни поджелудочной железы, ЖКБ, холестероза желчного пузыря [17, 18, 28, 29]. Мы не будем подробно останавливаться на этих заболеваниях, т.к. НАЖБП, холестерозу желчного пузыря и ЖКБ посвящено большое количество исследований и публикаций. Что касается неалкогольной жировой болезни поджелудочной железы, то эта патология сейчас подробно изучается и мы планируем посвятить ей монографию. Отметим, что печень и поджелудочная железа не только являются органамимишенями при МС, но и сами играют ведущую роль в формировании ИР и МС [32].
При поражении толстой кишки у больных с МС появляются неспецифические жалобы: метеоризм, запоры. Рентгенологически определяются значительные нарушения моторики, утолщение и ригидность стенок толстой кишки, замедление пассажа бария, исчезновение гаустрации, дефекты наполнения различной величины. У 30 % больных могут обнаруживаться единичные или множественные дивертикулы толстой кишки, эрозии. Наиболее часто эти изменения локализуются в селезеночном изгибе толстой кишки и в ее нисходящем отделе [5, 6, 10].
При гистологическом исследовании слизистой толстой кишки определяются кровоизлияния, уменьшение или исчезновение бокаловидных клеток собственной пластинки слизистой, большое количество сегментоядерных лейкоцитов, единичные эозинофилы. В капиллярах собственной пластинки обнаруживаются сгустки фибрина, свежие кровоизлияния. В подслизистой основе — отек, значительное полнокровие сосудов, что свидетельствует о микроциркуляторных нарушениях [6, 10].
У больных пожилого и старческого возраста возможно развитие микроскопического ишемического колита с выраженным болевым синдромом. В тяжелых случаях формируется развернутая клиника ишемического колита с кишечными кровотечениями, лихорадкой, лейкоцитозом и с последующим образованием стриктур кишечника [10].
Существенное значение в патогенезе МС имеют нарушения кишечной флоры. И наоборот, они развиваются вторично при патологии толстой кишки у больных МС, и тогда образуется порочный круг: нарушение кишечной микрофлоры ® дислипидемия ® МС ® прогрессирование изменений состава кишечной флоры и слизистой оболочки толстой кишки.
На фоне глубоких микроэкологических нарушений в кишечнике всегда изменен липидный состав крови. Микроорганизмы желудочнокишечного тракта вмешиваются в холестериновый метаболизм, воздействуя непосредственно на ферментные системы клеток хозяина, участвующие в рециркуляции желчных кислот и синтезирующие эндогенный холестерин [11, 21].
Усиленное размножение бактерий в тонкой кишке приводит к повышенной деконъюгации связанных желчных кислот и образованию их токсичных эндогенных солей, нарушающих микроциркуляцию в стенке кишки, увеличивающих всасывание практически до 100 % желчных кислот в печень. Уменьшается их синтез в гепатоцитах, повышается содержание холестерина в плазме крови в связи с отсутствием потребности в его использовании в синтезе желчных кислот. Нарушается природный механизм холестеринового гомеостаза — энтерогепатическая циркуляция желчных кислот, формируется дислипопротеидемия [11, 21].
При изменении энтерогепатической циркуляции желчных кислот в печень с кровью поступает повышенное количество эндотоксина грамотрицательной микрофлоры. Для его связывания вначале используются антиатерогенные ЛПВП. Сохранение повышенной эндотоксемии приводит к депрессии ретикулоэндотелиальной системы печени и гепатоцитов, активизации многочисленных цитокиновых каскадов, системы пероксидации крови, подавлению антиоксидантной защиты организма. Увеличивается количество гуморальных и клеточных (например, эндотелий сосудов) мишеней эндотоксина. В крови увеличивается количество модифицированных форм липопротеидов низкой плотности, обладающих значительным атерогенным потенциалом. Создаются реальные дисметаболические условия для реализации холестериновой агрессии в органахмишенях и формирования липидного дистресссиндрома [11, 21].
Нарушение энтерогепатической циркуляции желчных кислот при липидном дистресссиндроме не ограничивается только изменениями метаболизма холестерина. Недостаточное поступление желчных кислот в толстую кишку способствует многочисленным дисметаболическим процессам. Это отражается на микробной трансформации холестерина в стероидные гормоны. В толстой кишке в условиях дисбиоза снижается синтез летучих жирных кислот — главного механизма водноэлектролитного, кислотнощелочного и энергетического баланса организма человека. Нарушается деятельность пищеварительнотранспортного конвейера. Формируется синдром нарушенного пищеварения [11, 21]. По мнению Ю.И. Решетилова с соавт. (2011) [25], при этом формируется не только органический МС, но и функциональный МС. Имеется в виду, что при функциональном МС изменяется динамика расщепления, абсорбции и усвоения пищи, часто на фоне физиологически некорректных качественных и количественных характеристик пищевого рациона.
В настоящее время сформирована убедительная точка зрения в отношении возрастающего онкологического риска при МС. Признана роль ИР, локального эстрогенообразования и гиперандрогенизации в создании предрасположенности к развитию ряда онкологических заболеваний, а также показано значение молекулярногенетических факторов, часть из которых ассоциирована с гормональнометаболическими нарушениями, как основы для формирования различных патогенетических вариантов опухолей. Общность патогенетических механизмов развития МС и канцерогенеза позволяет определить дополнительные факторы риска возникновения ракового перерождения тканей, наметить возможные пути первичной немедикаментозной и, возможно, медикаментозной профилактики [13].
В итальянском исследовании, результаты которого опубликованы в 1997 г., показана взаимосвязь между ИР и развитием рака толстой кишки и рака молочной железы. Результаты этого исследования, в которое вошли 22 561 мужчина и 18 495 женщин, а наблюдение длилось 7 лет, показали, что 27 % женщин, умерших от рака толстой кишки, имели ИР (в контроле 3 %). Кроме того, 9,5 % пациентов, умерших от рака молочной железы, также имели ИР (в контроле 3,5 %) [13].
Показан высокий риск развития рака простаты, эндометрия у больных с МС.
Результаты большого исследования Американского общества рака (2005 г.) показали, что ожирение явилось причиной опухолей у 14 % мужчин и 20 % женщин. При этом среди мужчин максимальной весовой категории риск умереть от рака на 52 % больше, чем у мужчин с нормальным весом. Среди женщин с очень большим весом риск больше на 62 %. Среди женщин с максимальным весом причиной смерти был рак матки — в 6 раз чаще, рак почки — в 5 раз, рак шейки матки — в 3 раза, рак молочной железы, желчного пузыря, поджелудочной железы и пищевода — в 2 раза чаще по сравнению с контрольной группой [13].
Риск рака повышается также при дислипидемии, СД. Так, данные американского исследования, опубликованные в 2005 г. (30 000 участников, 400 здоровых добровольцев и 169 пациентов с раком поджелудочной железы; продолжительность 17 лет), свидетельствуют о том, что ИР и гиперинсулинемия сопряжены с риском рака поджелудочной железы у мужчин. Авторы исследования полагают, что СД 2го типа является фактором риска рака поджелудочной железы, что связывают с активностью инсулинового фактора роста [13].
Показано, что инсулин обладает митогенным действием, стимулирует пролиферацию ряда клеток в культуре, оказывает антиапоптотическое действие. Окислительный стресс, являющийся одним из компонентов патогенеза МС, — промотор канцерогенеза. Инсулин формирует как митогенную, так и метаболическую платформу, создающую благоприятную ситуацию для стадии промоции опухолевого роста. В условиях ИР изменения в основных эндокринных гомеостатических системах способны создавать условия, благоприятствующие опухолевому росту. Механизмы, благодаря которым реализуются эти условия, в частности усиление пролиферации и угнетение клеточного иммунитета под влиянием формирующегося при ИР набора гормональнометаболических сдвигов, определяются таким состоянием, как атеросклероз, СД 2го типа, ожирение, дислипидемия [13].
Модификация образа жизни, направленная на коррекцию массы тела с использованием комбинации гипокалорийной диеты и адекватной физической активности, — основной способ коррекции метаболических факторов риска. Снижение массы тела приводит к улучшению чувствительности к инсулину, а это основная задача при лечении пациентов с МС [0].
Для лиц с избыточной массой тела и ожирением необходимо снижение массы тела на 7–10 % за 6–12 месяцев. Диетотерапия включает низкое потребление насыщенного жира, трансмерных жирных кислот (трансжиры), холестерина и простых углеводов (сахар, мучные и хлебобулочные изделия), увеличение потребления фруктов, овощей и цельнозерновых продуктов.
Снижение массы тела должно сочетаться с регулярными физическими нагрузками периодичностью не менее 30–45 мин 4–5 раз в неделю. Основную часть физической активности должны составлять аэробные нагрузки (ходьба, плавание, теннис, велосипед и др.), т.к. именно такие нагрузки максимально снижают массу тела и улучшают инсулиночувствительность.
Основной мишенью для медикаментозного лечения является ожирение. Считают, что у пациентов с МС и индексом массы тела более 30 кг/м2 (или 27 кг/м2 с осложнениями) уменьшение массы тела только с помощью диеты и изменения образа жизни невозможно. Таким больным назначают препараты, рекомендованные FDA, — сибутрамин и орлистат. Сибутрамин — центральный ингибитор обратного захвата норадреналина и серотонина, приводящий к подавлению аппетита. Орлистат — ингибитор кишечных липаз, препятствующий расщеплению и абсорбции жира в кишечнике [19].
Терапия ИР состоит в назначении метформина, тиазолидиндионов (розиглитазон, пиоглитазон). Для коррекции дислипидемии необходимы гиполипидемические средства (статины, клофибрат, гемфиброзил). Показана эффективность антиоксидантов, в частности витамина Е.
Бариатрическая хирургия применяется для лечения ожирения у пациентов с индексом массы тела более 40 кг/м2 (или 35 кг/м2 с осложнениями), нормализация массы тела у которых с помощью модификации образа жизни или применения фармакотерапии невозможна.
Для лечения НАЖБП эффективны препараты урсодезоксихолевой кислоты, эссенциальных фосфолипидов, антиоксиданты. При развитии декомпенсированного цирроза печени или гепатоцеллюлярной аденокарциномы больные должны быть внесены в лист ожидания трансплантации печени [19].
Таким образом, МС — серьезная междисциплинарная проблема, в решение которой вовлечены и гастроэнтерологи. Именно поэтому практические врачи различных специальностей должны приобретать все более глубокие знания по этой проблеме для своевременной диагностики и лечения загадочного синдрома Х.
Список литературы находится в редакции