Газета «Новости медицины и фармации» Гастроэнтерология (446) 2013 (тематический номер)
Вернуться к номеру
От эпидемии ожирения к эпидемии сахарного диабета
Авторы: Бутрова С.А. - ГУ «Эндокринологический научный центр РАМН», г. Москва
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
Одним из самых распространенных хронических заболеваний в мире является ожирение. Его распространенность настолько велика, что приобрела характер неинфекционной эпидемии. По сведениям ВОЗ, опубликованным в 2003 г., около 1,7 млрд человек на планете имеют избыточную массу тела или ожирение [1]. Чаще всего оно встречается в США, Германии и Канаде; лидирующее положение занимает США: 34 % взрослого населения в этой стране имеют избыточную массу тела (индекс массы тела (ИМТ) 25–29,9) и 27 % — ожирение (ИМТ > 30).
Результаты выборочных исследований, проведенных в России, позволяют предположить, что в настоящее время не менее 30 % трудоспособного населения нашей страны имеет избыточную массу тела и 25 % — ожирение.
Неуклонный рост ожирения отмечается практически во всех странах мира. За последние 10 лет распространенность ожирения в мире выросла в среднем на 75 %. В Великобритании, например, к концу прошлого столетия темпы ожирения дали впечатляющую картину: за 10 лет число мужчин с избыточной массой тела выросло с 33 до 45 %, женщин — с 24 до 34 %; число мужчин с ожирением увеличилось более чем вдвое (с 7 до 16 %), а женщин — в полтора раза (с 12 до 18 %). Темпы роста ожирения в Японии, по выражению ученых, приобретают характер цунами. В Китае избыточную массу тела (ИМТ > 24,0) имеет 33,6 % населения, ожирение (ИМТ > 28,0) — 7,6 %. Особенно интенсивно наступает ожирение в развивающихся странах. Так, в Бразилии за 15 лет его распространенность почти удвоилась: с 2,5 до 4,8 % у мужчин и с 6,9 до 11,7 % у женщин. Несомненно, что такой бурный рост обусловлен проникновением «западного» образа жизни в эти страны — внедрением современных производственных технологий, в том числе в индустрию питания, изменением привычного питания, компьтеризацией образа жизни, гиподинамией и другими факторами.
Во всех регионах мира прогнозируется дальнейший рост числа тучных людей и предполагается, что к 2025 г. от ожирения будут страдать уже 40 % мужчин и 50 % женщин.
Повсеместно увеличивается частота ожирения и избыточной массы тела среди детского населения. Исследования Национального института здоровья и питания США, проводимые с 1963 г., зарегистрировали стремительный рост ожирения у детей и подростков, особенно в последние два десятилетия [2]. Распространенность ожирения (> 95-го процентиля) среди детей 6–11 лет увеличилась вдвое (c 7 до 13 %), а среди подростков 12–19 лет — почти в 3 раза (с 5 до 14 %). Предполагают, что это связано с высокой популярностью «быстрой еды» (fast food) и компьютеризацией досуга. В городских районах Китая избыточную массу тела имеют 12 %, а ожирение — 11 % детей в возрасте 7–17 лет. Подобная ситуация складывается в большинстве стран мира. Вместе с тем известно, что 15 % детей в возрасте до 2 лет, 25 % детей дошкольного возраста, имеющих избыточную массу тела, и 80 % детей 10–14 лет с ожирением и отягощенной наследственностью сохраняют ожирение и во взрослом периоде жизни.
С распространением ожирения по планете множатся и усугубляются связанные с ним тяжелые соматические заболевания: сахарный диабет типа 2 (СД2), артериальная гипертония, коронарная болезнь сердца, атеросклероз, онкологические заболевания и др. В 2002 г. было зарегистрировано 115 млн человек, имеющих заболевания, обусловленные ожирением. Средняя продолжительность жизни больных ожирением на 8–10 лет короче, чем у людей с нормальной массой тела. В США ожирение уже расценивается как ведущая из потенциально устранимых причин смертности: более 53 % всех смертельных случаев у женщин с ИМТ > 29 напрямую связано с ожирением. От заболеваний, связанных с ожирением, в мире ежегодно умирают 2,5 млн человек, в том числе в Европе — 320 тыс., в США — 280 тыс. человек.
Ожирение и СД2
Наиболее значимым медицинским последствием ожирения является СД2, так как ожирение является важнейшим среди ведущих факторов риска развития СД2. Большая часть вновь выявленных случаев этого тяжелого заболевания диагностируется у лиц с ожирением. Высокая распространенность СД2 также напрямую ассоциируется с ожирением: около 90 % больных СД2 имеют избыточную массу тела или ожирение.
Эпидемических масштабов достигла сегодня и распространенность сахарного диабета: с 1985 г. по настоящее время число больных увеличилось в 6 раз и составило 177 млн человек [3]. Основную часть больных сахарным диабетом (80–95 %) составляют лица с СД2.
Важно отметить, что фактическая распространенность СД2 превышает регистрируемую по обращаемости в 2–3 раза! Кроме того, около 200 млн человек имеют нарушенную толерантность к глюкозе (НТГ), которая расценивается как предстадия СД2 [4]. Причем наиболее распространенной среди европейцев и других популяций является форма НТГ с ожирением. НТГ также чаще встречается у детей с ожирением. В США, например, НТГ имеется у каждого четвертого полного ребенка в возрасте 4–10 лет и у каждого пятого 11–18 лет [5].
Установлено, что ежегодно у 5–10 % пациентов НТГ переходит в сахарный диабет, за пятилетие — у 20–34 %, а при сочетании гликемии натощак (> 5 ммоль/л) и НТГ — у 38–65 %; при этом вероятность перехода НТГ в сахарный диабет выше у людей с избыточной массой тела [6].
Согласно опубликованным прогнозам сахарный диабет, к сожалению, не отстает по темпам прироста от ожирения: к 2025 г. сахарный диабет предположительно будут иметь более 300 млн человек [7]. Особенно большой рост заболеваемости сахарным диабетом ожидается среди населения развивающихся стран Азии, Африки и Латинской Америки. К 2025 г. в этих странах предполагается увеличение заболеваемости сахарным диабетом в среднем на 170 %, тогда как в развитых странах — на 42 %, что, несомненно, связано с социально-экономическими и демографическими изменениями в этих странах.
Сегодня СД2 является серьезной проблемой для всех стран мира, как индустриальных, так и развивающихся. Эта проблема охватывает не только взрослое, но и детское население: доля СД2 у детей составляет в разных странах от 15 до 45 %; отмечается тенденция дальнейшего роста этих тревожных показателей [8].
Многочисленные проспективные исследования подтверждают тесную связь между ожирением и СД2. В исследовании здоровья медицинских сестер (Nurses' Health Study) было показано, что при увеличении массы тела на 8–10,9 кг риск развития СД2 возрастает в 2,7 раза. По сравнению с женщинами, имеющими ИМТ 22, уже при ИМТ 25 риск развития СД2 увеличивается в 5 раз, а при ИМТ 35 — в 93 раза [9]! Результаты Фрамингемского исследования свидетельствуют о том, что заболеваемость и сахарным диабетом, и артериальной гипертонией возрастает при увеличении массы тела.
Вероятность развития СД2 определяется также длительностью ожирения и особенностями отложения жировой ткани в организме. Показано, что у мужчин при окружности талии 100 см и более независимо от ИМТ риск развития CД2 возрастает в 3,5 раза [10]. Абдоминальный тип ожирения является независимым от степени ожирения фактором риска развития сахарного диабета. Именно этому типу ожирения часто присущи нарушения, которые и создают предпосылки для развития СД2, раннего развития атеросклероза и сердечно-сосудистых осложнений. В последние десятилетия ХХ столетия эти нарушения при ожирении стали рассматривать в комплексе, поскольку только при таком подходе можно объективно оценить их прогностическую значимость для здоровья. Метаболические, гемодинамические нарушения и их клинические проявления были объединены понятием «метаболический синдром».
Метаболический синдром
Основными составляющими метаболического синдрома являются абдоминально-висцеральное ожирение, инсулинорезистентность, гиперинсулинемия, нарушенная толерантность к глюкозе или СД2, дислипидемия, артериальная гипертония, ишемическая болезнь сердца, гиперкоагуляция, микроальбуминурия и др. Клиническое значение метаболического синдрома заключается в том, что он объединяет комплекс факторов риска, которые создают предпосылки для раннего развития СД2, атеросклероза и его осложнений. У пациентов с метаболическим синдромом смертность от сердечно-сосудистых заболеваний в 2–3 раза выше, а риск развития сахарного диабета в 5–9 раз превышает таковой у лиц без метаболического синдрома [11]. Многие исследователи рассматривают метаболический синдром как прелюдию сахарного диабета. Распространенность метаболического синдрома в общей популяции довольно высока и колеблется от 14 до 24 %, среди лиц с НТГ она составляет 50 %, а при сахарном диабете — 80 % [12].
Известно, что основными причинами инвалидности и смертности больных СД2 являются заболевания сердечно-сосудистой системы: инфаркт миокарда, сердечная недостаточность, инсульт. Показано, что уже на стадии преддиабета высока распространенность известных факторов риска сердечно-сосудистых заболеваний [8]. Так, у лиц с НТГ частота развития ишемической болезни сердца в 2 раза больше, чем у людей без нарушений. Артериальная гипертония также чаще обнаруживается у лиц с НТГ.
Риск развития сердечно-сосудистой патологии в 3–4 раза выше при имеющемся СД2, чем без него [13]. Сахарный диабет занимает 4-е место в общей структуре смертности в большинстве развитых стран мира, является также ведущей причиной слепоты и нарушений зрения у взрослого населения.
Известно, что в основе развития СД2 лежат инсулинорезистентность (ИР) периферических тканей и недостаточная секреция инсулина. ИР часто выявляется у больных ожирением, при других заболеваниях или нарушениях, входящих в понятие «метаболический синдром». Так, ИР находят у 58 % больных с артериальной гипертонией, у 84 % — с гипертриглицеридемией, у 42 % — с гиперхолестеринемией, у 66 % — с НТГ [14]. Частота и выраженность ИР при ожирении возрастают при увеличении общей массы тела, особенно висцеральной жировой ткани. При метаболическом синдроме ИР обнаруживают в 95 % случаев, что свидетельствует о ведущей роли инсулинорезистентности в развитии метаболического синдрома и ее связующей роли между ожирением и СД2.
Исследования эффективности изменения образа жизни в профилактике СД2
Поскольку из внешних факторов, способствующих развитию и прогрессированию ИР и ожирения, ведущую роль играют переедание, чрезмерное потребление жирной пищи и малоподвижный образ жизни, можно было предположить, что оздоровление питания и повышение физической активности будут способствовать отсрочке или предотвращению развития сахарного диабета. В связи с этим в Европе, Америке и Китае было проведено несколько проспективных исследований эффективности изменения образа жизни в профилактике СД2 — как без препаратов, снижающих ИР и применяемых для лечения СД2, так и в сочетании с ними.
Так как у больных ожирением (ИМТ > 30) с НТГ вероятность усугубления нарушений углеводного обмена весьма велика, то эти пациенты и были включены в исследования. Во всех исследованиях ставилась цель снизить заболеваемость сахарным диабетом, воздействуя на ожирение путем снижения массы тела на более чем 5 % от исходной. Для этого рекомендовалось гипокалорийное питание с содержанием жира менее 30 % калорийности суточного рациона, насыщенных жиров менее 10 %, клетчатки более 15 г/1000 ккал, регулярные физические нагрузки по 30 мин в день. Систематически проводились занятия с диетологом и инструкторами по физической нагрузке.
Исследования Diabetes Prevention Program (DPS), проведенные в Финляндии, и Diabetes Prevention Study (DPP), осуществленное в США, показали, что снижение массы тела, достигнутое изменением образа жизни, эффективно в предупреждении развития СД2 у больных ожирением и НТГ [15, 16]. Оба эти исследования показали снижение частоты развития СД2 на 58 % в течение 3 лет изучения. В исследовании DPP, проведенном в США, сравнивали также эффективность интенсивного изменения образа жизни с эффективностью применения метформина (850 мг 2 раза в день). В группе метформина пациенты применяли стандартные рекомендации по питанию и физическим нагрузкам. В этой группе пациентов риск развития сахарного диабета снизился в среднем на 31 %. А у молодых больных с ИМТ > 30 отмечена одинаковая эффективность метформина и изменения образа жизни в отношении профилактики сахарного диабета.
В исследовании Study to Prevent Non-Insulin-Dependent Diabetes Mellitus (STOP-NIDDM) в течение 3 лет и 3 мес. изучали эффективность применения акарбозы (максимальная доза 100 мг 3 раза в день) [17]. По сравнению с плацебо риск развития СД2 на фоне применения акарбозы снизился на 25 %.
В исследовании Troglitazone in Prevention of Diabetes (TRIPOD) изучали профилактическую эффективность троглитазона у женщин с НТГ, имевших гестационный диабет в анамнезе [18]. Риск развития сахарного диабета снизился на 56 % через 2 года лечения.
На основании данных, полученных в этих исследованиях, были сделаны выводы о том, что изменение образа жизни или применение препаратов (метформин, акарбоза, троглитазон) в сочетании с диетотерапией и увеличением физической активности приводят к снижению риска развития сахарного диабета на 31–58 % в течение 3–6 лет.
Причем во всех исследованиях, за исключением TRIPOD, показано, что наиболее эффективным в предупреждении сахарного диабета является интенсивное изменение образа жизни. Все исследования подтвердили также, что определяющим фактором в профилактике СД2 является снижение массы тела.
Во многих ранее проведенных исследованиях показано, что у больных ожирением умеренное снижение массы тела (на 5–10 % от исходной) способствует нормализации или улучшению метаболических нарушений, предотвращению развития их клинических проявлений, более благоприятному течению ассоциированных заболеваний и увеличению продолжительности жизни пациентов. D. Williamson и соавт. сообщили, что снижение массы тела на 9 кг у женщин с ожирением приводит к снижению общей смертности на 25 %, смертности от СД2 — на 30–40 % [19]. Однако согласно статистике только 5 % больных удается сохранить достигнутое с помощью диеты и физической нагрузки уменьшение массы тела в течение 1,5–2 лет. Большинство пациентов с ожирением не могут надолго удерживать достигнутые результаты. Средством повышения действенности лечения ожирения является фармакотерапия, которая помогает более интенсивно снижать массу тела, предотвращает развитие рецидивов, улучшает метаболические показатели и закрепляет приверженность больных к лечению.
Эффективность применения Ксеникала (орлистат) у больных ожирением подтверждена многими проспективными исследованиями [20, 21]. Было показано, что лечение Ксеникалом способствовало как эффективному снижению массы тела, так и удержанию достигнутого в процессе лечения. Снижение массы тела в диапазоне от более 5 % до менее 10 % от исходной в группе получавших Ксеникал было достигнуто у 84,4 и 51,5 % больных соответственно; а в группе плацебо — у 31,9 и 22,7 % пациентов. В течение второго года лечения уменьшение массы тела на 10 % и более сохранялось у 18–34 % больных, получавших Ксеникал, против 6–17,5 % группы плацебо. Причем более интенсивное снижение массы тела на фоне лечения Ксеникалом сопровождалось существенным уменьшением факторов риска сердечно-сосудистых заболеваний, таких как гиперинсулинемия, гиперхолестеринемия, масса висцеральной жировой ткани. У больных ожирением с СД2, как показал ретроспективный анализ результатов ранее проведенных исследований, применение Ксеникала приводило к существенному улучшению показателей углеводного обмена [22]. У 61 % больных HbA1c уменьшался на 0,5 % и более и у 46 % — на 1 % и более, в группе плацебо — у 43 и 29 % соответственно; р = 0,00032. Уровень глюкозы натощак уменьшался на 2,02 ммоль/л у пациентов, получавших Ксеникал, а на фоне плацебо — на 0,69 ммоль/л; р = 0,001.
Назначение Ксеникала пациентам с ожирением и НТГ в течение 2 лет приводило к нормализации показателей углеводного обмена у 71,6 % больных и более низкой по сравнению с плацебо частоте перехода НТГ в СД2: 3 против 7,6 % в группе контроля [23]. Лечение Ксеникалом также способствовало улучшению показателей липидного обмена, снижению гиперинсулинемии, уровня артериального давления у данной категории больных.
Проведенные ранее исследования по предупреждению развития СД2 и результаты комплексного лечения больных осложненным ожирением предопределили проведение исследования эффективности длительного (4 года) лечения Ксеникалом в профилактике СД2, а также изучение влияния длительного применения Ксеникала на динамику массы тела, факторов риска сердечно-сосудистых заболеваний; переносимость и безопасность лечения препаратом в течение 4 лет (прежде максимальная длительность лечения Ксеникалом составляла 2 года). Исследование Xenical in the рrevention of Diabetes in Obese Subjects (XENDOS) стартовало в 1997 г. и закончилось в мае 2002 г.
XENDOS — это проспективное многоцентровое рандомизированное плацебо-контролируемое исследование, в котором участвовали 3304 больных ожирением (ИМТ > 30) в возрасте 30–60 лет с нормальной толерантностью к глюкозе (79 %) и с НТГ (21 %); 40 % из них имели метаболический синдром [24, 25]. Диагноз метаболического синдрома ставили соответственно критериям The National Cholesterol Education Program (NCEP) Adult Treatment Panel III (ATPIII): наличие 3 признаков абдоминального ожирения (окружность талии > 102 см у мужчин, > 88 см у женщин) или более, триглицериды 1,7 ммоль/л и более; холестерин липопротеинов высокой плотности (ХС ЛПВП) менее 1 ммоль/л у мужчин, менее 1,3 ммоль/л у женщин; артериальная гипертония (> 130/85 мм рт.ст.), глюкоза натощак 6,1 ммоль/л и более. Распространенность индивидуальных факторов риска среди пациентов с метаболическим синдромом была следующая: абдоминальное ожирение — 100 %, гипертриглицеридемия — 88 %, низкий ХС ЛПВП — 71 %, артериальная гипертония — 56 %, нарушенная гликемия натощак — 15 %, НТГ — 31 %.
После рандомизации пациенты получали Ксеникал по 120 мг или плацебо 3 раза в день в сочетании с гипокалорийным питанием (дефицит суточной калорийности составлял 800 ккал) и интенсификацией физической активности. Консультации диетолога проводили каждые 2 нед. в течение первых 6 мес. исследования, а затем ежемесячно. Длительность исследования составила 4 года.
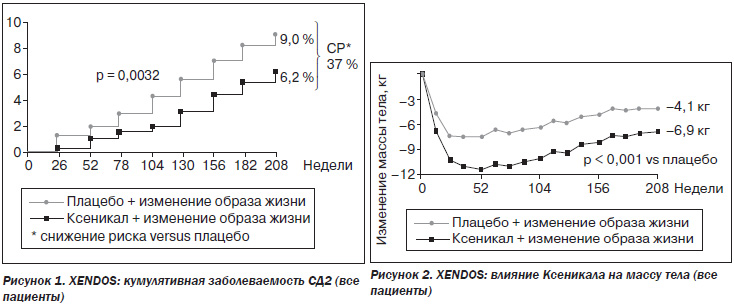
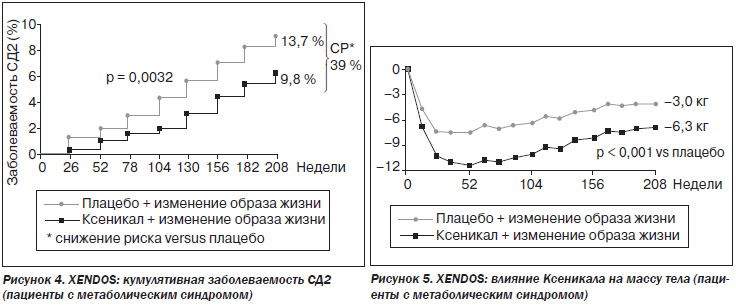
Результаты исследования показали, что в группе контроля (изменение образа жизни + плацебо) риск развития СД2 составлял 9 %, а в группе получавших Ксеникал — 6,2 %. Кумулятивная заболеваемость сахарным диабетом на фоне приема Ксеникала была на 37,3 % ниже, чем в группе контроля (рис. 1). Лечение Ксеникалом приводило к более стойкому снижению массы тела, чем плацебо: к концу первого года лечения масса тела уменьшалась на 11,4 кг, четвертого года — на 6,9 кг, а при приеме плацебо — на 7,5 и 4,1 кг соответственно (рис. 2).
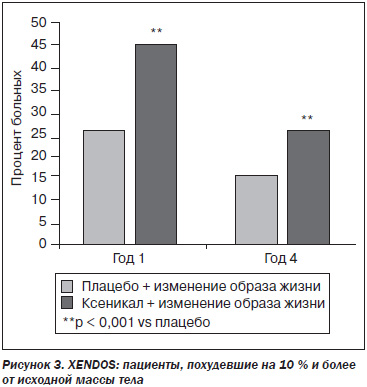
Снизить массу тела на 10 % и более и удержать достигнутый результат смогли 26 % больных, получавших Ксеникал, против 15 % группы контроля (рис. 3).
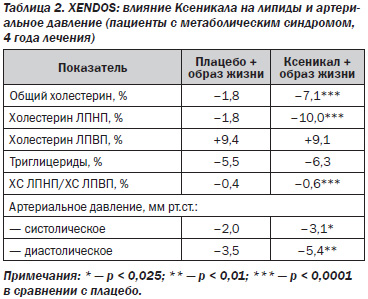
Снижение массы тела сопровождалось уменьшением окружности талии (показателя накопления массы висцеральной жировой ткани в абдоминальной области): к окончанию исследования окружность талии у пациентов, получавших Ксеникал, уменьшилась в среднем на 6,4 см, плацебо — на 4,4 см. Прием Ксеникала также способствовал более благоприятным изменениям профиля сердечно-сосудистых факторов риска и уровня артериального давления (табл. 1).
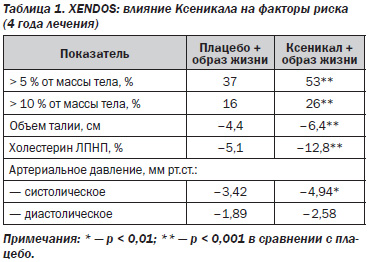
У пациентов с метаболическим синдромом кумулятивная заболеваемость СД2 в группе Ксеникала составила 9,8 %, в группе контроля — 13,7 %, т.е. была ниже, чем в контрольной группе, на 39 % (рис. 4). Снижение массы тела составило в среднем 6,3 кг по сравнению с 3 кг в контрольной группе (рис. 5).
Динамика показателей липидного обмена на фоне лечения у больных с метаболическим синдромом представлена в табл. 2.
Концентрация жирорастворимых витаминов в крови (A, D, E, K) как в группе Ксеникала, так и в группе плацебо на протяжении всего исследования оставалась в пределах нормальных значений. Частота побочных эффектов была сравнима во всех группах исследования, за исключением нарушений со стороны желудочно-кишечного тракта, которые регистрировали чаще в группе Ксеникала. Однако эти проявления были умеренными и на первых этапах исследования.
Результаты XENDOS доказали, что применение Ксеникала в сочетании с диетотерапией и увеличением физической активности более действенно, чем только изменение образа жизни, в предупреждении развития СД2, способствует более эффективному снижению массы тела, улучшению показателей липидного обмена и артериального давления и более стойкому удержанию достигнутых результатов; а также продемонстрировали хорошую переносимость и безопасность применения Ксеникала в течение 4 лет.
Таким образом, ожирение и СД2 — два взаимосвязанных заболевания, несущих в себе серьезную угрозу здоровью населения всей планеты, в настоящее время являются одной из глобальных проблем современной медицины и требуют безотлагательных усилий, направленных в первую очередь на снижение заболеваемости и увеличение продолжительности жизни людей. Результаты приведенных исследований по профилактике СД2 открывают новые возможности в решении этой задачи. Сегодня одной из наиболее эффективных стратегий предупреждения развития СД2 и прогрессирования ожирения является назначение Ксеникала в сочетании с изменением образа жизни.
1. International Obesity Task Force (IOTF), Collated data 2003.
2. Wang Y., Monteiro C. et al. // Amer. J. Clin. Nutr. — 2002. — 75. — 971-7.
3. Zimmet P. Abstract Book The 2nd Xenical Event Monte Carlo, March 14–16, 2003.
4. Zimmet P., Alberti K. et al. // Nature. — 2001. — 414. — 782-7.
5. Sinha R., Fisch G. et al. // N. Engl. J. Med. — 2002. — 346. — 802-10.
6. Sherwin R.S., Anderson R.M. et al. // Diabetes Care. — 2003. — 26. — S62-S69.
7. World Health Organization. Report of a WHO Consultation. WHO Technical Report Series 894. — Geneva, 2000.
8. Дедов И.И., Сунцов Ю.И., Кудрякова С.В. Сахарный диабет. Руководство для врачей. — М.: Универсум Паблишинг, 2003. — 75-93.
9. Colditz G.A., Willet W.C. et al. // Ann. Int. Med. — 1995. — 122. — 481-6.
10. Chan J.M., Stampfer M.J. // Diabetes Care. — 1994. — 17. — 961-9.
11. Laaksoner D.E., Lokka H.M. et al. // Am. J. Epidemiol. — 2002. — 156. — 1070-7.
12. Isomaa B., Almgren P. et al. // Diabetes Care. — 2001. — 24. — 683-9.
13. Nesto R. // Acta Diabetol. — 2001. — 38. — S. 3-84.
14. Borona E., Kiechl S. et al. // Diabetes. — 1998. — 47. — 1643-8.
15. Tuomilehto J., Lindstrom J. et al. // N. Engl. J. Med. — 2001. — 344. — 1343-50.
16. Diabetes Prevention Program Research Group // N. Engl. J. Med. — 2002. — 346. — 393-403.
17. Chiasson J.-L. et al. // Lancet. — 2002. — 359. — 2072-7.
18. ADA // Diabetes Care. — 2002. — 25. — 742-7496.
19. Williamson D.F., Pamuk E. et al. // Amer. J. Epidemiol. — 1995. — 141. — 1128-34.
20. Rossner S., Sjostrom L. et al. // Obes. Res. — 2000. — 8. — 49-61.
21. Sjostrom L., Rissanen A. et al. // Lancet. — 1998. — 352. — 167-72.
22. Hanefeld M., Platon J., Sache G. // Diabetologia. — 2001. — 44 (suppl. 1). — A231.
23. Heymsfield S.B., Segal K.R. et al. // Arch. Intern. Med. — 2000. — 160. — 1321-6.
24. Sjostrom L., Targerson J.S., Houptman J. et al. XENDOS (Xenical in the prevention of Diabetes in Obese Subjects), a landmark study Poster presented in international Congress on Obesity (ICO), August 2002, San Paulo, Brazil.
25. Targerson J.S. XENDOS — a Unique Advantage Abstract Book Satellite Symp, May 2003, Helsinki.