Газета «Новости медицины и фармации» 4 (445) 2013
Вернуться к номеру
Оптимізація реабілітаційних заходів після перенесених гострих респіраторних захворювань у дітей в амбулаторних умовах
Авторы: Марченко Т.З.1, Ткачів Н.М.2, Морозович О.М.2, Сакалош Л.П.1, 1 Львівський національний медичний університет імені Данила Галицького, 2 Жовківська центральна районна лікарня Львівської області
Рубрики: Педиатрия/Неонатология, Оториноларингология
Разделы: Клинические исследования
Версия для печати
Гострі респіраторні вірусні захворювання відповідальні за суттєвий рівень захворюваності і смертності в усьому світі [1]. Бронхообструктивний синдром, що найчастіше супроводжує ці захворювання в 50 % дітей віком до 6 років, значно ускладнює перебіг інфекції [1]. За поширеністю інфекції дихальних шляхів займають перше місце у світі: так, 6–8 разів на рік хворіє середньостатистична дитина, а за все життя людина може хворіти на гострі респіраторні вірусні інфекції (ГРВІ) 6 років [2]. Гострі інфекційні захворювання, у тому числі ГРВІ, можуть бути однією з основних причин гіповітамінозів, тому що в дитини знижується апетит, виникають обмінні порушення, порушується всмоктування в травному каналі [3].
При гострих інфекційних захворюваннях збільшується потреба у вітамінах і мікроелементах [3], але навіть їх достатнє надходження з їжею не завжди може забезпечити потреби організму, що росте, особливо в умовах хвороби та реабілітації. Тому при гострих і хронічних захворюваннях дефіцит мікронутрієнтів, поширений серед дітей і без інфекції, цілком очікуваний [4, 5]. Порушення обміну одного мікронутрієнту не буває: всі зміни взаємопов’язані, тому в результаті змінюється функціонування внутрішніх органів, порушується формування імунної відповіді, виникає патологічний біоценоз кишечника, затримуються ріст, психомоторний розвиток, статеве дозрівання дитини [3]. Порушення апетиту можуть бути функціональними й органічними [6].
Серед причин органічних порушень апетиту в дітей — гострі респіраторні захворювання з гіпертермією й інтоксикацією, глистові інвазії, дефіцитні стани (гіповітамінози, дисмікроелементози) [6]. На рівень апетиту прийом ліків впливає як у бік зниження (антибіотики, антипіретики, відхаркувальні), так і підвищення (гормони) [7]. Найчастіше зустрічаються порушення апетиту в молодших школярів і дошкільників, коли проблеми соціальної адаптації та навчального навантаження стають непосильними. Про це може свідчити наявна в них дисфункція кори надниркових залоз [7], що характерна для хронічної стресової реакції з підвищеним умістом глюкокортикоїдних фракцій і зменшенням промінералокортикоїдів. Це свідчить про переважання катаболічних процесів над анаболічними [6]. Варіабельність апетиту корелює з віковими особливостями обміну речовин і потребами в окремих харчових інгредієнтах [7]. Нераціональні методи виховання в сім’ї, гіперопіка, суперечки між батьками, одна дитина в сім’ї, насильне годування, спосіб кулінарної обробки продуктів, температура їжі також викликають зниження апетиту [6, 7].
Для корекції апетиту (найчастіше його підсилення) здавна застосовували гіркоти, полівітаміни, рідше — анаболіки. Солодкі сиропи на основі рослин для дітей в цьому плані найбільш фізіологічні і прийнятні, тому що гіркоти дітьми не сприймаються [6]. З точки зору впливу на метаболічні процеси вважається раціональним призначення полівітамінних і вітамінномікроелементних препаратів [7], а застосування травних ферментів при порушеннях апетиту дискутабельне [6, 7]. Тому і діагностика, і лікування порушень апетиту вимагають врахування конституційносоматичних особливостей, фізичного розвитку, стану здоров’я дитини, наявних захворювань, соціальнонегативних факторів [6], що сприятиме покращенню формування імунної відповіді дитини, росту й розвитку, знижуючи частоту повторних захворювань дихальної системи.
Реабілітаційна програма після перенесених ГРВІ повинна бути спрямована як на підвищення апетиту, санацію можливих вогнищ інфекції, гемоглобінове оздоровлення, так і на корекцію транзиторних відхилень, загальної реактивності, що можна визначити за показниками традиційної гемограми з розрахунком інтегральних коефіцієнтів реактивнозахисного потенціалу організму дітей — клітиннофагоцитарного захисту (КФЗ) і специфічного імунного лімфоцитарномоноцитарного потенціалу (СІЛМП) [8–10]. Низький рівень цих показників вказує на зниження реактивнозахисного потенціалу організму, визначає стан і ризик порушення здоров’я дитини при мінімальних затратах часу, без проведення дорогих спеціальних імунологічних досліджень [10].
Мета дослідження — оптимізація реабілітації в амбулаторних умовах дітей після перенесених гострих інфекцій дихальних шляхів у плані корекції апетиту, рівня гемоглобіну та можливих транзиторних відхилень захисних сил організму із включенням безрецептурного препарату Біоарон С (PhytoPharm Klenka) у комплекс реабілітації на фоні корекції дієти за основними інгредієнтами, у тому числі вітамінами й мікроелементами, санації вогнищ інфекції в рото і носоглотці методами місцевої й фізіотерапії.
Матеріали і методи дослідження
Під спостереженням були 50 дітей віком 3–10 років з організованих дитячих колективів (дитячі дошкільні установи і школи), які перенесли гострі інфекції дихальних шляхів (ГРВІ, гострі отит, ринофарингіт, тонзилофарингіт, бронхіт та їх комбінацію). Реабілітаційні заходи проводили з 8го дня від початку гострого захворювання. Діти були умовно розподілені на 2 групи. До основної групи (30 осіб) входили пацієнти, яким у комплекс реабілітаційних заходів був включений Біоарон С у дозі 5 мл двічі на добу дітям до 6 років і 5 мл тричі на добу дітям віком понад 6 років протягом 2 тижнів. Препарат містить екстракт алое, сік аронії, вітамін C, тобто наявні біогенні стимулятори водної витяжки з листя алое, а також вітаміни та мікроелементи. Водна витяжка з листя алое стимулює гранулопоез, посилює здатність до абсорбції, деградації та розпізнавання антигенів. Перш за все посилює гуморальну відповідь; стимулює збільшення кількості лімфоцитів В у периферичній крові, одночасно менше впливаючи на захисну реакцію клітинного типу. Крім того, незначно посилює опірність контактній інфекції. Імуностимулююча дія препарату проявляється в рівновазі імунної системи, що особливо важливо для дітей, які ще на мають сформованого в повному обсязі захисного механізму.
Контрольну групу становили 20 дітей, яким у реабілітаційні заходи не включали прийом Біоарону С. Групи дітей були практично ідентичними за віком (середній вік в основній групі — 5,13 ± 1,40 року, у контрольній — 5,09 ± 1,20 року) та статтю (переважали хлопчики — 62 і 63 % відповідно). За кількістю дітей із частотою гострих захворювань 4–7 разів на рік (41 % в основній групі і 40 % — у контрольній), за обтяженим спадковим анамнезом за хронічним тонзилітом (12 і 11 % відповідно) і підвищеною частотою респіраторних інфекцій (12 і 13 % відповідно). За нозологічною характеристикою перенесених захворювань ці групи дітей також мало відрізнялися: переважали ГРВІ (36 і 37 % відповідно), гострий тонзилофарингіт (10 і 11 % відповідно), гострий ринофарингіт (21 і 20 % відповідно), гострий отит (13 і 11 % відповідно). Найчастіше поєднувалися гострий ринофарингіт та отит (26 і 25 % відповідно), гострий бронхіт та отит (19 і 20 % відповідно).
Діагностику, лікування й реабілітацію гострих захворювань дихальних шляхів проводили згідно з чинними протоколами надання медичної допомоги дітям [11].
До початку реабілітаційних заходів легкий ступінь залізодефіцитної анемії (ЗДА) із рівнем гемоглобіну 100–110 г/л виявили у 20 % дітей основної групи й у 21 % — контрольної.
Рівень гемоглобіну в межах 111–119 г/л був у 41 % дітей основної групи і 39 % — контрольної. Дітям із рівнем гемоглобіну 100 г/л і більше препарати заліза не призначали згідно з протоколом діагностики й лікування ЗДА [12].
Динаміка апетиту вивчалася до початку реабілітації, на 14й і 28й день за анкетними даними й даними спостереження (табл. 1), а інтегральні коефіцієнти захисного потенціалу організму дітей — за показниками гемограми до початку реабілітації і через 28 днів. Аналізували також динаміку рівня гемоглобіну до початку реабілітації і через 28 днів.
Результати та їх обговорення
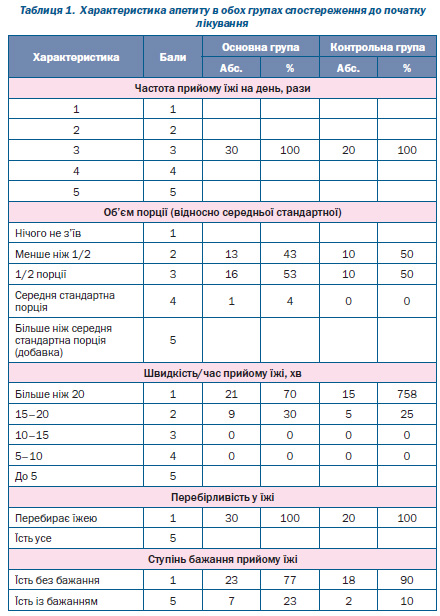
Характеристика параметрів апетиту до початку реабілітації була однаковою в обох групах пацієнтів (табл. 1): усі діти їли не частіше ніж 3 рази на добу, менше 1/2 порції з’їдали 43 % дітей основної групи і 50 % дітей контрольної групи, 1/2 порції з’їдали 53 і 50 % відповідно. Переважна більшість дітей їла більше ніж 20 хв (70 % дітей основної групи і 75 % — контрольної). Усі діти були перебірливими в їжі, більшість (77 % основної групи і 90 % — контрольної) їла без бажання.
Вивчені параметри апетиту мали набагато кращу позитивну динаміку в процесі реабілітації в основній групі дітей порівняно з контрольною (табл. 2, 3).
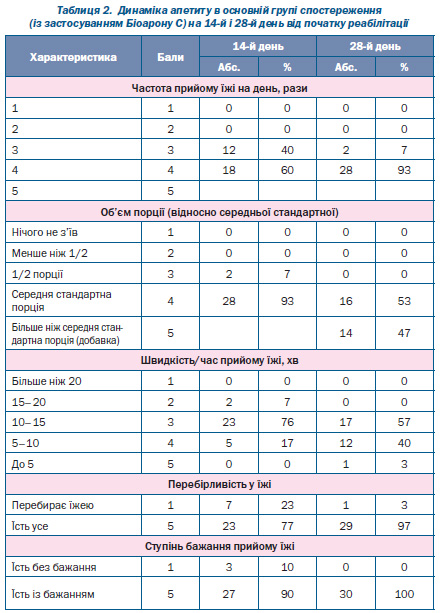
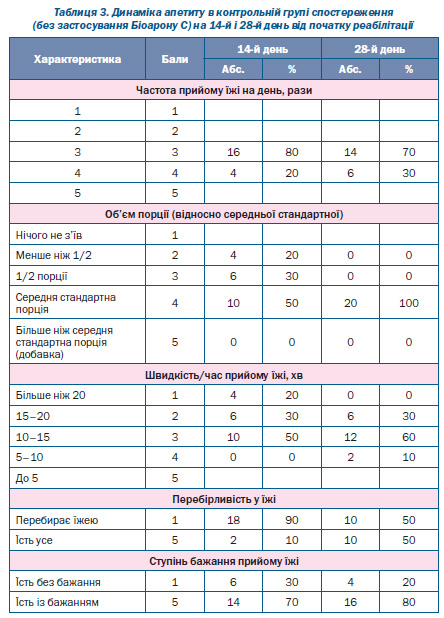
Як видно з даних табл. 2, 3, уже на 14й день реабілітації 60 % дітей основної групи потребували прийому їжі 4 рази на добу, лише 20 % дітей контрольної групи їли 4 рази на день. На 28й день ця різниця була ще більшою: 93 % дітей основної групи мали бажання та їли 4 рази на добу, а в контрольній групі таких дітей було лише 30 % (p < 0,05) (рис. 1).
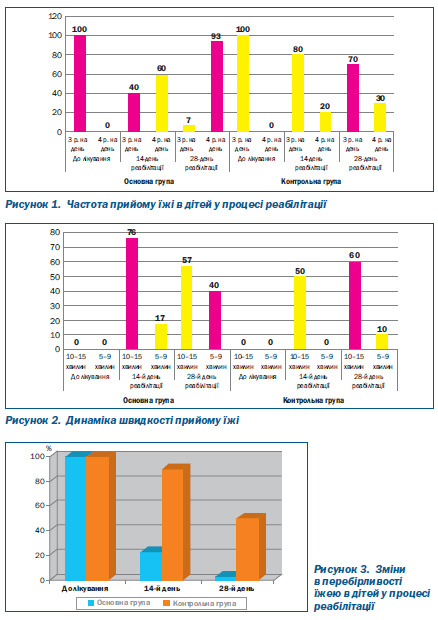
Динаміка об’єму порції також була набагато кращою в дітей основної групи порівняно з контрольною (табл. 2, 3): на 14й день реабілітації середньостатистичну порцію з’їдали 93 % дітей основної групи і лише 50 % дітей контрольної групи (p < 0,05), а на 28й день 47 % дітей основної групи з’їдали більше від середньої стандартної порції (добавка), таких дітей у контрольній групі не було (p < 0,05).
Оцінюючи швидкість прийому їжі в динаміці, ми бачимо за даними табл. 2, 3, що на 14й день реабілітації 76 % дітей основної групи їли протягом 10–15 хвилин, а в контролі — 50 % пацієнтів (p < 0,05). Уже на 14й день реабілітації 17 % дітей основної групи їли протягом 5–10 хвилин, а в контролі таких дітей не було (p < 0,05). На 28й день реабілітації 40 % дітей основної групи приймали їжу за 5–10 хвилин, а в контрольній групі — лише 10 % дітей (p < 0,05) (табл. 2, 3, рис. 2).
Перебірливість у їжі на 14й день реабілітації спостерігалася у 23 % дітей основної групи і в 90 % контрольної групи (p < 0,05) (табл. 2, 3, рис. 3).
На 28й день реабілітації 97 % дітей основної групи не перебирали їжею, а в контрольній групі таких дітей було 50 %.
Із бажанням їли на 14й день реабілітації 90 % дітей основної групи й лише 70 % — контрольної групи (p < 0,05) (табл. 2, 3).
На 28й день реабілітації 100 % дітей основної групи мали бажання їсти, а в контрольній — лише 80 % (p < 0,05).
Середній бал характеристики апетиту за даними анкетування в процесі реабілітації також був вірогідно (p < 0,05) вищим в основній групі дітей (рис. 4) уже на 14й день реабілітації (16,9), а на 28й день реабілітації — 23,2, що вірогідно більше, ніж у контрольній групі (16,8; p < 0,05).
Динаміка середнього рівня гемоглобіну в дітей основної групи через 28 днів була також значно кращою, ніж у дітей контрольної групи (рис. 5).
Так, на 28й день реабілітації в дітей основної групи середній рівень гемоглобіну був вірогідно (p < 0,05) вищим, ніж у дітей контрольної групи.
У процесі реабілітації всі 20 % дітей основної групи із легким ступенем ЗДА на 28й день реабілітації мали оптимальний рівень гемоглобіну, а в контрольній групі із 21 % дітей із легким ступенем ЗДА — лише 11 % (рис. 6), тому в подальшому цим дітям було рекомендовано приймати препарати заліза.
Із 40 % дітей із субоптимальним рівнем гемоглобіну в процесі реабілітації на 28й день усі вони мали оптимальний рівень гемоглобіну (124,4 ± 4,4 г/л). Тоді як у 39 % дітей контрольної групи із субоптимальним рівнем гемоглобіну до початку реабілітації через 28 днів залишився субоптимальний рівень гемоглобіну в 14 % (рис. 7).
Вивчення в динаміці середніх значень коефіцієнта КФЗ показало, що стартові показники були ідентичними в обох групах дітей і становили 0,520 ± 0,012 в основній групі і 0,520 ± 0,010 у контрольній, що, за даними авторів [8], може вказувати на послаблення кооперуючої функції фагоцитів у периферичній крові і може спричинити ризик «прориву» захисного бар’єру на шляху наступної інфекції, тобто ризик рецидиву або реінфікування. На 28й день реабілітації середнє значення КФЗ відрізнялося в дітей основної і контрольної груп: у дітей основної групи він навіть перевищував показники здорових (за даними літератури [8]) і становив 0,620 ± 0,010, вірогідно (p < 0,05) перевищуючи стартовий показник в основній групі і показник у дітей контрольної групи на 28й день (0,540 ± 0,013). У дітей контрольної групи вірогідного підвищення КФЗ у процесі реабілітації не виявлено (рис. 8). Низький коефіцієнт фагоцитарного захисту, відображаючи кількісний уміст фагоцитів у периферичній крові, пов’язаний із підвищеним надходженням цих клітин у шоковий орган із метою виконання основних функцій вродженого імунітету, що забезпечують захист шляхом фагоцитозу інфекційних агентів, а також представлення антигену клітинам адаптивного імунітету.
Стартові показники СІЛМП у дітей обох груп були подібними (0,550 ± 0,004 — в основній групі і 0,570 ± 0,002 — у контрольній) і перевищували, за даними літератури [8], показники здорових дітей (0,470 ± 0,009, p < 0,05). На 28й день реабілітації показник СІЛМП нормалізувався у 87 % дітей основної групи і лише у 12 % дітей контрольної групи і становив у середньому відповідно 0,480 ± 0,004 в основній групі, а в контрольній — 0,550 ± 0,001, тобто вірогідним (p < 0,05) було зниження рівня СІЛМП до значень здорових дітей лише в основній групі (рис. 9).
На думку дослідників [8–10], підвищення значень СІЛМП пояснюється збільшенням циркуляції моноцитів (а в тканинах — макрофагів), що виконують функції презентації антигенів лімфоцитами, які мають фізіологічну функцію антитілоутворення в процесі диференціювання. Тому збільшення значень СІЛМП, що відображає кількісний уміст моноцитів і лімфоцитів, непрямо може свідчити про напруженість адаптивного імунітету, особливо в часто хворіючих дітей, навіть за відсутності клініки гострої інфекції дихальних шляхів [10]. Зниження цього показника на 1–1,5 % свідчить про відхилення захисного потенціалу організму. У дітей із 10 років ці показники залежать від віку і статі [10].
Взаємозв’язок неспецифічних факторів захисту й гуморального імунітету підтверджується виявленим позитивним зв’язком середньої сили IgA із КФЗ (r = 0,71, p < 0,05) і негативним зв’язком IgA із СІЛМП (r = –0,7, p < 0,05), що може вказувати на можливість оцінки імунної системи за інтегральними коефіцієнтами гемограми дітей [8].
Оскільки імунна система дітей дозріває поступово і безперервно зазнає тренувальних навантажень ззовні, вона не завжди встигає адекватно реагувати на антигенну стимуляцію, починають виснажуватися адаптивні можливості із послабленням компенсаторних механізмів, що сприяє збільшенню частоти формування хронічного перебігу захворювань, виникненню анемії [13].
За концепцією Патріка Холта (2001), багато хронічних захворювань дорослих є результатом порушення дозрівання імунної системи в дитинстві [13]. Зміна імунних показників у дітей у разі повторних інфекцій може бути раннім маркером хронізації запального процесу, випереджаючи її клінічні прояви [14, 15]. Напруженість процесів імунного реагування, порушення міжклітинної кооперації й недостатність резервних можливостей є факторами високого ризику виникнення місцевих і системних ускладнень.
Виявлена нами у дітей основної групи позитивна динаміка показників традиційної гемограми з розрахунком інтегральних коефіцієнтів реактивнозахисного потенціалу організму дітей — клітиннофагоцитарного захисту і специфічного імунного лімфоцитарномоноцитарного потенціалу — вселяє надію на можливість зменшення ризику наступної гострої інфекції або її рецидиву, запобігання хронізації процесу й виникненню місцевих та системних ускладнень.
Приємний смак Біоарону С, його позитивний і швидкий вплив на покращення апетиту були факторами прихильності пацієнтів та їх батьків до лікування. Ознак непереносимості препарату не було, але в однієї дитини з атопічним дерматитом в анамнезі на 3тю добу реабілітації з’явилися явища легкої алергічної шкірної реакції, що стало причиною відміни препарату і призначень антигістамінних засобів.
Відмінностей у динаміці всіх вивчених показників за гендерною ознакою, за характером перенесених гострих захворювань дихальних шляхів у дітей віком 3–10 років нами не відмічено.
Висновки
1. Включення безрецептурного фітопрепарату Біоарон С у комплекс реабілітації дітей після перенесених гострих захворювань респіраторного тракту сприяє покращенню апетиту за показниками частоти прийому їжі, її об’єму, тривалості і перебірливості вже на 14й день реабілітації з наростанням позитивних тенденцій і на 28й день реабілітації.
2. Позитивна динаміка середнього рівня гемоглобіну, оптимізація його рівня в дітей із легким ступенем залізодефіцитної анемії та із субоптимальним рівнем гемоглобіну спостерігалася через 28 днів у всіх пацієнтів, які в комплексі реабілітації отримували Біоарон С.
3. Покращення компенсаторного реактивнозахисного потенціалу за показниками КФЗ у периферичній крові в дітей основної групи порівняно з контрольною групою може свідчити і про підвищення кооперуючої функції фагоцитів периферичної крові і з посиленням захисного бар’єру на шляху наступної інфекції або рецидиву інфекції, і про зменшення напруженості адаптивного імунітету. Це може вселяти обережний оптимізм щодо запобігання хронізації процесу із виникненням місцевих і системних ускладнень.
Список літератури знаходиться в редакції

