Газета «Новости медицины и фармации» Неврология (438) 2013 (тематический номер)
Вернуться к номеру
Сучасні принципи діагностики та лікування хворих із гострим ішемічним інсультом та ТІА
Рубрики: Медицина неотложных состояний, Неврология
Разделы: Официальная информация
Версия для печати
РЕКОМЕНДОВАНО
Наказ Міністерства охорони здоров’я
03.08.2012 № 602
Адаптована клінічна настанова, заснована на доказах
Робоча група:
Яворська В.О. - Професор кафедри неврології та нейрохірургії Харківської медичної академії післядипломної освіти, к.м.н.
Бондарь О.Б. - Асистент кафедри неврології та нейрохірургії Харківської медичної академії післядипломної освіти, к.м.н.
Гребенюк А.В. - Доцент кафедри неврології та нейрохірургії Харківської медичної академії післядипломної освіти, к.м.н.
Гуляєв Д.В - Доцент Школи охорони здоров’я Національного університету «Києво-Могилянська академія», к.м.н.
Гуляєва М.В. - Виконавчий директор ВГО «Українська асоціація боротьби з інсультом»
Євстигнеєва О.В. - Представник пацієнтів
Костюківська Г.Є. - Доцент кафедри УЗД та кафедри променевої діагностики Харківської медичної академії післядипломної освіти, к.м.н., лікар-рентгенолог першої категорії
Мацевич О.Ю. - Старша медична сестра інсультного центру МЦ «Універсальна клініка «Оберіг»
Першина Ю.В. - Асистент кафедри неврології та нейрохірургії Харківської медичної академії післядипломної освіти
Пилипенко М.М. - Доцент кафедри анестезіології та інтенсивної терапії Національної медичної академії післядипломної освіти імені П.Л. Шупика, к.м.н.
Піонтківська Н.І. - Фізичний реабілітолог інсультного центру МЦ «Універсальна клініка «Оберіг»
Рогова О.Г. - Доцент кафедри менеджменту та економіки в сімейній медицині Харківської медичної академії післядипломної освіти, к.ю.н.
Самосюк Н.І. - Асистент кафедри неврології № 1 Національної медичної академії післядипломної освіти імені П.Л. Шупика, к.м.н.
Тріщинська М.А. - Доцент кафедри неврології № 1 Національної медичної академії післядипломної освіти імені П.Л. Шупика, к.м.н.
Фломін Ю.В. - Завідуючий інсультним центром клініки «Оберіг», к.м.н., доцент кафедри менеджменту та економіки в сімейній медицині Харківської медичної академії післядипломної освіти
Методичне керівництво та координація діяльності мультидисциплінарної робочої групи:
Степаненко А.В. - Радник Міністра охорони здоров’я, консультант ДП «Державний експертний центр МОЗ України», д.м.н., професор
Методичний супровід та інформаційне забезпечення:
Ліщишина О.М. - Директор Департаменту стандартизації медичних послуг ДП «Державний експертний центр МОЗ України»
Горох Є.Л. - Начальник Відділу якості медичної допомоги та інформаційних технологій ДП «Державний експертний центр МОЗ України»
Кравець О.М. - Начальник Відділу доказової медицини ДП «Державний експертний центр МОЗ України»
Шилкіна О.О. - Начальник Відділу методичного забезпечення нових технологій в охороні здоров’я ДП «Державний експертний центр МОЗ України»
Державний експертний центр МОЗ України є членом Guidelines International Network (Міжнародна мережа настанов) Міжнародного проекту ADAPTE (Франція)
Рецензенти:
Зозуля І.С. - Проректор з наукової роботи, завідувач кафедри медицини невідкладних станів Національної медичної академії післядипломної освіти імені П.Л. Шупика, д.м.н., професор
Московко С.П. - Завідувач кафедри неврології та нейрохірургії Вінницького національного медичного університету, д.м.н., доцент
Пашковський В.М. - Завідувач кафедри нервових хвороб, психіатрії та медичної психології Буковинської державної медичної академії, д.м.н., професор
Перегляд — 2015
ЗМІСТ
Перелік скорочень
Вступ
1. Поінформованість населення та освітні програми для населення та медичних працівників
2. Надання допомоги хворим з інсультом на догоспітальному етапі
3. Транзиторна ішемічна атака
4. Невідкладні діагностичні та лікувальні заходи після доставки в лікарню
5. Верифікація діагнозу (візуалізація мозку, серця та судин)
6. Класифікація та оцінювання тяжкості ішемічних інсультів
7. Базисне (недиференційоване) лікування гострого інсульту та корекція порушень гомеостазу
8. Специфічне лікування в ранньому періоді ішемічного інсульту
8.1. Антитромботичні засоби
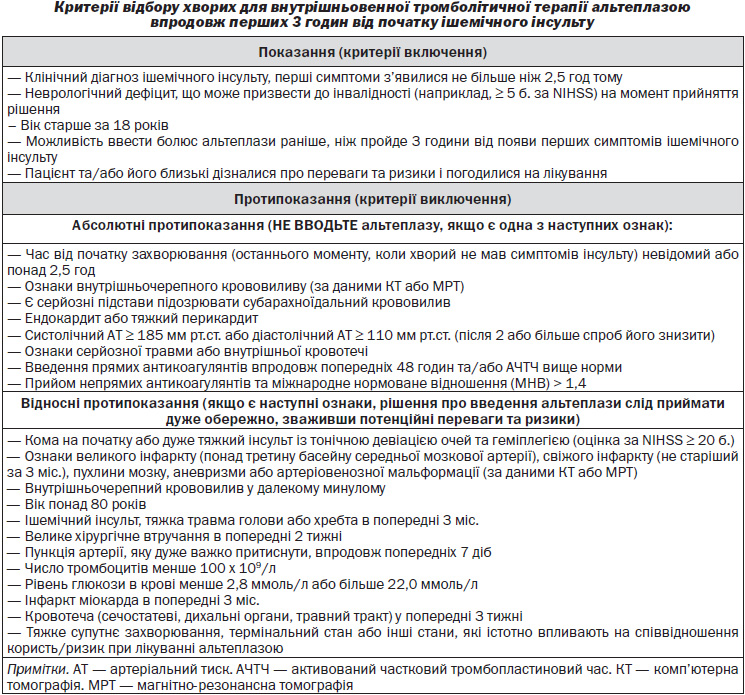
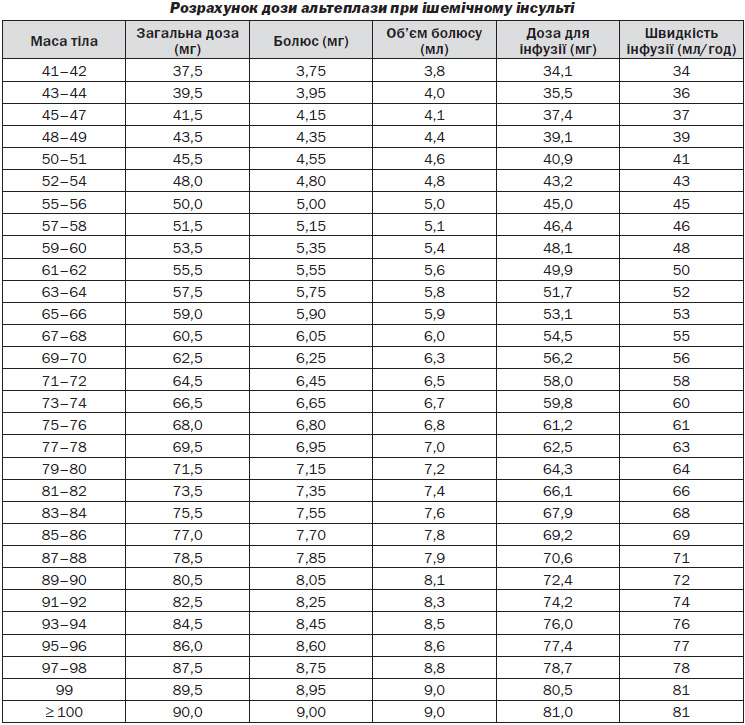
8.2. Тромболітична терапія
8.3 Нейропротектори
8.4. Хірургічні втручання при ішемічному інсульті
9. Діагностика та лікування неврологічних ускладнень
9.1. Лікування набряку мозку та внутрішньочерепної гіпертензії при інсультах
9.2. Епілептичні напади
9.3. Післяінсультний біль
10. Профілактика, діагностика та лікування соматичних ускладнень
10.1. Легеневі ускладнення, нозокоміальна пневмонія
10.2. Запобігання тромбоемболічним ускладненням у хворих, що перенесли інсульт
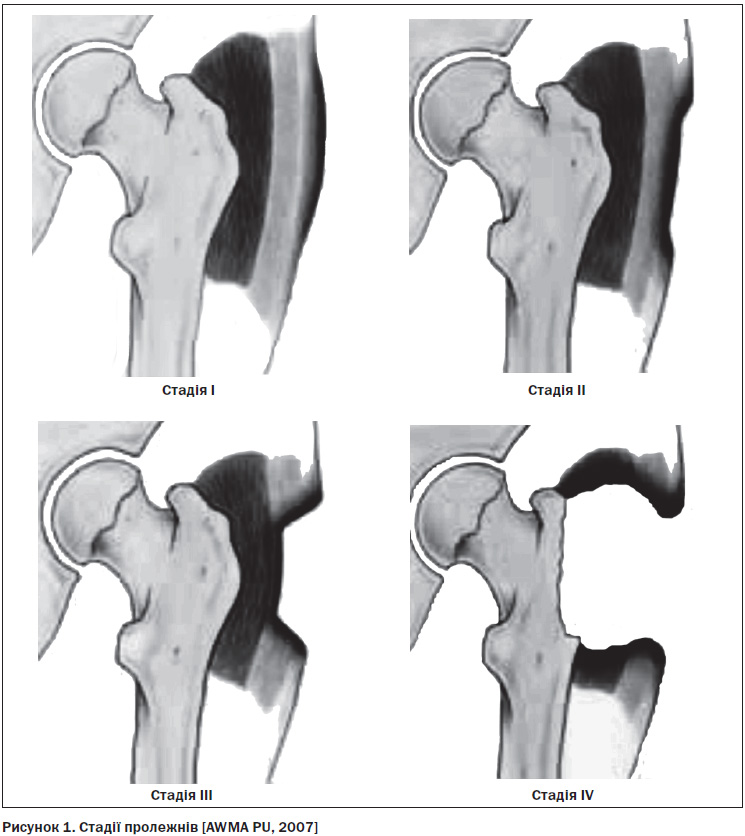
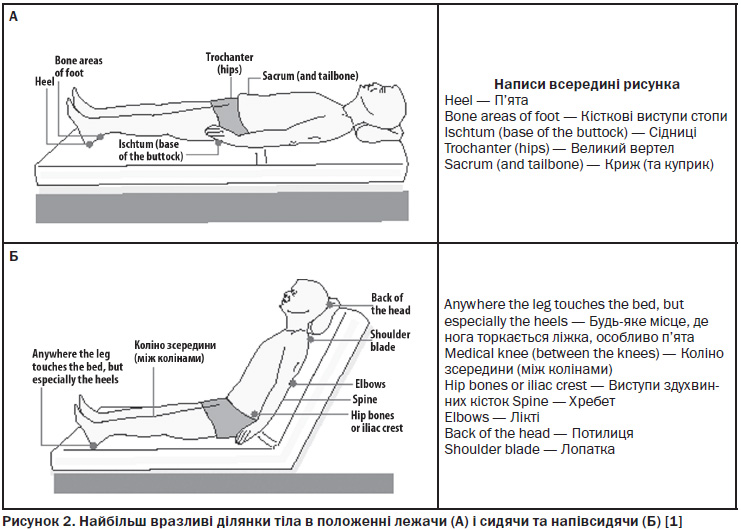
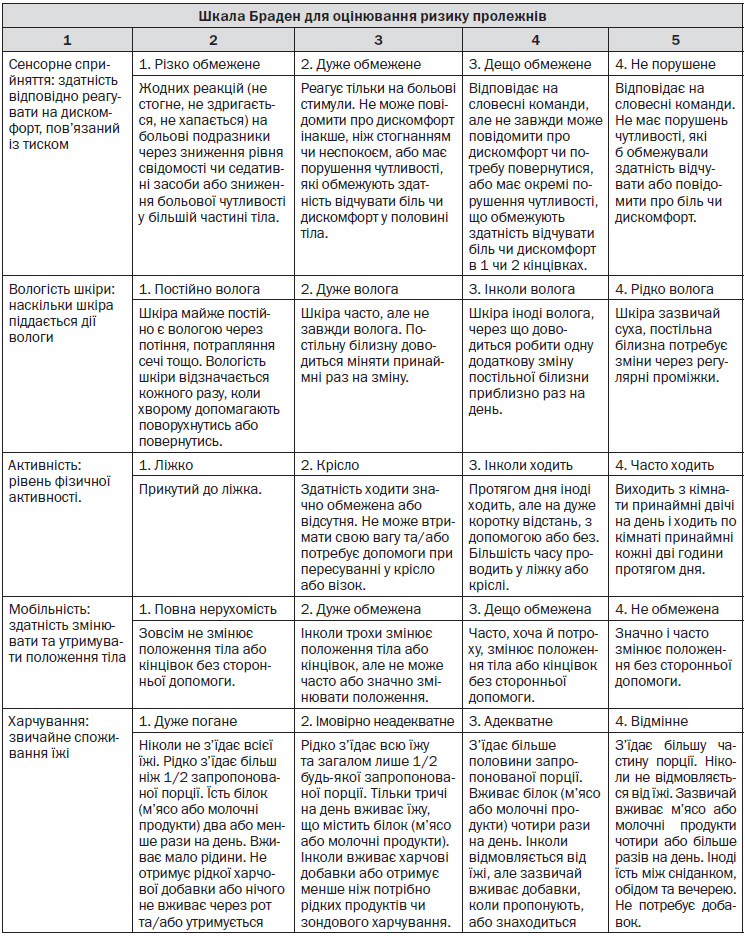
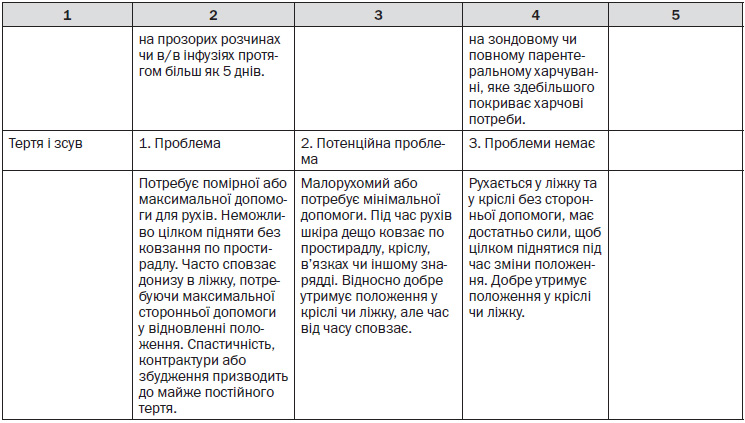
10.3. Пролежні: класифікація, оцінювання ризику, профілактика та лікування
10.4. Порушення дефекації та сечовипускання
11. Мобілізація та рання реабілітація
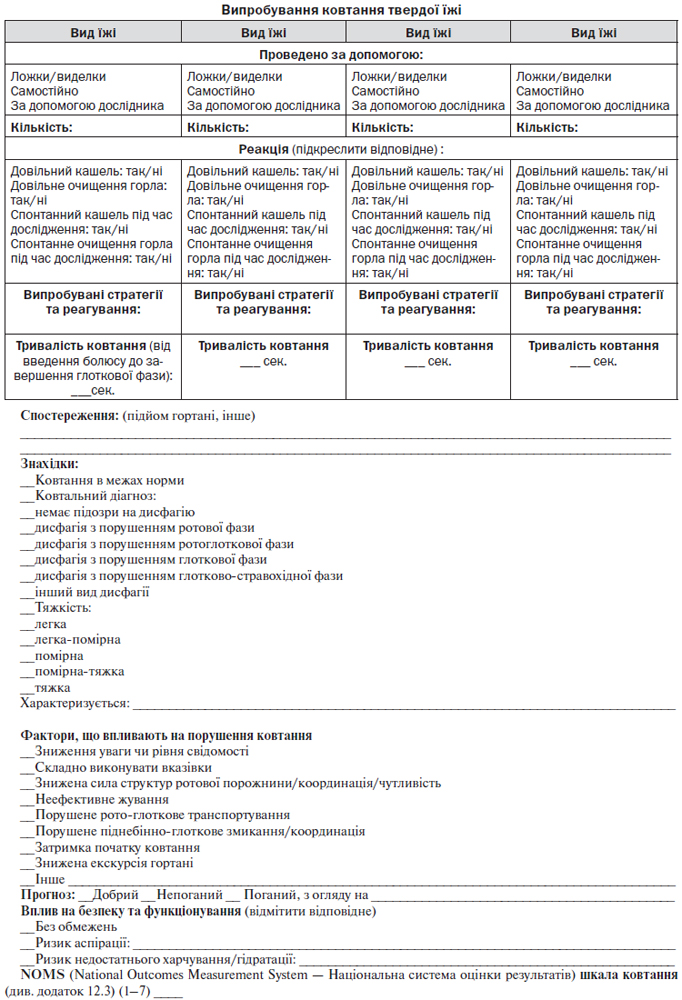
12. Порушення ковтання та харчування при інсульті
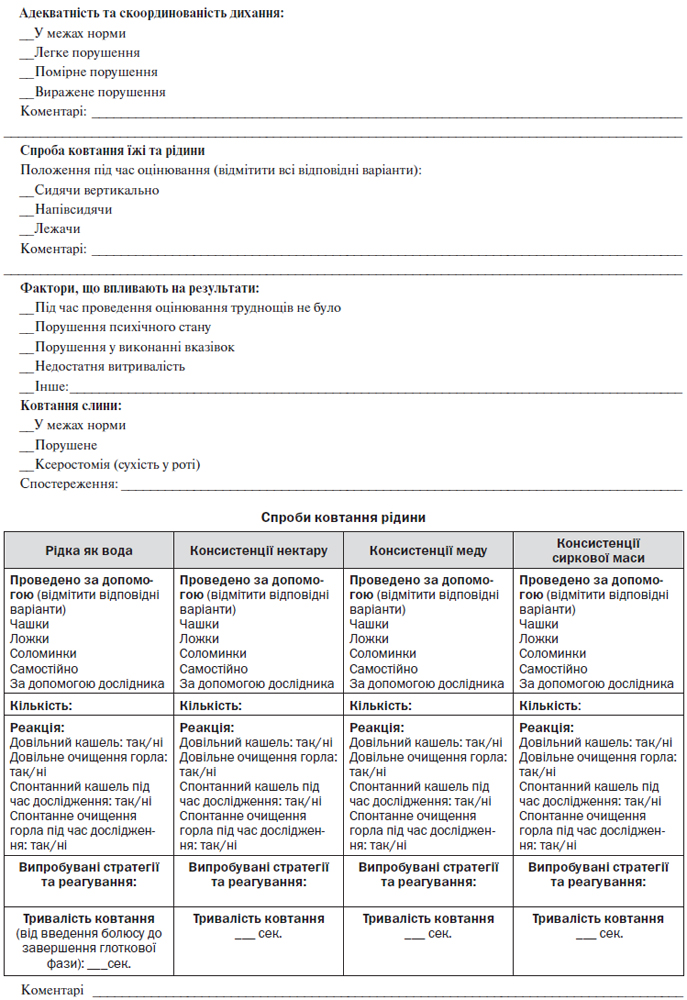
12.1. Дисфагія
12.2. Нутритивна підтримка
13. Когнітивні порушення після інсульту
14. Емоційні розлади після інсультів
15. Рання вторинна профілактика
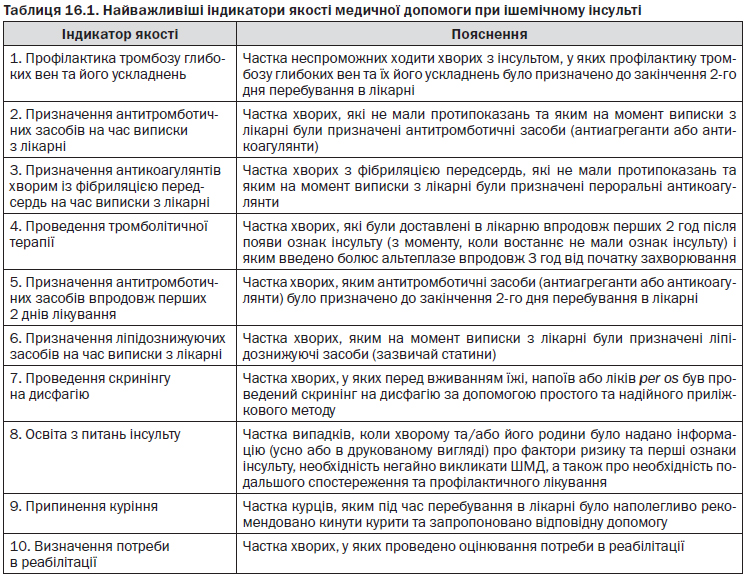
16. Управління якістю та індикатори якості лікування
17. Юридичні аспекти надання допомоги при гострому інсульті
Вступ
Необхідність створення даної клінічної настанови
Цереброваскулярні захворювання (ЦВЗ) належать до найбільш розповсюджених неінфекційних хвороб і найчастіших захворювань нервової системи, а їх найнебезпечніша форма — гостре порушення мозкового кровообігу (ГПМК) — зустрічається частіше, ніж гострий інфаркт міокарда. У світі щороку реєструється понад 15 млн інсультів, і майже половина інсультів і третина смертей від інсульту спостерігається у віці молодше 70–75 років. З інсультами пов’язані 10 % всіх смертей (майже 6 млн на рік), що робить інсульт причиною смерті № 2 на планеті [3, 4]. Проте в більшості випадків насідком ГПМК є не смерть, а обмеження життєдіяльності, тому інсульти є провідною причиною інвалідності серед людей старшої вікової групи. У середньому 60 % хворих, які перенесли інсульт, мають стійкі неврологічні порушення, що перешкоджають їх повсякденній життєдіяльності. Так, інсульти часто призводять до порушень рухів та здатності до пересування, високого ризику падінь та переломів, зорових та мовних розладів, дисфункції тазових органів, порушень ковтання та аліментарної недостатності, емоційних (депресія) та когнітивних (до ступеня деменції) розладів.
Коментар робочої групи
Україна посідає одне з перших місць у Європі за показниками захворюваності на ЦВЗ та смертності від інсульту, що створює велике навантаження на систему охорони здоров’я, соціального забезпечення, економіку та все суспільство. В Україні, згідно з офіційною статистикою, ЦВЗ є причиною смертності № 2 (100–110 тис. смертей, близько 14 % від всіх померлих), щороку стається 100–110 тис. інсультів (понад третина з них — у людей працездатного віку), 30–40 % хворих на інсульт помирають впродовж перших 30 днів і до 50 % — упродовж 1 року від початку захворювання, 20–40 % хворих, що вижили, стають залежними від сторонньої допомоги (12,5 % первинної інвалідності), і лише близько 10 % повертаються до повноцінного життя. [1]
Такі показники різко контрастують із завданнями, які зазначені у Гельсинборзькій декларації 2006 р. щодо стратегії боротьби з інсультом в Європі, затвердженій 2-ю Об’єднаною конференцією Європейського регіонального бюро ВООЗ та Європейської інсультної організації: до 2015 р. довести 30-денну летальність при інсульті до рівня < 15 % і незалежність у побуті через 90 днів серед тих, хто вижив, до рівня > 70 %. Таким чином, інсульт є однією з найгостріших медико-соціальних проблем, для вирішення якої необхідні об’єднання зусиль, ретельне вивчення світового досвіду та рішучі послідовні дії [2].
В останні роки змінилися погляди на стратегію та тактику ведення хворих з гострими порушеннями мозкового кровообігу. Це обумовлено появою нових даних про патофізіологію гострого періоду мозкового інсульту. Наслідком розвитку наукових досліджень у галузі інсультології стала можливість реалізації концепції «час — мозок», яка сформувала нове ставлення до інсульту з визнанням його невідкладним станом, лікування якого вимагає екстреної госпіталізації, а надання медичної допомоги здійснюється в перші хвилини, години з моменту його розвитку в спеціалізованих інсультних відділеннях, у штаті яких повинні працювати підготовлені спеціалісти мультидисциплінарної команди: лікарі, середній медичний персонал, фахівці з питань реабілітації, логопеди, психологи, соціальні працівники.
Переконливі результати нещодавно виконаних високо-якісних досліджень дозволили сформулювати в світовій інсультології головні стратегічні напрямки, що будуть впливати на захворюваність, смертність та результати лікування й реабілітації в пацієнтів після перенесеного інсульту.
Публікації стандартів та клінічних рекомендацій останніх років, які мають високі рівні доказовості, стали передумовою написання представлених клінічних настанов (КН) «Сучасні принципи діагностики та лікування хворих з гострим ішемічним інсультом та ТІА».
Відбір клінічних настанов для адаптації
Під час адаптації цієї клінічної настанови у якості прототипів були використані клінічні настанови провідних світових національних та міжнародних організацій (American Stroke Association, Canadian Stroke Network & Heart and Stroke Foundation of Canada, European Federation of Neurological Societies, European Stroke Organization, Intercollegiate Stroke Working Party, National Stroke Foundation of Australia, Scottish Intercollegiate Guidelines Network, Stroke Foundation of New Zealand та ін.). Відібрані прототипи КН оцінювались робочою групою розробників за допомогою інструменту AGREE, який рекомендований методикою, що затверджена наказом МОЗ № 102/18 від 19.02.2009 року «Про затвердження уніфікованої методики з розробки клінічних настанов, стандартів, уніфікованих клінічних протоколів медичної допомоги на засадах доказової медицини». Після оцінки за допомогою інструменту AGREE для адаптації було відібрані 14 клінічних настанов, які отримали найвищу оцінку експертів.
Компетенції даної клінічної настанови
Коментар робочої групи
Загальні цілі
1. Головною метою цієї настанови є надання допомоги організаторам охорони здоров’я, лікарям сімейної медицини, лікарям неврологічних відділень, інсультних блоків, спеціалістам із питань реабілітації для оптимізації надання медичної допомоги пацієнтам з гострим ішемічним інсультом та ТІА. Акцент робиться на організації надання медичної допомоги, діагностиці та сучасних методах базисної та специфічної терапії, ранній вторинній профілактиці та ранній реабілітації, профілактиці ускладнень.
2. Також розробники КН вважають, що використання доказової бази, яка лежить в основі даної настанови, зменшить необґрунтовану варіабельність клінічної практики при наданні медичної допомоги пацієнтам з інсультом.
3. Збільшить доступ широкого загалу медичних працівників та інших осіб, які залучені в процес надання медичної допомоги пацієнтам з інсультом, до сучасної наукової інформації високої якості доказовості.
4. Прискорить втілення в практичну роботу наукових досягнень у питаннях впровадження сучасної інсультної допомоги в Україні.
5. Підвищить якість надання медичної допомоги пацієнтам з інсультом та дозволить раціонально використовувати ресурси системи охорони здоров’я.
1. Поінформованість населення та освітні програми для населення та медичних працівників
Проміжок часу від появи перших симптомів до дзвінка в службу екстреної медичної допомоги є одним із значущих факторів затримок на догоспітальному етапі. Основними причинами затримок звернення за медичною допомогою є не тільки не-обізнаність з симптомами інсульту і нерозуміння їх серйозності, але й заперечення хвороби та надія, що симптоми минуть самі.
Це означає, що навчання населення вмінню розпізнати симптоми інсульту і зміна ставлення людей до гострого інсульту можуть зменшити час від початку виникнення симптомів до контакту зі швидкою медичною допомогою.
Самі пацієнти рідко виявляють настороженість: у багатьох випадках звертаються за медичною допомогою члени їх сім’ї. Інформування та навчання має бути спрямоване як на осіб із високим ризиком розвитку інсульту, так і на людей, які їх оточують.
Більшість досліджень продемонструвало, що тільки 33–50 % пацієнтів розпізнають симптоми інсульту. Є величезні відмінності між теоретичними знан-нями про інсульт і реакцією при його розвитку. У деяких дослідженнях показано, що пацієнти з кращими знаннями про симптоми інсульту не завжди надходять у стаціонар у більш ранній термін.
Викладання студентам-медикам елементарних знань про інсульт під час першого року навчання в медичному коледжі продемонструвало більш високий рівень збереження цих знань. Обсяг післядипломної освіти є універсальним, але навчальні програми для фахівців з інсульту все ще неоднакові, навіть у Європі. Для подолання такої гетерогенності та збільшення кількості фахівців, які надають допомогу при інсульті, деякі країни (наприклад, Франція, Великобританія) розробили і впровадили національні навчальні плани. Ряд інших країн здійснюють спеціалізацію всередині неврологічних навчальних програм. Для координації навчання були створені програми European Master in Stroke Medicine (http://www.donau-uni.ac.at/en/studium/strokemedicine/index.php) і Stroke Summer Schools (http://www.eso-stroke.org). У Шотландії створений безкоштовний інтернет-ресурс — www.SrtokeTraining.org, який складається з навчальних модулів і тестів, за умови успішного складання іспиту видається сертифікат. Усім, хто працює в інсультному блоці, рекомендовано пройти відповідні тести. Сертифікат можуть отримати медичні працівники з інших країн.
Коментар робочої групи
В Україні необхідно, щоб всі лікарі, які беруть участь у менеджменті пацієнтів з інсультом (неврологи, терапевти, нейрохірурги), проходили курси з тематичного удосконалення на кафедрах або факультетах післядипломної освіти вищих навчальних закладів МОЗ України, на яких обговорюються сучасні підходи до ведення гострого періоду інсульту, ранньої післяінсультної реабілітації, первинної та вторинної профілактики. У даний час у процес навчання активно впроваджуються сучасні технології (у тому числі й для дистанційної освіти) — електронні, телекомунікаційні.
Беручи до уваги концепцію безперервної медичної освіти для лікарів, необхідно збільшити доступність сучасних, заснованих на доказовій медицині обґрунтованих клінічних рекомендацій, електронних бібліотек, вказаних вище інтернет-ресурсів і систем підтримки прийняття клінічних рішень. Це вимагає певних матеріально-технічних умов:
— у галузі вищої освіти: сучасне лабораторне обладнання та бібліотеки, центри відпрацювання практичних навичок, технічні засоби для дистанційного навчання;
— в медичних організаціях (ЛПЗ): доступ до сучасних високоякісних джерел інформації, комп’ютеризація робочих місць, доступ до мережі Інтернет, електрон-них бібліотек, встановлення на комп’ютерах систем прийняття клінічних рішень, використання медичних симуляторів та тренажерів.
Для збільшення точності постановки діагнозу інсульту і швидкості госпіталізації у стаціонар навчання має бути також спрямоване на весь персонал відділень невідкладної допомоги. У нашій країні можуть бути залучені бригади фельдшерів ШМД, члени яких регулярно відвідують короткострокове тематичне навчання.
Навчання пацієнтів, їх родин, та осіб, які доглядають за ними, є важливою частиною допомоги пацієнтам з інсультом на всіх етапах. Освітні програми включають передачу інформації та навичок самообслуговування пацієнтам і догляду за пацієнтами.
В Україні фахівцями Української асоціації боротьби з інсультом розроблена та впроваджується освітня програма «Життя після інсульту», спрямована на освіту пацієнтів, які пережили інсульт, та їх родин, а також освітня програма первинної профілактики «Стоп інсульт», спрямована на стратифікацію факторів серцево-судинного ризику серед населення та обізнаності фахівців в питаннях інсульту та його наслідків. Інформаційні ресурси для населення з питань інсульту — www.insult.net.ua, www.реабилитация.kiev.ua.
Рекомендації
Для збільшення інформованості населення про інсульт рекомендовані освітні програми (рівень обґрунтованості B) [ESO, 2008; AHA/ASA, 2007].
— В освітніх програмах для населення повинен бути акцент на основних ознаках інсульту і на тому, що інсульт — це стан, що потребує невідкладної допомоги, і при його розвитку необхідно негайно дзвонити в службу ШД (рівень обґрунтованості B) [ESO, 2008; СSS, 2008; AHA/ASA, 2007].
— Освітні програми для населення мають включати інформацію про те, що інсульт може розвинутися в будь-якому віці (дитячий, дорослий) (рівень обґрунтованості С) [СSS, 2008].
— Для збільшення інформованості про інсульт серед професіоналів (лікарів невідкладної допомоги) рекомендовані освітні програми (рівень обґрунтованості B) [ESO, 2008; СSS, 2008].
— Зміст освітніх програм має бути специфічним для етапу інсультної допомоги і відповідати підготовленості та завданням пацієнта, членів сім’ї та осіб, які доглядають хворих (рівень обґрунтованості В) [СSS, 2008].
— Освітні програми повинні включати всі аспекти медичної допомоги та відновлення при інсульті, включаючи природу інсульту і його прояви, синдроми та симптоми; порушення та їх вплив на якість життя, їх менеджмент, у тому числі тренінги для осіб, які доглядають, планування виписки; громадські ресурси, програми з обслуговування та підтримки, зовнішню адаптацію (рівень обґрунтованості А) [NSF, 2010; СSS, 2008; RCP, 2008; 1].
— Освіта повинна бути інтерактивною, своєчасною, сучасною, доступною різними мовами і в різних форматах (письмовий, усний, спеціальний для пацієнтів з різними формами афазії, групові консультації), специфічною для задач пацієнта, родичів і осіб, які доглядають хворого при різних порушеннях. Повинна бути забезпечена загальнодоступність освіти для хворих, що перенесли інсульт (рівень обґрунтованості В) [NSF, 2010; СSS, 2008; RCP, 2008; 1].
— Лікарі, що займаються веденням інсультних хворих, і члени мультидисциплінарної бригади повинні розробляти способи освіти пацієнтів, членів їх сім’ї та осіб, які доглядають за ними. При цьому певні члени бригади відповідають за надання і документацію освіти (рівень обґрунтованості С) [AHA/ASA, 2007].
2. Надання допомоги хворим з інсультом на догоспітальному етапі
Коментар робочої групи
Концепція «час = мозок» означає, що допомога при інсульті повинна бути екстреною. Від якості та своєчасності надання цієї допомоги залежить здоров’я, а в багатьох випадках — і життя людини. Надання адекватної, ефективної та кваліфікованої допомоги можливе лише за умов своєчасної діагностики та лікування цієї патології. Проте навіть тривала праця в якості лікаря медицини невідкладних станів не дозволяє накопичити достатню кількість необхідних для цього практичних навичок, враховуючи стрімкий перебіг світового й вітчизняного досвіду надання медичної допомоги. Крім того, для досягнення кращих результатів інсульту необхідна продуктивна співпраця служби швидкої медичної допомоги (СШМД), неврологічної і нейрохірургічної служб, організація ургентного поетапного інструментального обстеження і лікування за загальноприйнятими стандартами, яких в Україні, на жаль, ще немає. СШМД повинні мати відповідні протоколи для швидкого оцінювання стану хворих, лікування та транспортування. Основні напрямки догоспітальної допомоги полягають у швидкому розпізнаванні інсульту; виключенні супутніх захворювань, що можуть імітувати інсульт; стабілізації стану хворого та його швидкому транспортуванні до відповідної лікувальної установи з попереднім повідомленням її про прибуття. Такі стратегії, як телемедицина та повітряний медичний транспорт, можуть збільшити доступність тромболітичної терапії у віддалених районах та сільській місцевості. Необхідне створення клінічних настанов та транспортних протоколів для забезпечення оптимального лікування на всіх етапах медичної допомоги. До теперішнього часу в нашій країні вони відсутні.
Догоспітальний етап включає надання медичної допомоги хворим із гострими порушеннями мозкового кровообігу з моменту звернення хворого (або його представників) за медичною допомогою до моменту госпіталізації. Проміжок часу від появи перших симптомів інсульту до дзвінка в СШМД є одним із значущих чинників, що впливають на перебіг інсульту при подальшому лікуванні, тому зменшити втрату часу на цьому етапі вкрай важливо [6, 15, 20, 34]. Втрата часу на догоспітальному етапі виникає при розпізнаванні перших ознак інсульту, транспортуванні хворого до спеціалізованого медичного закладу та є серйозною перешкодою для надання спеціалізованого лікування (тромболізису) у пацієнтів з інсультом [7]. Тому відповідна підготовка персоналу швидкої медичної допомоги є одним із найважливіших компонентів скоординованої інсультної допомоги. Для удосконалення навичок персоналу екстреної медичної допомоги в діагностиці інсульту, методах надання невідкладної допомоги такому контингенту хворих необхідно проводити освітні заходи для персоналу СШМД [17, 31].
У момент виникнення перших ознак інсульту пацієнт або його родичі повинні звернутися за медичною допомогу до СШМД. Швидке звернення до СШМД зменшує проміжок часу від появи симптомів хвороби до госпіталізації в лікарню [25, 26].
Оцінка стану пацієнта з інсультом починається диспетчером СШМД, який спілкується з пацієнтом (або його представником) по телефону. При підозрі на гострий інсульт диспетчер СШМД забезпечує негайне спрямування бригади екстреної медичної допомоги (БЕМД) до хворого з підозрою на інсульт [23].
Медична допомога на догоспітальному етапі повинна бути надана хворим з інсультом у перші хвилини, з початку розвитку перших ознак захворювання. БЕМД виконує чіткий протокол надання екстреної медичної допомоги хворим з підозрою на інсульт та забезпечує прохідність дихальних шляхів, стабілізацію кровообігу, виявлення ознак і симптомів інсульту, встановлює або підтверджує час, коли пацієнта бачили у доброму самопочутті в останній раз, запобігає розвитку гіпоксемії, контролює рівень глюкози у крові та температуру тіла, а потім негайно транспортує пацієнта в найближчу, найбільш відповідну для пацієнта, установу [1]. Попереднє повідомлення приймаючого ВНД про майбутнє прибуття потенційного інсультного хворого разом з інформацією про супутні захворювання і приблизний час появи симптомів хвороби прискорить подальшу оцінку стану хворого [1].
Одним із важливих моментів при зборі анамнезу хвороби пацієнта є інформація про час появи перших симптомів хвороби. Найближчих родичів, якщо такі є, необхідно доправити до лікарні разом із пацієнтом, вони можуть бути корисними для отримання необхідної інформації чи згоди на лікування. Номери телефонів свідків події (у разі, якщо інсульт стався не вдома) або родичів, включаючи стільникові, можуть допомогти лікарям ВНД уточнити анамнез або отримати згоду на лікування. Необхідно обов’язково з’ясувати, які ліки приймає пацієнт, при цьому особливу увагу необхідно приділяти виявленню антикоагулянтів, антитромбоцитарних і антигіпертензивних препаратів.
Для швидкої діагностики інсульту необхідно використовувати стандартизовані діагностичні інструменти (шкали) [10]. Захворювання, що імітують інсульт, такі як мігрень, епілептичні напади, ново-утворення, метаболічні порушення, уросепсис, можуть створювати істотні проблеми [11, 13]. Використання стандартизованих діагностичних шкал дозволяє без втрати часу поставити діагноз, що підвищує вірогідність виявлення пацієнтів, які будуть госпіталізовані впродовж «вікна терапевтичних можливостей» і яким може бути проведене спеціалізоване тромболітичне лікування.
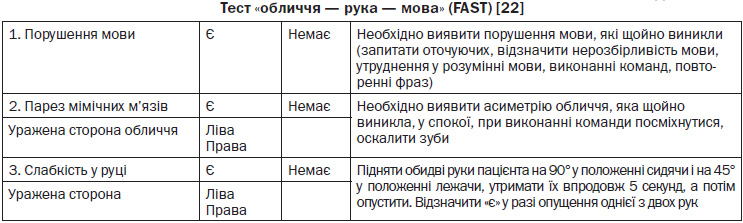
Для діагностики інсульту на догоспітальному періоді використовують прості методики, такі як тест FAST «обличчя — рука — мова» [22] (додаток 2.4).
Додаток 2.4
Пацієнти із симптомами інсульту повинні бути без зволікання доставлені в найближчий медичний центр із відділенням гострих порушень мозкового кровообігу (інсульту), у якому виконується екстрена терапія. Пацієнти з давністю симптомів інсульту в межах трьох годин повинні бути оглянуті й транспортовані в першу чергу. На шляху до стаціонару слід моніторувати основні життєві показники (АТ, ЕКГ) та забезпечити венозний доступ [17].
Алгоритм надання медичної допомоги на догоспітальному етапі сприяє ухваленню рішення й наданню допомоги при гострому інсульті. Доведено, що система надання медичної допомоги при використанні послідовних протоколів із позначенням первинних і вторинних інсультних центрів (ІЦ) з можливістю невідкладного лікування; транспортні протоколи; зв’язок між лікарнями і екстреною медичною допомогою, стандартні протоколи лікування і механізми транспортування пацієнта з віддалених/сільських районів впливають на смертність від інсульту [2, 21, 29].
Протоколи надання медичної допомоги хворим з інсультом на догоспітальному етапі сприяють швидкій госпіталізації в інсультні центри. При використанні догоспітального протоколу пацієнти частіше доставляються в інсультні центри в проміжок «вікна терапевтичних можливостей» (до 4,5 год) — це збільшує вірогідність застосування тромболізису [3, 4, 12, 14, 27–29, 32, 33].
Для полегшення ухвалення рішення про відповідне транспортування, місце призначення й лікування по дорозі у лікарню персонал швидкої допомоги заповнює скринінгову форму при інсульті [2].
Транспортний інсультний протокол (додаток 2.2) допомагає БЕМД у відповідному лікуванні інсультних хворих дорогою до лікарні. Копія інсультної скринінгової форми БЕМД вноситься в медичну картку ВНД. Запис персоналу БЕМД про ознаки, симптоми і час початку інсульту мають важливе значення у лікуванні хворих в інсультних центрах. Іноді пацієнти (без порушення свідомості) можуть прибувати до лікарні на приватному транспортному засобі [2].
Телемедицина з використанням двостороннього відеоконференційного зв’язку є відповідним, обґрунтованим і реальним способом наблизити тромболізис до пацієнтів у віддалених або сільських стаціонарах, де за часом повітряний або наземний транспорт неприйнятні [9, 16, 18]. Було доведено, що точність і правильність рішень при оцінюванні показань до ТЛТ, прийнятих неврологами за допомогою телемедицини, вище порівняно з телефонним зв’язком (98 і 82 % відповідно). Не було відмінностей у частоті використання ТЛТ, 90-денних функціональних наслідків, смертності і внутрішньомозкових крововиливів після застосування ТЛТ [3, 19]. Крім того, витрати на лікування при використанні телемедицини в перспективі 90-денного терміну і довічно є меншими, ніж при застосуванні звичайного лікування. Ці витрати можна рахувати авансом, оскільки додаткові витрати на підвищення якості життя після інсульту в багато разів перевищують витрати на використання цього методу [3, 4, 8, 12, 14, 24, 27, 28, 32, 33].
Рекомендації
— Пацієнти з давністю симптомів інсульту в межах 4,5–6 годин повинні без зволікання транспортуватися до найближчих установ, які надають невідкладну інсультну допомогу (рівень обґрунтованості C) [СSS, 2008].
— Настійно рекомендується безпосередній контакт пацієнтів або інших представників громадськості із СШМД за телефоном 103, оскільки це скорочує час до призначення лікування при гострому інсульті (рівень обґрунтованості B) [СSS, 2008; AHA/ASA, 2007].
— Диспетчери СШМД повинні визначити пріоритетність у черговості пацієнтів відповідно до ознак і симптомів гострого інсульту (рівень обґрунтованості С) [СSS, 2008].
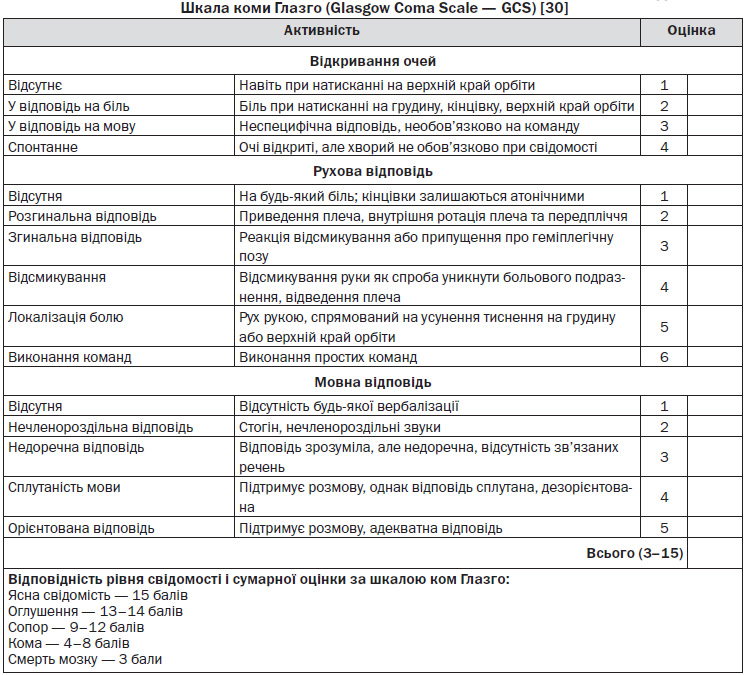
— Працівники СШМД повинні володіти навиками використання догоспітальних скринінгових інструментів і включати їх у протоколи догоспітальної оцінки пацієнтів із підозрою на інсульт (рівень обґрунтованості B) [NSF, 2010]. При відсутності порушення свідомості користуватися шкалою (FAST) «обличчя — рука — мова», а при порушенні свідомості — шкалою ком Глазго.
— Персоналу СШМД рекомендується приступити до лікування інсульту за протоколом (додаток 2.1) з перших хвилин (рівень обґрунтованості B) [ AHA/ASA, 2007].
— Рекомендована негайна госпіталізація пацієнта до блоку інтенсивної терапії, клінічне обстеження, лабораторні тести та нейровізуалізація, доступність використання необхідних медикаментів у стаціонарі, що приймає хворих (рівень обґрунтованості В) [ESO, 2008; NSF, 2010].
— Персонал СШМД повинен завчасно проінформувати стаціонар, що приймає (по телефону, радіозв’язку), щодо хворого з підозрою на гострий інсульт із метою підготовки до його прибуття (рівень обґрунтованості C) [СSS, 2008].
— Для полегшення транспортування пацієнтів у найближчу або найбільш відповідну установу (з інсультним блоком), що надає допомогу при гострому інсульті, необхідно дотримуватись прямих транспортних протоколів (табл. 1) (рівень обґрунтованості C) [СSS, 2008; NSF, 2010].
— У віддалених районах та сільській місцевості рекомендується використання вертольотів для транспортування та можливостей телемедицини з метою збільшення доступності лікування в стаціонарі (рівень обґрунтованості B) [ESO, 2008].
Додатки
Додаток 2.1
Додаток 2.2
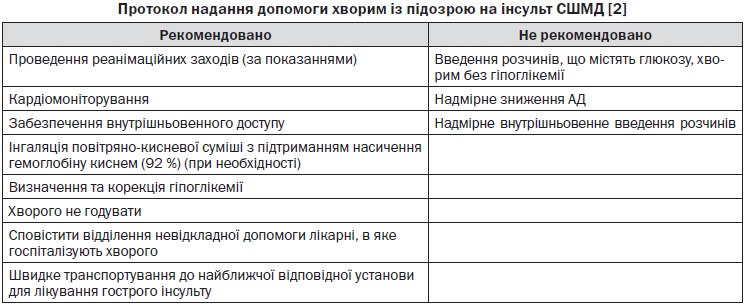
Транспортний протокол з інсульту СШМД [2]
— Стандартні методи відновлення прохідності дихальних шляхів, стабілізації дихання і кровообігу.
— Контролюйте будь-які втручання, які можуть надмірно знизити артеріальний тиск. Гіпотензія призводить до зниження мозкового кровотоку і додаткового ушкодження ураженої ділянки мозку.
— Почніть внутрішньовенне введення фізіологічного розчину натрію хлориду через катетер 18-го або 20-го калібру зі швидкістю 100 мл/годину. Не використовуйте розчини, що містять глюкозу. Розчин, що містить глюкозу, сприяє збільшенню загибелі нейронів. Якщо час дозволяє, вставте другий внутрішньовенний катетер 18 калібру.
— Якщо немає протипоказань, оптимальне положення для голови хворого — під кутом 30 градусів.
— Оксигенацію потрібно проводити під контролем рівня насичення гемоглобіну киснем (вище 95 %).
— Обстеження хворого:
а) рівень свідомості з використанням шкали коми Глазго (додаток 2.3);
Додаток 2.3
б) обстеження при будь-яких розладах мови або при труднощах у спілкуванні (незрозуміла мова);
в) обстеження при асиметрії обличчя;
г) обстеження при слабкості в руці. Попросіть пацієнта утримати руки в положенні під кутом 90 градусів з двох сторін проти сили тяжіння. Пацієнт повинен тримати свої руки попереду тіла під кутом 90 градусів 10 секунд. Відзначайте будь-яку слабкість в руці або її опускання;
д) обстеження при слабкості в нозі. Попросіть пацієнта утримати ноги в положенні під кутом 45 градусів з двох сторін проти сили тяжіння. Пацієнт повинен тримати свої ноги попереду тіла під кутом 45 градусів 10 секунд. Відзначайте будь-яку слабкість в нозі або її опускання.
— Візьміть кров на аналіз, якщо це передбачено локальним протоколом.
— Спостерігайте за хворим для виявлення судом. З’ясуйте наявність судом і їх лікування в анамнезі.
— Контролюйте АТ. Зв’яжіться з ІЦ для отримання поради:
- Якщо САТ більше 220 мм рт.ст. або ДАТ більше 120 мм рт.ст.
- Якщо САТ менше 80 мм рт.ст.
— При наявності порушення серцевого ритму проведіть заходи з його стабілізації.
— Негайно надайте інформацію диспетчеру для призначення госпіталізації до ІЦ центру. Диспетчер повинен повідомити ІЦ, в якому проводиться підготовка до прибуття хворого (готовність КТ/МРТ)
— Негайно сповістіть чергову медсестру і/або чергового лікаря ІЦ щодо прибуття.
3. Транзиторна ішемічна атака
Уявлення про транзиторну ішемічну атаку (ТІА) почали формуватися у 50-х роках минулого сторіччя і пов’язані з ім’ям C.M. Fisher [16]. У літературних джерелах показано, що «правило 24 годин» дозволяє відмежувати ТІА від інсульту, який проявляється стійким неврологічним дефіцитом [14].
Під ТІА розуміють скороминущу (< 24 годин) гіпофункцію ділянок мозку внаслідок ішемії в певному судинному басейні, каротидному або вертебробазилярному (ВББ). Згідно з класичним дослідженням M.L. Dyken і співавт. [4], середня тривалість ТІА в каротидному басейні 14 хвилин (90 % продовжуються < 6 годин), у ВББ — 8 хвилин (90 % продовжуються < 2 годин).
У зв’язку з широким використанням методів нейровізуалізації (МРТ в дифузійно-зважених режимах), які мають високу чутливість в гострому періоді ішемічного інсульту, 24-годинне тимчасове вікно стає все менш адекватним діагностичним критерієм [17, 21]. Тому разом з традиційним визначенням ТІА існує нове [5].
Традиційне визначення ТІА — це раптовий неврологічний або ретинальний дефіцит у басейні певної мозкової артерії, який триває менше 24 годин (10–20'') [26].
Нове визначення ТІА — це короткий епізод неврологічної дисфункції, викликаний фокальною мозковою, спінальною або ретинальною ішемією, що триває менше 1 години, при умові відсутності доказів інфаркту мозку на МРТ [20].
Таке визначення увійшло до Європейських й Американських рекомендацій і є інструментом постановки діагнозу ТІА в деяких країнах.
У кінці 2009 р. був опублікований огляд наукового звіту Американської асоціації інсульту, у якому зазначено, що останні дані вимагають перегляду за 3 ключовими моментами:
1) визначення поняття ТІА (формулювання);
2) виявлення ризику розвитку інсульту (діагностика);
3) ведення пацієнтів з ТІА (лікування).
Був запропонований переглянутий варіант: ТІА — це епізод неврологічної дисфункції, викликаний фокальною церебральною, ретинальною або спінальною ішемією без гострого інфаркту [Науковій звіт AHA/ASA TIA, 2009].
В Україні досі залишається традиційне визначення ТІА. Інструментом стандартизації та об’єктивізації клінічної інформації, динаміки неврологічних змін, прогнозу, оцінки ефективності того або іншого виду лікування або реабілітаційної програми служать шкали, які приведені у вигляді додатків.
Ризик розвитку гострого ішемічного інсульту після ТІА залежить від характеру і тривалості симптомів, причому абсолютний ризик коливається в межах від 1 до 15 % на рік, а відносний — зростає в 2–5 і більше разів [19, 25]. Особливо він високий у перші дні після ТІА. За даними крупного метааналізу (10 126 чоловік), ризик протягом першого тижня варіював від 0 до 12,8 %. Найнижчий ризик (0,9 %) був у пацієнтів при наданні невідкладної допомоги фахівцями підрозділів інсультної служби, а найвищий (11 %) — у тих, хто не звернувся по медичну допомогу [8].
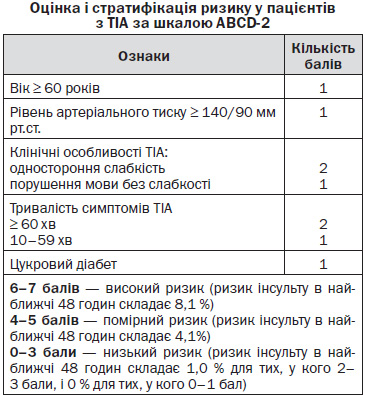
Високий ризик інсульту асоціюється з тривалістю симптомів більше 1 години, стенозом сонних артерій > 50 %, повторними ТІА (більше 3 епізодів впродовж 72 годин) зі зростаючою тривалістю і/або тяжкістю порушень, а також з джерелом емболів у серці (наприклад, наявність фібриляції передсердя), виникненням епізоду на тлі прийому антиагрегантів, схильністю до гіперкоагуляції і високою оцінкою за шкалою ABCD [11, 23].
Оцінка за шкалою ABCD не характеризує вірогідність усього спектра ішемічних подій, але має тісний зв’язок із високою загрозою його виникнення [22]. При використанні даного інструменту ризик інсульту пропорційний кількості балів, яка варіює від 0 до 7. Бали нараховуються за наступними 5 показниками: вік (1 б., якщо > 60 років), артеріальний тиск (1 б., якщо систола ≥ 140 або діастола ≥ 90 мм рт.ст.), клінічні прояви (2 б. при геміпарезі та 1 б. при мовних порушеннях без парезів), наявність цукрового діабету (1 б.) й тривалість симптомів (10–59 хвилин — 1 б., > 60 хвилин — 2 б.) [12]. За даними дослідження OXVASC, ризик гострого ішемічного інсульту впродовж 7 днів після ТІА мав тісний зв’язок з оцінкою за шкалою ABCD. Так, при оцінці до 5 балів ризик склав 0,4 %, при 5 б. — 12,1 %, а при 6–7 б. — 31,4 %, причому найбільш вагомими предикторами гострого ішемічного інсульту були геміпарез і велика тривалість порушень [6, 7].
Іншу можливість виявити пацієнтів із високим ризиком розвитку гострого ішемічного інсульту дає нейровізуалізація [17]. Якщо при проведенні КТ протягом 48 годин після ТІА виявляються ознаки свіжого ішемічного ушкодження тканини мозку, то відношення шансів повторного гострого ішемічного інсульту досягає 4,6 % [3]. Ще більш інформативним є дослі-дження за допомогою дифузійно-зважених режимів МРТ у першу добу після ТІА. Так, наявність декількох нових вогнищ є незалежним предиктором повторного гострого ішемічного інсульту, інших судинних подій або смерті [24]. Якщо ж свіжі вогнища зустрічалися разом з ознаками оклюзії церебральної артерії, то 90-денний ризик розвитку гострого ішемічного інсульту був 32,6 % [2].
Основним в діагностиці ТІА є огляд невролога, що має підготовку з інсульту, а також лабораторні й інструментальні обстеження. Лабораторні тести охоплюють клінічний аналіз крові з підрахунком тромбоцитів, біохімічний профіль з ліпідограмою й оцінкою толерантності до глюкози, протромбіновий і активований частковий тромбопластиновий час, фібриноген, С-реактивний білок, електроліти, креатинін. До числа необхідних інструментальних досліджень входить електрокардіографія, КТ/МРТ, неінвазивна візуалізація серця, екстра- та інтракраніальних артерій. За показниками проводиться: холтерівський моніторинг, ехокардіоскопія (трансторакальна/езофагальна), артеріографія з контрастом, дослідження гемокоагуляції (АФС, ГЦ), дослідження ліквору [1, 10, 12]. Немає єдиної точки зору на те, де обстежувати таких пацієнтів — в стаціонарі або амбулаторно. Госпіталізувати необхідно тільки при високому рівні (> 4 %) ризику розвитку інсульту, коли співвідношення вартість/ефективність виправдані. Загальноприйнятою вважається думка, що обстеження повинне бути завершене протягом декількох днів. Тому пацієнтів направляють під спостереження дільничних (сімейних) лікарів, які приймають і обстежують їх як амбулаторних хворих. При відмові пацієнта продовжити діагностичні заходи або затягуванні на 8–15 діб (і довше) шанси запобігти розвитку інсульту різко знижуються, оскільки ризик інсульту максимальний протягом першого тижня після ТІА [13].
Клінічним діагностичним алгоритмом є наступні ознаки: раптовий неврологічний дефіцит (включаючи скарги), чітке переважання вогнищевих проявів над загальномозковими, тривалість неврологічних симптомів 10–20 хвилин, відразу максимальна їх вираженість і відсутність прогресу. При стенозі загальної або внутрішньої сонної артерії можна вислухати шум систоли над біфуркацією [10].
Лікування полягає в усуненні причини ТІА і корекції чинників ризику, що модифікуються. Обов’язковим елементом будь-яких профілактичних заходів повинна бути зміна образу життя:
— нормалізація ваги тіла і, що особливо важливе, свіввідношення об’єму талії та об’єму стегон;
— збільшення фізичної активності до рівня 45–60 хвилин вправ середньої інтенсивності 4–5 днів на тиждень;
— припинення паління (включаючи пасивне) [9] і зловживання алкоголем;
— зміна дієти (наприклад, перехід на середземноморську дієту знижує загальний ризик смерті на 50 % за 2 роки) [15].
На жаль, ефективність даних заходів часто недооцінюється.
До медичних втручань, які дозволяють знизити ризик виникнення інсульту після ТІА, відносяться усунення гіповолемії, прийом аспірину, комбінації аспірину з клопідогрелем, пероральних антикоагулянтів і, можливо, статинів, а також хірургічна реваскуляризація [7, 18].
Бажано кожному хворому, що переніс ТІА, видавати пам’ятку з вказівкою відповідей на такі питання:
— Що таке ТІА?
— Що з’явилося причиною розвитку ТІА?
— Як уникнути інсульту?
— Що залежить особисто від Вас?
— Для проведення всебічного обстеження і пошуку причин розвитку ТІА обов’язково звертатися до лікаря.
Коментар робочої групи: «Аспірин» — це торгова назва лікарського засобу ацетилсаліцилова кислота.
Рекомендації
— Пацієнти з підозрою на ТІА повинні бути госпіталізовані в стаціонар з відділенням гострого порушення мозкового кровообігу, де можуть бути забезпечені діагностика й екстрена допомога (рівень обґрунтованості В) [ESO, 2008].
— При підозрі на ТІА — екстрене проведення КТ або МРТ головного мозку (рівень обґрунтованості А) [RCP, 2008].
— При МРТ головного мозку бажане використання дифузійно-зважених і градієнтних зображень Т2-зважених (рівень обґрунтованості А) [RCP, 2008].
— Пацієнтам з ТІА, малим інсультом і спонтанним регресом рекомендується в терміновому порядку проведення судинної візуалізації (ультразвук, КТ- або МР-ангіографія) (рівень обґрунтованості А) [ESO, 2008].
— Усім пацієнтам з ТІА рекомендується проведення раннього клінічного обстеження, що включає оцінку фізіологічних параметрів, а також рутинних аналізів крові (дані в описовій частині) (рівень обґрунтованості А) [ESO, 2008].
— Усім пацієнтам з ТІА рекомендується проведення ЕКГ в 12 відведеннях, а також холтерівський моніторинг ЕКГ за наявності аритмій і невстановленої причини ТІА (рівень обґрунтованості А) [ESO, 2008].
— Пацієнтів з підозрою на перенесену ТІА оглянути якнайшвидше для оцінки ризику розвитку подальшого інсульту за шкалою ABCD-2 (додаток 1) (рівень обґрунтованості В) [RCP, 2008].
— При низькому ризику розвитку інсульту за шкалою ABCD-2 (3) хворих, які перенесли ТІА не пізніше ніж впродовж попередніх 72 годин, доцільно госпіталізувати, якщо повноцінне обстеження в амбулаторних умовах провести неможливо (рівень обґрунтованості С) [RCP, 2008].
— При низькому ризику розвитку інсульту за шкалою ABCD-2 (3) необхідно:
а) негайно почати лікування аспірином (у первинній дозі 300 мг/добу, потім — по 100 мг/добу) за відсутності порушення серцевого ритму;
б) провести оцінку стану здоров’я впродовж не більше 1 тижня після появи симптомів;
в) при підтвердженні діагнозу почати заходи щодо вторинної профілактики з обговоренням індивідуальних факторів ризику (рівень обґрунтованості С) [RCP, 2008].
— Пацієнти з першочергово низьким ризиком розвитку інсульту (ABCD-2 (3)), але з наростанням частоти ТІА (дві або більше на тиждень) повинні отримувати таке ж лікування, як і пацієнти з підтвердженим високим ризиком інсульту за шкалою ABCD-2 (рівень обґрунтованості С) [RCP, 2008].
— При високому ризику розвитку інсульту за шкалою ABCD-2 (4) необхідно пацієнта госпіталізувати і негайно почати лікування аспірином (у первинній дозі 300 міліграм на добу, потім — по 100 мг/добу) за відсутності порушення серцевого ритму, провести оцінку стану здоров’я протягом 24 годин після появи симптомів; при підтвердженні діагнозу почати заходи вторинної профілактики, включаючи обговорення індивідуальних чинників ризику (рівень обґрунтованості С) [RCP, 2008].
— Пацієнти, у яких неясний судинний басейн або патологія, повинні піддаватися негайній візуалізації головного мозку (рівень обґрунтованості С) [RCP, 2008].
— Пацієнти, які перенесли ТІА, пройшли візуалізацію судин та мають стеноз сонних артерій 50–99 % за критеріями NASCET або 70–99 % за критеріями об’єднаної групи ECST, повинні протягом 1-го тижня бути направлені на планову консультацію нейрохірурга щодо операції (каротидна ендартеректомія) протягом максимум 2 тижнів від початку появи симптомів ТІА (рівень обґрунтованості А) [RCP, 2008].
Додатки
Додаток 1
4. Невідкладні діагностичні та лікувальні заходи після доставки в лікарню
Невідкладні діагностичні тести
В приймальному відділені обстеження та ранній початок лікування пацієнтів з інсультом повинні бути пріоритетними. Оскільки терапевтичне вікно для лікування гострого ішемічного інсульту обмежене в часі, дуже важливо швидко провести обстеження та діагностику ішемічного інсульту. Обстеження пацієнта спеціалістом, діагностичні тести, враховуючи нейровізуалізацію, для скорочення часу повинні проводитися майже одночасно. Розробка організованого протоколу та створення інсультної команди можуть прискорити клінічну оцінку, проведення діагностичних досліджень та винесення рішення про раннє лікування.
Обстеження пацієнта з можливим інсультом починається, як і при інших критичних станах, за схемою АВС: визначення прохідності дихальних шляхів (А — air), оцінка ефективності, частоти і ритму дихання (B — breathing) та ефективності роботи серцево-судинної системи (C — circulation) — визначення артеріального тиску, частоти та ритму серцевих скорочень, наповнення периферійних вен [2].
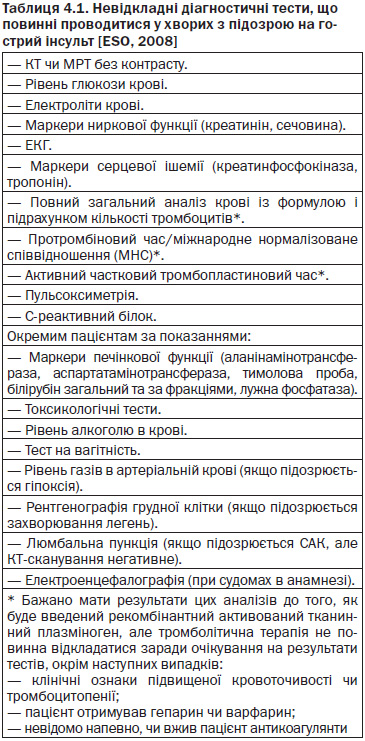
Клінічне обстеження (збір анамнезу, загальний огляд та неврологічне обстеження) залишається основною частиною обстеження хворого з можливим інсультом. Особливо важливою є інформація про час початку симптомів захворювання та інсульт в анамнезі. Інсультні клінічні шкали, такі як Шкала тяжкості інсульту Національного інституту здоров’я (NIH Stroke Scale (NIHSS)), дозволяють отримати важливу інформацію про тяжкість інсульту, прогноз і необхідну тактику лікування. Метою неврологічного обстеження є не тільки діагностика інсульту та його потенційної причини, але і виключення захворювань, що імітують його (тобто станів, які мають схожу з інсультом клінічну картину), виявлення станів, які потребують невідкладної медичної допомоги. Оскільки часу обмаль, рекомендується обмежена кількість діагностичних тестів — дослідження повинні бути доступні 24 години на добу та 7 діб на тиждень (табл. 4.1) [1].
Раніше рекомендувалося рутинне проведення рентгенографії грудної клітки у всіх хворих на інсульт. Дослідження показали, що рентгенографія грудної клітки потрібна лише 3,8 % пацієнтів, яким проводили рутинне дослідження грудної клітки в приймальному відділенні, що свідчить про те, що цей тест має обмежені, але не нульові інформативні можливості [3].
Дослідження цереброспінальної рідини має обмежене значення в обстеженні пацієнтів із можливим інсультом. Чутливість нейровізуалізаційних методів дослідження досить висока для виявлення внутрішньомозкового крововиливу. Клінічна картина субарахноїдального крововиливу чи гострої інфекції ЦНС відрізняється від такої при ішемічному інсульті. Дослідження цереброспінальної рідини може бути показане в пацієнтів з інсультом, що є вторинним по відношенню до інфекційного захворювання.
Додаткові діагностичні тести, такі як візуалізація серця й судин, звичайно займають час та можуть призвести до відтермінування невідкладного лікування [5].
Рекомендації
— Розробка протоколу обстеження пацієнтів із пі-дозрою на інсульт та створення спеціалізованої команди спеціалістів (спеціаліст-інсультолог, медична сестра, лаборант, радіолог) дозволяють прискорити клінічну оцінку, проведення діагностичних тестів та визначення тактики раннього лікування. У приймальному відділені бажано завершити обстеження пацієнтів із можливим інсультом та визначити тактику лікування впродовж 60 хвилин (рівень обґрунтованості В) [AHA/ASA, 2007].
— У приймальному відділенні рекомендується використання стандартної оцінки, оскільки це підвищує точність і швидкість первинної діагностики інсульту. Шкала FAST (fase, arm, speech test) «обличчя — рука — мовлення» характеризується високою специфічністю та дозволяє виключити судомний напад і гіпоглікемію (рівень обґрунтованості В) [SIGN118, 2010].
— Пацієнти з можливим інсультом повинні пройти ретельне загальноклінічне та неврологічне обстеження. Рекомендується використовувати клінічні інсультні шкали, перевагу слід віддавати таким шкалам, як Шкала тяжкості інсульту Національного інституту здоров’я (NIH Stroke Scale (NIHSS)) (рівень обґрунтованості А) [AHA/ASA, 2007].
— Хворим з можливим інсультом або ТІА рекомендується проведення в екстреному порядку КТ (рівень обґрунтованості B) [СSS, 2008] або МРТ головного мозку (рівень обґрунтованості A) [СSS, 2008]. У разі проведення МРТ головного мозку слід віддавати перевагу дифузійно-зваженому зображенню (ДЗЗ) і градієнт Т2*-зваженому зображенню (рівень обґрунтованості B) [[ESO, 2008]; СSS, 2008].
— Судинна візуалізація повинна бути проведена так швидко, наскільки це можливо, для кращого розуміння причини інсульту та покращення лікування. Судинна візуалізація включає КТ-ангіографію, МР-ангіографію, катетерну ангіографію й дуплексну ультрасонографію (рівень обґрунтованості А) [AHA/ASA, 2007].
— Рекомендується проводити обмежену кількість гематологічних, коагуляційних та біохімічних тестів (рівень обґрунтованості В) [ESO, 2008]. Не рекомендується рутинне проведення тестів на тромбофілію, визначення антифосфоліпідних антитіл, інших аутоантитіл або рівня гомоцистеїну (рівень обґрунтованості С) [SIGN118, 2010].
— Окремі пацієнти можуть потребувати проведення додаткових досліджень: катетерна ангіографія, рентгенографія органів грудної клітки, серологія на сифіліс, ВIЧ-дослiдження, скринінг на васкуліт або тромбофілію. Ці тести повинні проводитися так швидко, наскільки це можливо, від появи симптомів інсульту, а в деяких пацієнтів може виникнути потреба в терміновій процедурі (рівень обґрунтованості С) [NSF, 2010].
— У пацієнтів із клінічними або іншими ознаками гострих серцевих або легеневих захворювань обґрунтованим є проведення рентгенологічного дослідження грудної клітки (рівень обґрунтованості В) [AHA/ASA, 2007]. Більшість хворих на гострий інсульт не потребують рутинного проведення рентгенологічного дослідження органів грудної клітки під час госпіталізації (рівень обґрунтованості В) [AHA/ASA, 2007].
— Рекомендується рутинне проведення ЕКГ у 12 відведеннях, оскільки серед хворих на гострий інсульт розповсюджені серцеві захворювання (рівень обґрунтованості В) [AHA/ASA, 2007].
— Хворим з інсультом і ТІА рекомендується проведення холтерівського моніторування ЕКГ після найгострішого періоду захворювання при наявності аритмій і невстановленому варіанті інсульту (рівень обґрунтованості А) [AHA/ASA, 2007].
— Проведення ехокардіографії рекомендується лише обмеженій кількості пацієнтів (рівень обґрунтованості В) [ESO, 2008].
— Більшість хворих на гострий інсульт не потребують рутинного проведення дослідження цереброспінальної рідини (рівень обґрунтованості В) [AHA/ASA, 2007].
— Всі хворі з вірогідним інсультом у приймальному відділенні повинні бути обстежені на предмет мальнутриції та порушення ковтання (рівень обґрунтованості В) [NICE, 2008].
— Всі хворі з можливим інсультом в приймальному відділенні повинні бути оглянуті на предмет порушення сечовиділення (нетримання, парадоксальне нетримання або затримка) та дефекації (рівень обґрунтованості С) [NSF, 2010].
5. Верифікація діагнозу (візуалізація мозку, серця та судин)
5.1. Візуалізація головного мозку
Пацієнти з гострим порушенням мозкового кровообігу (ГПМК) повинні мати пріоритет над іншими пацієнтами для проходження методів нейровізуалізації, тому що час має вирішальне значення. У хворих із підозрою на транзиторну ішемічну атаку (ТІА) або ішемічний інсульт (ІІ) загальний і неврологічний огляд, що завершується діагностичним нейровізуалізаційним методом, необхідно виконувати відразу ж після прибуття в лікарню, для того щоб лікування можна було розпочати негайно [11]. Обстеження пацієнтів з ТІА є однаково терміновим, тому що до 10 % цих пацієнтів переносять інсульт у межах наступних 48 годин [6, 9]. Попереднє оповіщення лікувальної установи та належне сполучення з відділенням нейровізуалізації полегшує доступ до методів нейровізуалізації. Діагностичні кабінети повинні працювати за схемою 24/7, тобто 24 години на добу 7 днів на тиждень.
Діагностичне зображення має бути чутливим і специфічним у виявленні інсульту, особливо на ранній стадії. Апаратура повинна забезпечити надійні зображення, і процедура має бути технічно можливою для здійснення в пацієнтів із гострим інсультом [EFNS, 2006]. Швидкий і уважний неврологічний огляд потрібен з метою визначення, який із методів нейровізуалізації має переваги для використання в конкретному випадку. Вибір методу нейровізуалізації повинен ґрунтуватися на даних неврологічного статусу і на стані пацієнта, наприклад, до 45 % хворих із гострим інсультом неможливо провести магнітно-резонансну томографію через медичні умови та протипоказання [2]1.
Пацієнти, госпіталізовані в межах 3–4,5 години від початку симптомів, можливо, є кандидатами для внутрішньовенного тромболізису. Проведення спіральної комп’ютерної томографії (СКT) достатньо перед тромболізисом [EFNS, 2006].
СКТ широко доступна, надійно ідентифікує більшість станів, що імітують інсульт (наприклад, пухлина, субдуральна гематома та ін.), і відрізняє гострий ішемічний від геморагічного інсульту в межах перших 5–7 днів. Ургентне сканування СКТ є найбільш рентабельною стратегією для візуалізації головного мозку в пацієнтів із ТІА та ІІ, оскільки СКТ доступніший, недорогий і швидкий метод візуалізації [EFNS, 2006; AHA/ASA, 2007]. Для обстеження хворих із підозрою на ГПМК бажано використовувати багатозрізову (мультиспіральну) СКТ (4 та більше зрізів), тому що це більш чутливий та швидкий метод на відміну від покрокової та однозрізової КТ. Стандартна СКТ менш чутлива, ніж MРТ, для ранніх ішемічних змін [2]. Дві третини хворих із помірними і грубими проявами інсульту мають помітні ішемічні зміни в межах перших декількох годин, але не більше ніж 50 % хворих із мінімальними проявами інсульту мають помітне ішемічне пошкодження на СКТ, відповідне клінічним симптомам, особливо в межах перших декількох годин від початку захворювання [AHA/ASA, 2007].
Висока чутливість МРТ особливо стає в нагоді у виявленні інфаркту на території вертебробазилярного басейну, лакунарного інфаркту та маленьких кіркових інфарктів. Дифузійно-зважена MРТ (ДЗ МРТ) набагато чутливіша у виявленні гострої ішемії в межах 8–12 годин від початку симптомів, ніж СКТ [1, 2, 8, 11]. Інші МРТ-послідовності (fluid-attenuated inversion recovery — FLAIR, T2,Т1) менш чутливі в ранньому виявленні ішемічного пошкодження мозку, проте необхідні для ідентифікації патології, що імітує інсульт (наприклад, розсіяний склероз, енцефаліт, гіпоксичне мозкове пошкодження і тому подібне) [8]. Деякі стани, наприклад гострі порушення обміну речовин, взагалі можуть не визначаться на МРТ. Проте дифузійно-зважені зображення (ДЗЗ) можуть бути негативні у хворих із явним ІІ. MРТ може також виявити інтрапаренхіматозні та субарахноїдальні крововиливи на послідовності FLAIR, а маленькі гострі та старі крововиливи впродовж тривалого періоду — на послідовності T2*-градієнт-ехо [EFNS, 2006].
Проведення МРТ особливо важливе в пацієнтів із підозрою на ІІ з незвичайними клінічними проявами та незвичайною етіологією або в пацієнтів із підозрою на інші захворювання, що імітують інсульт, але не підтверджені на СКТ [AHA/ASA, 2007].
У педіатричних випадках у 12 % пацієнтів причиною ІІ є артеріальна диссекція. У таких випадках необхідне проведення MРТ шиї з використанням Т1-зваженого зображення (ЗЗ) з пригніченням сигналу від жирової тканини для виявлення артеріальної інтрамуральної гематоми [AHA/ASA, 2007].
Недолік проведення MРТ у пацієнтів з підозрою на ІІ та ТІА — це її відносно висока вартість, відсутність 100% готовності, довга тривалість дослідження та наявність протипоказань у пацієнтів. MРТ менш придатна для пацієнтів у стані психомоторного збудження, пацієнтів з блюванням і тих пацієнтів, котрим проводиться вентиляція легенів. При проведенні СКТ і особливо МРТ виникають проблеми, пов’язані із забезпеченням прохідності дихальних шляхів та оксигенації. Тому процедуру бажано виконувати за наявності моніторингу пульсоксиметрії та в присутності анестезіолога. Важливим заходом забезпечення достатньої оксигенації під час проведення процедури дослідження є інгаляція кисню. Бажана централізована подача кисню та наявність дихальної апаратури в діагностичному відділенні.
5.1.1. Рекомендації
— Усі пацієнти з підозрою на ІІ або ТІА повинні бути терміново обстежені шляхом візуалізації головного мозку СКТ або МРТ («терміново» — це щонайшвидше, у межах 24 годин від початку симптомів) (рівень обґрунтованості А) [EFNS, 2006; СSS, 2008; NSF, 2010].
— У більшості випадків початковим нейровізуалізаційним методом є безконтрастна СКТ (рівень обґрунтованості В) [AHA/ASA, 2007; СSS, 2008].
— Якщо проводиться МРТ, дослідження повинне включати ДЗЗ (там, де це доступно та практикується) для виявлення гострої ішемії (рівень обґрунтованості А) [EFNS, 2006], Т2*-градієнт-ехо та FLAIR для виявлення геморагії та Т2-ЗЗ або FLAIR для визначення розмірів інфаркту та виявлення станів, що імітують інсульт (рівень обґрунтованості A) [EFNS, 2006; ESO, 2008].
— Дослідження головного мозку має бути проаналізоване досвідченим лікарем — фахівцем у КТ або МРТ головного мозку (рівень обґрунтованості C) [AHA/ASA, 2007].
— Екстрене лікування інсульту не має бути затримане для того, щоб одержати багатомодальне нейровізуалізаційне дослідження (рівень обґрунтованості C) [AHA/ASA, 2007].
— Повторне термінове проведення СКТ або MРТ головного мозку необхідне при погіршенні стану пацієнта (рівень обґрунтованості A) [NSF, 2010].
— Якщо в дітей первинне СКТ негативне, необхідно виконувати МРТ для визначення подальшої тактики лікування (рівень обґрунтованості В) [СSS, 2008].
— Візуалізація головного мозку рекомендується перед проведенням будь-якої специфічної терапії в лікуванні гострого ІІ (рівень обґрунтованості A) [AHA/ASA, 2007].
5.2. Візуалізація екстра- та інтракраніальних артерій
Візуалізація інтракраніальних та екстракраніальних артерій необхідна для виявлення причини розвитку ТІА та ІІ. Гемодинамічно значущий стеноз сонних артерій досить часто є чинником ризику розвитку II та ТІА [AHA Imaging, 2009]. Пацієнти з симптомами ураження каротидного басейну, які можуть розглядатися як хворі на каротидну ендартеректомію, повинні в короткі терміни піддатися неінвазивному судинному дослідженню [AHA/ASA, 2007]. В ургентному порядку її необхідно проводити всім хворим із підозрою на ТІА та ІІ в каротидному басейні тільки в установах, що забезпечують ендоваскулярне реканалізаційне лікування (каротидну ендартеректомію, стентування, ангіопластику). Необхідність у візуалізації судин перед інтравенозним тромболізисом не була продемонстрована. Дослідження судин необхідне також для виключення судинних аномалій: артеріовенозних мальформацій, аневризм, патологічної звитості. Неінвазивне дослі-дження зазвичай включає ультрасонографію (дуплексну, триплексну або в допплерогафічному режимі), контрастну та безконтрастну магнітно-резонансну ангіографію (МРА) або контрастну спіральну комп’ютерну ангіографію (СКТА). Ці методи є безпечні, у той час як катетеризаційна інтраартеріальна ангіографія має 1–3 % ризику виникнення інсульту у хворих із гемодинамічно значущим каротидним стенозом [10]. Недавній систематичний огляд літератури показав, що неінвазивні візуалізуючі методи, такі як допплерографічна ультрасонографія, СКТА, контрастна МРА, забезпечують достатню точність у виявленні 70–99 % стенозу внутрішньої сонної артерії (чутливість 0,85–0,95, специфічність 0,85–0,93) порівняно зі стандартною інтраартеріальною ангіографією [3, 4, 12, 13]. З цих методів контрастна МРА — найвідчутніший і специфічний неінвазивний зображувальний метод для візуалізації стенозу сонної артерії [10]. Безконтрастна MРА менш надійна. Проте контрастна МРА — відносно новий метод, який недоступний у багатьох центрах, тоді як допплерографічна ультрасонографія широко доступна й використовується в більшості спеціалізованих центрів. Неінвазивні методи для виявлення 50–70 % стенозів менш точні, ніж інтраартеріальні методики. Дигітальна субтракційна ангіографія (ДСА) — це золотий стандарт для визначення ступеня стенозу артерії. Її проведення необхідне в тих випадках, коли дані інших методів були неперекон-ливими.
Деякі дані свідчать, що ТІА та ІІ у вертебробазилярному басейні пов’язані з високим ризиком рецидивуючого інсульту. Ультрасонографія хребетних артерій — корисна методика, але інтракраніальна ультрасонографія вертебробазилярного басейну може показувати неточні дані через низьку специфічність. Обмежені дані свідчать, що використання підсилених контрастом MРА і СКТА є найкращим неінвазивним методом у візуалізації інтракраніальних відділів хребетних і основних артерій.
Судинна візуалізація більшою мірою пріоритетна в пацієнтів із TІА або ІІ з легким неврологічним дефіцитом порівняно з пацієнтами, що мають помірний і тяжкий неврологічний дефіцит. У пацієнтів із гострим ІІ судинне дослідження виявляє локалізацію оклюзії. Результати проведених досліджень свідчать, що внутрішньовенний тромболізис ефективніший для периферичного, ніж для проксимального тромбозу, і що інтраартеріальний тромболізис і механічна тромбектомія ефективніші для лікування проксимального тромбозу великої судини, ніж внутрішньовенний тромболізис [14]. Гострий тромбоз великої інтракраніальної судини точніше визначається на СКТА, MРА і ДСА. Для демонстрації гострих оклюзій більш дистальних судинних гілок або для оцінки підгострих і хронічних стенозів, вазоспазмів і васкулітів ДСА перевершує СКТА і MРА і тому має бути використана в діагностуванні [AHA/ASA, 2007].
Для візуалізації екстракраніальних артерій ультрасонографія — оптимальна та доступна методика. Мобільні апарати дозволяють проводити дослідження біля ліжка хворого. МРА і СКТА більш чутливі та специфічні порівняно з ультрасонографією у визначенні каротидного стенозу та оклюзії, але менш доступні. ДСА — це рекомендований метод для встановлення ступеня каротидного стенозу перед ендартеректомією, але коли є відповідність неінвазивних ангіографічних методів, проведення ДСА необов’язкове. Транс-краніальна допплерографія може використовуватися як неінвазивна методика для виявлення вазоспазму або стенозів унаслідок серпоподібноклітинної анемії та інших артеріальних хвороб [AHA Imaging, 2009]. Для остаточного діагнозу СКТА і ДСА точніші у визначенні ступеня стенозу. Безконтрастна МРА менш чутлива у визначенні стенозу, ніж СКТА і ДСА, але також може бути корисною.
5.2.1. Рекомендації
— Усім хворим з ТІА та ІІ (з легким неврологічним дефіцитом) в каротидному басейні, які потенційно є кандидатами на каротидну реваскуляризацію (ендартеректомію, стентування або ангіопластику) та госпіталізовані у спеціалізовані центри, необхідно проводити термінову (у перебігу 24 годин) візуалізацію інтра- та екстракраніальних артерій (рівень обґрунтованості В) [EFNS, 2006; СSS, 2008; NSF, 2010; AHA Imaging, 2009].
— Візуалізація судин може включати ультрасоно-графію, СКТА, МРА і катетеризаційну інтраартеріальну ангіографію залежно від наявності даного методу в стаціонарі та характеристик пацієнта (рівень обґрунтованості A) [EFNS, 2006; AHA/ASA, 2007; NSF, 2010].
— ДСА — це рекомендований метод для визначення ступеня каротидного стенозу перед ендартеректомією (рівень обґрунтованості A) [EFNS, 2006; AHA Imaging, 2009], але коли є відповідність двох неінвазивних ангіографічних методів, ДСА не проводиться (рівень обґрунтованості B) [EFNS, 2006].
— Судинна візуалізація необхідна як попереднє дослідження перед інтраартеріальним введенням фармакологічного засобу, хірургічної процедури або ендоваскулярного втручання (рівень обґрунтованості В) [AHA/ASA, 2007].
— Судинна візуалізація не повинна затримувати лікування пацієнтів з ІІ, якщо симптоми з’явилися менше 3–4,5 години тому (рівень обґрунтованості B) [AHA/ASA, 2007].
— У педіатричних випадках церебральні та цервікальні артерії мають бути обстежені так скоро, як це можливо, переважно впродовж 24 годин (рівень обґрунтованості C) [СSS, 2008].
— Незважаючи на те, що СКТА (за відсутності важких кальцифікатів) і MРА надзвичайно точні у виявленні диссекції, ДСА залишається золотим стандартом, і її потрібно використовувати для встановлення остаточного діагнозу (рівень обґрунтованості А) [EFNS, 2006; AHA Imaging, 2009]. Якщо використовується стандартна МРТ шиї, необхідне використання Т1-ЗЗ із пригніченням сигналу від жиру (рівень обґрунтованості А) [AHA Imaging, 2009].
— Неінвазивне дослідження цервіко-краніальних судин необхідно виконувати як частину оцінки пацієнтів із підозрою на TІА (рівень обґрунтованості A) [AHA/ASA, 2007].
5.3. Візуалізація серця
5.3.1. Рекомендації
— Кардіограму необхідно робити щонайшвидше після TІА та ІІ (рівень обґрунтованості A) [ESO, 2008] [3].
— Тривалий 24-годинний кардіальний моніторинг (стаціонарна телеметрія або холтерівське моніторування) корисний після гострого періоду інсульту для пацієнтів з аритмією та з неясним походженням ТІА та ІІ (рівень обґрунтованості А) [AHA/ASA, 2007, ESO, 2008].
— В ехокардіографії (як мінімум трансторакальна ехокардіографія (ТТЕ)) раціонально оцінювати хворих із підозрою на TІА, особливо пацієнтів, у яких причина не була ідентифікована іншими методами (рівень обґрунтованості B) [AHA/ASA, 2007]. TEE корисна в ідентифікації пороків серця, атеросклерозу дуги аорти та хвороб клапанів серця, коли діагностування цієї патології веде до змін у лікуванні (рівень обґрунтованості B) [AHA/ASA, 2007, ESO, 2008].
6. Класифікація та оцінювання тяжкості ішемічних інсультів (код МКХ-10: I 63.0 — І 63.9)
Інсульт — це синдром, причини та прояви якого дуже неоднорідні. За даними сучасної літератури, число причин інсульту сягає 150, а у 25–40 % випадків етіологія інсульту залишається невстановленою. Визначення підтипу (тобто механізму розвитку) ішемічного інсульту є важливим з декількох причин. Це дозволяє краще описати фенотип захворювання та провести стратифікацію ризиків у учасників клінічних випробувань, провести розподіл пацієнтів на групи в епідеміологічних дослі-дженнях та класифікацію хворих із метою вибору діагностичних та лікувальних заходів [1, 2].
6.1. Класифікація ішемічних інсультів
6.1.1. Основні принципи класифікації інсультів
Класифікація інсультів має передбачати можливість її використання як у клінічній практиці, так і в наукових дослідженнях, зокрема клінічних випробуваннях та під час вивчення профілактичних стратегій. До класифікації мають увійти основні типи церебральних інсультів (ішемічний інсульт, внутрішньомозковий та субарахноїдальний крововиливи, венозний інсульт) та спинномозкові інсульти. Визначаючи підтип ішемічних інсультів (атеротромботичний, кардіоемболічний, лакунарний або іншої етіології), слід обирати найбільш імовірний, проте не виключати можливості декількох причин (наприклад, ознаки ураження великих та дрібних артерій одночасно). Класифікація має ґрунтуватися на даних анамнезу, фізикального огляду та результатах вчасно проведених інструментальних та лабораторних досліджень [1, 2].
6.1.2. Робочій варіант класифікації ішемічних інсультів наведено в табл. 6.1 [1, 2]

6.2. Діагностичне обстеження для встановлення підтипу ішемічного інсульту
6.2.1. Мінімальний обсяг обстеження [1, 2]
1. Документування основних факторів ризику: артеріальна гіпертензія, гіперліпідемія, куріння, цукровий діабет, надмірна вага (індекс маси тіла, окружність талії), малорухомий спосіб життя, хвороби серця та серцеві аритмії, судинні захворювання в родині, судинні події (інфаркти міокарда, інсульти, транзиторні ішемічні атаки, claudicatio intermittens) та втручання на судинах (наприклад, ендартеректомія чи ангіопластика/стентування) в анамнезі.
2. Лабораторні аналізи: клінічний аналіз крові з підрахунком числа тромбоцитів, гематокрит, МНО, ліпідограма, ферменти печінки, креатинін, глюкоза.
3. ЕКГ (+/ моніторинг), ЕхоКГ (за показаннями).
4. Візуалізація мозку (МРТ або КТ).
5. Візуалізація позачерепних церебральних артерій (дуплексне сканування, КТ-ангіографія або МР-ангіографія з контрастом, традиційна субтракційна катетерна артеріографія).
6. Візуалізація внутрішньочерепних церебральних артерій (транскраніальна допплерографія, КТ-ангіо-графія або МР-ангіографія з контрастом, традиційна катетерна субтракційна артеріографія).
6.2.2. Показання для дослідження стінок та порожнин серця (трансторакальна або крізьстравохідна ЕхоКГ, МРТ серця)
— Підозра щодо джерела емболів у серці, вади або пухлини серця.
— Підозра щодо ендокардиту (інфекційний або неінфекційний).
— Підозра щодо відкритого овального вікна та/або передсердної септальної аневризми.
— Пошук ділянок акінезії або аневризми в лівому шлуночка.
— Пошук ознак фіброзу міокарда, кардіоміопатії.
Крізьстравохідна ЕхоКГ показана у випадках, коли треба детально дослідити праві та ліві камери серця та/або грудну аорту, виміряти розмір відкритого овального вікна та підтвердити наявність септальної аневризми. Це дослідження має проводити кваліфікований оператор із досвідом обстеження хворих на інсульт.
6.2.3. Як діагностувати серцеві аритмії?
При гострому інсульті бажано проводити постійний моніторинг ЕКГ впродовж перших 2448 год перебування в лікарні. Холтерівський моніторинг рекомендується проводити у випадках, коли є підстави підозрювати серцеві аритмії, передусім фібриляцію передсердь (наприклад, аритмії в минулому або періодичне відчуття серцебиття/перебоїв у серці).
6.2.4. Коли показані дослідження системи гемостазу?
— Підвищене зсідання крові в родичів.
— Молоді хворі з криптогенним інсультом.
— Злоякісні пухлини, які можуть спричинити гіперкоагуляцію.
— Венозні тромбози та/або тромбоемболії в минулому.
— Повторні епізоди кардіогенної емболії у хворих із фібриляцією передсердь, якщо МНО в межах норми.
6.2.5. Особливі випадки
У разі підозри щодо інфекційного ендокардиту необхідно терміново відправити кров на бактеріологічне дослідження та замовити ЕхоКГ. У разі підозри щодо розшарування стінки аорти необхідно негайно зробити КТ-ангіографію. У разі підозри щодо розшарування стінки (диссекції) церебральних артерій слід зробити МР-ангіографію разом з МРТ у режимі з пригніченням сигналу від жиру або катетерну артеріографію, щоб виявити крововилив у стінці артерії (щоб виявити ознаки розшарування артерії, дослідження має бути виконане впродовж перших 15 днів від початку захворювання).
6.3. Підтипи ішемічних інсультів [1, 2]
6.3.1. Атеротромботичний ішемічний інсульт
Атеротромботичний ішемічний інсульт розвивається на тлі атеросклеротичного ураження позачерепних та великих внутрішньочерепних артерій. Безпосередньою причиною оклюзії може бути збільшення розміру атеросклеротичної бляшки, зокрема, за рахунок утворення тромбу на її поверхні. Пристінковий тромб може відриватися й мігрувати з рухом крові, спричиняючи оклюзію дистальної артерії меншого діаметра (артеріо-артеріальна емболія). Механізми атеротромбозу є найбільш імовірною причиною ішемічного інсульту, коли наявна хоча б одна з наступних ознак:
1) тяжкий (7099 %) атеросклеротичний стеноз позачерепної або великої внутрішньочерепної церебральної артерії, у басейні якої виник інфаркт (за даними катетерної артеріографії, МРТ з високою роздільною здатністю або — у випадку внутрішньої сонної артерії — у разі співпадіння результатів двох методів візуалізації артерій, наприклад дуплексного сканування та КТ- чи МР-ангіографії);
2) атеросклеротичний стеноз < 70 % церебральної артерії, у басейні якої виник інфаркт, за наявності тромбу в просвіті судини (за даними катетерної артеріографії, МРТ з високою роздільною здатністю або — у випадку внутрішньої сонної артерії — у разі узгоджених результатів двох методів візуалізації артерій, таких як дуплексне сканування, КТ- та МР-ангіографія);
3) рухомий тромб дуги аорти;
4) оклюзія церебральної артерії, у басейні якої виник інфаркт, за наявності ознак її атеросклеротичного ураження.
6.3.2. Ішемічний інсульт унаслідок хвороби дрібних судин мозку (лакунарний інсульт)
Лакунарний інсульт розвивається внаслідок ураження дрібних внутрішньомозкових судин, здебільшого перфоруючих артерій та артеріол (плазморагії, фібриноїдний некроз, ліпогіаліноз). Таке ураження в більшості випадків розвивається в пацієнтів, які тривалий час страждають від артеріальної гіпертензії та/або цукрового діабету. У разі оклюзії дрібної артерії зазвичай спостерігається невеликий інфаркт (діаметр до 15 мм), розташований у білій речовині півкуль мозку, базальних гангліях чи основі мосту. Хвороба дрібних судин є найбільш імовірною причиною ішемічного інсульту в разі поєднання ознаки 1) з однією чи кількома з подальших ознак 2), 3) або 4):
1) дрібний інфаркт у басейні глибокої церебральної артерії (інфаркт у глибоких відділах мозку, який за даними КТ або МРТ має діаметр < 15 мм та може пояснити симптоми);
2) один або кілька старих або «німих» інфарктів у басейнах інших артерій;
3) лейкоареоз та/або розширені периваскулярні проміжки (за даними КТ або МРТ);
4) повторні транзиторні ішемічні атаки в тому ж басейні та з тими ж симптомами впродовж попереднього місяця (імовірність лакунарного інсульту зростає до 80 %).
6.3.3. Кардіоемболічний ішемічний інсульт
Джерелом емболів, які спричиняють оклюзію церебральної артерії, є порожнини або клапани серця. Згустки крові у серці можуть з’являтися внаслідок серцевих аритмій (передусім фібриляції передсердь), інфаркту міокарда, післяінфарктної аневризми, вад серця, інфекційно-запальних процесів, пухлин серця тощо. Особливим випадком емболії є парадоксальна емболія, коли згусток крові, що утворився у венах, крізь дефект перетинок між правими та лівими камерами серця (найчастіше — крізь відкрите овальне вікно) потрапляє в ліве передсердя чи лівий шлуночок і звідти — у церебральну артерію. Оскільки тиск у лівих камерах серця зазвичай вищий, ніж у правих камерах серця, парадоксальна емболія виникає тільки за умов підвищеного тиску в грудній клітці (наприклад, під час значного фізичного напруження). Кардіогенна емболія є найбільш імовірною причиною ішемічного інсульту в разі наявності наступних ознак:
1) мітральний стеноз;
2) штучний клапан серця;
3) інфаркт міокарда впродовж попередніх 4 тижнів;
4) інтрамуральні тромби в лівих камерах серця;
5) аневризма лівого шлуночка;
6) зареєстрована фібриляція або тріпотіння перед-сердь;
7) синдром слабкості синусового вузла;
8) дилатаційна кардіоміопатія;
9) фракція викиду лівого шлуночка < 35 %;
10) ендокардит;
11) пухлина серця;
12) відкрите овальне вікно плюс ознаки тромбозу in situ;
13) відкрите овальне вікно плюс ознаки тромбозу глибоких вен або тромбоемболія легеневої артерії перед ішемічним інсультом.
6.3.4. Ішемічний інсульт іншої етіології
Якщо виключені три найбільш поширені причини, слід розглянути можливість того, що етіологією ішемічного інсульту є наступні більш рідкісні причини:
1) розшарування стінки церебральної артерії (підтверджують наступні ознаки: інтрамуральна гематома в стінці артерії (за даними МРТ або КТ) або типове повздовжнє звуження внутрішньої сонної артерії після біфуркації або сегментів V2V4 хребцевої артерії (за даним артеріографії, КТ- чи МР-ангіографії));
2) гемодинамічні розлади (істотне зниження артеріального тиску, здебільшого в людей похилого віку з атеросклеротичним ураженням церебральних судин, яке спричиняє ішемію на межі судинних басейнів мозку);
3) доліхоектазія з ускладненою аневризмою;
4) справжня поліцитемія, тяжкий тромбоцитоз (> 800 000/мм3);
5) васкуліти (наприклад, системний червоний вовчак);
6) дисеміноване внутрішньосудинне зсідання крові;
7) антифосфоліпідний синдром (див. відповідні критерії);
8) хвороба Фабрі;
9) менінгіт;
10) серпоподібноклітинна хвороба;
11) розрив аневризми церебральної артерії (+/− вазоспазм);
12) гіпергомоцистеїнемія;
13) вживання наркотичних засобів (наприклад, кокаїну).
Якщо є рівноцінні підстави віднести ішемічний інсульт до двох або більше підтипів, тоді обирають категорію «Ішемічний інсульт із кількома імовірними причинами». Якщо дані анамнезу й фізичного огляду та результати обстеження не дають достатніх підстав, щоб віднести ішемічний інсульт до одного з наведених вище підтипів, слід вважати, що найбільш імовірну причину не встановлено (криптогенний інсульт). Якщо результати обстеження відсутні або неповні, надійно встановити підтип ішемічного інсульту неможливо.
6.4. Оцінювання тяжкості ішемічних інсультів
Основним інструментом для оцінювання тяжкості неврологічних порушень при ішемічному інсульті слід вважати інсультну шкалу Національних інститутів здоров’я США (National Institutes of Health stroke scale — NIHSS) [3]. Переклад NIHSS з інструкціями українською мовою наведено в додатку 6.1.
7. Базисне (недиференційоване) лікування гострого інсульту та корекція порушень гомеостазу
Базисне лікування та відновлення гомеостазу
Під базисним лікуванням розуміють основні терапевтичні стратегії, що направлені на стабілізацію стану хворого та корекцію тих порушень, які можуть ускладнити відновлення неврологічних функцій. Базисна терапія включає підтримку функцій дихання і кровообігу, корекцію метаболічних та волемічних порушень, контроль рівня артеріального тиску.
У хворих із неускладненим перебігом інсульту загальновизнаною є необхідність у активному моніторингу неврологічного статусу і таких життєво важливих показників, як артеріальний тиск, пульс, сатурація киснем артеріальної крові, рівень глюкози і температура тіла.
Для стандартизації оцінки неврологічного статусу використовують неврологічні шкали: Шкала інсульту Національного інституту здоров’я (NIHSS) [1, 2].
Немає достовірних даних стосовно того, як часто повинен проводитися моніторинг; у дослідженнях, присвячених організації відділень для лікування хворих на гостре порушення мозкового кровообігу, вітальні функції та неврологічний статус визначалися від 4 до 6 раз на добу впродовж перших 48–72 годин від початку інсульту. Вважається, що більш інтенсивного моніторингу (частіше ніж кожні 4 години) потребують пацієнти з порушенням свідомості (на рівні глибокого приглушення, сопору та коми), прогресуючим неврологічним дефіцитом чи супутньою кардіореспіраторною патологією, а також хворі після тромболітичної терапії впродовж 24 годин.
Основною метою інтенсивної терапії є попередження гіпоксії та пов’язаного з нею збільшення ушкодження головного мозку. Найбільш поширеними причинами гіпоксії є часткова обструкція верхніх дихальних шляхів, гіповентиляція, аспіраційна пневмонія та ателектази [3].
Підвищена температура тіла (лихоманка) у хворих на гострий ішемічний інсульт асоціюється з несприятливим прогнозом та підвищенням ризику летальності, що вірогідно пов’язано з підвищенням активності метаболічних процесів, збільшенням вивільнення нейромедіаторів, підвищенням проникності гематоенцефалічного бар’єру, індукцією апоптозу та запалення, накопиченням лактату та підвищенням рівня продукції вільних радикалів. У ході експериментальних досліджень був встановлений прямий зв’язок між гіпертермією, розміром вогнища і несприятливим прогнозом [1, 4].
Пацієнти з ураженою правою гемісферою, особливо острівцем, мають підвищений ризик розвитку ускладнень зі сторони серцево-судинної системи, вірогідно внаслідок вторинного порушення функції автономної нервової системи.
У хворих на гострий інсульт часто виникають вторинні зміни на ЕКГ — депресія сегмента ST, QT, інверсія зубця Т та U хвилі. Крім того, може спостерігатися підвищення рівня ферментів крові, яке свідчить про пошкодження міокарда.
Існує поняття U-подібного взаємозв’язку між АТ і летальністю хворих на інсульт: як високі, так і низькі цифри АТ асоціюються з підвищеним ризиком ранньої і пізньої летальності [2].
При САТ менше 220 мм рт.ст. i ДАТ менше 120 мм рт.ст.:
— спостереження за відсутності ускладнень (диссекція аорти, гострий інфаркт міокарда, набряк легень, гіпертензивна енцефалопатія);
— корекція інших симптомів (головний біль, збудження, нудота, блювота);
— боротьба з ранніми ускладненнями (гіпоксія, підвищення внутрішньочерепного тиску, судоми, гіпоглікемія).
У найгострішій фазі інсульту (перші 24 години — 7 діб) треба уникати використання вазоактивних (судинорозширювальних) і специфічних антигіпертензивних препаратів!!! Мета — зниження АТ на 10–15 % від попереднього рівня [3].
Швидке зниження АТ у хворих на гострий ішемічний інсульт може бути небезпечним. Існує консенсус, що активне зниження АТ проводять, коли діастолічний АТ перевищує 120 мм рт.ст. або систолічний АТ понад 220 мм рт.ст. (табл. 1).
Клінічні дослідження показали, що гіперглікемія у хворих з інсультом асоціюється з несприятливими наслідками лікування та більшим за об’ємом вогнищем із залученням кори, враховуючи пацієнтів після тромболітичної терапії.
Більшість пацієнтів із гострим інсультом дегідратовані вже при надходженні до стаціонару, що асоціюється з несприятливими наслідками лікування. Як правило, пацієнтам із гострим інсультом вводять рідину внутрішньовенно, особливо із порушеною свідомістю та розладами ковтання. Найбільш ефективний тип чи об’єм інфузії не визначений [1, 3].
Рекомендації
— Рекомендується моніторинг неврологічного статусу, частоти серцевих скорочень, артеріального тиску, температури тіла та насичення гемоглобіну киснем (SpO2) впродовж 72 годин у хворих із неврологічним дефіцитом (рівень обґрунтованості С) [ESO, 2008].
— Пацієнти без ознак гіпоксії не потребують додаткової подачі кисню (рівень обґрунтованості В) [AHA/ASA, 2007]. Додаткова подача кисню рекомендується хворим із SpO2 < 92–95 % (рівень обґрунтованості C) [ESO, 2008].
— У пацієнтів із гострим інсультом та порушенням свідомості або функцій черепних нервів бульбарної групи необхідно підтримувати прохідність дихальних шляхів, санувати трахеобронхіальне дерево та оптимізувати вентиляцію легень (може знадобитися штучна вентиляція легень) (рівень обґрунтованості C) [AHA/ASA, 2007].
— Не рекомендується використовувати гіпербаричну оксигенацію в лікуванні ішемічного інсульту, за виключенням випадків, коли інсульт був спричинений повітряною емболією (рівень обґрунтованості В) [AHA/ASA, 2007].
— Рекомендується лікування лихоманки (при температурі > 37,5 °C) за допомогою парацетамолу (ацетамінофену) в дозі 6000 мг/добу і фізичного охолодження (рівень обґрунтованості С) [ESO, 2008].
— Профілактичне призначення антибіотиків у імунокомпетентних пацієнтів не рекомендується (рівень обґрунтованості В) [ESO, 2008].
— Рекомендується пошук супутньої інфекції при підвищенні температури тіла > 37,5 °C (рівень обґрунтованості C) [ESO, 2008].
— Рекомендується проведення моніторування серцевої діяльності впродовж 24 годин після інсульту з метою виявлення фібриляції передсердь та інших потенційно небезпечних аритмій, які можуть потребувати невідкладного втручання (рівень обґрунтованості B) [AHA/ASA, 2007].
— Не рекомендується рутинне зниження АТ в гострому періоді інсульту (рівень обґрунтованості C) [ESO, 2008].
— Рекомендується обережне зниження АТ у пацієнтів з рівнем АТ > 220/120 мм рт.ст. при повторних вимірюваннях, із вираженою серцевою недостатністю, диссекцією аорти, гіпертонічною енцефалопатією (рівень обґрунтованості C) [ESO, 2008].
— Слід уникати різкого зниження АТ (рівень обґрунтованості C) [ESO, 2008]. Знижувати АТ доцільно приблизно на 15 % впродовж 24 годин. Рівень цільового АТ не визначений (рівень обґрунтованості C) [AHA/ASA, 2007].
— Немає достатньо даних щодо переваги окремих препаратів для зниження артеріального тиску у пацієнтів із гострим інсультом (рівень обґрунтованості C) [AHA/ASA, 2007].
– Рекомендується моніторинг рівня глюкози (рівень обґрунтованості C) [ESO, 2008]. Рівень глюкози слід визначити повторно, якщо попередній її рівень виходив за межі норми або в пацієнта в анамнезі ЦД (рівень обґрунтованості В) [ESO, 2008].
— При рівні глікемії > 180 мг/дл (> 10 ммоль/л) рекомендується зниження рівня глюкози крові за допомогою інсуліну — 2 ОД/годину в/в повільно (рівень обґрунтованості C) [ESO 2008].
— При гіпоглікемії (< 50 мг/дл [< 2,8 ммоль/л]) рекомендується внутрішньовенне введення декстрози чи інфузія 10–20% розчину глюкози (рівень обґрунтованості C) [ESO, 2008].
— Рекомендується рутинне раннє визначення стану водного балансу та внутрішньовенне введення рідини для підтримки нормальної осмолярності плазми крові (285–310 мосм/л), тобто еуволемії (рівень доведеності C) [SIGN118, 2010].
— Рекомендується активний моніторинг водно-електролітного балансу в пацієнтів із тяжким неврологічним дефіцитом і розладами ковтання (рівень обґрунтованості C) [ESO, 2008].
— Для відновлення водного балансу впродовж перших 24 годин від початку інсульту рекомендується 0,9% розчин NaCl (рівень обґрунтованості C) [ESO, 2008].
— Для попередження ятрогенної гіперглікемії перевагу слід надавати 0,9% розчину NaCl перед глюкозовмісними препаратами (рівень обґрунтованості В) [SIGN118, 2010].
— Гемодилюція не рекомендується як рутинний метод у хворих на гострий інсульт, за винятком випадків поліцитемії (рівень обґрунтованості А) [SIGN118, 2010].
— У пацієнтів, яким неможливо проводити внутрішньовенне введення рідини з метою підтримки нормального рівня осмолярності плазми, можна застосовувати підшкірне введення (рівень обґрунтованості С) [SIGN118, 2010].
— Гіпотензію, що виникла внаслідок гіповолемії, слід корегувати шляхом внутрішньовенного введення рідини (0,9% розчину NaCl); при низькому артеріальному тиску, який виник внаслідок зменшення серцевого викиду, рекомендується лікування аритмій чи відновлення скоротливої здатності серця (рівень обґрунтованості C) [AHA/ASA, 2007].
— Усі хворі на гострий інсульт повинні бути обстежені на предмет зниженого харчування (мальнутриції) або виявлення факторів ризику розвитку мальнутриції. Скринінг повинен повторюватися кожного тижня (рівень обґрунтованості C) [NICE, 2008].
— Хворим, які здатні адекватно харчуватися, рутинна харчова підтримка не рекомендується (рівень обґрунтованості C) [NICE, 2008].
— У хворих на гострий інсульт повинен проводитися скринінг здатності до ковтання перед тим, як будуть призначені пероральні медикаменти та проведене харчування (рівень обґрунтованості C) [NICE, 2008].
— У пацієнтів, які не можуть отримувати адекватну кількість рідини та поживних речовин per оs, рекомендується раннє встановлення назогастрального зонду (рівень обґрунтованості C) [NICE, 2008].
— Рання мобілізація, що включає активне положення в ліжку (зміна положення тіла кожні 2 години), сидіння на краю ліжка, стояння, за відсутності протипоказань, повинна ініціюватися впродовж перших 3 діб після інсульту (рівень обґрунтованості А) [SIGN118, 2010].
Коментар робочої групи
Станом на 01.05.2012 лікарський засіб нікардипін не зареєстрований в Україні.
8. Специфічне лікування в ранньому періоді ішемічного інсульту (тромболізис, антитромботичні засоби, хірургічні втручання, нейропротекція)
8.1. Антитромботичні засоби
Результати проведених досліджень свідчать про невелике, але статистично значуще зниження летальності та частоти ускладнень (включаючи повторні ішемічні події) при призначенні ацетилсаліцилової кислоти (АСК) в дозі 160325 мг на день впродовж 48 год після появи симптомів ішемічного інсульту. Переваги АСК пов’язані скоріше з профілактикою повторних інсультів у ранньому періоді, ніж з обмеженням власне неврологічних наслідків інсульту. У клінічному випробуванні рекомбінантного тканинного активатора плазміногену при інсульті Національного інституту неврологічних захворювань та інсульту (National Institute of Neurological Disorders and Stroke rt-PA Stroke Study) антитромботичні засоби (включаючи АСК) не призначалися до того, як за допомогою повторної томографії мозку через 24 год після тромболітичної терапії було виключено внутрішньочерепний крововилив. Лікування АСК також зменшує ризик тромбозів глибоких вен та тромбоемболій, але в цьому відношенні поступається за ефективністю прямим антикоагулянтам.
Наразі бракує даних клінічних випробувань щодо безпечності та ефективності інших антитромботичних засобів (як монотерапії або в комбінації з АСК) в ранньому періоді ішемічного інсульту, хоча є окремі докази безпечності та ефективності нетривалого (кілька тижнів) лікування комбінацією АСК з клопідогрелем та безпечності початку лікування комбінацією АСК плюс дипіридамол з модифікованим вивільненням у перші 24 год від початку захворювання. Особливості використання антитромботичних засобів в подальшому розглядаються в окремих клінічних настановах, але в цілому прийом антитромботичних засобів є дуже важливим для запобігання тяжким судинним подіям після інсульту чи транзиторної ішемічної атаки.
Лікування прямими антикоагулянтами (гепарин, гепарини з низькою молекулярною масою або гепариноїди) не зменшує ризик ані повторних інсультів в ранньому періоді (при будь-яких підтипах ішемічних інсультів, включаючи кардіоемболічні), ані прогресування (збільшення тяжкості симптомів) інсульту та пов’язане з істотним підвищенням частоти геморагічних ускладнень. При лікуванні прямими антикоагулянтами зростає ризик як симптомної геморагічної трансформації інфаркту мозку (особливо у хворих із тяжкими інсультами), так і позачерепних кровотеч. На ризик кровотечі, вочевидь, не має великого впливу болюс чи шлях введення (внутрішньовенно чи підшкірно). Моніторинг показників гемокоагуляції (активований частковий тромбопластиновий час — АЧТЧ) з відповідною корекцією дози антикоагулянтів, імовірно, робить лікування більш безпечним.
Результати переважної більшості досліджень свідчать про те, що лікування антикоагулянтами у великих дозах не поліпшує результатів інсульту. Попри думку деяких експертів та існуючу практику окремих центрів, немає переконливих доказів ефективності лікування антикоагулянтами хворих з ураженнями вертебробазилярного басейну, диссекцією церебральних артерій, внутрішньосерцевими або внутрішньоартеріальними тромбами. При диссекціях церебральних артерій, які спричиняють близько 2 % від загального числа інсультів та 520 % ішемічних інсультів у молодому віці (до 45 років), ефективність лікування антикоагулянтами та антиагрегантами істотно не відрізняється. Протипоказаннями для призначення антикоагулянтів у високих дозах є великий інфаркт мозку (понад 50 % басейну середньої мозкової артерії), неконтрольована артеріальна гіпертензія та ознаки тяжкої хвороби дрібних судин мозку (лейкоареоз). Зараз тривають дослідження використання антикоагулянтів як додаткового втручання при фармакологічному чи механічному тромболізисі, але до отримання їх результатів користь такого поєднання вважається недоведеною. Використання антикоагулянтів у профілактичних дозах після інсульту у хворих, які не ходять, дозволяє знизити ризик венозних тромбозів та тромбоемболій (див. розділ клінічних настанов щодо профілактики тромбозів глибоких вен та їх ускладнень).
8.1.1. Рекомендації
1. АСК (160325 мг на добу) має бути призначена усім хворим з ішемічним інсультом якомога швидше від початку захворювання, але не пізніше 48 год з моменту появи симптомів. Першу дозу АСК слід прийняти одразу після того, як за допомогою нейровізуалізації було виключено внутрішньочерепний крововилив (рівень обґрунтованості A) [ESO, 2008, RCP, 2008, AHA/ASA, 2007].
2. У хворих, яким проводили тромболітичну терапію, прийом АСК слід відтермінувати до виключення внутрішньочерепного крововиливу за допомогою повторної томографії мозку через 24 год (рівень обґрунтованості A) [RCP, 2008, CSS, 2008].
3. Перед призначенням АСК слід провести скринінг на порушення ковтання. У разі порушень ковтання (дисфагії) АСК можна вводити через зонд до шлунка або в ректальних супозиторіях (рівень обґрунтованості A) [RCP, 2008, CSS, 2008].
4. Після перших 14 днів лікування дозу АСК можна зменшити до профілактичної (75100 мг на день), яку використовують впродовж тривалого часу, доки не прийнято рішення щодо іншого антитромботичного лікування (рівень обґрунтованості A) [RCP, 2008].
5. Використання інших антитромбоцитарних засобів, включаючи комбіновані та внутрішньовенні, у ранньому періоді ішемічного інсульту не рекомендується (рівень обґрунтованості C) [ESO, 2008, AHA/ASA, 2007].
6. Якщо немає спеціальних показань (наприклад, тромбоемболія легеневої артерії), при ішемічному інсульті не рекомендується використання лікувальних доз антикоагулянтів (наприклад, внутрішньовенна інфузія гепарину) (рівень обґрунтованості A) [AHA/ASA, 2007].
7. Хворим, які відповідають критеріям відбору для тромболітичної терапії, не можна призначати лікування антикоагулянтами замість тромболізису (альтеплазе) (рівень обґрунтованості A) [AHA/ASA, 2007].
8. Лікування антикоагулянтами слід особливо обережно проводити при тяжких інсультах через значний ризик геморагічних ускладнень (зокрема, внутрішньо-черепних крововиливів) (рівень обґрунтованості A) [AHA/ASA, 2007].
9. Не рекомендується вводити антикоагулянти у будь-якій дозі впродовж перших 24 год після тромболітичної терапії (рівень обґрунтованості В) [AHA/ASA, 2007].
8.2. Тромболітична терапія
8.2.1. Внутрішньовенний тромболізис у перші 3 години від початку захворювання
Тромболітична терапія шляхом внутрішньовенного введення рекомбінантного тканинного активатора плазміногену (рТАП, альтеплазе) є єдиним видом специфічного медикаментозного лікування хворих на ішемічний інсульт з доведеною ефективністю, що схвалений у AHA/ASA, 2007 та Європейському Союзі. Тромболітична терапія рТАП асоціюється зі зниженням ризику інвалідності та поліпшенням результатів лікування інсульту в багатьох категорій хворих. Продовжуються дослідження інших засобів для тромболітичної терапії (тенектеплаза, десмотеплаза, проурокіназа тощо), але наразі використання жодного з них при ішемічному інсульті не рекомендується.
Згідно з офіційною інструкцією лікарського засобу, починати тромболізис (вводити болюс рТАП) дозволено впродовж перших 3 годин з моменту появи перших симптомів інсульту, хоча межі «терапевтичного вікна» ще остаточно не визначені. Вже майже два десятиріччя девізом спеціалістів з лікування гострого інсульту є вислів «час — це мозок!». Він підкреслює: чим швидше розпочато тромболізис, тим вища імовірність хорошого результату. При гострій вогнищевій ішемії мозку кожної хвилини гине близько 2 млн нейронів, тому ефективність лікування зменшується буквально з кожною хвилиною. Лікування хворих, які відповідають критеріям відбору, слід розпочинати якомога раніше (незалежно від того, скільки ще залишається часу в межах «терапевтичного вікна»).
Хворі з дуже тяжкими інсультами (вихідна оцінка за NIHSS > 22 балів) зазвичай мають дуже поганий прогноз незалежно від лікування, але іноді і в них можна побачити позитивний ефект від тромболітичної терапії. Оскільки при тяжкому неврологічному дефіциті (вихідна оцінка за NIHSS > 20 балів) ризик геморагічних ускладнень є достатньо високим, рішення щодо лікування рТАП слід приймати особливо обережно.
Тромболітична терапія рТАП пов’язана з підвищеним ризиком симптомних внутрішньочерепних крововиливів, які можуть призвести до смерті хворого. В оригінальному клінічному випробуванні рТАП при інсульті Національного інституту неврологічних захворювань та інсульту AHA/ASA, 2007 (дослідження National Institute of Neurological Disorders and Stroke — NINDS) частота симптомних крововиливів становила близько 6 %. Але, за даними останніх реєстрів, частота симптомних внутрішньомозкових крововиливів у сучасній клінічній практиці є нижчою. Рекомендації щодо лікування внутрішньочерепних крововиливів як ускладнення тромболітичної терапії наведено у клінічних настановах Інсультної ради Американської асоціації серця 2010 р. (див. Stroke 2010; 41: 2108-2129)
Найкращим способом уникнути геморагічних ускладнень є ретельний відбір хворих та дуже уважний догляд за ними під час та після введення рТАП (зокрема, моніторинг артеріального тиску). Критерії відбору хворих для внутрішньовенної тромболітичної терапії рТАП наведено в додатку А, а основні положення протоколу лікування, таблиця для розрахунку дози альтеплазе та прототип плану дій (листа призначень), розрахованого на молодших лікарів або середній медичний персонал, у разі проведення тромболізису наведено у додатках Б, В та Г відповідно. Описання серій клінічних випадків свідчать про можливість успішного використання тромболітичної терапії рТАП у випадках, коли на початку інсульту спостерігаються напади судом, якщо є підстави вважати, що вогнищевий неврологічний дефіцит спричинений ішемією мозку, а не має постіктальну природу (параліч Тода). Згідно з сучасними поглядами, антитромботичні засоби (антиагреганти, антикоагулянти) мають призначатися не раніше ніж за 24 год після тромболізису (після виключення внутрішньомозкової гематоми за допомогою повторної томографії голови).
Тромболітична терапія дає найкращі результати, коли її проводять у спеціалізованих центрах, в яких працює підготовлений персонал, суворо дотримуючись критеріїв відбору хворих та протоколу лікування. Широке застосування тромболітичної терапії у лікарнях, які не відповідають вимогам (підготовлений персонал, внутрішній протокол тромболізису при ішемічному інсульті, цілодобовий доступ до КТ або МРТ та лабораторії, наявність інтенсивної терапії та можливість консультації нейрохірурга), не рекомендується. Хоча отримання письмової інформованої згоди не є обов’язковою передумовою проведення тромболізису, необхідно надати хворому та/або його близьким повну інформацію щодо потенційних переваг та ризиків лікування рТАП та отримати їх дозвіл на таке лікування.
8.2.2. Внутрішньовенний тромболізис у проміжку 34,5 години від початку захворювання
Результати 3-го Об’єднаного європейського дослі-дження при гострому інсульті (European Cooperative Acute Stroke Study 3 — ECASS-3), які стали відомі у 2008 р., продемонстрували, що лікування альтеплазою може бути безпечним та ефективним у проміжку 34,5 год від початку захворювання. Важливо відзначити, що у ECASS-3 поряд із традиційними критеріями відбору, згідно з рекомендаціями Інсультної ради Американської асоціації серця (American Heart Association Stroke Council), були застосовані додаткові критерії відбору: з дослідження виключали хворих віком > 80 років, пацієнтів із вихідною оцінкою за NIHSS > 25 б., а також тих, хто приймав антикоагулянти, і тих, хто страждав від цукрового діабету та переніс інсульт у минулому. Лікування рТАП та подальше спостереження не мало істотних відмінностей від рекомендацій щодо тромболітичної терапії у перші 3 год від початку захворювання, за винятком того, що дозволялось використовувати парентеральні антикоагулянти з метою профілактики тромбозу глибоких вен у перші 24 год після тромболізису. У ECASS-3 частота симптомних внутрішньомозкових крововиливів (за визначенням ECASS-3) в групі активного лікування та у групі плацебо становила 2,4 та 0,2 % (відношення шансів 9,85, р = 0,008). Якщо використовувати визначення симптомних внутрішньомозкових крововиливів, яке запропоновано NINDS, відповідні показники склали 7,9 та 3,5 % (відношення шансів 2,38, р = 0,006). Цікаво, що використання парентеральних антикоагулянтів впродовж перших 24 год після введення рТАП у ECASS-3 не призвело до значного збільшення частоти внутрішньомозкових крововиливів порівняно з іншими клінічними випробуваннями.
У ECASS-3 частота головної кінцевої точки за ефективністю (01 б. за модифікованою шкалою Ренкіна через 90 днів) у групі альтеплазе була вищою, ніж у контрольній групі (52,4 порівняно з 45,2 %, р = 0,04), а летальність у групах істотно не відрізнялась. Таким чином, результати ECASS-3 у поєднанні з результатами інших досліджень створюють докази рівня В стосовно того, що внутрішньовенна тромболітична терапія рТАП у проміжку між 3 та 4,5 год від початку ішемічного інсульту є безпечною та може поліпшувати результати лікування в ретельно відібраних хворих. Зважаючи на це, провідні міжнародні та національні інсультні товариства внесли зміни до своїх клінічних настанов, затвердивши нові межі «терапевтичного вікна» для тромболітичної терапії — до 4,5 години від початку захворювання.
8.2.3. Внутрішньоартеріальний тромболізис та комбінована тромболітична терапія
Є небагато даних клінічних випробувань щодо ефективності внутрішньоартеріального тромболізису при ішемічному інсульті. Згідно з даними одного дослідження, внутрішньовенне застосування принаймні одного з фібринолітиків має переваги в лікуванні ретельно дібраних хворих з ішемічними інсультами внаслідок оклюзії середньої мозкової артерії. Нові дані про застосування урокінази у хворих з оклюзіями хребцевих та базилярної артерій у перші 24 год після появи симптомів та у хворих з емболічним інсультом в каротидному басейні впродовж перших 4,5 год свідчать про можливість використання внутрішньоартеріального тромболізису в повсякденній роботі. Кандидатами для цього втручання передусім можуть бути хворі на ішемічний інсульт, які доставлені у лікарню в перші кілька годин від початку, але мають протипоказання для внутрішньовенного тромболізису.
Комбіновані втручання (вживання внутрішньовенного тромболізису разом з ультразвуком, лазером, антитромботичними засобами, нейропротекторами, гіпотермією тощо) привертають багато уваги завдяки великому потенціалу покращити відновлення перфузії та захист мозку від ішемічного ураження. На жаль, ми поки не маємо доказової бази, яка б підтвердила безпечність та ефективність комбінованої реваскуляризації при ішемічних цереброваскулярних подіях. Бракує надійних доказів більшої ефективності механічних засобів порівняно з фармакологічним тромболізисом при ішемічному інсульті. Також відсутні дані, які демонструють переваги використання разом з тромболізисом нейропротекторів чи будь-яких інших засобів.
8.2.4. Рекомендації
1. Усі хворі з ішемічним інсультом, який може призвести до інвалідності, мають бути негайно розглянуті як кандидати для проведення тромболітичної терапії, якщо є можливість розпочати лікування впродовж перших 4,5 год від початку захворювання. Тромболізис впродовж перших 3 годин слід проводити тільки у хворих, які відповідають критеріям відбору (додаток 8.1) (рівень обґрунтованості A) [CSS, 2008; RCP, 2008; AHA/ASA, 2007].
2. Відбір хворих для тромболізису у проміжку 3,04,5 год після появи симптомів здійснюється з урахуванням додаткових критеріїв виключення, які використовувались у ECASS-3: вік понад 80 років, вихідна оцінка за NIHSS > 25 б., прийом антикоагулянтів, поєднання цукрового діабету та інсульту в минулому (рівень обґрунтованості B) [AHA/ASA, 2007].
3. Внутрішньовенний тромболізис рТАП має проводитись виключно у лікарнях, які відповідають певним вимогам (необхідна інфраструктура, підготовлений персонал, локальні протоколи тромболітичної терапії, подальшого спостереження та лікування ускладнень) та тільки під наглядом лікаря, який є спеціалістом з лікування інсульту та має досвід тромболітичної терапії (рівень обґрунтованості С) [NSF, 2010; RCP, 2008].
4. Усі хворі, що відповідають критеріям відбору для тромболітичної терапії, мають отримати лікування впродовж 60 хвилин з моменту доставки у лікарню (рівень обґрунтованості C) [CSS, 2008; RCP, 2008].
5. Лікування альтеплазою має проводитись згідно з рекомендаціями Американської інсультної асоціації (див. додатки 8.2, 8.3, 8.4): загальна доза — 0,9 мг/кг маси тіла (не більше 90 мг), 10 % від загальної дози (0,09 мг/кг) вводять як внутрішньовенний болюс за 1 хвилину, а 90 % (0,81 мг/кг) — шляхом внутрішньовенної інфузії впродовж 60 хвилин (рівень обґрунтованості A) [CSS, 2008; AHA/ASA, 2007; RCP, 2008].
6. Використання інших фібринолітиків (зокрема, стрептокінази) для тромболізису при ішемічному інсульті поза межами наукових досліджень не рекомендується (рівень обґрунтованості A) [AHA/ASA, 2007].
7. Тромболітична терапія може проводитися у хворих із підвищеним артеріальним тиском, якщо його вдалося знизити до потрібного рівня за допомогою антигіпертензивних засобів. Лікар має переконатися в стабільності артеріального тиску перед введенням болюсу альтеплази. У більшості хворих зі значно підвищеним артеріальним тиском не вдається його достатньо стабілізувати, щоб проводити тромболізис у межах «терапевтичного вікна» (рівень обґрунтованості B) [AHA/ASA, 2007].
8. Хворий з нападом судом на початку інсульту може вважатися кандидатом для тромболітичної терапії, якщо лікар впевнений, що неврологічний дефіцит спричинений вогнищевою ішемією мозку і не є постіктальним феноменом (рівень обґрунтованості C) [AHA/ASA, 2007].
9. В центрах, які мають достатній досвід тромболітичної терапії, тромболізис при ішемічному інсульті може проводитись у хворих, які мають відносні протипоказання. Рішення щодо доцільності тромболітичної терапії за наявності відносних протипоказань (наприклад, вік до 18 або після 80 років або ранні ознаки великого інфаркту мозку при нейровізуалізації) лікуючий лікар приймає на власний розсуд з урахуванням бажань хворого та/або його родини (рівень обґрунтованості C) [ESO, 2008; CSS, 2008].
10. У разі гострої оклюзії середньої мозкової артерії, зокрема у хворих із протипоказаннями для внутріш-ньовенного лікування рТАП, за умови перебування хворого у спеціалізованому інсультному центрі проведення внутрішньоартеріального тромболізису можливе впродовж 6 годин від початку захворювання (рівень обґрунтованості B) [ESO, 2008; AHA/ASA, 2007].
11. У разі оклюзії базилярної артерії проведення внутрішньовенного тромболізису може бути доцільним навіть після 3 годин від початку захворювання, а у частині випадків, зокрема при неефективності внутрішньовенного лікування, слід розглянути проведення внутрішньоартеріального тромболізису (рівень обґрунтованості B) [ESO, 2008].
12. Можливість проведення внутрішньоартеріального тромболізису не має бути причиною відмови від проведення внутрішньовенного лікування рТАП у хворих, які відповідають критеріям відбору (рівень обґрунтованості C) [AHA/ASA, 2007].
13. Будь-які додаткові втручання, що можуть використовуватись разом з тромболізисом, не рекомендуються (рівень обґрунтованості B) [AHA/ASA, 2007].
14. Кожному хворому, у якого немає протипоказань, через 24 години після тромболізису має бути призначена АСК (рівень обґрунтованості С) [RCP, 2008].
Додаток 8.1
Додаток 8.2
Додаток 8.3
Додаток 8.4
Коментар робочої групи
Клексан, Фраксипарин, Фрагмін — це торгові назви лікарських засобів еноксапарин, надропарин, далтепарин відповідно. Плавікс — клопідогрель, Агренокс — це торгова назва комбінованого лікарського засобу, що містить дипіридамол і кислоту ацетилсаліцилову.
8.3. Нейропротектори
Лікувальні засоби, що зменшують пошкодження, запобігають загибелі або сприяють відновленню клітин мозку після гострої ішемії або реперфузії (так звані нейропротектори), можуть зменшувати неврологічний дефіцит та поліпшувати результати лікування інсульту. Концепція нейропротекції має достатнє наукове обґрунтування, а потреба у нейропротекторах сьогодні є навіть більшою, ніж раніше. Потенційні мішені для втручань охоплюють ефекти збуджуючих амінокислот, таких як глутамат (ексайтотоксичність), трансмембранні потоки кальцію, активацію протеаз в клітинах, апоптоз, дію вільних радикалів, запалення, а також відновлення мембран і нейромедіаторних систем. В експерименті при ішемічному інсульті досліджено понад 1000 речовин, і в багатьох випадках результати були дуже обнадійливі. Однак наразі жодна з цих речовин не продемонструвала беззаперечної ефективності (тобто здатності істотно поліпшувати клінічно значущі результати лікування захворювання) у контрольованих клінічних випробуваннях при ішемічному інсульті, і, відповідно, не отримала дозволу на клінічне використання за цим показанням у розвинених країнах. Слід зазначити, що не всі потенційні нейропротектори виявилися безпечними — у деяких дослідженнях результати в групі активного лікування були гіршими, ніж у контрольній групі, або частота небажаних подій виявилася неприпустимою.
Експерти висловили чимало міркувань та припущень щодо причин негативних результатів клінічних досліджень нейропротекторів. Більшість клінічних випробувань нейропротекторів були невеликими та/або мали певні вади дизайну (хоча були й достатньо великі та методологічно якісні дослідження, щоб дати надійні результати). Складність ішемічного каскаду (зокрема, багатовекторна дія деяких сполук) робить малоймовірною результативність будь-якого засобу, який діє лише на одну з його ланок. Можливо, нові лікарські засоби та більш досконалий дизайн клінічних випробувань дозволять отримати докази того, що нейропротекція є корисною при лікуванні ішемічного інсульту. Потенційні нейропротектори можуть використовуватись як самостійно, так і разом з іншими втручаннями, зокрема фармакологічною або механічною тромболітичної терапією. Важливими перевагами нейропротекторів є можливість розпочинати лікування на догоспітальному етапі та відсутність потреби у швидкому проведенні нейровізуалізації. Згідно з метааналізом даних клінічних досліджень, до найбільш перспективних засобів належать цитиколін та нейротрофічні фактори (такі як Церебролізин® (пептидний препарат із мозку свиней) та гранулоцитарний колонієстимулючий фактор); ці засоби є безпечними, їх ефективність зараз вивчається у великих клінічних випробуваннях.
Наявність безпечного та ефективного нейропротектора принесла б користь більшості хворих на інсульт в усьому світі. Однак, щоб мати підстави рекомендувати втручання з ефектами нейропротекторів для лікування хворих з ішемічним інсультом, необхідно провести великий обсяг досліджень. Нещодавно були оприлюднені нові рекомендації STAIR, спрямовані на подальше вдосконалення наукових досліджень у цій царині. Триваючі клінічні випробування потенційних нейропротекторів вже найближчим часом дозволять отримати нові дані щодо їх безпечності та ефективності.
8.3.1. Рекомендації
На теперішній час жодні втручання або засоби з потенційними властивостями нейропротектора (здатністю зменшувати пошкодження або стимулювати відновлення мозку) не мають доведеної ефективності (поліпшення клінічно значущих результатів лікування ішемічного інсульту) і не можуть бути рекомендовані для клінічного використання поза межами наукових досліджень (рівень обґрунтованості A) [AHA/ASA, 2007; ESO, 2008; RCP, 2008; NSF, 2010].
8.4. Хірургічні втручання при ішемічному інсульті
8.4.1. Відкриті хірургічні втручання
При великих інфарктах мозку, що охоплюють більше половини басейну середньої мозкової артерії та супроводжуються значним набряком та дислокацією мозку (так звані інфаркти зі злоякісним перебігом, або «злоякісні інфаркти»), прогноз хворих є дуже поганим: при консервативному лікуванні летальність сягає 80 %. В таких випадках, щоб уникнути критичного підвищення внутрішньочерепного тиску та значної дислокації мозку, було запропоновано робити широку декомпресійну трепанацію черепа — гемікраніектомію. Метааналіз трьох клінічних випробувань підтвердив, що при «злоякісних» інфарктах гемікраніектомія дозволяє значно зменшити летальність та дещо поліпшити функціональні результати лікування порівняно з консервативним лікуванням. Переваги хірургічного лікування були документовані у хворих, які відповідали критеріям відбору (вік 1860 років, інфаркт > 50 % басейну середньої мозкової артерії, пригнічення свідомості, тяжкий неврологічний дефіцит [NIHSS > 15 б.] та можливість провести втручання в перші 48 год від початку захворювання). Зважаючи на результати цих клінічних випробувань та досвід багатьох центрів, де проводять таке втручання, у випадках тяжкого інсульту внаслідок оклюзії середньої мозкової артерії слід замовити негайну консультацію нейрохірурга.
Вентрикулостомія та хірургічна декомпресія вважаються методом вибору при лікуванні великих інфарктів мозочку з мас-ефектом, хоча їх ефективність не підтверджено даними клінічних випробувань. Рекомендується виконувати операцію раніше, ніж з’являться ознаки дислокації та вклинення стовбуру мозку. Результати лікування можуть бути дуже хорошими навіть у хворих, які перед операцією були в комі.
Є дуже мало даних щодо ефективності екстреної каротидної ендартеректомії при ішемічному інсульті. У цілому це втручання вважається надто небезпечним і не проводиться за інших умов, крім виникнення гострого інсульту одразу після ендартеректомії. Раптове відновлення або збільшення кровотоку може сприяти розвитку набряку мозку або спричинити геморагічну трансформацію, зокрема при великих ішемічних вогнищах. З іншого боку, час, що потрібен для діагностики ураження артерій та підготовки операційної, обмежує потенційну користь такого втручання. Однак є і повідомлення про хороші результати каротидної ендартеректомії в перші 24 год від початку ішемічного інсульту в каротидному басейні у хворих із тяжким стенозом внутрішньої сонної артерії та легким або помірним неврологічним дефіцитом.
Невідкладний екстракраніально-інтракраніальний анастомоз не поліпшує результати лікування при ішемічному інсульті і істотно збільшує ризик внутрішньочерепних крововиливів. Разом з тим є окремі повідомлення про хороші результати екстреного накладання анастомозу та мікрохірургічної емболектомії в середній мозковій артерії. У літературі мало даних про результати невідкладних хірургічних втручань при оклюзіях артерій вертебробазилярного басейну.
8.4.2. Ендоваскулярні хірургічні втручання
Ендоваскулярні втручання є одним із найбільш перспективних способів лікування гострої ішемії, і в цій області ведуться активні дослідження. З метою усунення оклюзії позачерепної або внутрішньочерепної артерії, що спричинила ішемічний інсульт, було запропоновано декілька ендоваскулярних втручань: невідкладна ангіопластика зі стентуванням, механічне руйнування та/або видалення тромбу (тромбектомія) тощо. У більшості випадків механічна тромбектомія проводилася разом із внутрішньовенним або внутрішньоартеріальним тромболізисом. Вже схвалено використання декількох засобів для механічної тромбектомії при ішемічному інсульті (MERCI, PENUMBRA, SOLITAIRE), але їх ефективність остаточно ще не доведено. Застосування ендоваскулярних процедур обмежене високоспеціалізованими центрами, де є необхідні ресурси та кваліфіковані фахівці, оскільки тільки за таких умов ці втручання можуть бути достатньо безпечними.
8.4.3. Рекомендації
1. У хворих віком від 1860 років зі «злоякісними інфарктами» в басейні середньої мозкової артерії та тяжким неврологічним дефіцитом (NIHSS > 15 б.) за відсутності протипоказань рекомендується проводити хірургічну декомпресію (гемікраніектомію) в перші 48 год від початку захворювання (рівень обґрунтованості A) [ESO, 2008; RCP, 2008; NSF, 2010].
2. На даний час ефективність та безпечність невідкладної каротидної ендартеректомії та інших екстрених відкритих хірургічних втручань у хворих з ішемічним інсультом є недоведеними. Хірургічні втручання, пов’язані з підвищеним ризиком, можуть негативно вплинути на результати лікування захворювання, тому їх проведення у широкій клінічній практиці не рекомендується (рівень обґрунтованості С) [AHA/ASA, 2007].
3. Хоча знаряддя для механічної тромбектомії, такі як тромбекстрактор MERCI, забезпечують високий процент реканалізації церебральних артерій, їх ефективність щодо поліпшення функціональних результатів лікування при ішемічному інсульті остаточно не доведено. Чи є корисними інші види ендоваскулярного лікування ішемічного інсульту, поки невідомо. Потрібні додаткові дослідження, щоб з’ясувати роль невідкладних ендоваскулярних втручань у гострому періоді ішемічного інсульту (рівень обґрунтованості B) [AHA/ASA, 2007; NSF, 2010].
9. Діагностика та лікування неврологічних ускладнень
9.1. Лікування набряку мозку та внутрішньочерепної гіпертензії при інсультах
9.1.1. Передумови
Набряк головного мозку зазвичай розвивається в перші 24–48 годин від початку інсульту, досягає свого максимуму на 3-тю — 5-ту добу і починає повільно регресувати на 7–8-му добу [2, 3]. У деяких хворих з інфарктом в басейні середньої мозкової артерії набряк мозку і внутрішньочерепна гіпертензія можуть призвести до грижового випинання та дислокації найбільш рухомих ділянок мозку, що спричиняє компресію стовбурових структур [2, 3]. Розвиток великого півкульного інсульту внаслідок повної чи значної оклюзії середньої мозкової артерії обов’язково супроводжується розвитком масивного набряку мозку і значним підвищенням внутрішньочерепного тиску (ВЧТ) [ESO, 2008]. Помірний набряк мозку може розвиватися під час реперфузії після успішного тромболізису з використанням rtPA (альтеплазе).
Набряк мозку є основною причиною підвищення ВЧТ, проте його точна діагностика й оцінка ступеня вираженості пов’язана зі значними труднощами. Розвиток клінічно-значимого набряку мозку, як правило, супроводжується зниженням рівня свідомості і оцінки за Шкалою ком Глазго. У таких хворих необхідно запідозрити розвиток внутрішньочерепної гіпертензії й пов’язаних з нею ускладнень. У хворих з тяжким перебігом інсульту саме величина ВЧТ є інтегральним показником вираженості набряку, тяжкості ускладнень та ефективності лікування. Крім того, ВЧТ можна точно виміряти з використанням сучасних засобів моніторингу. У хворих з порушенням свідомості за типом коми діагностику внутрішньочерепної гіпертензії слід при можливості проводити шляхом визначення тиску в шлуночках мозку, паренхімі мозку (інвазивний моніторинг) чи тиску ЦСР при проведенні люмбальної пункції.
При виникненні симптомів підвищення ВЧТ необхідно в першу чергу усунути больовий синдром, нормалізувати температуру тіла, виключити гіпоксемію, гіперкапнію, виражене підвищення АТ, попередити повороти голови для запобігання компресії вен шиї [ESO, 2008].
9.1.2. Рекомендації із застосування осмотично активних речовин
— При симптомах гострого підвищення ВЧТ застосовують осмотично активні розчини: манітол (25–50 г з інтервалом у 3–6 годин), гіпертонічні розчини NaCl (10% по 50–100 мл) (рівень обґрунтованості В) [ESO, 2008; 1, 4].
— При внутрішньочерепній гіпертензії більш ефективне повторне застосування невеликих доз манітолу (0,25–0,5 г/кг) струменево чи болюсно, ніж постійна крапельна інфузія сумарної дози (рівень обґрунтованості В) [AHA/ASA, 2007].
— При застосуванні осмотично активних речовин осмолярність плазми не повинна перевищувати 320 мосм/л (рівень обґрунтованості C) [4]. У нормі рівень осмолярності крові становить 285–310 мосм/л.
— Застосування гліцеролу знижує короткострокову летальність, проте не впливає на довгострокове виживання хворого (рівень обґрунтованості В) [NSF, 2010]. Препарат для парентерального використання (для зниження ВЧТ) в Україні не зареєстрований.
9.1.3. Рекомендації щодо інших методів лікування набряку мозку та внутрішньочерепної гіпертензії
— Для швидкого зниження ВЧТ можуть бути застосовані внутрішньовенні анестетики: барбітурати (тіопентал натрію), пропофол та бензодіазепіни (сибазон, мідазолам) — болюсно чи у вигляді постійної інфузії (рівень обґрунтованості C) [ESO, 2008].
— Застосування внутрішньовенних анестетиків вимагає моніторингу АТ та встановлення контролю дихальних шляхів (інтубація трахеї).
— У хворих із підвищеним ризиком клінічно значимого набряку легень рекомендують обмежити використання гіпоосмолярних розчинів (та потенційно гіпоосмолярних, таких як 5% глюкоза) як для в/в, так і для ентерального введення (рівень обґрунтованості C) [ESO, 2008].
— Обмеження введення ізоосмолятних та гіперосмолярних розчинів (менше добових потреб у рідині) не рекомендується (рівень обґрунтованості C) [AHA/ASA, 2007; ESO, 2008].
— Кортикостероїди не рекомендовані для рутинного застосування при лікуванні набряку мозку й внутрішньочерепної гіпертензії (рівень обґрунтованості A) [AHA/ASA, 2007; ESO, 2008].
— Фуросемід не рекомендований для рутинного застосування при лікуванні набряку мозку і внутрішньочерепної гіпертензії (рівень обґрунтованості C).
— Гіпервентиляція не рекомендована для рутинного застосування при лікуванні внутрішньочерепної гіпертензії (рівень обґрунтованості B) [AHA/ASA, 2007; ESO, 2008].
Висновки
Основне лікування клінічно значимого набряку мозку, який супроводжується підвищенням ВЧТ, спрямоване на покращення відтоку крові з порожнини черепа, зниження потреби мозку в кисні та виведенні надлишку цереброспінальної рідини. Ефективність застосування діуретиків у лікуванні набряку мозку поки що не отримала переконливих доказів.
9.2. Епілептичні напади
Упродовж перших діб після інсульту у 2–23 % пацієнтів виникають епілептичні напади (така розбіжність у частоті виникнення залежить від дизайну проведених досліджень) [AHA/ASA, 2007]. Реальний/справжній ризик виникнення епілептичних нападів тяжіє до меншого відсотка. Найчастіше епілептичні напади виникають впродовж перших 24 годин після розвитку інсульту та є зазвичай фокальними, з вторинною генералізацією чи без неї.
Ризик виникнення епілептичних нападів високий у пацієнтів із вогнищами кіркової локалізації, з тяжким інсультом, геморагічним інсультом. Повторні епілептичні напади виникають у 20–80 % пацієнтів. Ризик виникнення ранніх післяінсультних епілептичних нападів (ті, що трапляються впродовж перших 2 тижнів після інсульту) коливається від 2 до 33 %. Щодо пізніх післяінсультних епілептичних нападів (виникають після 2-го тижня з моменту інсульту), цей ризик коливається від 3 до 67 % [2]. Ймовірність виникнення пізніх епілептичних нападів більша в пацієнтів із попередньо існуючою деменцією [1]. Епілептичний статус виникає рідко.
Немає доказів на користь призначення проти-епілептичних засобів з метою первинної профілактики епілептичних нападів після інсульту. У разі виникнення епілептичних нападів слід застосовувати стандартні протиепілептичні засоби (ПЕЗ), опираючись на загальні принципи лікування епілептичних нападів, з урахуванням супутніх захворювань та лікарських засобів, що вже приймає пацієнт.
Рекомендації
— Призначення антиконвульсантів рекомендоване для лікування та попередження повторного виникнення післяінсультних епілептичних нападів. Вибір антиконвульсантів у пацієнтів з інсультом слід проводити відповідно до загальних принципів лікування епілептичних нападів (рівень обґрунтованості В) [AHA/ASA, 2007; ESO, 2008; NSF, 2010]
— Не рекомендоване призначення з профілактичною метою протиепілептичних засобів пацієнтам з інсультом, у яких ще не було епілептичних нападів (рівень обґрунтованості С) [AHA/ASA, 2007; ESO, 2008].
9.3. Післяінсультний біль
Хронічний біль після інсульту трапляється/виникає у 11–55 % пацієнтів, проте цей біль не завжди пов’язаний з інсультом — мова може йти про попередньо існуючі хронічні больові синдроми, що більш «яскраво» себе проявляють після інсульту. Найбільш частими формами хронічного післяінсультного болю є біль у ділянці плечового суглоба, біль внаслідок високого м’язового тонусу, центральний післяінсультний біль, головний біль напруження. У одного пацієнта може бути декілька форм післяінсультного болю. Тривалий біль після інсульту спричиняє зниження якості життя, погіршує настрій, сон, соціальну активність.
Центральний післяінсультний біль (ЦПІБ) — синдром, що виникає у 2–8 % пацієнтів після ГПМК, характеризується невропатичним болем (пекучий, гострий чи колючий біль, що посилюється при торканні больової ділянки, впливі на неї водою, під час рухів), а також порушенням чутливості у частинах тіла відповідно до ураженої внаслідок ГПМК ділянки головного мозку.
Доказова база щодо ефективності тих чи інших засобів для лікування ЦПІБ — недостатня. В одному з досліджень показано, що амітриптилін істотно знижує ЦПІБ порівняно з плацебо (доза поступово збільшувалась: від 12,5 мг двічі на день впродовж 1 дня, потім 25 мг двічі на день впродовж 1 дня, далі — 25 мг вранці та 50 мг ввечері). Проте додаткове дослідження не показало ефективність амітриптиліну, що застосовувався з профілактичною метою у пацієнтів із таламічним інсультом. Необхідно зважати на відомий кардіотоксичний вплив трициклічних антидепресантів (особливо при застосуванні в значній дозі) та знаходити баланс між цією побічною дією та знеболювальним ефектом, особливо в пацієнтів похилого віку. В Кокранівському огляді показано, що трициклічні антидепресанти та венлафаксин дуже ефективні при невропатичному болю. Є підстави вважати, що й інші антидепресанти можуть бути ефективними при лікуванні ЦПІБ, проте кількість досліджень недостатня.
Згідно з Кокранівським оглядом, докази ефективності антиконвульсантів при невропатичному болю слабкі. Єдине дослідження щодо лікування ЦПІБ у пацієнтів з інсультом, включене у цей огляд, показало невелику ефективність карбамазепіну у зниженні ЦПІБ. При невропатичному болю можуть застосовуватись ламотриджин і габапентин, вони добре переносяться, проте можуть знижувати когнітивні функції.
У Кокранівському огляді подана інформація щодо 7 невеликих досліджень, у яких трамадол показав свою ефективність при невропатичному болю. Жодне з цих досліджень не фокусується на пацієнтах з інсультом, тому не ясно, наскільки можна поширювати ці дані на пацієнтів з інсультом, які мають ЦПІБ.
Хірургічна та хімічна симпатектомія ще потребують доказів ефективності.
Також можуть бути запропоновані інші форми лікування, що знижують біль — крізьшкірна нейростимуляція, акупунктура чи психологічна допомога, проте доказовість цих методів обмежена.
Високий м’язовий тонус у відновному періоді може негативно впливати на повсякденну активність та погіршувати якість життя. ЛФК, лікування положенням, релаксуюча терапія, шинування застосовуються повсюдно, проте доказова база недостатня.
Доведено, що фармакотерапія ботулотоксином ефективно знижує тонус м’язів у руках і ногах, але функціональна користь вивчена менше. Пероральні препарати застосовуються з обмеженням через їх побічну дію.
Біль у ділянці плеча виникає у 30–40 % пацієнтів з інсультом (принаймні один раз такий біль відчули 72 % пацієнтів з інсультом), які мають руховий та чутливий дефіцит в руці та поганий функціональний статус, та асоціюється з поганим функціональним прогнозом. З метою профілактики можуть застосовуватись пасивні рухи. У Кокранівському систематизованому огляді не знайдено достатньої кількості даних для рекомендації ортезів при сублюксації плечового суглоба. Вважається, що цей біль не пов’язаний із підвивихом плечового суглоба. Роль положення верхньої кінцівки та маніпуляцій/поводження з нею залишаються невизначеними. Проте слід дотримуватись бережного поводження з ураженою верхньою кінцівкою під час транспортування пацієнта, проведення реабілітаційних занять тощо; фіксування її під ліктьовий суглоб та передпліччя (в т.ч. за допомогою бандажу, косиночної пов’язки) для запобігання мікротравматизації та розтягнення капсули плечового суглоба під час знаходження пацієнта у вертикальному положенні (сидіння, ходьба). Щодо лікування болю в плечовому суглобі рекомендоване проведення гімнастики (активної і пасивної, обов’язково обережної, з м’яким обережним розтягуванням) та мобілізуючих методик (з акцентом на зовнішню ротацію та абдукцію). Проведені дослідження не показали переваг стрепінгу (наклеювання стрічок на ділянку суглоба для його фіксації) плечового суглоба чи внутрішньосуглобових ін’єкцій triamcinolone (синтетичний кортикостероїд). За даними англійських дослідників, ефективною може бути високоінтенсивна крізьшкірна електронейростимуляція. За відсутності ефекту від нефармакологічного лікування — призначення нестероїдних протизапальних засобів.
Рекомендації
1. Пацієнтам з інсультом, які мають центральний післяінсультний біль (ЦПІБ), рекомендовані трициклічні антидепресанти (наприклад, спробувати спочатку амітриптилін, за умов його неефективності — інший трициклічний антидепресант чи венлафаксин) (рівень обґрунтованості B) чи антиконвульсанти (наприклад, габапентин, ламотриджин, карбамазепін) (рівень обґрунтованості С) [ESO, 2008; RCP, 2008; AHA/ASA, 2007; NSF, 2010].
2. Якщо ЦПІБ не піддається контролю впродовж кількох тижнів, пацієнта слід спрямувати до спеціалізованого центру, що займається больовими синдромами (переконливих обґрунтувань немає, рекомендовано виходячи з інтересів хворого та на підставі практичного досвіду — Good practice point) [AHA/ASA, 2007; СSS, 2008; NSF, 2010; ESO, 2008].
3. З метою попередження виникнення болю в плечовому суглобі рекомендована стратегія захисту плечового суглоба з мінімізацією його травматизму — обережне поводження з паретичною кінцівкою (рівень обґрунтованості В) [RCP, 2008; СSS, 2008], у вертикальному положенні застосування підтримуючого бандажу для запобігання мікротравматизації плечового суглоба (рівень обґрунтованості А) [RCP, 2008; СSS, 2008].
4. Біль у плечовому суглобі слід лікувати за допомогою гімнастики (пасивної та активної, обережної), мобілізуючих методик (з акцентом на зовнішню ротацію та абдукцію плеча) (рівень обґрунтованості B) [СSS, 2008]; за відсутності ефекту залучити високоінтенсивну крізьшкірну електронейростимуляцію (рівень обґрунтованості А) та/чи нестероїдні протизапальні засоби (рівень обґрунтованості С) [RCP, 2008].
10. Профілактика, діагностика та лікування соматичних ускладнень
10.1. Легеневі ускладнення, нозокоміальна пневмонія
У хворих з інсультами, особливо в тих, хто перебуває в коматозному стані, найбільш частими і найбільш грізними є легеневі ускладнення [AHA/ASA, 2007; ESO, 2008]. Вони значно погіршують перебіг інсульту, і хворі мають менші шанси на повне одужання.
Легеневі ускладнення можна розділити на декілька категорій:
— Нейрогенні порушення функції легень:
- порушення ритму дихання;
- нейрогенний набряк легень.
— Інфекційні ускладнення:
- гнійний ендобронхіт;
- нозокоміальна пневмонія (НП).
— Інші (вторинні, багатофакторні порушення):
- аспірація шлункового вмісту;
- кардіогенний набряк легень;
- ателектази;
- синдром гострого пошкодження легень (СГПЛ) і його найтяжча форма — гострий респіраторний дистрес-синдром (ГРДС).
Серед легеневих ускладнень найчастішими і найбільш грізними є інфекційні ускладнення.
Гнійний ендобронхіт
Гнійний ендобронхіт є найбільш частим з інфекційних ускладнень з боку дихальної системи, що розвивається мало не в усіх хворих з тяжкими інсультами, які потребують проведення подовженої ШВЛ. Проте клінічне значення цього ускладнення залишається невизначеним. Прогресування гнійного ендобронхіту може ускладнюватись розвитком ателектазів (внаслідок закупорки бронхів харкотинням) та підвищенням ризику розвитку нозокоміальної пневмонії. Адекватне видалення харкотиння шляхом санації трахеї за допомогою катетера, а також проведення санаційної бронхоскопії є ефективними методами в запобіганні ателектазування.
Нозокоміальна пневмонія (НП)
Бактеріальна (нозокоміальна) пневмонія є найбільш вагомим серед ускладнень у хворих з інсультом і може значно погіршувати прогноз захворювання [1, 6]. Нозокоміальною (внутрішньогоспітальною) вважають пневмонію, симптоми якої з’являються не раніше ніж через 48 год після госпіталізації. Ранньою є НП, яка розвивається упродовж 5 діб з моменту госпіталізації; пізньою — та, що розвивається після зазначеного терміну. Окремо виділяють вентилятор-асоційовану пневмонію, яка розвивається через 48 год після початку проведення ШВЛ.
Причини та фактори ризику НП
Уже понад 20 років відомо, що найчастішими причинами НП при інсульті є мікроаспірація вмісту ротоглотки або аспірація шлункового вмісту [4]. Аспіраційна пневмонія найчастіше розвивається на самих ранніх етапах інсульту. Частота розвитку як мікроаспірації, так і масивної аспірації зростає пропорційно ступеню вираженості порушень ковтання, довільного кашлю, а також глибині порушення свідомості. Встановлення контролю над дихальними шляхами у коматозних хворих шляхом інтубації трахеї значно зменшує ризик виникнення клінічно значимої аспірації. Іншим методом профілактики аспірації є проведення заходів зі зменшення інтенсивності нудоти та профілактика блювоти (попередження перерозтягнення шлунка, попере-дження виникнення гіпоксії тощо).
Крім того, розвитку НП сприяє викликана інсультом імуносупресія, яка напряму пов’язана з його тяжкістю [2, 5]. У країнах, що розвиваються, частота розвитку НП корелює також із якістю дотримання асептики-антисептики, наявністю достатньої кількості одноразових витратних матеріалів.
Раніше виділяли так звану гіпостатичну пневмонію, якою вважали пневмонію, що розвивається у «прикутих до ліжка» хворих. Впровадження інвазивних діагностичних методів виявлення збудників, таких як бронхоальвеолярний лаваж, щіткова біопсія, дозволили встановити, що у багатьох пацієнтів із симптомами «гіпостатичної пневмонії» характерні рентгенологічні симптоми могли бути обумовлені іншими причинами. Найчастіше ними були ателектази, СГПЛ. Згідно з сучасними класифікаціями, діагноз гіпостатичної пневмонії не встановлюють.
Критерії діагностики НП
Для покращення діагностики НП розроблені клінічні та бактеріологічні критерії встановлення діагнозу. Клінічні критерії:
— Наявність інфільтрату на рентгенограмі.
— Лейкоцитоз > 11 х 109/л чи лейкопенія < 3,5 х 109/л.
— Температура > 38 °С.
— Гнійне харкотиння, виділення збудника.
Проте чутливість та специфічність цих критеріїв недостатня для ефективної ранньої діагностики НП. Так, гнійний ендобронхіт у поєднанні з ателектазом буде супроводжуватись більшістю з перерахованих симптомів. Точність діагностики НП вкрай важлива, тому що гнійний ендобронхіт не впливає на виживання хворих, тоді як НП різко підвищує летальність [6]. Вплив НП на виживання залежить не тільки від адекватності антибіотикотерапії, а й від часу початку її застосування.
Більш надійними, але все ще малодоступними є бактеріологічні методи дослідження — щіткова біопсія та бронхоальвеолярний лаваж. Діагностичним порогом встановлення діагнозу пневмонії при проведенні бактеріологічних посівів з матеріалу отриманого шляхом щіткової біопсії є 104 колонієформуючих одиниць, а з матеріалу бронхоальвеолярного лаважу — 103 колонієформуючих одиниць. Чутливість та специфічність даних методик дуже високі — понад 90 %, проте на встановлення діагнозу з їх використанням необхідно витратити близько 48 годин. Така затримка з початком антибіотикотерапії може суттєво впливати на ефективність лікування. Тому фарбування за Грамом рідини, отриманої під час проведення бронхоальвеолярного лаважу, і проведення бактеріоскопії зразка є ефективним методом ранньої діагностики НП та вибору стартового антибіотика.
Оскільки бактеріологічні критерії впроваджено далеко не в кожній клініці нашої країни, то в діагностиці НП слід скрупульозно оцінювати клінічні критерії. Не останню роль відіграє кількість та якість проведення рентгенологічних досліджень. У провідних зарубіжних клініках в рутинну практику увійшло щоденне проведення оглядової рентгенографії органів грудної клітки у коматозних хворих, які перебувають на подовженій ШВЛ. Лікарі ВІТ більш ніж упевнені, що потенційна користь від своєчасного встановлення діагнозу НП значно переважає сумнівний ризик променевого навантаження. Характерно, що знімки роблять з самого ранку для того, щоб лікар-рентгенолог разом з лікарями ВІТ проаналізував рентгенограми хворого у динаміці ще до обговорення його стану та призначення лікування. Така сумісна оцінка та обговорення рентгенограм значно підвищує діагностичну значимість методу.
Лікування нозокоміальної пневмонії (рівень обґрунтованості С) [NSF, 2010]
Основні лікувальні заходи повинні бути спрямовані на:
— корекцію газового складу крові за рахунок розправлення ателектазованих ділянок;
— проведення адекватної антибіотикотерапії.
Методами корекції газового складу крові є регулярні бронхоскопії, застосування ПТКВ та вентиляції у положенні на животі. Всі ці методи можуть сприяти підвищенню ВЧТ, тому повинні застосовуватись лише за виконання певних умов. У хворих, які перебувають у коматозному стані, необхідно з першої доби починати проводити процедури, спрямовані на запобігання розвитку ателектазування і поліпшення відділення харкотиння (масаж, регулярні перевертання хворих). З накопиченням слизу і харкотиння в порожнині рота і глотки необхідно проводити їх аспірацію із застосуванням електровідсмоктувача.
У клінічну практику лікування НП необхідно впровадити деескалаційну антибіотикотерапію, яка характеризується призначенням найбільш потужних антибіотиків самого широкого спектра одразу після встановлення діагнозу пневмонії [6].
Критерієм адекватності антибіотикотерапії є активність антибіотика стосовно всіх збудників, які виділяються при посіві.
Методи профілактики нозокоміальної пневмонії можна розділити на декілька груп [6]:
— Гігієнічні заходи (найбільш ефективні):
- дотримання асептики при санації трахеї тощо;
- миття та дезінфекція рук після контакту з хворим чи потенційно інфікованим матеріалом.
— Попередження потрапляння збудників шляхом мікроаспірації:
- ентеральне харчування шляхом постійної інфузії чи невеликими порціями болюсно, але з обов’язковим контролем резидуального об’єму шлунка;
- надання припіднятого положення головному кінцю хворого;
- постійна аспірація секрету з ротоглотки навколо манжетки інтубаційної трубки.
— Попередження потрапляння збудників шляхом транслокації з кишечника:
- раннє збалансоване ентеральне харчування;
- селективна деконтамінація кишечника (ефективність остаточно не доведена).
— Попередження потрапляння збудників у дихальні шляхи з повітря та дихальної суміші:
- використання «закритих аспіраційних систем»;
- використання дихальних фільтрів-теплообмінників.
Ефективність антибіотикопрофілактики не доведена ні на загальному масиві неврологічних та нейрохірургічних хворих, ні при інсульті зокрема [AHA/ASA, 2007, ESO, 2008]. Так, в одному з рандомізованих контрольованих досліджень призначення левофлоксацину по 500 мг впродовж 3 діб лише погіршувало результати лікування [6]. Навіть потужна антибіотикопрофілактика, із застосуванням а/б широкого спектра, неспроможна запобігти розвитку НП. Вона лише призводить до того, що якщо НП виникає, то мікроорганізми вже будуть резистентними до цих антибіотиків. Тому потужну антибіотикотерапію слід зарезервувати до можливого виникнення НП.
10.2. Запобігання тромбоемболічним ускладненням у хворих, що перенесли інсульт
Тромбоемболія легеневої артерії є безпосередньою причиною близько 10 % смертельних випадків після інсульту, і це ускладнення може бути виявлене приблизно у 1 % хворих, які перенесли інсульт. Ризик венозних тромбоемболічних ускладнень у хворих, госпіталізованих із інсультом, становить 20–50 %. Джерелом емболів, що потрапляють до легеневої артерії, зазвичай є тромби, які утворюються у венах нижньої кінцівки (частіше тієї, яка стала паралізованою внаслідок інсульту) або таза. На додаток до спричинювання тромбоемболії легеневої артерії, яка становить загрозу життю, тромбоз глибоких вен нижньої кінцівки з клінічними проявами уповільнює одужання, відновлення та реабілітацію після інсульту. Додаткові одвічно наявні фактори ризику можуть підвищувати небезпеку венозного тромбозу та тромбоемболії легеневої артерії, а тому на них слід звернути увагу в кожного хворого, який потрапляє у лікарню з гострим інсультом. Ризик тромбозу глибоких вен найвищий серед знерушених хворих та хворих похилого віку, які перенесли тяжкий інсульт.
Запровадження заходів для запобігання тромбозу глибоких вен після інсульту є покажчиком якості роботи інсультних центрів у США. Можливі підходи зниження ризику тромбозу глибоких вен включають ранню мобілізацію, профілактичне призначення антитромботичних засобів, використання зовнішнього стискаючого приладдя. Загальновизнаним є твердження про те, що рання мобілізація та належна гідратація знижують ризик тромбозу глибоких вен та тромбоемболії легеневої артерії.
Рекомендації стосовно профілактичного застосування антикоагулянтної терапії для запобігання венозним тромбоемболічним ускладненням у хворих з інсультом дещо суперечливі. У керівних положеннях Королівської колегії лікарів стверджується, що профілактичне лікування антикоагулянтами не слід застосовувати як узвичаєну практику.
Антикоагулянти призначаються для запобігання тромбозу глибоких вен та тромбоемболії легеневої артерії серед тяжко хворих. Значна частина даних на підтримку застосування антикоагулянтів отримана з клінічних випробувань, у яких ці лікарські засоби використовувалися у хворих, що були знерухомлені внаслідок причин інших, ніж інсульт. Метааналіз показав ефективність цих засобів і у хворих з інсультом. Хоча підшкірне введення гепарину — нефракціонованого чи низької молекулярної маси — може запобігти венозним тромбоемболічним ускладненням, ця сприятлива дія може бути переважена підвищеним ризиком внутрішньочерепного крововиливу. Американська асоціація інсульту та Шотландська міжколегіальна мережа розробників керуючих положень рекомендують профілактичне застосування нефракціонованого гепарину (НФГ), або гепарину низької молекулярної маси (ГНММ), або гепариноїду для запобігання венозним тромбоемболічним ускладненням у знерушених хворих, що перенесли інсульт. Профілактичне застосування НФГ або ГНММ показане у хворих із факторами що обумовлюють високий ризик венозних тромбоемболічних ускладнень — тривалим знерухомленням, ожирінням, діабетом, раніше перенесеним інсультом. У хворих з додатковими факторами ризику тромбоемболічних ускладнень слід зіставити очікувану користь від профілактичного антикоагулянтного лікування НФГ або ГНММ з ризиком серйозних геморагічних ускладнень [CSS, 2008]. Втім, ризик серйозних геморагічних ускладнень при профілактичному застосуванні антикоагулянтів зазвичай відносно невисокий.
Суттєвої різниці в ефективності та безпечності між НФГ та ГНММ не було виявлено. Хоча в одному дослідженні, що порівнювало застосування ГНММ (еноксапарину) та НФГ для запобігання тромбоемболічним ускладненням у хворих, які перенесли інсульт, частота тромбоемболічних ускладнень була дещо нижчою у хворих, яким вводився ГНММ, порівняно з хворими, які отримували НФГ, при рівній частоті ускладнень, висновки цього дослідження були не зовсім коректними, оскільки в дослідженні порівнювалися нееквівалентні дозування: еноксапарин застосовувався у дозі 40 мг на добу, що призначена для хворих з високим ризиком тромбоемболічних ускладнень, тоді як НФГ — у дозі 5000 МО двічі на добу, що зазвичай призначена для хворих з помірним ризиком.
Для довготривалого лікування зазвичай застосовуються пероральні антикоагулянти, такі як варфарин. Згідно з результатами одного дослідження, низькоінтенсивне лікування варфарином ефективне в запобіганні венозним тромбоемболічним ускладненням. Ацетилсаліцилова кислота може бути ефективною при наявності протипоказань до застосування антикоагулянтів, хоча безпосередніх порівнянь з антикоагулянтами не проводилось. Хворим, у яких трапилася тромбоемболія легеневої артерії з тромбів у нижній кінцівці, при наявності протипоказань до призначення антитромботичних лікарських засобів може бути необхідним встановлення фільтру в нижню порожнисту вену.
Досвід застосування зовнішнього стискання вен нижніх кінцівок, наприклад еластичних панчіх або пристроїв для переміжного пневматичного стискання, доволі обмежений. Хоча панчохи, що забезпечують зовнішнє стандартизоване стискання кінцівок ефективні в запобіганні венозним тромбоемболічним ускладненням у хірургічних хворих, їх ефективність після інсульту не доведена. Застосування зовнішнього стискання може бути доцільним у лікуванні хворих, яким не можуть бути призначені антикоагулянтні засоби.
Рекомендації
— У хворих, які вважаються схильними до високого ризику тромбоемболічних ускладнень, слід оцінити доцільність та оптимальні способи профілактичного лікування (рівень обґрунтованості В) [CSS, 2008].
— Своєчасно розпочата адекватна гідратація сприяє запобіганню не тільки тромбоемболічним, але і численним іншим ускладненням у гострому та підгострому періодах інсульту (рівень обґрунтованості С) [CSS, 2008; ESO, 2008].
— Рання мобілізація доцільна у всіх хворих з не надто тяжким інсультом і сприяє запобіганню не тільки тромбоемболічним, але і численним іншим ускладненням у гострому та підгострому періодах інсульту (рівень обґрунтованості С) [AHA/ASA, 2007; CSS, 2008].
— Застосування антикоагулянтів не повинно бути рутинним у всіх хворих на інсульт (рівень обґрунтованості А) [CSS, 2008].
— Підшкірне введення антикоагулянтів рекомендоване у лікуванні знерушених хворих та при наявності додаткових факторів ризику тромбоемболічних ускладнень (рівень обґрунтованості А). Оптимальний час для початку такого лікування не визначений [AHA/ASA, 2007; CSS, 2008; ESO, 2008].
— Ацетилсаліцилова кислота може бути застосована для запобігання тромбозу глибоких вен, але менш ефективна, ніж антикоагулянти (рівень обґрунтованості А) [AHA/ASA, 2007; CSS, 2008].
— Застосування пристроїв для переміжного пневматичного стискання рекомендоване для лікування хворих, яким не можуть бути призначені антикоагулянти (рівень обґрунтованості В) [AHA/ASA, 2007; CSS, 2008; ESO, 2008].
10.3. Пролежні: класифікація, оцінювання ризику, профілактика та лікування
10.3.1. Міжнародна класифікація пролежнів за тяжкістю
Міжнародну класифікацію пролежнів було запропоновано у спільних настановах щодо профілактики та лікування пролежнів Європейської експертної комісії з пролежнів та Національної експертної комісії з пролежнів [E&NPUAP, 2009]. Автори настанов досягли згоди щодо виокремлення чотирьох рівнів пошкодження тканин, які позначаються як стадії (I, II, III або IV, див. рис. 1). Стадії пролежнів визначаються виходячи з уявлення, що прогресування відбувається в напрямку від стадії I до стадії III або IV, хоча на практиці так буває не завжди.
Стадія I: Стійке почервоніння ділянки шкіри
Цілісність шкіри не порушено, але на ній є обмежена зона стійкого почервоніння (еритема), яке найчастіше знаходиться над виступаючою кісткою. Ця зона може бути болючою, твердішою або м’якішою, теплішою або прохолоднішою за оточуючі ділянки шкіри. Поява такої зони зазвичай вказує на високий ризик пролежнів.
Стадія II: Часткова втрата товщі шкіри
Часткова втрата товщі шкіри, яка виглядає як пласка відкрита виразка з вологим або сухим рожевим дном рани без некротичних мас та ознак ураження більш глибоких тканин. Також може мати вигляд пухиря, заповненого серозною або серозно-кров’янистою рідиною. Цю категорію не слід використовувати для описання розривів шкіри, опіків, дерматиту, мацерації або саден.
Стадія III: Повна втрата товщі шкіри
Ураження всієї шкіри (дерма та підшкірна жирова тканина). Глибина рани залежить від анатомічних особливостей частини тіла, де вона розташована (наприклад, пролежні на вухах, затилку або щиколотках можуть бути пласкими, а на сідницях — дуже глибокими). В рані можна побачити підшкірний жир, але не видно і не відчуваються на дотик кістки, сухожилля чи м’язи. Можуть бути кармани й тунелі та/або некротичні маси, але останні дозволяють бачити глибину ушкодження шкіри.
Стадія IV: Глибоке ураження тканин (видно м’язи або кістки)
Ураження тканин таке глибоке, що можна побачити (або відчути на дотик) кістки й сухожилля та/або м’язи. Можуть бути некротичні маси або струп, часто бувають кармани та тунелі. Глибина рани залежить від анатомічних особливостей частини тіла, де вона розташована, зокрема там, де немає підшкірної (жирової) клітковини, рани можуть бути неглибокими. Поширення на м’язи, сухожилля, фасції різко збільшує ризик остеомієліту.
10.3.1.1. Рекомендації
1. Для документування тяжкості пролежнів слід використовувати класифікацію з підтвердженою валідністю (рівень обґрунтованості C) [E&NPUAP, 2009].
2. Слід навчити всіх медичних працівників розрізняти пролежні та інші види ран (венозні, артеріальні чи невропатичні виразки, розриви шкіри, інтертриго), а також належним чином використовувати класифікацію у разі пролежнів різної локалізації (рівень обґрунтованості C) [E&NPUAP, 2009].
3. Не слід використовувати міжнародну класифікацію пролежнів за тяжкістю для описання інших видів ран, крім пролежнів, зокрема ран на слизових оболонках (рівень обґрунтованості C) [E&NPUAP, 2009].
4. Не слід використовувати класифікацію «у зворотний бік»: тобто пролежень ІІІ стадії, коли загоюється, не стає пролежнем ІІ стадії, його слід називати пролежнем ІІІ стадії, що загоюється (рівень обґрунтованості С) [RCP, 2008].
10.3.2. Оцінювання ризику
В усіх медичних закладах має бути політика зменшення ризику пролежнів, яка включає чіткі рекомендації щодо оцінювання ризику з урахуванням особливостей хворих, що перебувають у цьому закладі. Рекомендації мають містити інформацію про цілі оцінювання, терміни першого та повторних оцінювань, інструменти, які слід використовувати, способи документування результатів оцінювання ризику та дії, які слід виконати залежно від оцінки.
Останнім часом було проведено багато епідеміологічних досліджень, результати яких дозволили краще зрозуміти фактори ризику розвитку пролежнів. Впродовж останніх трьох десятиліть було створено кілька інструментів та шкал для оцінювання ризику, головна мета яких полягає у виокремленні хворих з високим ризиком появи пролежнів. Оцінювання ризику має ґрунтуватися на висновках цих досліджень та результатах оцінювання за шкалами, але слід також враховувати, що ця область постійно розвивається і ще не досягнуто загального консенсусу в цих питаннях.
10.3.2.1. Рекомендації
1. В усіх медичних закладах слід запровадити систему оцінювання ризику пролежнів у хворих на інсульт (рівень обґрунтованості C) [E&NPUAP, 2009].
2. Слід навчити всіх медичних працівників, як правильно та надійно оцінювати ризик пролежнів та документувати результати усіх оцінювань ризику пролежнів (рівень обґрунтованості В) [E&NPUAP, 2009].
3. Слід використовувати комплексний підхід до оцінювання ризику (з урахуванням оцінки за шкалою Браден, ретельного огляду шкіри та клінічних міркувань), який дозволяє виявити хворих з високим ризиком появи пролежнів (рівень обґрунтованості C) [E&NPUAP, 2009].
4. Під час оцінювання ризику слід враховувати фактори, які можуть суттєво впливати на ризик пролежнів, зокрема нутритивний стан (рівень гемоглобіну та альбуміну, харчування, вага), кровообіг в тканинах (цукровий діабет, нестабільність гемодинаміки, низький артеріальний тиск погіршують мікроциркуляцію та оксигенацію), зволоження шкіри (сухість та надмірна вологість збільшують ризик пролежнів), загальний стан здоров’я та похилий вік, а також порушення чутливості та температуру тіла (рівень обґрунтованості В) [E&NPUAP, 2009].
5. Комплексне оцінювання ризику слід провести після госпіталізації та повторювати так часто, як це необхідно, згідно зі станом хворого (рівень обґрунтованості C) [E&NPUAP, 2009].
6. Використання шкали Браден (додаток 10.1) може допомогти виокремити серед хворих з інсультом тих, у кого великий ризик пролежнів. Слід розробити та запровадити план дій щодо хворих з високим ризиком розвитку пролежнів (рівень обґрунтованості C) [E&NPUAP, 2009].
10.3.3. Профілактика пролежнів
10.3.3.1. Рекомендації щодо догляду за шкірою
1. Якщо це можливо, повертайте пацієнта таким чином, щоб він не лежав на ділянці тіла, де зберігається почервоніння шкіри (рівень обґрунтованості C) [E&NPUAP, 2009].
2. Не використовуйте масаж для профілактики пролежнів, а також уникайте сильного тертя шкіри, яке може викликати мікротравми та/або запалення, особливо в літніх людей (рівень обґрунтованості В) [E&NPUAP, 2009].
3. Суха шкіра є незалежним фактором ризику розвитку пролежнів. Щоб зменшити ризик пошко-дження шкіри, не протирайте шкіру спиртовими розчинами, які роблять шкіру сухою, і використовуйте засоби для пом’якшення та зволоження шкіри, такі як олії, креми, лосьйони (рівень обґрунтованості В) [E&NPUAP, 2009].
4. Уникайте надмірного зволоження та перегріву ділянок шкіри, оскільки ці чинники погіршують захисні властивості рогового шару (рівень обґрунтованості С) [E&NPUAP, 2009].
10.3.3.2. Рекомендації щодо харчування
1. Оскільки недостатня вгодованість є модифікованим фактором ризику пролежнів, у кожного хворого з підвищеним ризиком пролежнів слід оцінити нутритивний (харчовий) стан та ризик мальнутриції (рівень обґрунтованості С) [E&NPUAP, 2009].
2. Кожному хворому із поганим нутритивним станом та високим ризиком пролежнів слід надати нутритивну допомогу, яка охоплює більш детальне обстеження із залученням дієтолога, оцінювання харчових потреб, порівняння споживання нутрієнтів з потребою у них, розробку плану дій щодо усунення браку нутрієнтів, моніторинг та повторне оцінювання нутритивного статусу (рівень обґрунтованості С) [E&NPUAP, 2009].
3. Кожному хворому з поганим нутритивним станом та ризиком пролежнів щоденно рекомендується споживати не менше 3035 ккал та 1,251,5 г білка на 1 кг ваги тіла та щонайменше 1 мл рідини на 1 споживану ккал (наприклад, хворому з вагою 80 кг на день необхідно не менше 2400–2700 ккал, 100–120 г білка та 2,4–2,7 л рідини). Оскільки багато хворих із поганим нутритивним станом та ризиком пролежнів не можуть задовольнити всі харчові потреби при звичайному харчуванні, слід розглянути використання змішаних харчових добавок з високим вмістом білка та інших цінних нутрієнтів (зокрема, крізь назогастральний зонд чи гастростому) між прийомами звичайної їжі (рівень обґрунтованості А) [E&NPUAP, 2009].
10.3.3.3. Рекомендації щодо положення тіла
1. Зміна положення тіла проводиться задля зменшення тривалості та рівня тиску на найбільш вразливі ділянки тіла (рис. 2). Сильний тиск на кісткові виступи впродовж короткого часу та несильний тиск впродовж тривалого часу є однаково шкідливими, тому слід приділяти увагу як силі, так і тривалості тиску.
2. У кожного хворого з підвищеним ризиком пролежнів слід розробити графік зміни положення тіла (рівень обґрунтованості А) [E&NPUAP, 2009].
3. Частота зміни положення тіла залежить від особливостей хворого (стан здоров’я та шкіри, вік, ризик пролежнів) та від якостей поверхні (здатність перерозподіляти тиск), на якій він лежить. У хворих з інсультом, прикутих до ліжка, слід забезпечити часте повертання, щоб запобігти пошкодженню шкіри (рівень обґрунтованості А) [E&NPUAP, 2009].
4. Уникайте стискання, тертя та зсуву шкіри під час зміни положення, використовуйте допоміжні засоби. Хворого слід піднімати, а не тягнути під час зміни положення тіла (рівень обґрунтованості С) [E&NPUAP, 2009].
5. У разі високого ризику пролежнів хворого слід повертати кожні 1–2 години на 3045°, укладаючи на один чи другий бік, спину або живіт (якщо немає протипоказань). Уникайте положень, у яких виникає значний тиск на вразливі ділянки тіла, зокрема на боці під кутом 90° або напівсидячи (рівень обґрунтованості С) [E&NPUAP, 2009].
6. Коли хворий сидить, слід обирати таке положення, яке є зручним, не обмежує рухів та зменшує тиск на м’які тканини. Використовуйте підставку для ніг, якщо ноги хворого не торкаються землі. Оскільки в положенні сидячи площа опори є порівняно невеликою, тиск і, відповідно, ризик появи пролежнів збільшується, тому час сидіння без полегшення тиску має бути обмеженим (рівень обґрунтованості С) [E&NPUAP, 2009].
7. Усім, хто бере участь у догляді за хворим, слід надати інформацію про важливість зміни положення тіла для профілактики пролежнів, а також пояснити, як правильно змінювати положення тіла та які положення дозволяють запобігти появі пролежнів (рівень обґрунтованості С) [E&NPUAP, 2009].
10.3.4. Оцінювання пролежнів
1. Оцінювання пролежнів слід зробити на початку (після госпіталізації) й принаймні щотижня в подальшому, документуючи результати (описання, фотографування). Щотижневі огляди дозволять слідкувати за перебігом та вчасно виявити неявні ускладнення і необхідність змін у лікуванні (рівень обґрунтованості С) [E&NPUAP, 2009].
2. Під час оцінювання пролежнів слід описувати їх локалізацію, стадію, розмір, характер дна та країв рани, ексудат, некротичні маси, струп, запах, наявність грануляцій та/або епітелізації (рівень обґрунтованості С) [E&NPUAP, 2009].
3. Після оцінювання пролежня слід визначити, чи відповідним є його лікування, та за потреби внести необхідні зміни (рівень обґрунтованості С) [E&NPUAP, 2009].
4. Слід проводити моніторинг загоєння пролежня, використовуючи спеціальні інструменти (наприклад, Pressure Ulcer Scale for Healing або Bates-Jensen Wound Assessment) або клінічні міркування (про загоєння свідчать зменшення кількості ексудату та розміру рани, поліпшення дна рани) (рівень обґрунтованості С) [E&NPUAP, 2009].
5. У випадку погіршення стану хворого (підйом температури тіла) або появи кровотечі чи болю слід негайно оглянути пролежні й повідомити лікаря (рівень обґрунтованості С) [E&NPUAP, 2009].
10.3.5. Окремі рекомендації щодо лікування пролежнів
10.3.5.1. Рекомендації щодо харчування
1. Слід оцінити нутритивний статус кожного хворого з пролежнями на початку лікування та повторювати оцінювання в подальшому, особливо за відсутності позитивної динаміки з боку пролежнів (рівень обґрунтованості С) [E&NPUAP, 2009].
2. З метою оцінювання нутритивного статусу та ви-значення необхідних втручань хворого з пролежнями, якщо це можливо, має оглянути дієтолог. Оцінювання нутритивного статусу включає вимірювання ваги та її втрати (> 5 % за 30 днів або > 10 % за 180 днів), можливість їсти самостійно, адекватність харчування та можливості для усунення дефіциту нутрієнтів. Слід забезпечити достатню калорійність (3035 ккал/кг/добу) харчування, відповідне споживання білків (1,251,5 г/кг/добу), рідини, вітамінів та мінералів. Розгляньте призначення додаткового харчування (збагачені харчові добавки) між вживанням звичайної їжі (рівень обґрунтованості В) [E&NPUAP, 2009].
10.3.5.2. Рекомендації щодо положення тіла
1. Не дозволяйте хворому перебувати у положенні, коли є прямий тиск на пролежні (рівень обґрунтованості С) [E&NPUAP, 2009].
2. Змінюйте положення тіла не рідше ніж раз на 2–3 години незалежно від якості матрацу. Уникайте положень, у яких під тиском будуть ділянки тіла, де ще зберігається почервоніння (рівень обґрунтованості С) [E&NPUAP, 2009].
3. Збільшуйте обсяг рухів та мобільність, наскільки це можливо (рівень обґрунтованості С) [E&NPUAP, 2009].
4. Не використовуйте кільцеподібні засоби для підкладання та не наближайте впритул до пролежнів джерела тепла (радіатори, обігрівачі, грілки тощо), оскільки це може викликати мацерацію шкіри та уповільнювати загоєння (рівень обґрунтованості С) [E&NPUAP, 2009].
10.3.5.3. Рекомендації щодо промивання
1. Пролежні та шкіру навколо них слід промивати кожного разу, коли робиться заміна пов’язки (рівень обґрунтованості С) [E&NPUAP, 2009]
2. Чисті пролежні промивають фізіологічним розчином або питною водою. Пролежні з ознаками інфекції, некрозу, струпу слід промивати розчинами протимікробних засобів під тиском, щоб очистити рану (рівень обґрунтованості С) [E&NPUAP, 2009]
3. Слід робити відповідну дезінфекцію, щоб запобігти зараженню та поширенню інфекції (рівень обґрунтованості С) [E&NPUAP, 2009].
10.3.5.4. Рекомендації щодо очищення рани
1. Видалення нежиттєздатних тканин з дна чи країв пролежнів слід проводити, коли дозволяє стан хворого. Методи, серед яких можна обирати, нараховують хірургічне видалення, аутоліз, ферментне та механічне очищення (рівень обґрунтованості С) [E&NPUAP, 2009].
2. Хірургічне очищення зазвичай використовують за наявності флуктуації, абсцесу, флегмони, сепсису. Коли немає ургентних показань, слід використовувати аутоліз, ферментне або механічне очищення рани (рівень обґрунтованості С) [E&NPUAP, 2009].
3. Хірургічні втручання слід проводити особливо обережно в разі імунодефіциту, недостатності кровопостачання до нижніх кінцівок, лікування антикоагулянтами та відсутності антибіотикотерапії у септичних хворих (рівень обґрунтованості С) [E&NPUAP, 2009].
4. Під час та після очищення пролежня слід забезпечити відповідне знеболення. В подальшому рану слід оглядати щодня, щоб вчасно виявити ознаки інфекції та інші ускладнення (рівень обґрунтованості С) [E&NPUAP, 2009].
10.3.5.5. Рекомендації щодо пов’язок
1. Пов’язки є провідним компонентом лікування пролежнів. Пов’язку обирають залежно від стану дна пролежня та шкіри навколо нього. Слід розробити графік накладання та заміни пов’язок, дотримуючись рекомендацій виробників щодо способу використання й частоти заміни пов’язок (рівень обґрунтованості С) [E&NPUAP, 2009].
2. Оберіть таку пов’язку, яка дозволить підтримувати дно пролежня вологим, а шкіру навколо нього сухою (рівень обґрунтованості С) [E&NPUAP, 2009].
3. Слід надавати перевагу сучасним пов’язкам (гідроколоїди, гідрогелі, гідроволокна, піни, плівки, альгінати, м’який силікон), які створюють кращі умови для загоєння пролежнів порівняно з традиційними матеріалами (марля, марля з парафіном, прості наклейки) (рівень обґрунтованості С) [RCP, 2008].
10.3.5.6. Рекомендації щодо діагностики та лікування інфекцій у хворих із пролежнями
1. Гостре інфекційне ускладнення пролежня слід підозрювати в разі появи ознак запалення (почервоніння, підвищення температури та/або інфільтрація шкіри навколо пролежня, біль), крепітації, флуктуації або гнійного ексудату. Можлива також поява ознак системної інфекції (підвищення температури тіла, слабкість, збільшення лімфатичних вузлів), у осіб старечого віку — дезорієнтації та/або делірію. Рекомендується зробити мікробіологічне дослідження мазка з дна пролежня (ексудат, гній або струп як матеріал використовувати не слід) (рівень обґрунтованості С) [E&NPUAP, 2009].
2. У лікуванні зусилля слід спрямовувати на поліпшення реактивності хворого, профілактику поширення інфекції або потрапляння до рани нової інфекції, очищення рани (видалення некротичних тканин, дренування, застосування місцевих антисептиків). Слід уникати місцевого застосування антибіотиків через алергічні реакції, формування нечутливості та місцеве подразнення, яке уповільнює загоєння. У разі неприємного запаху або анаеробної інфекції місцево можна застосовувати метронідазол (рівень обґрунтованості С) [E&NPUAP, 2009].
3. Хворим з клінічними ознаками поширення інфекції (флегмона, остеомієліт, системна запальна реакція, сепсис) слід призначити системні антибіотики (рівень обґрунтованості С) [E&NPUAP, 2009].
10.4. Порушення дефекації та сечовипускання
Порушення випорожнення кишечника та сечовипускання є поширеним явищем безпосередньо після інсульту. Нетримання сечі є одним із найкращих прогностичних маркерів у хворих на інсульт.
Основним заходом у хворих із нетриманням сечі і калу є ретельний догляд. Встановлення постійного внутрішнього сечового катетера необхідно уникати через підвищення вірогідності уроінфекції. Спеціальна тренувальна програма для сечового міхура (Bladder training) може допомогти пацієнту в подальшому бути більш незалежним у побуті.
Рекомендації
— Всі пацієнти з інсультом повинні бути обстежені в приймальному відділенні на предмет нетримання та затримки сечовипускання (без або з парадоксальним нетриманням сечі) і нетримання або затримки калу (рівень обґрунтованості С) [NICE, 2008].
— Пацієнти з інсультом і нетриманням сечі повинні бути обстежені спеціально навченим персоналом з використанням стандартної функціональної оцінки (рівень доведеності В) [AWMA PU, 2007].
— Рекомендується ретельний сестринський догляд за пацієнтами з нетриманням сечі і калу в гострому періоді інсульту (рівень обґрунтованості С) [NICE, 2008].
— Слід уникати встановлення постійного сечового (уретрального) катетера щонайменше в перші 48 годин, якщо тільки затримка сечі не залишається. В іншому випадку постійний сечовий катетер необхідно перевіряти щоденно і видалити настільки швидко, наскільки це можливо (рівень обґрунтованості С) [AWMA PU, 2007].
— У пацієнтів з нетриманням сечі рекомендується використовувати тренувальні програми для сечового міхура (рівень обґрунтованості С) [AWMA PU, 2007].
— Рекомендується використовувати портативний ультразвук, як кращий неінвазивний метод для ви-значення кількості залишкової сечі як фактора ризику висхідної інфекції або виявлення травматичного ушкодження уретри катетером (рівень обґрунтованості С) [AWMA PU, 2007].
— Необхідно забезпечити ретельний догляд за функцією кишечника у хворих із персистуючою затримкою або нетриманням калу (рівень обґрунтованості А) [AWMA PU, 2007].
11. Мобілізація та рання реабілітація
Навіть за наявності оптимального інсультного відділення, що включає можливість проведення тромболітичної терапії, менше одного з трьох пацієнтів повністю відновлюється після інсульту. Завданням реабілітації є можливість дати людям з обмеженими можливостями досягти і підтримати на оптимальному рівні фізичні, інтелектуальні, психологічні та/або соціальні функції. Прихильники ранньої терапії, посилаючись на дані функціональної нейровізуалізації та дослідження на тваринах, вважають ранній період інсульту найбільш важливим для початку реабілітації. Ранній початок реабілітації є ключовим компонентом у відділенні для лікування гострих порушень мозкового кровообігу. Множинні безпосередні ускладнення інсульту (тромбоз глибоких вен, пролежні, формування контрактур, затримка стулу і гіпостатична пневмонія) пов’язані з недостатньою кількістю рухів, і, відповідно, мобілізація є фундаментальним компонентом ранньої реабілітації. Мобілізація — це дії, що дозволяють пацієнтові рухатися в ліжку, сідати, вставати і по можливості ходити.
Ключовою характеристикою відділення для лікування гострих порушень мозкового кровообігу (інсульту) є реабілітація, яка здійснюється мультидисциплінарною бригадою. До складу цієї команди входить лікар-фахівець з інсульту, штат медичних сестер, лікар ЛФК, ерготерапевт, логопед. Правильна організація якісної допомоги може бути значно більш важливою, ніж абсолютний час проведення терапії. При порівнянні спеціалізованої інсультної і звичайної реабілітаційної бригади, яка працює у звичайному відділенні, спеціалізована бригада досягає кращих результатів зі значно меншою кількістю годин терапії. Для тих пацієнтів, у яких неможливе проведення активної реабілітації, рекомендовано виконання пасивних рухів з метою профілактики контрактур і компресійного болю.
Метааналіз показав, що продовження реабілітації впродовж 1 року після інсульту знижує ризик функціональних погіршень і покращує активність у повсякденному житті. Втручання, що включають ерготерапію, ЛФК та мультидисциплінарний підхід, можуть створити оптимальну модель даної служби.
Велика інтенсивність реабілітації, особливо час, витрачений на активність у повсякденному житті (ADL), пов’язана з кращими функціональними результатами.
Рекомендації
— Для всіх пацієнтів з інсультом рекомендується направлення в інсультне відділення для отримання повноцінної мультидисциплінарної реабілітації (рівень обґрунтованості А) [ ESO, 2008; NSF, 2010; AHA/ASA, 2007].
— Всі пацієнти, госпіталізовані з гострим інсультом, повинні бути оцінені фахівцем з реабілітації якомога раніше (рівень обґрунтованості А) [RCP, 2008], особливо в перші 24–48 годин (рівень обґрунтованості С) [4]. Мультидисциплінарна бригада повинна розробити всебічний індивідуальний реабілітаційний план з урахуванням тяжкості інсульту та потреб і завдань пацієнта (рівень обґрунтованості С) [СSS, 2008; 4].
— Мультидисциплінарна бригада може складатися з лікаря, медсестри, лікаря ЛФК, ерготерапевта, логопеда, психолога, пацієнта, членів його сім’ї або осіб, які доглядають за пацієнтом (рівень обґрунтованості А) [AHA/ASA, 2007].
— Клініцисти повинні використовувати стандартизовані, валідні оціночні шкали для оцінки функціонального статусу і післяінсультних порушень (додаток 1) (рівень обґрунтованості С) [AHA/ASA, 2007; RCP, 2008; СSS, 2008].
— Пацієнти повинні бути мобілізовані якомога раніше і якомога частіше (рівень обґрунтованості В [NSF, 2010; RCP, 2008], переважно впродовж 24 годин від початку інсульту, якщо немає протипоказань (додаток 1.2) до мобілізації).
— Впродовж перших 3 діб після розвитку інсульту перед кожною мобілізацією пацієнта необхідно моніторувати артеріальний тиск, сатурацію кисню і пульс (рівень обґрунтованості С) [1].
— Пацієнтам із гострим інсультом слід приймати положення сидячи якомога раніше (як тільки це дозволить їх стан) (рівень обґрунтованості С [RCP, 2008].
— Кожен пацієнт з обмеженням пересування повинен бути оцінений фахівцем для визначення найбільш підходящих та безпечних методів мобілізації (рівень обґрунтованості В) [RCP, 2008].
— Мультидисциплінарна бригада повинна збиратися регулярно (як мінімум один раз на тиждень) і обговорювати прогрес і проблеми в стані пацієнта, реабілітаційні цілі, лікувальні та реабілітаційні заходи і планування його виписки (рівень В) [3] (рівень обґрунтованості С) [NSF, 2010]. Індивідуальний реабілітаційний план повинен регулярно оновлюватися на підставі оцінки стану пацієнта (рівень обґрунтованості С) [СSS, 2008].
— Мультидисциплінарна бригада повинна регулярно спілкуватися з пацієнтом, його родичами або особами, які доглядають за пацієнтом, для залучення їх до процесу лікування та реабілітації, постановки мети і планування виписки (рівень обґрунтованості С) [NSF, 2010].
— Рекомендований якомога ранній початок реабілітації (рівень обґрунтованості С) [ESO, 2008], як тільки буде досягнута стабілізація основних вітальних функцій (гемодинаміки, дихання) (рівень обґрунтованості А) [AHA/ASA, 2007].
— Після оцінки стану особи, які доглядають пацієнта, та персонал повинні пройти навчання з використання відповідних методів мобілізації і технік пересування індивідуально для кожного пацієнта (GPC) [NSF, 2010]. Навчання проводиться членами мультидисциплінарної бригади.
— Пацієнт повинен отримувати реабілітаційне лікування, інтенсивність і тривалість якого повинні бути засновані на індивідуальному реабілітаційному плані і відповідати потребам та рівню толерантності пацієнта до навантажень (рівень обґрунтованості А) [СSS, 2008; RCP, 2008].
— Пацієнтам з тяжким та середньої тяжкості інсультом, які готові до реабілітації (як тільки буде досягнута стабілізація основних вітальних функцій) і мають реабілітаційні завдання, треба надати можливість брати участь у реабілітації (рівень обґрунтованості А) [СSS, 2008].
— Пацієнтам з тяжким та середньої тяжкості інсультом треба проводити регулярну оцінку для визначення їх потреб у реабілітаційних заходах (рівень обґрунтованості С) [СSS, 2008].
— Пацієнт після інсульту повинен отримувати згідно з індивідуально розробленим планом мінімум 1 годину роботи з кожним фахівцем мультидисциплінарної бригади, мінімум 5 разів на тиждень з урахуванням індивідуальних потреб і толерантності до навантажень (рівень обґрунтованості А) [СSS, 2008; RCP, 2008], тривалість терапії залежить від тяжкості інсульту (рівень обґрунтованості С) [СSS, 2008].
— Рекомендується збільшувати тривалість та інтенсивність реабілітації з урахуванням індивідуальних потреб і толерантності до навантажень (рівень обґрунтованості В) [ESO, 2008].
— Мультидисциплінарна бригада повинна сприяти постійному застосуванню навичок, отриманих в ході реабілітації, у повсякденному активності пацієнта, пацієнтам повинна бути надана можливість, і їх необхідно заохочувати практикувати ці навички так багато, як тільки можливо, з урахуванням толерантності до навантажень (рівень обґрунтованості А) [RCP, 2008].
— Реабілітаційне лікування повинно включати повторення та інтенсивне використання завдань так часто, як можливо з урахуванням індивідуальних потреб і толерантності до навантажень, які змушують пацієнта опановувати необхідні моторні навички, що залучають кінцівки (рівень обґрунтованості А) [СSS, 2008].
— Рання виписка пацієнта з інсультного відділення додому можлива у разі інсульту легкого або середнього ступеня тяжкості за умови подальшого продовження реабілітації мультидисциплінарною бригадою в амбулаторних умовах (рівень обґрунтованості А) [ESO, 2008].
— Всі пацієнти з будь-якими наслідками інсульту, які не були госпіталізовані, повинні піддаватися всебічній оцінці в амбулаторних умовах на предмет функціональних порушень (оцінка когнітивних функцій, скринінг депресії, скринінг здатності до пересування), та оцінки для визначення реабілітаційного потенціалу (рівень обґрунтованості А [RCP, 2008] переважно впродовж 2 тижнів (рівень обґрунтованості С) [AHA/ASA, 2007, RCP, 2008; СSS, 2008].
Додаток 11.1

Додаток 11.2

12. Порушення ковтання та харчування при інсульті
12.1. Дисфагія
Дисфагія зустрічається у 64–90 % пацієнтів (варіабельність даних залежить від характеру та часу проведення досліджень щодо виявлення дисфагії). Може відбуватись порушення однієї чи кількох фаз ковтання: оральної, оральної підготовчої, фарингеальної чи стравохідної, найчастіше в пацієнтів з інсультом порушується орофарингеальна фаза. Частота дисфагії вища в гострому періоді інсульту і знижується до 15 % упродовж 3 місяців. У багатьох пацієнтів з дисфагією відновлення функції ковтання відбувається впродовж першого тижня, а в більшості випадків покращання настає до кінця другого тижня.
Дисфагія пов’язана з виникненням таких ускладнень, як аспіраційна пневмонія, дегідратація та недостатнє харчування. Аспірація виникає у 22–42 % пацієнтів згідно з відеофлюороскопічним дослідженням. 1/3–1/2 пацієнтів після інсульту з тих, що можуть мати аспіраційний синдром, мають приховану аспірацію (пацієнти не мають таких ознак аспірації, як кашель, поява «вологого» голосу тощо після ковтання). Наявність аспірації підвищує ризик виникнення пневмонії (аспіраційної). Недоїдання виявляється у 7–15 % пацієнтів при находженні у лікарню та у 22–35 % пацієнтів на 2-му тижні госпіталізації. Серед пацієнтів, які потребують тривалої реабілітації, відсоток осіб з недостатнім харчуванням може сягати 50 %.
Для запобігання виникненню вторинних ускладнень дисфагії важливо обстежувати кожного пацієнта з гострим інсультом на наявність порушень ковтання, а за умови їх виявлення — провести подальшу повну оцінку. Скринінг дисфагії необхідно здійснити якомога швидше з моменту поступлення пацієнта, щойно це дозволить його стан, але не пізніше 24 годин із моменту госпіталізації. Скринінгові тести на наявність дисфагії були розроблені для використання не спеціалістами (тобто це може бути не логопед, а медсестра) інсультної команди, які, проте, мають обов’язково пройти навчання з використання цих тестів. Щодо вибору скринінгових тестів, декілька системних обзорів сходяться у думці щодо цінності тестів з раннім приліжковим оцінюванням дисфагії. Проте 3 систематичних огляди не в змозі дійти висновку, яку саме батарею тестів із приліжкового оцінювання дисфагії слід використовувати. Деякі тести, що використовуються сьогодні в світі: Massey Bedside Swallow Screen [4] (2002); Timed Test of Swallowing and Questionnaire [1] (1998); Screening Tool for Acute Neurological Dysphagia (STAND) (2007); Standardized Swallowing Assessment (SSA) [5] (1993, 1996, 1997; 2001); Gugging Swallowing Screen (GSS) (2007) [8]; Toronto Bedside Swallowing Screening Test (TOR-BSST©) [3] (2009) — два останні, запропоновані нещодавно, показали високу чутливість, специфічність, відмінну міжрейтерську надійність (тобто результати оцінювання дисфагії за допомогою цієї батареї тестів різними фахівцями не відрізнялись).
Скринінг дисфагії за допомогою зазначених тестів проводиться біля ліжка пацієнта і полягає в:
— оцінці рівня свідомості пацієнта і його здатності взяти участь в обстеженні, оцінці ступеня постурального контролю (пацієнт здатний сидіти в вертикальному положенні — за підтримки чи самостійно). Порушення свідомості і постурального контролю унеможливлюють подальший скринінг, пацієнт має вигодовуватись непероральним шляхом до наступного скринінгу;
— якщо пацієнт здатний активно брати участь в обстеженні і може за підтримки знаходитись сидячи в вертикальному положенні, процедура також має включати:
- спостереження за гігієною ротової порожнини, за контролем оральної секреції;
- спостереження за проявами порушень ротоглоткової фази ковтання (задуха, кашель, «вологий» голос тощо);
- оцінку якості голосу пацієнта, функції м’язів ротової порожнини, чутливості ротової порожнини та начальних відділів глотки і здатність кашляти;
- за необхідності (для перевірки аспіраційного ризику) — тести водою для перевірки функції ковтання, такі, наприклад, що включені у тести TOR-BSST, GSS, чи тест з 3 чайними ложками води.
Останній полягає в тому, що пацієнту пропонують випити по черзі 3 чайні ложки води і після кожної випитої ложки спостерігають за появою ознак аспірації (кашель, зміна звучання голосу тощо). Якщо ознаки аспірації не з’явились — пропонують випити воду зі склянки, далі — спробувати проковтнути їжу різної текстури (додаток 12.1). Чутливість цього тесту > 70 % і специфічність 22–66 % у виявленні аспірації. Комбінація приліжкових скринінгових тестів з контролем сатурації кисню підвищує чутливість зазначених ковтальних тестів (87–100 %) [6]. Цілком можливо, що пацієнти з «німою/прихованою» аспірацією «успішно» виконають тест з водою і аспірація у них триватиме. Проте всім пацієнтам, в т.ч. й тим, які успішно пройшли скринінг дисфагії, необхідно щоденно проводити моніторинг порушень ковтання впродовж усього періоду госпіталізації.
За умови виявлення порушень ковтання під час скринінгу подальшу повну оцінку ковтання із уточненням характеру (яка саме фаза ковтання порушена і чому) та тяжкості порушень здійснює фахівець — логопед. Повна клінічна оцінка ковтання (наприклад, запропонована ASHA — www.asha.org чи Logemann (1999) [2]) містить детальний контроль фаз ковтання, руховий та чутливий статус органів ротової порожнини, аналіз даних анамнезу тощо (додатки 12.2, 12.3); і, якщо це буде визнано за необхідне після клінічної оцінки, додаткове інструментальне обстеження — відеофлюороскопічна оцінка ковтання (золотий стандарт) та/чи фіброоптичне ендоскопічне дослідження ковтання. На підставі цього пропонується індивідуальна терапевтична стратегія та компенсаторні прийоми для запобігання аспірації.
Ентеральне годування показане, якщо повна оцінка ковтання виявила високий ризик аспірації чи за неможливості задоволення потреб у харчуванні per os. Пацієнтам з порушенням ковтання рекомендована рання постановка назогастрального зонда (впродовж перших 48 годин з моменту виникнення інсульту). Якщо дисфагія виражена і триватиме більше 6 тижнів, може бути показана гастростома чи єюностома, проте вони не рекомендовані в перші 2 тижні після виникнення інсульту. Пацієнти з дисфагією повинні проходити щоденний моніторинг впродовж перших двох тижнів після виникнення інсульту для визначення покращання чи повного відновлення ковтання, далі оцінка порушень ковтання має проводитись кожні 2–3 місяці впродовж першого року, потім — кожні 6 місяців. Пацієнти з стійкою втратою ваги та рецидивуючою інфекцією органів грудної клітки мають бути негайно повторно обстежені на наявність дисфагії.
Щодо стратегій з попередження ускладнень та відновлення нормального ковтання, вони поділяються на прямі та непрямі методи. Серед прямих — модифікація консистенції їжі та напоїв, стратегії безпечного ковтання, оптимізація положення пацієнта з інсультом під час прийому їжі. До непрямих методів належать вправи для м’язів (на покращання координації та сили), що беруть участь у ковтанні, стимуляція структур ротової порожнини та глотки — електростимуляція (крізьшкірна та внутрішньоглоткова) та термальна тактильна стимуляція; транскраніальна магнітна стимуляція ділянок моторної проекційної зони органів ротової порожнини та глотки. Зазначені стратегії мають проводитись і пацієнтам з ентеральним вигодовуванням. Проте немає достатньо даних, що рекомендують специфічне лікування порушень ковтання. Особлива увага приділяється гігієні ротової порожнини у всіх пацієнтів без виключення.
Рекомендації
1. Оцінка ковтання рекомендована всім пацієнтам з ГПМК і має проводитись якомога швидше, впродовж 24 годин з моменту поступлення (переконливих обґрунтувань немає, рекомендовано виходячи з інтересів хворого та на підставі практичного досвіду — Good practice point) [ESO, 2008; RCP, 2008; AHA/ASA, 2007; 7].
2. Пацієнт має пройти скринінг порушень ковтання, перш ніж почне їсти, пити чи приймати ліки per os. Тестування має проводити спеціально навчена особа (у т.ч. медсестра), використовуючи перевірений тест (рівень обґрунтованості B) [ESO, 2008; SIGN118, 2010; AHA/ASA, 2007; NSF, 2010; 7].
3. Годування per os рекомендоване пацієнтам без дисфагії (рівень обґрунтованості B) [ESO, 2008].
4. Пацієнти, у яких виявили порушення ковтання під час скринінгу, мають бути оглянуті логопедом для детальної оцінки характеру дисфагії, в т.ч. із застосуванням інструментальних методів дослідження, з подальшим отриманням рекомендацій щодо терапевтичної тактики (переконливих обґрунтувань немає, рекомендовано виходячи з інтересів хворого та на підставі практичного досвіду — Good practice point) [NSF, 2010; 7].
5. Глотковий рефлекс не є надійним і чутливим показником для виявлення дисфагії і має використовуватись лише для більш докладної скринінгової процедури (рівень обґрунтованості В) [SIGN118, 2010, NSF, 2010].
6. Пацієнтам з порушенням ковтання рекомендована рання постановка назогастрального зонда (впродовж перших 48 годин з моменту виникнення інсульту) (рівень обґрунтованості B) [ESO, 2008].
7. Необхідно проводити скринінг/перевірку нутритивного/харчового статусу пацієнта впродовж 48 годин з моменту госпіталізації. Особливої уваги потребують оцінка та контроль гідратації пацієнта (переконливих обґрунтувань немає, рекомендовано виходячи з інте-ресів хворого та на підставі практичного досвіду — Good practice point) [NSF, 2010] (рівень обґрунтованості B) [RCP, 2008].
8. Крізьшкірна ентеральна гастростомія не рекомендована в перші 2 тижні після виникнення інсульту (рівень обґрунтованості В) [ESO, 2008, NSF, 2010].
9. Немає достатньо даних, що рекомендують специфічне лікування дисфагії (переконливих обґрунтувань немає, рекомендовано виходячи з інтересів хворого та на підставі практичного досвіду — Good practice point) [ESO, 2008].
Додаток 12.3
Національна система оцінки результатів
(National Outcomes Measurement System)
http://www.asha.org
Ковтання
Примітка: на рівнях 3–5 деякі пацієнти можуть відповідати лише одному з перелічених критеріїв. Якщо вам складно вирішити, який рівень є найбільш відповідним, використовуйте дієтичний рівень як найважливіший, якщо саме він віддзеркалює ковтальну функцію (а не лише стан зубного ряду). Про дієтичні рівні 6 та 7 слід судити лише на підставі функції ковтання, будь-які порушення зубного ряду до уваги не беріть.
Рівень 1. Особа не в змозі безпечно ковтати будь-що при годуванні через рот. Все харчування та введення рідини відбувається не через рот (напр., назогастральний зонд, крізьшкірна гастростома).
Рівень 2. Особа не в змозі безпечно ковтати через рот для підтримання адекватного нутритивного стану та гідратації, але під пильним контролем може проковтнути невелику порцію певної консистенції з лікувальною метою («тренування ковтання»). Потребує альтернативного способу годування.
Рівень 3. Пацієнт потребує альтернативного способу годування, оскільки вживає менше 50 % їжі та напоїв через рот, та/або ковтання є безпечним за умови помірного заохочення до застосування компенсаторних стратегій ковтання, та/або потребує максимальних дієтичних обмежень.
Рівень 4. Ковтання є безпечним, але пацієнт потребує помірного заохочення до застосування компенсаторних стратегій ковтання та/або має помірні дієтичні обмеження, та/або все ще потребує зондового харчування, та/або спеціальних добавок
Рівень 5. Ковтання є безпечним з мінімальними дієтичними обмеженнями та/або пацієнт потребує мінімального заохочення до використання компенсаторних стратегій ковтання. Особа інколи може допомагати собі власними силами. Вся їжа та рідина, які необхідні пацієнту, можуть бути спожиті через рот у відповідний час (сніданок, обід, підвечірок, вечеря).
Рівень 6. Ковтання є безпечним, пацієнт їсть і п’є самостійно, інколи може потребувати мінімального заохочення. Особа зазвичай допомагає собі власними силами, якщо виникають якісь труднощі/перешкоди під час ковтання. Можлива необхідність уникати певних харчових продуктів (напр., поп-корн, горіхи), або потрібно більше часу (через дисфагію).
Рівень 7. Здатність пацієнта їсти самостійно не обмежена через функції ковтання. Ковтання є безпечним та ефективним при вживанні будь-яких страв чи напоїв. У разі потреби ефективно використовуються компенсаторні стратегії ковтання.
Ковтання: рівні дієт/обмежень
Максимальні обмеження: рівень на 2 чи більше рівнів нижче за звичайний щодо твердих продуктів та напоїв.
Помірні обмеження: рівень на 2 чи більше рівнів нижче за звичайний щодо твердих продуктів або напоїв (але не обох разом), АБО рівень на 1 нижче за звичайний щодо твердих продуктів та напоїв.
Мінімальні обмеження: рівень на 1 нижче за звичайний щодо твердих продуктів або напоїв.
Їжа
Звичайна: без обмежень.
Нижче на 1 рівень: м’ясо готують до м’якого стану; уникати жорстких чи волокнистих продуктів. Можна включати такі страви, як м’ясний хліб, запечена риба, м’яка курятина. Овочі готуються до м’якого стану.
Нижче на 2 рівні: м’ясо рублене або подрібнене до стану фаршу. Всі овочі в страві однієї консистенції (напр., овочеве суфле, печена картопля) чи можуть бути потовчені до стану пюре виделкою.
Нижче на 3 рівні: м’ясо та овочі у вигляді пюре.
Напої
Звичайні: рідкої консистенції (як вода), без обмежень.
Нижче на 1 рівень: густини нектару, сиропу; трохи загущені.
Нижче на 2 рівні: густини меду; помірно загущені.
Нижче на 3 рівні: густини сиркової маси; дуже густі.
12.2. Нутритивна підтримка
12.2.1. Передумови
Переважна більшість пацієнтів з інсультом надходять до лікарні в стані помірної чи вираженої дегідратації, яка несприятливо впливає на перфузію мозку. Дегідратація внаслідок недостатнього ентерального вживання рідини супроводжується несприятливими наслідками лікування [2, 10]. У кожного 5–6-го пацієнта з інсультом відмічається недостатнє харчування (дефіцит маси тіла), що теж несприятливо впливає на наслідки лікування [11]. Вже через 2 тижні після початку лікування відсоток хворих із недостатнім харчуванням сягає 22–35 % від усіх госпіталізованих хворих з інсультом [1]. Нарешті, серед хворих з затримкою реабілітації до 50 % мають недостатнє харчування [5]. Тому всі пацієнти з інсультом повинні бути оцінені стосовно наявності симптомів недостатнього харчування та факторів ризику його розвитку (рівень обґрунтованості В) [7].
Поряд з проведенням інфузійної терапії проведення раннього клінічного харчування дозволяє корегувати дегідратацію, порушення електролітного складу крові, попередити розвиток дефіциту енергетичних та пластичних матеріалів, а також покращити результати лікування (рівень обґрунтованості В) [8, 9]. З іншого боку, у великому рандомізованому контрольованому дослідженні на популяції хворих з інсультом, які могли ковтати, було продемонстровано, що встановлення назогастрального зонда не призводить до покращення наслідків лікування порівняно з харчуванням таких хворих звичайним оральним шляхом (рівень обґрунтованості В) [3, 4]. Ці результати вказують на те, що до хворих, які можуть ковтати, можна застосовувати підходи, які спрямовані на покращення ефективності традиційного харчування, тоді як встановлення зонду та використання «спеціальних сумішей» повинно бути зарезервоване для більш тяжкої категорії хворих з порушенням ковтання, а також для тих, у кого вже є порушення нутритивного статусу. Крім того, слід з обережністю переносити дані, отримані в центрах, де в рутинну практику впроваджено найбільш досконалі методики харчування, на загальну популяцію хворих з інсультом. Так, існують дослідження, які свідчать про те, що навіть у розвинених країнах нутритивна підтримка у хворих з інсультом все ще не виведена на оптимальний рівень, тобто багатьом хворим вона проводиться в недостатньому обсязі [6, 12].
12.2.2. Мета харчування
Ентеральне харчування (ЕХ) у хворих з тяжким інсультом повинно переслідувати дві основні мети:
1) перешкоджати дегенеративним змінам і порушенню цілісності травного тракту і, тим самим, запобігти бактеріальній транслокації з просвіту ШКТ у системний кровотік;
2) забезпечити задоволення збільшених, внаслідок пов’язаного з інсультом гіперкатаболічного стану, енергетичних потреб організму, а також потреб у рідині та електролітах.
Виконанню першої мети (запобігти дегенеративним змінам ШКТ) щонайкраще сприяють ентеральні суміші, збагачені волокнами целюлози. Ці суміші зараз комерційно доступні. Виконання другої мети — поповнення енергетичних потреб в обсязі до 120–140 % від нормальних добових потреб (рівень обґрунтованості В) [NSF, 2010] — потребує введення в зонд досить великих об’ємів висококонцентрованих і високоосмолярних поживних сумішей.
12.2.3. Загальні принципи раннього ентерального харчування
Клінічне харчування поділяють на парентеральне та ентеральне. Парентеральне харчування полягає у введенні розчинів амінокислот, глюкози та ліпідів у центральну чи периферичну вени. Основним показанням до парентерального харчування є неможливість проведення або відсутність толерантності до ЕХ, що у хворих з інсультами спостерігається рідко. Тому задоволення енергетичних та пластичних потреб пацієнта повинно якомога раніше розпочинатися ентеральним шляхом (рівень обґрунтованості В) [NSF, 2010].
Оцінка функції ковтання
Усім пацієнтам з інсультом, свідомість яких порушена незначною мірою, необхідно перевірити функцію ковтання (рівень обґрунтованості С) [NSF, 2010]. Якщо пацієнт ковтає адекватно, ентеральне харчування може здійснюватись природним шляхом. При наявності порушень ковтання (дисфагії), а також у всіх хворих з тяжким інсультом (у гострому періоді) для проведення харчування необхідно встановлювати зонд (рівень обґрунтованості В) [NSF, 2010].
Методи зондового харчування
Для проведення ентерального харчування найчастіше встановлюють назогастральний зонд (рівень обґрунтованості В) [NSF, 2010]. Назогастральний зонд підвищує ризик розвитку нозокоміальних синуситів, тому тривалість його використання повинна обмежуватися.
У хворих, у яких в гострому періоді контроль дихальних шляхів здійснюється за допомогою оротрахеальної інтубації, і коли очікується, що оротрахеальна інкубаційна трубка буде використовуватись упродовж тривалого часу, шлунковий зонд теж рекомендують встановлювати через рот (орогастрально). Це знижує ризик розвитку нозокоміальних синуситів. Оскільки орогастральний зонд значно більше подразнює рефлексогенні зони порожнини рота та важче переноситься хворими, після екстубації трахеї його замінюють на назогастральний. Проте певна категорія хворих з інсультом погано переносять і назогастральний зонд, і блювотні рефлекси, які у них виникають, підвищують ризик виникнення аспірації. У хворих з порушенням моторики шлунка і ризиком збільшення його резидуального об’єму та розвитку аспірації шлункового вмісту замість назогастрального зонда встановлюють назоєюнальний зонд. Його найчастіше встановлюють ендоскопічно.
Іншими варіантами встановлення зонда є гастростома. Гастростома простіша в обслуговуванні і зменшує кількість ускладнень, пов’язаних з тривалим використанням назогастрального зонда. Серед ускладнень, пов’язаних з накладенням і функціонуванням самої гастростоми, трапляється, хоча і рідкісне, проте таке грізне ускладнення, як перитоніт (рівень обґрунтованості В) [13]. Крім того, на загальній категорії хворих з інсультом, які потребують зондового харчування, встановлено, що ендоскопічне накладання гастростоми не супроводжується покращенням результатів лікування порівняно з використанням звичайних назогастральних зондів (рівень обґрунтованості В) [3, 4].
Таким чином, встановлення назогастрального зонда вважається методом вибору у хворих з порушенням ковтання впродовж першого місяця лікування (рівень обґрунтованості В) [NSF, 2010].
Розрахунок добових потреб у харчуванні
Оптимальним є розрахунок добової потреби в рідині, калоріях та харчових компонентах, які забезпечують цей калораж (вуглеводи, білки, ліпіди), електролітах, а потім розподілення всіх цих компонентів між ентеральним та парентеральним шляхами введення. Чим тяжчий стан пацієнта, тим детальніше та ретельніше слід підраховувати ці потреби і тим важливішим стає правильний вибір препаратів для клінічного харчування.
Оскільки клінічне харчування через зонд має найбільше значення для хворих з тяжким інсультом, які перебувають в коматозному стані, то й потреби в нутрієнтах ми наводимо для цієї категорії хворих, у яких індекс маси тіла (ІМТ) не перевищує 30 кг/м2, ІМТ розраховують шляхом поділу маси тіла (в кілограмах) на квадрат зросту (в метрах); наприклад при масі тіла 85 кг та зрості 1,7 м ІМТ становить 29,4 кг/м2. Крім того, у хворих з ІМТ понад 30 розрахунок проводиться не на реальну, а на так звану належну (ідеальну, розрахункову) масу тіла.
Середні добові потреби:
— протеїнів — 1–2 г/кг;
— ліпідів — 1–1,5 г/кг;
— вуглеводів — 3–4 г/кг;
— калорій — 25–30 ккал/кг.
Терміни призначення ентерального харчування
Раннім називають ентеральне харчування, яке призначають впродовж перших 48 год з моменту виникнення критичного стану. Зондове харчування повинно розпочинатися якомога раніше (оптимально вже з першої доби), тому що впровадження цього простого й доступного методу супроводжується тенденцією до покращення результатів лікування (рівень обґрунтованості А) [3, 4]. У ВІТ відсутність перистальтичних шумів не є протипоказанням до проведення ЕХ. На цільові показники введення нутрієнтів необхідно вийти за 2–3 доби з моменту початку харчування.
Фокус на окремих компонентах ентерального харчування
Імуномодулюючим називають ЕХ, яке містить аргінін, глютамін, нуклеїнові кислоти, омега-3 жирні кислоти та антиоксиданти. Проте клінічні категорії хворих, у яких було б переконливо продемонстровано переваги сумішей, збагачених перерахованими добавками, перед стандартними сумішами, поки що не встановлені.
При гострому респіраторному дистрес-синдромі є докази переваг сумішей з так званим протизапальним ліпідним профілем, які містять омега-3 жирні кислоти з риб’ячого жиру та антиоксиданти (докази рівня А).
Є дані про те, що вітаміни, мікроелементи (наприклад, селен) можуть призначатися усім хворим, які перебувають у тяжкому чи критичному стані, проте оптимальні строки їх призначення та дози поки що залишаються невідомими.
Ліпіди
Розповсюджена думка, що хворі з надлишковою масою тіла (ожирінням) не потребують екзогенного введення ліпідів, оскільки мають підвищені їх ендогенні запаси, є хибною. Ендогенні запаси не можуть забезпечити організм достатньою кількістю абсолютно необхідних незамінних (есенціальних) омега-3 і омега-6 жирних кислот. Крім того, високий рівень ендогенного чи введеного з лікувальною метою інсуліну запобігає вивільненню ліпідів у кровотік з їх депо. Практичний бік застосування ліпідів полягає у тому, що вони дозволяють значною мірою задовольнити енергетичні потреби організму. На одиницю енергії, отриманої з ліпідів, організм продукує меншу кількість СО2, ніж при використанні вуглеводів. Такі переваги особливо важливі у період переведення хворих із ШВЛ на самостійне дихання.
Обмеженням у застосуванні ліпідів є знижена толерантність шлунково-кишкового тракту пацієнтів до однократного введення великої кількості цих препаратів, що проявляється розвитком діареї. Для попередження цього ускладнення введення ліпідів повинно бути рівномірно розподілене впродовж усієї доби.
Контроль ефективності проведення харчування
Найбільш простим і ефективним способом конт-ролю є зважування хворого під час надходження до стаціонару і в процесі лікування (рівень обґрунтованості С) [NSF, 2010]. Інші методи, такі як рівень альбуміну, преальбуміну, антропометричні методи, можуть застосовуватись у хворих із помірною та середньою тяжкістю інсульту, але вони все ще не валідовані у хворих, які перебувають у критичному стані. Рівень гідратації оцінюють за гематокритом, сухістю/вологістю шкірних покривів, величиною діурезу, наповненістю периферичних вен тощо. Крім того, важливим є регулярне дослідження електролітного складу крові, а при можливості — визначення осмолярності крові.
Ускладнення та їх профілактика
Введення в зонд великих об’ємів висококонцентрованих і високоосмолярних поживних сумішей може супроводжуватися розвитком низки ускладнень. Найбільш частими серед них є: виражені диспептичні розлади і діарея, порушення евакуації їжі зі шлунка й аспірація шлункового вмісту, розвиток гіперглікемії. При проведенні ентерального харчування слід уникати продуктів, які сприяють метеоризму, оскільки він може значно підвищувати внутрішньочеревний тиск і тим самим порушувати повернення венозної крові до серця. Хворим, які страждають від закрепів, необхідно давати послаблюючі і періодично призначати гіпертонічні клізми.
Для попередження аспірації шлункового вмісту при повному введенні розрахункових потреб в ЕХ головний кінець ліжка слід припідняти на 30° (до 45°). Введення їжі ліпше проводити шляхом постійної інфузії, а не болюсно, а також на фоні використання прокінетиків. Якщо хворому все ще проводиться аналгоседація, то дози наркотичних анальгетиків повинні бути зниженими.
У випадках частого виникнення застою у шлунку зонд для проведення харчування повинен бути ендоскопічно встановлений у тонкий кишечник (кінець повинен бути проведений за зв’язку Трейця).
При виникненні діареї слід докласти зусиль для виявлення її етіологічного чинника. У таких пацієнтів повинні використовуватися суміші, які містять розчинні волокна або невеликі пептиди.
Практичні аспекти
Вже понад 10 років раннє ентеральне харчування активно пропагується практично у всіх категорій хворих, які перебувають в інтенсивній терапії.
Коментар робочої групи
Проте в нашій країні ні у ВІТ, ні в неврологічних відділеннях у повному обсязі цей метод все ще не впроваджено. Це в основному пов’язано з тим, що застосування методу в тому вигляді, як це рекомендують клінічні настанови, потребує значних витрат часу лікарів, середнього, а також молодшого медичного персоналу. Крім того, точність розрахунків калоражу та інгредієнтів, а також кількості часу, який витрачає медичний персонал на введення продуктів для ентерального харчування, залежать від самих продуктів, які використовуються. Так, коли використовуються готові продукти, які вже на виробництві розведені, упаковані в спеціальні градуйовані мішки і готові до використання, то медсестрі залишається лише приєднати цей мішок до зонда і виставити на крапельниці чи на спеціальному приладі дозаторі швидкість погодинної інфузії, яку задав лікар. Дещо складніше використовувати комерційно доступні препарати (які, як правило, купують родичі пацієнта) для ентерального харчування, які є сухими сумішами і які медсестри повинні розчиняти перед введенням пацієнту. У деяких лікарнях все ще існують харчоблоки, які готують «щелепно-лицевий стіл» — напіврідкі каші, які можуть бути використані для зондового харчування.
Розповсюдженим є метод, коли родичі пацієнта готують напіврідкі страви або просто купують соки та молочнокислі продукти, які медичний персонал вводить пацієнту впродовж доби. При цьому підрахунок калоражу та вмісту нутритивних компонентів (білків, вуглеводів, ліпідів) вкрай тяжкий. Встановлено, що як за калоражем, так і за вмістом білків та ліпідів така їжа не задовольняє й половини добових потреб пацієнта.
Невизначеним є і питання щодо осмолярності розчинів, які використовують для ентерального (у т.ч. зондового) харчування. Найчастіше пацієнтам дають пити чи вводять у зонд столову або мінеральну воду, соки, лимонади тощо. Такі розчини можуть бути гіпоосмолярними і в гострому періоді можуть сприяти набряку мозку. Навіть якщо розчин містить значну кількість глюкози і не є гіпоосмолярним, він може бути джерелом вільної рідини, оскільки глюкоза може швидко метаболізуватись, а вільна рідина може швидко переміщатися у клітини, у т.ч. і головного мозку. Саме вживання пацієнтами в гострому періоді інсульту гіпоосмолярних розчинів може в деяких пацієнтів спричиняти появу клінічних симптомів набряку мозку. Такий досвід міг сприяти формуванню у свідомості деяких неврологів причинно-наслідкового зв’язку між кількістю рідини на вираженістю набряку мозку. На етапі подальшого лікування осмолярність розчинів відіграє вже меншу роль. Існують рекомендації, які дозволяють давати хворим їх улюблені напої з тим, щоб спонукати їх пити більше і попереджувати розвиток дегідратації (рівень обґрунтованості А) [7]. У переважній більшості клінічних настанов з інсульту наголошується на тому, що у хворих, які самостійно вживають їжу, медичний персонал повинен моніторувати об’єм та склад харчування. У разі недостатності такого харчування повинна проводитись його корекція.
Рекомендації
— Усі хворі впродовж першої доби після надхо-дження повинні бути оцінені спеціалістом на предмет наявності порушення ковтання; повинні бути оцінені також рівень гідратації та нутритивний статус хворого (рівень обґрунтованості А) [NSF, 2010].
— Усім хворим із порушенням ковтання впродовж першої доби повинен бути встановлений назогастральний зонд і введена тестова доза ентерального харчування (рівень обґрунтованості С) [NSF, 2010].
— Усім хворим з порушенням харчування при надходженні, а також хворим із тяжкими інсультами, у яких порушення свідомості буде, імовірно, тривати довго, ентеральне харчування повинно проводитись кваліфікованими спеціалістами (які пройшли відповідну підготовку). Об’єм ентерального харчування та дози його компонентів повинні бути ретельно розраховані, а під час проведення харчування необхідно моніторувати толерантність до нього і при необхідності вчасно вносити корекцію (рівень обґрунтованості В) [NSF, 2010].
13. Когнітивні порушення після інсульту
13.1 Порушення когнітивних функцій після інсульту
Основним проявом інсульту зазвичай вважають слабкість м’язів однієї половини тіла (геміпарез), але близько п’ятої частини хворих на інсульт парезів не має, а велика кількість інсультів взагалі не супроводжуються гострим неврологічним дефіцитом (так звані німі інсульти). «Німі» інсульти, здебільшого лакунарні, є дуже поширеним явищем (наявні майже у чверті літніх людей). Дані деяких досліджень свідчать, що на один інсульт з явними клінічними проявами (гострі неврологічні порушення) припадає 6–9 «німих» інсультів, які є важливим фактором ризику когнітивних порушень, деменції та інсульту з клінічними проявами [1]. Кожного пацієнта з цереброваскулярним захворюванням слід вважати таким, що має когнітивні порушення, поки не доведено зворотне [СSS, 2008].
Когнітивні порушення та деменція часто спостерігаються після інсульту (впродовж перших 12 міс. когнітивні розлади різної тяжкості є приблизно у двох третин хворих, і у третині випадків вони досягають ступеня деменції). Когнітивні розлади пов’язані з обмеженнями в повсякденній життєдіяльності, можуть призводити до значної залежності від сторонньої допомоги, негативно впливати на відновлення функцій та збільшувати смертність. Когнітивні розлади після інсульту можуть мати різний перебіг. З одного боку, у частини хворих когнітивні порушення можуть регресувати і навіть повністю зникнути. З іншого боку, майже у половини хворих з судинними когнітивними розладами без деменції впродовж 5 років розвивається деменція. Судинна деменція є другим за частотою типом деменції (після хвороби Альцгеймера), а поєднання нейродегенеративних та судинних уражень мозку є найчастішою причиною когнітивних розладів у літніх людей.
Важливо розпочинати скринінг на когнітивні порушення вже на ранніх стадіях цереброваскулярних захворювань, зокрема вже наприкінці гострого періоду інсульту. Наразі немає загальновизнаного золотого стандарту для оцінки когнітивних функцій після інсульту. Коли після скринінгу або клінічного огляду є підстави підозрювати когнітивні порушення, для вибору лікувальної тактики рекомендується більш детальне оцінювання, яке проводять спеціалісти (ерготерапевт, медичний психолог або нейропсихолог, логопед). Оцінювання когнітивних функцій має велике значення для визначення спроможності хворого брати участь у реабілітації, потреби у сторонній допомозі та здатності самостійно приймати рішення [СSS, 2008].
У хворих після інсульту когнітивні порушення спостерігаються в багатьох доменах. Для функціонального стану хворих, імовірно, найбільше значення мають абстрактне мислення, судження, мовні функції, увага та концентрація. Ці фактори в подальшому також суттєво впливають на відновлення пам’яті та виконавчі функції [1]. Вибіркове сприйняття сенсорних подразників (брак уваги або нехтування) є найчастішим когнітивним порушенням при інсультах (до 20–40 % хворих у гострому періоді, здебільшого при вогнищах у правій півкулі мозку). Запропоновано декілька інструментів як для скринінгу на брак уваги, так і для більш детальної оцінки, однак наразі невідомо, який з інструментів є найбільш придатним. Оскільки брак уваги істотно збільшує ризик падінь та поганих функціональних результатів лікування, відповідний скринінг слід проводити у всіх хворих.
Досить поширеним розладом, особливо при ураженні лівої півкулі мозку, є апраксія. Як і у випадку браку уваги, існує декілька інструментів для скринінгу та більш детальної оцінки апраксії, проте золотий стандарт наразі не визначено. Апраксія може мати значний вплив на повсякденну життєдіяльність, тому скринінг має бути проведений у кожного хворого.
Не менш поширеними серед хворих на інсульт є розлади комунікації, передусім афазія. Афазія зустрічається майже в третини хворих з першим інсультом і збільшує летальність. Інші розлади, що призводять до погіршення комунікації, включають апраксію мовлення та дизартрію. Прогноз при комунікативних розладах є в цілому сприятливим (у більшості хворих спостерігається повне або значне відновлення впродовж року). Першим кроком у лікуванні афазії є її відповідна діагностика. Одним з найліпших засобів для виявлення афазії є скринінговий тест на афазію Френчай (Frenchay Aphasia Screening Test FAST). В літературі можна знайти багато інших тестів для діагностики афазії, але їх надійність, валідність та придатність для практики потребують подальшого вивчення. Після скринінгу проводиться більш детальне оцінювання, яке дозволяє краще спрямувати лікувальні заходи. Детальне дослідження афазії з використанням спеціальних тестів (наприклад, Бостонське діагностичне дослідження афазії — Boston Diagnostic Aphasia Examination — BDAE) зазвичай виконують спеціалісти (логопеди, фахівці з мовних порушень), які мають необхідні навички. Висновки щодо ефективності лікування комунікаційних розладів зробити досить складно, оскільки більшість проведених досліджень мають істотні методологічні обмеження. Більшість фахівців вважає, що ранній початок та значна інтенсивність лікування дозволяють досягти кращих результатів. На мовні функції можуть істотно впливати розлади слуху, які часто зустрічаються у літніх людей, тому при наявності комунікативних розладів варто провести аудіометрію. У разі мовних порушень для дослідження когнітивних функцій слід використовувати невербальні тести, оскільки результати вербальних тестів будуть невідповідними [СSS, 2008].
13.2. Рекомендації щодо оцінювання та лікування когнітивних порушень
13.2.1. Рекомендації щодо оцінювання когнітивних порушень
1. У хворих з ознаками цереброваскулярних захворювань, зокрема у пацієнтів після інсульту, слід періодично (не рідше ніж один раз на рік) проводити скринінг на когнітивні порушення з використанням відповідних інструментів із підтвердженою валідністю (рівень обґрунтованості B) [CSS, 2008; NSF, 2010].
2. Дослідження когнітивних функцій передбачає оцінювання наступних доменів: рівень свідомості, увага, орієнтація, пам’ять, мова, гнозис, зорово-просторове сприйняття, праксис та виконавчі функції (проникливість, судження, здатність передбачати наслідки своїх дій, розв’язання проблем, абстрактне мислення, планування, здатність розпочинати дії та реалізувати задуми). Скринінг на когнітивні порушення може проводити лікар, медична сестра або фахівець з реабілітації, які мають належну підготовку (рівень обґрунтованості C) [CSS, 2008].
3. Монреальське оцінювання когнітивних функцій (Montreal Cognitive Assessment — MoCA, додаток 13.1) вважається більш чутливим до судинних когнітивних порушень, ніж Міні-дослідження психічних функцій (Mini Mental Status Exam — MMSE, додаток 13.2). MoCA слід використовувати для скринінгу на когнітивні розлади у разі нормальної оцінки (> 24 б.) за MMSE. Потрібні подальші дослідження придатності MoCA порівняно з іншими скринінговими шкалами у хворих на інсульт (рівень обґрунтованості B) [CSS, 2008].
4. Поряд зі скринінгом на когнітивні порушення слід робити скринінг на депресію, оскільки депресія часто спостерігається після інсульту і може сприяти виникненню когнітивних розладів. З метою скринінгу на депресію слід використовувати відповідні інструменти (див. розділ про емоційні порушення після інсульту) з підтвердженою валідністю (рівень обґрунтованості B) [CSS, 2008].
5. Якщо під час скринінгу виявлені когнітивні порушення, необхідно провести більш детальне нейропсихологічне дослідження з метою визначення тяжкості порушень та ступеня збереження різних доменів когнітивних функцій та подальшої тактики лікування. Детальне вивчення когнітивних функцій потребує спеціальних знань з медичної (клінічної) психології і має проводитись спеціалістом, який пройшов відповідне навчання (рівень обґрунтованості B) [CSS, 2008].
6. У хворих після інсульту або транзиторної ішемічної атаки слід проводити оцінювання когнітивних функцій при переході до нового етапу лікування: перед випискою з лікарні, на початку реабілітації, потім через певні проміжки часу (не менше 1 разу на рік) впродовж стаціонарної чи амбулаторної реабілітації та подальшого спостереження (рівень обґрунтованості C) [CSS, 2008].
13.2.2. Рекомендації щодо лікування когнітивних порушень
1. У хворих з судинними когнітивними порушеннями слід проводити агресивне лікування всіх судинних факторів ризику до досягнення оптимального рівня контролю (рівень обґрунтованості А) [CSS, 2008].
2. При лікуванні когнітивних порушень слід використовувати комплексний індивідуальний підхід, метою якого є повернення до бажаних видів діяльності, таких як робота, хобі, керуванням автомобілем, соціальна активність, стосунки з партнером, домашні справи тощо (рівень обґрунтованості C) [CSS, 2008].
3. Стратегія відновного лікування та реабілітації має враховувати наявні когнітивні порушення та когнітивні можливості хворого, які визначені на підставі якомога більш детального нейропсихологічного дослідження (рівень обґрунтованості В) [CSS, 2008].
4. Ефективність лікування окремих когнітивних розладів потребує подальшого вивчення. Поряд з втручаннями, спрямованими на відновлення та тренування, слід розглядати використання компенсаторних заходів (рівень обґрунтованості C) [CSS, 2008].
5. За наявності ознак депресії чи тривожності (при скринінгу) слід скерувати хворого на консультацію до психіатра або психотерапевта (рівень обґрунтованості C) [CSS, 2008].
6. Хворі з утрудненою комунікацією мають бути оглянуті фахівцем з мовних порушень/логопедом, їх лікування слід розпочинати якомога раніше, лікувальні сеанси слід проводити якомога частіше (рівень обґрунтованості С) [NSF, 2010].
7. У хворих з помірними та тяжкими судинними когнітивними порушеннями, які діагностовано за допомогою критеріїв NINDS-AIREN (додаток 13.3), слід розглянути питання про лікування інгібіторами холінестерази (галантамін, ривастигмін, донепезил). Є чимало доказів невеликого позитивного впливу галантаміну на когнітивні функції та поведінку при поєднанні хвороби Альцгеймера та цереброваскулярних захворювань, тому галантамін може розглядатися як засіб першої лінії для лікування хворих зі змішаними когнітивними розладами. Є чимало доказів невеликого позитивного впливу донепезилу на когнітивні функції та результати лікування в цілому (вплив на функціональний стан був менш переконливим), тому донепезил може розглядатися як засіб для лікування судинної деменції (рівень обґрунтованості С) [CSS, 2008].
Додаток 13.3
Критерії NINDS-AIREN для діагностики судинної деменції
Національний інститут неврологічних розладів та інсульту США (National Institute of Neurological Disorders and Stroke — NINDS) разом з Міжнародною асоціацією з досліджень та просвіти в галузі нейронаук (Association Internationale pour la Recherche et l’Enseignement en Neurosciences — AIREN) у 1993 р. запропонували рекомендації щодо діагностики судинної деменції, які отримали назву критеріїв NINDS-AIREN [2]. Згідно з цими критеріями, деменцією слід вважати тяжкі набуті когнітивні порушення, які спричиняють істотне обмеження повсякденної життєдіяльності і полягають у зниженні пам’яті та порушеннях ще принаймні у двох когнітивних доменах (орієнтація, увага, мова, зорово-просторове сприйняття, гнозис, праксис, виконавчі функції), що підтверджено клінічними даними та даними нейропсихологічного дослідження. В цьому документі перелічені стани, які унеможливлюють діагноз судинної деменції: порушення свідомості (включаючи делірій та психоз), тяжка афазія або дуже тяжкий неврологічний дефіцит, які не дають змоги провести нейропсихологічне дослідження, а також некомпенсовані соматичні захворювання, які можуть впливати на діяльність мозку. Також наведені ознаки, які свідчать на користь судинної деменції: ранній початок порушень ходи, схильність до падінь, часті та імперативні позиви на сечовипускання, псевдобульбарний синдром, апатія, абулія, депресія та значні порушення виконавчих функцій. Ранні та прогресуючі порушення пам’яті та відсутність вогнищевих неврологічних симптомів або ознак цереброваскулярного захворювання під час нейровізуалізації роблять діагноз судинної деменції дуже сумнівним.
І. Критерії імовірної судинної деменції:
1. Цереброваскулярна хвороба, яка проявляється вогнищевими неврологічними порушеннями (геміпарез, парез мімічної мускулатури за центральним типом, симптом Бабінського, гемігіпестезія, геміанопсія, афазія, дизартрія), що могли бути спричинені інсультом, та/або має ознаки при нейровізуалізації (множинні інфаркти мозку, або інфаркт у стратегічній зоні, такій як gyrus angularis, таламус, базальні відділи переднього мозку, басейн задньої та передньої мозкових артерій, або численні лакунарні інфаркти у базальних гангліях та білій речовині).
2. Встановлено зв’язок між деменцією та порушеннями, зазначеними у пункті 1, а саме збільшення когнітивних порушень та початок деменції впродовж перших 3 міс. після діагностованого інсульту або східчасте прогресування когнітивного дефіциту.
ІІ. Критерії достеменної судинної деменції:
1. Імовірна судинна деменція.
2. Морфологічне підтвердження цереброваскулярної хвороби (біопсія, автопсія).
3. Відсутність нейрофібрилярних вузликів та бляшок у кількості, що перевищує вікову норму.
4. Відсутність інших причин деменції.
ІІІ. У пацієнтів з когнітивними порушеннями, що відповідають критеріям деменції, та клінічними ознаками, що свідчать про судинні когнітивні порушення, за відсутності нейровізуалізації може бути встановлений діагноз можливої судинної деменції. Такий же діагноз може бути встановлений у випадку, коли зв’язок між інсультом та деменцією не встановлений або у разі хвилеподібного перебігу когнітивних порушень на тлі цереброваскулярної хвороби.
14. Емоційні розлади після інсультів
Післяінсультна депресія асоційована з недостатньою реабілітацією та поганим результатом. У клінічній практиці тільки в малої кількості пацієнтів із депресією встановлюється діагноз, і ще менша частина з них лікується. Депресія виявляється у 33 % пацієнтів, що вижили, але точної оцінки захворюваності депресіями у пацієнтів з інсультом не проводилося. Предикторами післяінсультної депресії в процесі реабілітації є погіршення фізичного дефіциту, когнітивні порушення і зростання тяжкості інсульту. Немає домовленості у виборі оптимального методу скринінгу та діагностики післяінсультних депресій. Антидепресанти, такі як селективні інгібітори зворотного захвату серотоніну і гетероциклічні антидепресанти, можуть поліпшити настрій після інсульту, але відомості, що дані препарати можуть викликати повну ремісію великого депресивного епізоду або попереджувати розвиток депресії, відсутні. Селективні інгібітори зворотного захвату серотоніну (СІЗЗС) краще переносяться, ніж гетероциклічні антидепресанти. Немає достатніх відомостей щодо рекомендацій психотерапії для лікування і профілактики післяінсультної депресії, хоча ця терапія може поліпшувати настрій. Емоційна лабільність є травмуючим фактором для пацієнтів та осіб, що їх оточують, селективні інгібітори зворотного захвату серотоніну можуть зменшувати емоційні прояви, однак вплив їх на якість життя залишається неясним.
Рекомендації
— Рекомендується спостереження пацієнтів для виявлення депресії впродовж перебування в стаціонарі та після виписки (рівень обґрунтованості В) [ESO, 2008]. Всім пацієнтам треба проводити скринінг депресії за допомогою валідних шкал (Госпітальна шкала депресії і тривоги (HAD) і шкала оцінки депресії Монтгомері (MADRS) (рівень обґрунтованості А) [СSS, 2008].
Скринінг слід проводити в основні перехідні моменти:
а) при надходженні пацієнта в інсультне відділення, особливо якщо в анамнезі є вказівки на епізоди депресії або мінливість настрою;
б) перед випискою додому або переведення у відділення реабілітації;
в) періодично (один раз на тиждень) впродовж реабілітаційного лікування у стаціонарі;
г) періодично (один раз на місяць) протягом 6 місяців після виписки.
— Мультидисциплінарна бригада при першій оцінці повинна з’ясувати, чи відзначалася раніше депресія у пацієнта (рівень обґрунтованості В) [СSS, 2008].
— Якщо передбачається ризик розвитку депресії у пацієнта, він повинен бути направлений до психіатра або психолога для подальшої оцінки та діагностики (рівень обґрунтованості В) [RCP, 2008].
— Пацієнти з легкими депресивними симптомами повинні спостерігатися в режимі «настороженого очікування», медикаментозне лікування починається тільки в тому випадку якщо депресія продовжується, цих пацієнтів слід залучати до одного або декількох із наступних заходів: збільшення соціальної активності, збільшення вправ, постановка цілей, інший психологічний вплив (рівень обґрунтованості А) [RCP, 2008].
— Пацієнти з діагностованою депресією повинні отримувати антидепресанти за відсутності протипоказань. Немає встановлених рекомендацій для переваг використання якого-небудь одного класу антидепресантів перед іншими, однак профіль побічних ефектів свідчить, що інгібітори зворотного захвату серотоніну можуть бути кращими в цих пацієнтів (рівень обґрунтованості А) [AHA/ASA, 2007].
— Лікарська терапія може використовуватися для лікування післяінсультної емоційної лабільності (рівень обґрунтованості В) [ESO, 2008].
— Медикаментозна і немедикаментозна терапія рекомендується для поліпшення настрою (рівень обґрунтованості А) [ESO, 2008].
— У дорослих пацієнтів із тяжкою, тривалою плаксивістю або плаксивістю, що завдає занепокоєння, інгібітори зворотного захвату серотоніну рекомендовані як препарати вибору (рівень обґрунтованості А) [AHA/ASA, 2007; RCP, 2008].
— Повинен проводитися моніторинг лікування, яке слід продовжувати мінімум 6 місяців після досягнення гарної відповіді (рівень обґрунтованості А) [СSS, 2008].
— Всі пацієнти з очевидними симптомами депресії повинні пройти ретельний скринінг на предмет гіпоактивного делірію (рівень обґрунтованості С) [СSS, 2008].
— Рутинне застосування антидепресантів із метою профілактики в інсультних пацієнтів не рекомендується (рівень обґрунтованості А) [AHA/ASA, 2007; СSS, 2008; RCP, 2008].
— Пацієнтам повинно бути надано інформацію щодо наслідків інсульту та вплив захворювання на їхнє життя (рівень обґрунтованості A) [AHA/ASA, 2007; СSS, 2008].
— Пацієнтам з помітною тривогою має бути запропонована консультація психолога (рівень обґрунтованості В) [СSS, 2008; RCP, 2008].
— Пацієнти та особи, які доглядають за ними, потребують індивідуальної психосоціальної підтримки, яка повинна бути частиною тривалої програми відновлення після інсульту (рівень обґрунтованості А) [СSS, 2008].
15. Рання вторинна профілактика
Пацієнти після ішемічного інсульту або ТІА мають підвищений ризик повторного інсульту. Вторинна профілактика, розпочата відразу після судинної події, може знизити частоту розвитку повторного інсульту, інвалідизації і смертності. Пацієнти після ішемічного інсульту або ТІА потребують термінової діагностики з метою лікування судинної патології, усунення активних факторів ризику, гемодинамічно значущих стенозів та інших джерел емболії. Стандартні оціночні шкали можуть допомогти виділити пацієнтів із високим ризиком повторної події. Існує декілька факторів, за допомогою яких визначається ранній ризик наступного інсульту після ТІА: вік (> 60 років), цукровий діабет, тривалість симптомів (> 10 хв), рухові або мовні порушення під час ТІА, високий артеріальний тиск (> 140/90 мм рт.ст.). Узагальнення цих факторів привело до створення шкали ABCD-2, яка була валідизована в 4 когортних дослідженнях (додаток 1) [2].
Всі особи з гострим інсультом, у яких за допомогою нейровізуалізаційного дослідження був виключений первинний внутрішньочерепний крововилив так швидко, наскільки це можливо, бажано впродовж 24 годин, повинні прийняти АСК 160–300 мг per os або ректально 300 мг чи ентерально через зонд, якщо є дисфагія. Терапію АСК рекомендується продовжувати 2 тижні, впродовж яких буде визначена програма довготривалої вторинної профілактики.
Всі пацієнти з ТІА повинні отримати 160–300 мг АСК на добу так швидко, наскільки це можливо, якщо немає протипоказань.
Препаратом, рекомендованим ESO, з меншою кількістю побічних ефектів (загальних кровотеч, внутрішньочерепних крововиливів, а також ульцерогенезу) є трифлузал, який призначають у дозі 600 мг на добу [1].
В іншому випадку альтернативним варіантом може бути клопідогрель — доза навантаження складає 300 мг, потім 75 мг щодоби. Після проведення загальноклінічної і клініко-неврологічної оцінки, виконання необхідних досліджень та встановлення діагнозу проводиться обговорення індивідуальних факторів ризику та призначаються заходи довготривалої вторинної профілактики (див. відповідний розділ).
Хворим, які мали явища диспепсії на фоні терапії АСК, слід призначати блокатори протонної помпи разом з аспірином. У разі виникнення в пацієнта з гострим ішемічним інсультом алергічної реакції на аспірин хворому призначається трифлузал [3].
У гострому періоді рутинне призначення антикоагулянтної терапії не рекомендується [2].
Рекомендації
— Рекомендується використовувати шкалу ABCD-2 для виявлення пацієнтів із високим ризиком розвитку інсульту після ТІА з метою невідкладного обстеження і початку лікування (рівень обґрунтованості С) [СSS, 2008].
— Усі пацієнти з гострим інсультом повинні отримати 160 мг ацетилсаліцилової кислоти, або 600 мг трифлузалу, відразу ж після нейровізуалізаційного обстеження та виключення внутрішньомозкового крововиливу (рівень обґрунтованості А) [СSS, 2008].
— У пацієнтів з дисфагією АСК може бути призначена ентерально через назогастральний зонд або у вигляді ректальних супозиторіїв (рівень обґрунтованості А) [СSS, 2008].
— Усім пацієнтам з ТІА або малим інсультом відразу після виключення внутрішньочерепного крововиливу необхідно розпочати антитромбоцитарну терапію (рівень обґрунтованості А) [СSS, 2008].
— Пацієнтам, яким проводилася тромболітична терапія, призначення АСК слід відкласти на 24 години після останньої нейровізуалізації та виключення внутрішньомозкового крововиливу (рівень обґрунтованості А) [СSS, 2008].
— Терапія АСК (80–325 мг на добу) повинна продовжуватися невизначений час або доки альтернативна антитромбоцитарна терапія не буде призначена (рівень обґрунтованості А) [СSS, 2008].
— Невідкладно розпочинати терапію статинами не рекомендується у хворих на гострий інсульт (безпечним вважається початок терапії статинами через 48 годин після появи симптомів захворювання) (рівень обґрунтованості C) [NICE 2008].
— Хворі на гострий інсульт, які отримували статини до судинної події, повинні продовжувати приймати препарат надалі (рівень обґрунтованості C) [NICE 2008].
— Пацієнти з ТІА або малим інсультом і стенозом каротидних артерій > 70 % та окремі хворі з симптомним 50–69% стенозом іпсилатеральної каротидної артерії можуть бути кандидатами для ендартеректомії. Операція повинна бути проведена так швидко, наскільки це можливо, бажано впродовж 2 тижнів (рівень обґрунтованості А) [NICE 2008; ESO 2008].
— Пацієнти з ТІА або малим інсультом та фібриляцією передсердь повинні негайно розпочати прийом варфарину відразу після виключення внутрішньочерепного крововиливу з цільовим міжнародним нормалізованим співвідношенням (МНС) від 2 до 3 (рівень обґрунтованості А) [NICE 2008; ESO 2008].
— Усі фактори ризику цереброваскулярних захворювань повинні корегуватися агресивно як фармакологічними, так і нефармакологічними заходами для отримання оптимального контролю (рівень обґрунтованості А) [ESO 2008].
— Усі пацієнти з ТІА або малим інсультом, які курять, повинні покинути курити, що повинно досягатися як медикаментозними, так і немедикаментозними заходами (рівень обґрунтованості В) [ESO 2008].
Додаток 1. Шкала ABCD-2 [AHA/ASA, 2007]
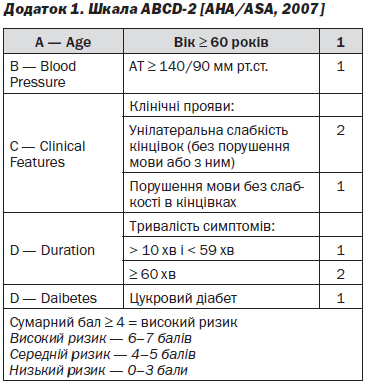
16. Управління якістю та індикатори якості лікування
Важливість оцінювання, моніторингу та підвищення якості медичної допомоги не викликає сумнівів. Прийнята в 1996 р. Європейським регіональним бюро ВООЗ Люблінська хартія «Про реформування охорони здоров’я в Європі» визначила безперервне покращення якості медичної допомоги та підвищення її ефективності як один із ключових принципів вдосконалення охорони здоров’я [1]. Підвищення якості і доступності медичної допомоги — це одне з найважливіших завдань державної політики в сфері охорони здоров’я громадян України, що зазначене в Законі України «Основи законодавства України про охорону здоров’я», Національному плані дій на виконання Указу Президента України № 1694/2005 від 06.12.2005 р. «Про невідкладні заходи щодо реформування системи охорони здоров’я населення», Указі Президента України № 70/2010 від 27.01.2010 р. «Про додаткові заходи щодо реформування системи охорони здоров’я населення» та багатьох інших нормативно-правових документах (http://zakon.rada.gov.ua).
Разом з тим кількісна оцінка якості охорони здоров’я та медичної допомоги є складним, коштовним та дуже вимогливим процесом, в якому попит громади та платників за медичну допомогу значно перевищують існуючі можливості. Щоб щось поліпшити, потрібно знати, що саме потребує поліпшення і як це оцінити. Щоб забезпечити поступ в цьому напрямку, широкі кола медичних працівників мають отримати відповідні знання та долучитися до оцінювання та поліпшення якості медичної допомоги.
16.1. Визначення якості медичної допомоги
Якість — це суб’єктивна ціннісна категорія, що не має змісту, специфічного для певної системи чи організації. Провідними характеристиками якісної медичної допомоги є виконання професійних медичних стандартів і відповідність медичної допомоги інтересам пацієнта. Існують декілька визначень якості медичної допомоги:
— Якість медичної допомоги визначається використанням медичної науки і технології з найбільшою користю для здоров’я людини, але без збільшення ризику. Рівень якості, таким чином, це співвідношення вигоди і ризику для здоров’я.
— Якість медичної допомоги — це ступінь, в якому медичні послуги на індивідуальному та популяційному рівні збільшують ймовірність бажаних результатів та відповідають сучасному рівню професійних знань.
— Під якістю медичної допомоги розуміють процес взаємодії лікаря та пацієнта, заснований на професіоналізмі лікаря, тобто його здатності знижувати ризик прогресування захворювання в пацієнта та виникнення нового патологічного процесу, оптимально використовувати ресурси медицини та забезпечити задоволеність пацієнта наданою йому медичною допомогою.
16.2. Клінічні настанови та індикатори якості
Оцінка якості передбачає визначення та використання певних критеріїв, які називають індикаторами якості. Індикаторами якості обирають тільки частину характеристик якості, яка найбільш підходить для поліпшення якості допомоги, зовнішнього порівняння, публічного обговорення та, можливо, диференціації в оплаті. Індикатори якості передбачають можливість кількісної оцінки та дозволяють запропонувати певні дії для поліпшення якості. Індикатори якості — це чітко визначені стандарти медичної допомоги, з якими порівнюється те, що є в дійсності.
Оскільки існують клінічні настанови щодо лікування інсульту, створені на засадах доказової медицини, виникає природне бажання скористатися ними як індикаторами якості медичної допомоги. Насправді, клінічні настанови та індикатори якості мають спільне наукове підґрунтя і досить тісно пов’язані між собою. Проте між клінічними настановами та індикаторами якості є суттєва різниця. Клінічні настанови пишуться, щоб запропонувати діагностичні та лікувальні заходи для більшості хворих за різних обставин, і лікуючий лікар на власний розсуд вирішує, як і коли скористатися рекомендаціями, що містяться у клінічних настановах. На відміну від цього індикатори якості вважаються складовою стандартів надання допомоги, і дії лікаря, який не дотримується цих стандартів, можуть бути розцінені як помилкові. Зважаючи на це, індикатори якості поряд з чітким описанням діагностичних та лікувальних заходів, що мають бути виконані, мають містити інформацію про те, яким чином на практиці відрізнити тих хворих, щодо яких ці заходи мають бути вжиті.
Наведення індикаторів якості є важливим доповненням до клінічних настанов. Індикатори якості не тільки дозволяють експертам розробити способи оцінювання якості медичної допомоги, але й можуть бути потужним засобом для якомога більш швидкого перенесення наукових досягнень у клінічну практику.
16.3. Базові компоненти якості медичної допомоги
Починаючи з робот проф. А. Donabedian, виділяють 3 аспекти медичної допомоги, що дозволяють оцінювати її якість: структура, процес та результати лікування [2]. Останнім часом також використовують індикатори економічної ефективності, які об’єднують витрати та результати лікування. Під структурою маються на увазі основні елементи, які створюють умови для надання якісною медичної допомоги: кваліфікація персоналу, матеріальні та людські ресурси для діагностики та лікування, система мобілізації цих ресурсів для надання допомоги хворим. Під процесом розуміють проведення відповідних діагностичних та лікувальних заходів у кожному випадку. Зазвичай під час оцінювання процесу обчислюється відношення числа хворих, у яких було проведено певне діагностичне чи лікувальне втручання, до числа хворих, яким воно було показане або не було протипоказане. Термін «результати лікування» вживають для позначення клінічно значущих наслідків захворювання та/або результатів лікування у певний проміжок часу. При інсульті результати лікування включають показники прогресування/ускладнень захворювання (смерть, повторний інсульт, інфаркт міокарда, деменція, повторна госпіталізація тощо), стану здоров’я хворого (неврологічний дефіцит, обмеження життєдіяльності, якість життя), навантажень під час догляду за хворим та економічних витрат. Розподіл медичної допомоги на означені компоненти вважається загальновизнаним, і його слід дотримуватись під час оцінювання та поліпшення якості допомоги хворим на інсульт.
16.4. Якість медичної допомоги хворим на інсульт
Попри те, що інсульт є величезною медико-соціальною проблемою в усьому світі, проведено мало дослі-джень, метою яких була розробка індикаторів якості медичної допомоги та оцінювання їх впливу на результати лікування. Індикатори якості, які ми маємо на сьогодні, відображують лише фрагменти допомоги, і є небезпека, що ми не звертаємо належної уваги на деякі важливі аспекти. Разом з тим існують переконливі докази того, що організований підхід до надання допомоги при інсульті дозволяє зменшити летальність, поліпшити функціональний стан пацієнта в подальшому та скоротити витрати. Конкретні фактори, що пов’язані з кращими результатами, та відносний вплив кожного з них на якість медичної допомоги необхідно визначити у майбутніх дослідженнях.
Наразі немає золотого стандарту (комплексу індикаторів якості), який би повною мірою дозволив порівнювати різни установи за загальною якістю медичної допомоги при інсульті, але вже є достатньо даних для того, щоб виокремити деякі індикатори якості, що характеризують ключові аспекти допомоги та дозволять охарактеризувати та поліпшувати якість всередині лікувальних закладів. Робоча група з інсульту Американської асоціації серця у 2000 р. запропонувала індикатори якості щодо структури, процесу та результату у 6 найважливіших доменах лікування ішемічного інсульту: організація допомоги, діагностика, збереження нервової тканини, запобігання ускладненням, початок вторинної профілактики та відновлення функцій [3].
16.4.1. Індикатори якості структури
Найбільшими недоліками індикаторів якості структури є те, що, з одного боку, досить складно продемонструвати їх зв’язок з результатами лікування, з іншого боку, вони рідко дають можливість швидко провести зміни, які поліпшать ситуацію. За відсутності структурних індикаторів якості, які мають доведений позитивний вплив на результати лікування інсульту, ми змушені обмежитись мінімальними стандартами, які будуть придатними для широкого кола лікувальних закладів.
1. Заходи щодо поліпшення якості. В лікувальному заході мають бути механізми моніторингу процесу надання допомоги хворим на інсульт та відповідних результатів лікування. Найважливішим є те, щоб медичні заклади спрямовували зусилля на виконання рекомендацій клінічних настанов у повсякденній роботі. Одночасно або постійно оцінювати всі показники, мабуть, недоцільно, але така діяльність має бути послідовною.
2. Компетентність співробітників. Медичні працівники, які надають допомогу хворим з інсультом, повинні мати принаймні базову підготовку з інсульту та сучасних принципів його лікування, а також з медичної допомоги при невідкладних станах.
3. Локальні протоколи. У закладах, які надають допомогу хворим із гострим інсультом, мають бути власні клінічні протоколи та маршрути пацієнта. Щонайменше мають бути протокол невідкладної допомоги хворому на інсульт (діагностичні та лікувальні заходи) та протокол внутрішньовенної тромболітичної терапії, який включає критерії відбору, координацію дій та безпосередньо протокол лікування та спостереження. Протокол тромболітичної терапії необхідний для уникнення втрат часу та виконання рекомендацій клінічних настанов (це має оцінюватись).
4. Візуалізація мозку. Оскільки клінічний огляд не дозволяє надійно виключити структурні відхилення, які можуть імітувати інсульт, та розрізнити ішемічний та геморагічний інсульт, нейровізуалізація посідає провідне місце в діагностиці гострого інсульту. Кожному хворому з підозрою на гострий інсульт має бути забезпечена можливість невідкладно зробити комп’ютерну томографію (КТ) або магнітно-резонансну томографію (МРТ).
5. Доступність нейрохірургічної допомоги. Допомога хворим має надаватись на тому рівні, якого вони потребують. Хворим з інсультом, при якому може бути потрібне хірургічне лікування (наприклад, субарахноїдальний крововилив, інсульт у мозочку з мас-ефектом), має бути забезпечений доступ до послуг нейрохірурга.
16.4.2. Індикатори якості процесу
У лікарнях, де пильно слідкували за індикаторами якості процесу, результати лікування інсульту були кращими. Тому саме на цих індикаторах зосереджено основну увагу тих, хто працює над поліпшенням якості допомоги хворим з інсультом.
1. Документація плану лікування. В історії хвороби має бути відображений план діагностичних та лікувальних заходів.
2. Початковий огляд. Найважливіше, щоб під час початкового огляду було встановлено точний діагноз та зібрано якомога повніші відомості про супутні захворювання, які можуть вплинути на лікування. Першочергову увагу слід приділяти скануванню мозку (КТ або МРТ), реєстрації електрокардіограми (для виявлення фібриляції передсердь та ішемії міокарда) та визначенню рівня глюкози крові (гіпоглікемія може нагадувати інсульт і потребує негайного лікування).
3. Невідкладне лікування. Хоча існує мало лікувальних втручань, що дозволяють обмежити по-шкодження мозку, чимало заходів можуть зменшити (або збільшити) ризик поганих результатів лікування при інсульті. Внутрішньовенна тромболітична терапія має виконуватись відповідноі до діючих міжнародних та національних клінічних настанов (зокрема рекомендацій Американської інсультної асоціації). Але оскільки її використовують лише у невеликої частини хворих з ішемічним інсультом, першочергову увагу слід приділяти наступним 3 індикаторам: призначення ацетилсаліцилової кислоти (АСК) в перші 48 год від початку захворювання (одразу після виключення внутрішньочерепного крововиливу за допомогою томографії), утримання від антигіпертензивних засобів (за відсутності показань до невідкладного зниження артеріального тиску) та зниження температури тіла, якщо вона становить ≥ 38,0 °С.
4. Профілактичні заходи. По-перше, практично всім хворим з ішемічним інсультом на момент виписки з лікарні мають бути призначені антигіпертензивні засоби та/або антитромботичні (антиагреганти або антикоагулянти). По-друге, хворому та його близьким має бути надано інформацію про індивідуальні фактори ризику інсульту, подальшу профілактику, перші симптоми інсульту та дії в разі їх появи.
5. Оцінка функціонального стану та план реабілітації. Медична документація має включати відомості не лише про неврологічний дефіцит, але й про функціональний стан хворого після інсульту з оцінкою потреби в сторонній допомозі та планом необхідних реабілітаційних заходів (допомога кінезіотерапевта, ерготерапевта, логопеда, психолога, соціального працівника тощо).
16.4.3. Індикатори якості результатів лікування
Результати лікування є мірою успішності надання медичної допомоги. При таких захворюваннях, як інсульт, важливо приділяти увагу саме тому, що має найбільше значення для хворого, тобто зосередити увагу на так званих пацієнт-орієнтованих результатах лікування (смерть, функціональний стан, якість життя). Вивчення та порівняння якості медичної допомоги за індикаторами якості результатів лікування є складною справою, адже на результати лікування поряд зі структурою та процесом допомоги можуть суттєво впливати інші чинники, передусім відмінності у вихідних характеристиках хворих (вік, стать, стан здоров’я до інсульту, тяжкість інсульту та супутніх захворювань тощо). Щоб зробити порівняння більш коректними, слід вносити поправки на кількісні оцінки ризику (прогнозу) та вивчати достатньо великі вибірки. Однак на сьогодні не існує методів, що дозволяють повною мірою врахувати вихідні відмінності та побічні чинники, що мають вплив на результати лікування при інсульті.
Ураження мозку може мати багато різних проявів (неврологічних, когнітивних, афективних, функціональних тощо). Невеликі вогнища можуть призводити до катастрофічних наслідків, які не завжди асоціюються з явними порушеннями. Індикатори якості результатів лікування мають відповідати загальним цілям: збереження мозку (летальність та інвалідність), профілактика ускладнень (пневмонія, тромбоз глибоких вен, летальність), вторинна профілактика (повторний інсульт, інфаркт міокарда, судинна смерть) та відновлення функцій (інвалідність та якість життя).
Досліджуючи результати лікування, слід обрати не тільки відповідні засоби (шкали), а й терміни оцінювання. У переважної більшості хворих відновлення значною мірою відбувається впродовж 1–3 міс. після інсульту. Проте деякою мірою відновлення продовжується і в подальшому. Задля поліпшення якості допомоги в гострому періоді інсульту рекомендується оцінювати результати лікування через 1 міс. від початку захворювання.
16.5. Найважливіші індикатори якості при ішемічному інсульті
Серед численних індикаторів якості медичної допомоги при інсульті 3 мають докази рівня А: лікування в інсультному блоці (Stroke Unit), призначення варфарину при фібриляції передсердь та антитромботичних засобів перед випискою з лікарні. Більшість експертів вважає важливими ще 5 індикаторів якості: призначення АСК у перші 48 год, візуалізація мозку у перші 24 год, візуалізація сонних артерій, розгляд можливості проведення тромболітичної терапії (за локальним протоколом) та рання мобілізація (впродовж перших 24–48 год).
Нещодавно з’явилася публікація консенсусу декількох провідних організацій США, що опікуються питаннями якості медичної допомоги (Об’єднана комісія, Американська асоціація серця, Центри з контролю та профілактики захворювань та Національний форум з якості); ці організації узгодили 10 найважливіших індикаторів якості процесу медичної допомоги при ішемічному інсульті (табл. 16.1) [4].
16.6. Рекомендації
1. Всі лікувальні заклади, які надають допомогу хворим на інсульт, мають брати участь у заходах з підвищення якості медичної допомоги, включаючи оцінювання за індикаторами якості та аудит (рівень обґрунтованості В) [NSF, 2010].
2. Під час оцінювання якості медичної допомоги та аудиту слід використовувати ряд індикаторів якості, що найбільше впливають на результати лікування та узгоджені з національними стандартами надання медичної допомоги хворим на інсульт (рівень обґрунтованості С) [NSF, 2010]. Ми пропонуємо використовувати 10 найважливіших індикаторів якості, що наведені в табл. 16.1.
17. Юридичні аспекти надання допомоги при гострому інсульті
Коментар робочої групи
Робоча група експертів вважає за необхідне додати цей розділ до адаптованих КН. Розділ написаний із використанням нормативних та юридичних документів України.
Первинна діагностика та встановлення початкового діагнозу «ішемічний інсульт» спирається на дані анамнезу, який лікуючий лікар (лікар швидкої допомоги) збирає зі слів самого пацієнта, його родичів або оточуючих (залежно від стану пацієнта).
У клінічному протоколі надання медичної допомоги хворим на ішемічний інсульт, який затверджено Наказом МОЗ України від 17.08.2007 р. № 487, зазначається, що усі хворі у гострому періоді підлягають терміновій госпіталізації, лікуванню та обстеженню в спеціалізованих інсультних відділеннях, або реанімаційних відділеннях, або нейрохірургічних відділеннях залежно від ступеня тяжкості хворого та методу лікування (хірургічного або консервативного) [7].
На догоспітальному та госпітальному етапах надання медичної допомоги пацієнту алгоритм дій лікаря визначається відповідно до положень «Основ законодавства України про охорону здоров’я» (далі — «Основ») [5].
17.1. Інформування
У першу чергу лікар, оцінивши стан пацієнта, повинен визначити подальший алгоритм інформування пацієнта (або осіб, які його супроводжують).
Наявний стан пацієнта є чинником, який визначає, хто є суб’єктом одержання від лікуючого лікаря медичної інформації.
Залежно від стану та віку пацієнта законодавство України розрізняє суб’єктів інформування та прийняття юридично значущих рішень щодо подальшого «медичного маршруту» пацієнта. Такими суб’єктами можуть бути:
1. Фізична особа, яка досягла чотирнадцяти років і яка звернулася за наданням їй медичної допомоги, має право на вибір лікаря та вибір методів лікування відповідно до його рекомендацій (ч. 2 ст. 284 Цивільного кодексу України (далі — ЦК)) [12].
2.Повнолітня фізична особа має право на достовірну і повну інформацію про стан свого здоров’я, у тому числі на ознайомлення з відповідними медичними документами, що стосуються її здоров’я (ч. 1 ст. 285 ЦК) [12]. Обмежено дієздатний (недієздатний) пацієнт має одержати інформацію про медичне втручання, пов’язаний з ним ризик і користь, у формі, доступній для його розуміння.
3. Батьки (усиновлювачі), опікун, піклувальник мають право на отримання інформації про стан здоров’я дитини або підопічного.
4. Особи, які супроводжують пацієнта (але не є його батьками (усиновлювачами, опікуном, піклувальником)), можуть бути суб’єктами одержання інформації про стан пацієнта у двох випадках: а) якщо, з точки зору лікаря, існує наявна загроза життю пацієнта — у невідкладних випадках, за наявності реальної загрози життю фізичної особи, медична допомога надається без згоди фізичної особи або її батьків (усиновлювачів), опікуна, піклувальника (ч. 5 ст. 284 ЦК) [12]; б) якщо сам пацієнт визначив осіб, які його супроводжують, як суб’єктів, яким лікар може повідомити відповідну інформацію.
Якщо пацієнта ніхто не супроводжує, а його стан та обставини його госпіталізації не дозволяють лікарю з’ясувати наявність/відсутність родичів (опікуна, піклувальника), лікар повинен діяти в найкращих інтересах пацієнта та з метою рятування його життя.
17.2. Одержання згоди на медичне втручання (комплекс медичних втручань)
Одержання добровільної інформованої згоди пацієнта на будь-яке медичне втручання сьогодні є основоположним принципом належного професійного спілкування медичного працівника та пацієнта. Чимало документів міжнародного права та численні акти національних законодавств розвинутих країн світу містять вимоги щодо одержання та оформлення інформованої згоди пацієнта. Серед міжнародно-правових документів — Лісабонська декларація про права пацієнта, ухвалена на 34-й сесії Всесвітньої медичної асоціації (1981) та доповнена на 47-й сесії (1995), а також Конвенція про захист прав і гідності людини щодо застосування біології та медицини (Конвенція про права людини та біомедицину) (Ов’єдо, 4 квітня 1997 року), яку підписала й Україна. Зокрема, ст. 5 вказаної Конвенції встановлює загальне правило, що «Будь-яке втручання у сферу здоров’я може здійснюватися тільки після добровільної та свідомої згоди на нього відповідної особи. Такій особі заздалегідь надається відповідна інформація про мету і характер втручання, а також про його наслідки та ризики. Відповідна особа у будь-який час може безперешкодно відкликати свою згоду» [3]. Аналіз законодавств країн ЄС свідчить, що сучасні європейські конституції містять положення щодо необхідності одержання інформованої згоди людини на будь-яке втручання, пов’язане з її здоров’ям [6].
У ст. 28 Конституції України відтворено принцип добровільної інформованої згоди людини на будь-яке медичне втручання: «Жодна людина без її вільної згоди не може бути піддана медичним, науковим чи іншим дослідам» [4].
Декларація про розвиток прав пацієнтів у Європі (1994), яку було ухвалено на консультаційній нараді під егідою регіонального представництва ВООЗ у Європі, містить наступні положення, що красномовно свідчать про загальноєвропейські принципи одержання інформованої згоди пацієнтів:
«Необхідною умовою для будь-якого медичного втручання є згода, надана пацієнтами на це втручання. Пацієнт має право відмовитися від медичного втручання чи призупинити його. Ускладнення, пов’язані з відмовою чи призупиненням втручання, мають бути чітко пояснені пацієнтові.
У випадку, коли пацієнт не здатний висловити своє бажання і необхідно терміново вчинити медичне втручання, вважається, що пацієнт згоден на проведення процедури, якщо тільки з раніше зробленої ним заяви не стає цілком очевидним, що в такій ситуації пацієнт висловив би свою відмову.
У випадку, коли для термінового необхідного медичного втручання необхідно отримати згоду від юридичного представника пацієнта, таке втручання може бути здійснене, якщо немає можливості отримати вчасно згоду представника» [1].
«Міжнародні етичні рекомендації для біомедичних досліджень за участю людських істот», підготовлені Радою міжнародних організацій медичних наук спільно з ВООЗ (2002), містять положення щодо необхідності одержання інформованої згоди людей — добровольців у біомедичних дослідженнях [13].
Відповідно до Зведення методичних рекомендацій з питань політики та надання послуг у царині психічного здоров’я (Mental health legislation and humah rights. Geneva, World Health Organization, 2003 (Mental Health Policy and Service and Guidance Package)) «Законодавство у царині психічного здоров’я та права людини», законодавством має бути приписано здійснення будь-якого лікувального втручання на підставі добровільної та інформованої згоди, за винятком обставин, що інколи виникають. Згода не може вважатися законною, якщо її отримано під тиском явної чи такої, що передбачається, загрози примусу або якщо не було висунуто для розгляду альтернативні пропозиції щодо курсу лікування. У законодавстві має бути перед-бачене добровільне лікування (тобто за умови одержання інформованої згоди) тих хворих, які були добровільно госпіталізовані. Пацієнти, що були госпіталізовані примусово, також мають проходити лікування на добровільній основі, за винятком поодиноких конкретних випадків, наприклад, коли такі хворі виявляються недієздатними висловити свою згоду і коли їх лікування є необхідним для покращення психічного здоров’я, та/або для запобігання значного погіршення психічного здоров’я, та/або для запобігання небезпечних дій щодо оточуючих [2].
Загальні підстави одержання інформованої згоди пацієнта визначено в «Основах законодавства про охорону здоров’я». Згода інформованого пацієнта необхідна для застосування методів діагностики, профілактики та лікування. Щодо пацієнта віком до 14 років (малолітнього пацієнта), а також пацієнта, визнаного в установленому законом порядку недієздатним, медичне втручання здійснюється за згодою їх законних представників (ч. 1 ст. 43 «Основ») [5]. Якщо відсутність згоди може призвести до тяжких для пацієнта наслідків, лікар зобов’язаний йому це пояснити. Якщо і після цього пацієнт відмовляється від лікування, лікар має право взяти від нього письмове підтвердження, а при неможливості його одержання — засвідчити відмову відповідним актом у присутності свідків. Якщо відмову дає законний представник пацієнта і вона може мати для пацієнта тяжкі наслідки, лікар повинен повідомити про це органи опіки й піклування (ч. 3, 5 ст. 43 «Основ») [5].
Для окремих видів медичних втручань в Україні вже розроблено рекомендовані форми для письмової фіксації інформованої згоди пацієнтів. Так, Наказ МОЗ України «Про затвердження Протоколу надання медичної допомоги хворим на туберкульоз» від 09.06.2006 № 384 (додаток в розділі VIII) містить Форму інформованої добровільної згоди пацієнта при виконанні протоколу [9]. А наказ МОЗ України «Про затвердження форми первинної облікової документації № 063-2/о «Інформована згода та оцінка стану здоров’я особи або дитини одним з батьків або іншим законним представником дитини на проведення щеплення або туберкулінодіагностики» та Інструкції щодо її заповнення» від 31.12.2009 № 1086 (зареєстрований в Мін’юсті України 2 серпня 2010 р. за № 594/17889) описує алгоритм одержання вказаної інформованої згоди [10].
З огляду на медичну та юридичну значущість одержання та фіксації добровільної інформованої згоди пацієнта (його законного представника) на надання медичної допомоги при гострому інсульті, а також враховуючи той факт, що в Україні відсутні нормативно-правові документи, які б містили форми інформованої згоди пацієнтів (їх законних представників) при гострому інсульті, робоча група експертів вважає за необхідне включити рекомендовані форми до адаптованих КН (див. додатки до розділу).
Залежно від особливостей суб’єкта одержання інформації, охарактеризованих вище, суб’єкти надання інформованої згоди на медичне втручання також будуть розрізнятися.
Якщо пацієнт — неповнолітня особа, яка досягла чотирнадцяти років, формуляр інформованої згоди на медичне втручання (комплекс медичних втручань) мають підписати сам пацієнт та його законний представник (один з батьків або піклувальник).
Якщо пацієнт — повнолітня фізична особа, яка не має явних ознак когнітивного дефіциту, він підписує формуляр інформованої згоди особисто.
У випадках, якщо стан пацієнта не дозволяє йому власноруч підписати формуляр інформованої згоди, пацієнт може дати усну згоду в присутності щонайменше одного свідка, який засвідчує згоду пацієнта в письмовій інформованій згоді (Наказ МОЗ України «Про затвердження Порядку проведення клінічних випробувань лікарських засобів та експертизи матеріалів клінічних випробувань і Типового положення про комісії з питань етики» від 23.09.2009 № 690 (зареєстр. в Мін’юсті України 29 жовтня 2009 р. за № 1010/17026)) [8].
У випадках, коли пацієнт в силу свого клінічного стану неспроможний самостійно дати інформовану згоду, необхідно отримати інформовану згоду законного представника, а в разі його відсутності — близьких родичів. Близькими родичами є чоловік/дружина, батьки, діти, рідні брати і сестри [8].
Якщо пацієнт — повнолітня фізична особа, дієздатність якої обмежена, що підтверджується відповідними документами (рішенням суду), наданими особами, які супроводжують такого пацієнта, формуляр інформованої згоди має підписувати сам пацієнт, за згодою піклувальника. Правочини, що виходять за межі дрібних побутових, вчиняються особою, цивільна дієздатність якої обмежена, за згодою піклувальника (ч. 3 ст. 37 ЦК) [12].
Якщо пацієнт — повнолітня фізична особа, визнана у встановленому законом порядку недієздатною, що підтверджується відповідними документами (рішенням суду), наданими особами, які супроводжують такого пацієнта, формуляр інформованої згоди має підписувати опікун пацієнта.
Якщо пацієнта супроводжують особи, які не є його піклувальником чи опікуном, а стан пацієнта не дозволяє зволікати, щоб з’ясувати волю опікуна/піклувальника, лікар може надати медичну допомогу без згоди зазначених осіб, зробивши про це запис в медичній документації пацієнта.
Якщо пацієнт — повнолітня фізична особа, щодо якої у лікаря немає інформації, чи обмежена дієздатність такої особи, лікар повинен керуватися презумпцією психічного здоров’я, викладеною у ст. 3 ЗУ «Про психіатричну допомогу»: «Кожна особа вважається такою, яка не має психічного розладу, доки наявність такого розладу не буде встановлено на підставах та в порядку, передбачених цим Законом та іншими законами України» [11]. Тому в цьому випадку формуляр інформованої згоди підписує сам пацієнт. У всіх випадках лікар повинен діяти в найкращих інтересах пацієнта.
Відповідно до ст. 66 ЦК, якщо над фізичною особою, яка перебуває у закладі охорони здоров’я або закладі соціального захисту населення, не встановлено опіку чи піклування або не призначено опікуна чи піклувальника, опіку або піклування над нею здійснює цей заклад [12]. Тому під час перебування у медичному закладі на лікуючого лікаря (як представника закладу) покладаються обов’язки опікуна такого пацієнта (дбати про підопічного, про створення йому необхідних побутових умов, забезпечення його доглядом та лікуванням; вчиняти правочини від імені та в інтересах підопічного та вживати заходів щодо захисту цивільних прав та інтересів підопічного).
Якщо у процесі огляду пацієнта лікар одержав відомості, які дають достатні підстави для обґрунтованого припущення про наявність у пацієнта тяжкого психічного розладу, внаслідок чого пацієнт:
— вчиняє чи виявляє реальні наміри вчинити дії, що являють собою безпосередню небезпеку для нього самого чи оточуючих, або
— неспроможний самостійно задовольняти свої основні життєві потреби на рівні, який забезпечує його життєдіяльність, або
— завдасть значної шкоди своєму здоров’ю у зв’язку з погіршенням психічного стану у разі ненадання психіатричної допомоги,
лікар (який має будь-яку медичну спеціальність), відповідно до ч. 2, 3 ст. 11 ЗУ «Про психіатричну допомогу», може звернутися з заявою про проведення лікарем-психіатром психіатричного огляду пацієнта без його усвідомленої згоди або без згоди його законного представника (якщо він невідомий на момент огляду пацієнта). Порядок проведення психіатричного огляду регламентується ЗУ «Про психіатричну допомогу» [11].
17.3. Лікування
Загальні принципи лікування хворих на інсульт можна вважати універсальними для будь-якого медичного втручання:
1. Принцип нешкідливості. Медичне втручання допускається лише в тому разі, коли воно не може завдати шкоди здоров’ю пацієнта (ч. 1 ст. 42 «Основ») [5].
2. Принцип наукової обґрунтованості.
3. Принцип свободи вибору пацієнта (право на вільний вибір лікаря та вибір методів лікування відповідно до його рекомендацій (ч. 1 ст. 38 «Основ») [5].
4. Принцип поінформованості (ч. 3 ст. 39 «Основ») [5].
5. Принцип відносної шкоди (порівняння лікарем потенційної шкоди від залишення пацієнта у небезпеці (при реальній загрозі) та потенційної шкоди від надання допомоги без попередньої згоди пацієнта). Лікар, приймаючи рішення про медичне втручання без згоди пацієнта, бере на себе повну відповідальність за наслідки медичного втручання і подальший стан пацієнта.
Важливим аспектом процесу лікування та реабілітації пацієнта, хворого на інсульт, є план лікування, який, за загальним правилом, лікуючий лікар має узгодити з пацієнтом (законним представником пацієнта). Разом з тим у випадку погіршення стану пацієнта та виникнення необхідності негайного вжиття заходів, які лікар вважає доцільними, останній має право змінити зазначений план лікування, діючи в найкращих інтересах пацієнта.
Законодавство України не містить чітко визначених юридичних фактів, які можуть розглядатися як підстава для заповнення пацієнтом (його законним представником) нового формуляру інформованої згоди. Доцільно заповнити такий новий формуляр інформованої згоди на комплекс реабілітаційних заходів у випадку суттєвої зміни (погіршення/покращення) стану пацієнта. Зокрема, такий формуляр інформованої згоди буде включати заходи щодо вторинної профілактики інсульту (заборона тютюнопаління та корекція інших факторів ризику, застосування антитромботичних препаратів, застосування антикоагулянтів непрямої дії, призначення статинів, каротидна ендартеректомія тощо).
Додаток 17.1.
Згода на комплекс медичних втручань пацієнта, хворого на інсульт
Я, (прізвище ім’я та по батькові), рік народження ________, проживаю за адресою: (повна поштова адреса, домашній телефон) даю добровільну згоду на здійснення нижчезазначеного комплексу медичних втручань.
Мені в зрозумілій для мене формі було роз’яснено інформацію про мій наявний стан та медичні наслідки зволікання щодо негайної госпіталізації в інсультне відділення, в т.ч. лікар (прізвище ім’я та по батькові) пояснив мені концепцію «терапевтичного вікна» (3–6 годин), впродовж яких надання медичної допомоги буде найбільш ефективним.
У тому числі я мав можливість поставити лікарю (прізвище ім’я та по батькові) питання про причини такого стану, мету та характер проведення запропонованих лікарем діагностичних заходів, зокрема таких:
Комп’ютерна томографія головного мозку ______ ______________________; магнітно-резонансна томографія____________; транскраніальна допплерографія_______; церебральна ангіографія_________; аналіз крові клінічний _________________; аналіз крові на ВІЛ; аналіз крові на HBs-антиген; RW; біохімічний аналіз крові _____________________________; аналіз сечі клінічний ____________; ЕКГ_____________; рентгенографія органів грудної клітини __________; рентгенографія черепа _________________________; консультація терапевта ______________; консультація офтальмолога ______________________; консультація нейрохірурга _______________________.
Додаткові діагностичні заходи (за показаннями): консультація ендокринолога________; ЕЕГ при наявності судомного синдрому _____________.
Я одержав відповіді на всі мої запитання, поставлені лікарю (лікарям).
Я мав можливість переконатися, що повідомлені мною дані про мої хронічні захворювання, у тому числі інформація про наявність будь-яких судинних захворювань (нещодавно перенесений інфаркт міокарда, миготлива аритмія, атеросклероз судин нижніх кінцівок і т.д.) чи інших факторів ризику …, схильність до алергічних реакцій на …препарати (додати необхідне) розбірливо та повно зафіксовані лікарем у медичній документації.
Я одержав інформацію про діагноз, особливості перебігу хвороби і прогноз очікуваного перебігу захворювання. Мені було надано можливість довідатися про досвід лікування таких станів лікарем (прізвище ім’я та по батькові) і я не маю сумнівів щодо його компетенції та досвіду.
Мені було роз’яснено передбачене законодавством України право вимагати заміни лікаря та моє право під час перебування на стаціонарному лікуванні в закладі охорони здоров’я інших медичних працівників, членів сім’ї, опікуна, піклувальника, нотаріуса та адвоката, а також священнослужителя для відправлення богослужіння та релігійного обряду.
У доступній формі мені було роз’яснено сутність запропонованих лікарем медичних втручань, зокрема таких ____________________________________________(додати необхідне).
Мені було пояснено та зі мною узгоджено план лікування. Разом з тим я визнаю право лікаря змінити зазначений план у разі виникнення ускладнень у ході лікування та необхідності негайного вжиття заходів, які лікар вважає доцільними.
Я поінформований про необхідність виключити з раціону харчування впродовж днів (місяців) наступні продукти: (додати необхідне). Я попереджений про можливі медичні наслідки недотримання цих рекомендацій.
Я поінформований про можливі ускладнення у процесі лікування, що може проявлятися у _____________________ (додати необхідне). Мені детально пояснено інформацію про можливу побічну дію призначених лікарських засобів, що може виявлятися у __________ (додати необхідне). Я цілком усвідомлюю, що у разі недотримання рекомендацій лікаря шанси на одужання та реабілітацію суттєво зменшуються.
У випадку погіршення мого стану прошу узгодити подальший план лікування та реабілітації з наступною особою (наступними особами): ______________________________________________________________.
Я усвідомлюю об’єктивну неможливість повного гарантування прогнозованого лікарем позитивного ефекту лікування, разом з тим я певен, що здійснення запропонованих діагностичних, лікувальних та реабілітаційних заходів повністю відповідає моїм інтересам.
Я усвідомлюю, що тривалість реабілітації є індивідуальною і залежить від термінів відновлення порушених функцій, що може відбуватися впродовж від__________до____ ___ місяців.
Я знаю, що відомості про характер та мету запропонованих медичних втручань є строго конфіденційними і не можуть бути піддані розголосу. Відповідно до ч. 2 ст. 7 ЗУ «Про захист персональних даних» від 1.06.2010 р. № 2297-VI, обробка моїх персональних даних необхідна в цілях охорони здоров’я, для забезпечення піклування чи лікування та здійснюється за умови, що такі дані обробляються медичним працівником або іншою особою закладу охорони здоров’я, на якого покладено обов’язки щодо забезпечення захисту персональних даних.
Згоду на проведення медичних втручань даю добровільно, без будь-якого натиску з боку лікарів чи адміністрації ЛПЗ. Цю добровільну згоду скріплюю власноручним підписом.
«Прочитав і згоден із цим текстом» «______»________20___ р. (підпис)_____________ .
Підпис лікаря _______________________
Додаток 17.2
Згода на комплекс медичних втручань
законного представника пацієнта, хворого на інсульт
Я, (прізвище ім’я та по батькові), рік народження ________, проживаю за адресою: (повна поштова адреса, домашній телефон) як законний представник даю добровільну згоду на здійснення нижчезазначеного комплексу медичних втручань пацієнту (прізвище ім’я та по батькові)), рік народження ________.
Мені в зрозумілій для мене формі було роз’яснено інформацію про наявний стан пацієнта (прізвище ім’я та по батькові) та медичні наслідки зволікання щодо його негайної госпіталізації в інсультне відділення, в т.ч. лікар (прізвище ім’я та по батькові) пояснив мені концепцію «терапевтичного вікна» (3–6 годин), впродовж яких надання медичної допомоги буде найбільш ефективним.
У тому числі я мав можливість поставити лікарю (прізвище ім’я та по батькові) питання про причини такого стану, мету та характер проведення запропонованих лікарем діагностичних заходів, зокрема таких:
Комп’ютерна томографія головного мозку ____________; магнітно-резонансна томогра-фія________; транскраніальна допплерографія________; церебральна ангіографія_______; аналіз крові клінічний _________________; аналіз крові на ВІЛ; аналіз крові на HBs-антиген; RW; біохімічний аналіз крові _____________________________; аналіз сечі клінічний_________; ЕКГ_______; рентгенографія органів грудної клітки_________; рентгенографія черепа_________; консультація терапевта_______; консультація офтальмолога___________; консультація нейрохірурга_____________.
Додаткові діагностичні заходи (за показаннями): консультація ендокринолога________; ЕЕГ при наявності судомного синдрому_____________.
Я одержав відповіді на всі мої запитання, поставлені лікарю (лікарям).
Я мав можливість переконатися, що повідомлені мною дані про відомі мені хронічні захворювання пацієнта (прізвище), у тому числі інформація про наявність будь-яких судинних захворювань (нещодавно перенесений інфаркт міокарда, миготлива аритмія, атеросклероз судин нижніх кінцівок і т.д.) чи інших факторів ризику …, схильність до алергічних реакцій на …препарати (додати необхідне) розбірливо та повно зафіксовані лікарем у медичній документації.
Я одержав інформацію про діагноз, особливості протікання хвороби пацієнта (прізвище) і прогноз очікуваного перебігу захворювання. Мені було надано можливість довідатися про досвід лікування таких станів лікарем (прізвище ім’я та по батькові) і я не маю сумнівів щодо його компетенції та досвіду.
Мені було роз’яснено передбачене законодавством України право вимагати заміни лікаря та право забезпечити допуск до пацієнта (прізвище) під час його перебування на стаціонарному лікуванні в закладі охорони здоров’я інших медичних працівників, членів сім’ї, опікуна, піклувальника, нотаріуса та адвоката, а також священнослужителя для відправлення богослужіння та релігійного обряду.
У доступній формі мені було роз’яснено сутність запропонованих лікарем медичних втручань, зокрема таких __________________________(додати необхідне).
Мені було пояснено та зі мною узгоджено план лікування. Разом з тим я визнаю право лікаря змінити зазначений план у разі виникнення ускладнень у ході лікування та необхідності негайного вжиття заходів, які лікар вважає доцільними.
Я поінформований про необхідність виключити з раціону харчування пацієнта (прізвище) впродовж днів (місяців) наступні продукти: (додати необхідне). Я попереджений про можливі медичні наслідки недотримання цих рекомендацій.
Я поінформований про можливі ускладнення в процесі лікування, що може проявлятися у _____________________ (додати необхідне). Мені детально пояснено інформацію про можливу побічну дію призначених лікарських засобів, що може виявлятися у __________ (додати необхідне). Я цілком усвідомлюю, що у разі недотримання рекомендацій лікаря шанси пацієнта (прізвище) на одужання та реабілітацію суттєво зменшуються.
Я усвідомлюю об’єктивну неможливість повного гарантування прогнозованого лікарем позитивного ефекту лікування, разом з тим я певен, що здійснення запропонованих діагностичних, лікувальних та реабілітаційних заходів повністю відповідає інтересам пацієнта (прізвище).
Відповідно до законодавства України (ч. 2 ст. 38 «Основ законодавства України про охорону здоров’я») я поінформований про власне право у випадку термінової необхідності звернутися за консультацією чи допомогою до лікаря, коли це виправдано станом пацієнта (прізвище).
Я усвідомлюю, що тривалість реабілітації пацієнта (прізвище) є індивідуальною і залежить від термінів відновлення порушених функцій, що може відбуватися впродовж _від__________до____ ___ місяців.
Я знаю, що відомості про характер та мету запропонованих медичних втручань є строго конфіденційними і не можуть бути піддані розголосу. Відповідно до ч. 2 ст. 7 ЗУ «Про захист персональних даних» від 1.06.2010 р. № 2297-VI, обробка персональних даних пацієнта (прізвище) необхідна в цілях охорони здоров’я, для забезпечення піклування чи лікування та здійснюється за умови, що такі дані обробляються медичним працівником або іншою особою закладу охорони здоров’я, на якого покладено обов’язки щодо забезпечення захисту персональних даних.
Згоду на проведення медичних втручань даю добровільно, без будь-якого натиску з боку лікарів чи адміністрації ЛПЗ. Цю добровільну згоду скріплюю власноручним підписом.
«Прочитав і згоден із цим текстом» «______»________20___ р. (підпис)_____________ Підпис лікаря _______________________
Додаток 17.3
Відмова від медичних втручань законного представника пацієнта, хворого на інсульт
Я, (прізвище ім’я та по батькові), рік народження ________, проживаю за адресою: (повна поштова адреса, домашній телефон) як законний представник відмовляюся від здійснення нижчезазначеного комплексу медичних втручань пацієнту (прізвище ім’я та по батькові)), рік народження ________.
Мені в зрозумілій для мене формі було роз’яснено інформацію про наявний стан пацієнта (прізвище ім’я та по батькові) та медичні наслідки зволікання щодо його негайної госпіталізації. У тому числі я мав можливість поставити лікарю (прізвище ім’я та по батькові) питання про причини такого стану, мету та характер проведення запропонованих лікарем діагностичних заходів, зокрема таких:
Компьютерна томографія головного мозку ____________; магнітно-резонансна томогра-фія________; транскраніальна допплерографія________; церебральна ангіографія_______; аналіз крові клінічний _________________; аналіз крові на ВІЛ; аналіз крові на HBs-антиген; RW; біохімічний аналіз крові _____________________________; аналіз сечі клінічний_________; ЕКГ_______; рентгенографія органів грудної клітки_________; рентгенографія черепа_________; консультація терапевта_______; консультація офтальмолога___________;
Додаткові діагностичні заходи (за показаннями): консультація ендокринолога________; ЕЕГ при наявності судомного синдрому_____________.
Я одержав відповіді на всі мої запитання. Я детально поінформований лікарем про важливість своєчасного проведення діагностичних та лікувальних заходів та наслідки зволікання щодо лікування, що може виявлятися у_______________. Я одержав інформацію про діагноз, особливості перебігу хвороби пацієнта (прізвище) і прогноз очікуваного перебігу захворювання.
Мені було роз’яснено передбачене законодавством України право вимагати заміни лікаря.
Я усвідомлюю, що відсутність згоди може призвести до тяжких для пацієнта (прізвище) наслідків, завдати значної шкоди його здоров’ю та створити небезпеку для його життя.
Я поінформований лікарем про обов’язок лікаря повідомити про мою відмову від діагностичних та лікувальних заходів органи опіки і піклування. Я цілком усвідомлюю власну відповідальність за життя та здоров’я пацієнта (прізвище) як його законний представник.
Мені роз’яснено, що, відповідно до «Основ законодавства України про охорону здоров’я», у разі моєї відмови від медичних приписів лікаря або порушення встановленого для пацієнта режиму лікар не несе відповідальності за здоров’я пацієнта (прізвище).
Одержанну від лікаря інформацію оцінюю як повну та достатню для прийняття остаточного відповідального рішення про відмову від госпіталізації пацієнта (прізвище). Цю відмову скріплюю власноручним підписом.
«Прочитав і згоден з цим текстом» «______»________20___ р. (підпис)_____________
Підпис лікаря ___________________
1. Декларация о развитии прав пациентов в Европе (1994). — Режим доступа: zdravinform.mednet.ru/pub/EU.1997.C.29.R.doc.
2. Законодательство в области психического здоровья и права человека: Свод методич. рек-ций по вопросам политики и оказания услуг в области псих. здоровья (Mental health legislation and humah rights. Geneva, World Health Organization, 2003 (Mental Health Policy and Service and Guidance Package) // ВОЗ, 2006. — Режим доступа: http://www.who.int/mental_health/policy/MH%20Legislation%20and%20Human%20Rights_ru.pdf.
3. Конвенція про захист прав і гідності людини щодо застосування біології та медицини: Конвенція про права людини та біомедицину (Ов’єдо, 4 квітня 1997 року) // Сайт законодавства України. — Режим доступу: http://zakon1.rada.gov.ua/cgi-bin/laws/main.cgi?nreg=994_334.
4. Конституція України від 28 червня 1996 р. // Сайт законодавства України. — Режим доступу: http://zakon1.rada.gov.ua/cgi-bin/laws/main.cgi?nreg=254%EA%2F96-%E2%F0.
5. Основи законодавства України про охорону здоров’я: Закон України вiд 19.11.1992 № 2801-XII (у редакції вiд 01.01.2012) // Сайт законодавства України. — Режим доступу: http://zakon1.rada.gov.ua/cgi-bin/laws/main.cgi?nreg=2801-12.
6. Права пациентов в Европейском Союзе. — Режим доступа: http://www.eu-patient.eu/Documents/Projects/Valueplus/Patients_Rights.pdf.
7. Про затвердження клінічних протоколів надання медичної допомоги за спеціальністю «Неврологія»: Наказ МОЗ України від 17.08.2007 № 487 // Неврология: Большой медицинский портал. — Режим доступу: http://neurology.com.ua/2010/08/04/nakaz-pro-zatverdzhennya-klinichnix-protokoliv-nadannya-medichnoyi-dopomogi-za-specialnistyu-nevrologiya.html.
8. Про затвердження Порядку проведення клінічних випробувань лікарських засобів та експертизи матеріалів клінічних випробувань і Типового положення про комісії з питань етики: Наказ МОЗ України від 23.09.2009 № 690 (Зареєст. в Мін’юсті України 29 жовтня 2009 р. за № 1010/17026) // Сайт законодавства України. — Режим доступу: http://zakon1.rada.gov.ua/cgi-bin/laws/main.cgi?nreg=z1010-09.
9. Про затвердження Протоколу надання медичної допомоги хворим на туберкульоз: Наказ МОЗ України від 09.06.2006 № 384 // Сайт МОЗ України. — Режим доступу: http://www.moz.gov.ua/ua/portal/dn_20060609_384.html.
10. Про затвердження форми первинної облікової документації № 063-2/о «Інформована згода та оцінка стану здоров’я особи або дитини одним з батьків або іншим законним представником дитини на проведення щеплення або туберкулінодіагностики» та Інструкції щодо її заповнення: Наказ МОЗ України від 31.12.2009 № 1086 (зареєстрований в Мін’юсті України 2 серпня 2010 р. за № 594/17889) // Сайт законодавства України. — Режим доступу: http://zakon.rada.gov.ua/cgi-bin/laws/main.cgi?nreg=z0594-10.
11. Про психіатричну допомогу: Закон України вiд 22.02.2000 № 1489-III (в редакції вiд 19.06.2007) // Сайт законодавства України. — Режим доступу: http://zakon1.rada.gov.ua/cgi-bin/laws/main.cgi?nreg=1489-14.
12. Цивільний кодекс України вiд 16.01.2003 № 435-IV (в редакції вiд 01.01.2012) // Сайт законодавства України. — Режим доступу: http://zakon1.rada.gov.ua/cgi-bin/laws/main.cgi?nreg=435-15.
13. International Ethical Guidelines for Biomedical Research Involving Human Subjects: Prepared by the Council for International Organizations of Medical Sciences (CIOMS) in collaboration with the World Health Organization (WHO), Geneva. — 2002. — Режим доступу: http://www.fhi360.org/training/fr/Retc/pdf_files/cioms.pdf.