Газета «Новости медицины и фармации» 4 (445) 2013
Вернуться к номеру
Кодеинсодержащие препараты: стоит ли их использовать?
Авторы: Савустьяненко А.В., доцент кафедры фармакологии Донецкого национального медицинского университета им. М. Горького
Рубрики: Семейная медицина/Терапия, Терапия
Разделы: Справочник специалиста
Версия для печати
 В мае 2012 г. в журнале Pediatrics — официальном издании Американской академии педиатрии — была опубликована тревожная статья со следующей аннотацией:
В мае 2012 г. в журнале Pediatrics — официальном издании Американской академии педиатрии — была опубликована тревожная статья со следующей аннотацией:
«В мае 2009 г. мы сообщали о факте смерти малыша, который получал кодеин после аденотонзиллэктомии, выполненной для борьбы с синдромом обструктивного апноэ во сне. Ребенок оказался ультрабыстрым метаболизатором по цитохрому P4502D6 (CYP2D6). В настоящей статье мы приводим 3 дополнительных фатальных или угрожающих жизни случая из Северной Америки. В 2 фатальных случаях дупликации функционального гена, кодирующего CYP2D6, обусловили достоверно большую продукцию более сильного вещества морфина из родительского препарата кодеина. В 1 случае у ребенка, который был быстрым метаболизатором, развилась тяжелая респираторная депрессия. Приведенные случаи свидетельствуют о том, что анальгезия кодеином или другими опиоидами, которые метаболизируются с помощью цитохрома CYP2D6, может быть небезопасной у детей младшего возраста, которым выполнили аденотонзиллэктомию для борьбы с синдромом обструктивного апноэ во сне» [1].
Заслуживает внимания тот факт, что двое из троих описанных в статье детей получали комбинированные препараты кодеина (ацетаминофен, более известный как парацетамол, и кодеин), которые популярны также и в нашей стране.
Учитывая актуальность темы, мы выполнили обзор исследований, цель которого сводилась к оценке клинической эффективности и безопасности комбинированных препаратов кодеина в современной педиатрической и терапевтической практике.
Кодеин является естественным алкалоидом опия [2, 3]. Впервые он был выделен из опия в 1833 г. Robiquet, и вскоре после этого была выяснена его способность ослаблять выраженность боли. Кодеин составляет около 0,5 % опия, который до сих пор является ценным источником получения данного вещества. Однако все же большую часть кодеина, применяемого в медицинских целях, получают с помощью метилирования морфина. Обезболивающая эффективность кодеина намного слабее, чем у морфина: соотношение составляет примерно 1 : 10.
Кодеин быстро и хорошо всасывается после перорального приема. Максимальная концентрация в плазме крови достигается через 1 ч, время полувыведения составляет 3–3,5 ч. Препарат метаболизируется главным образом в печени тремя путями (эти процессы протекают одновременно): глюкуронизацией в 6ОН положении (основной путь), Nдеметилированием до норкодеина (10–20 %) и Oдеметилированием до морфина (5–15 %). От 5 до 15 % препарата выводится с мочой в неизмененном виде.
Oдеметилирование кодеина до морфина осуществляется с помощью цитохрома P4502D6 (CYP2D6). Именно образование морфина ответственно за развитие обезболивающих эффектов кодеина. Отсюда следует также, что кодеин является пролекарством морфина.
Механизм действия кодеина сводится к тому, что образуемый из него морфин связывается с µ и kопиоидными рецепторами центральной нервной системы, что и приводит к развитию обезболивающего эффекта.
Кодеин применяют при острой и хронической боли легкой и умеренной степени тяжести у новорожденных, детей более старшего возраста и взрослых, особенно часто для борьбы с послеоперационной болью. При этом кодеин используют как в виде монотерапии, так и в комбинации с ненаркотическими анальгетиками (ацетаминофен), нестероидными противовоспалительными средствами (НПВС: ибупрофен, ацетилсалициловая кислота, более известная как аспирин) и антигистаминными средствами (дифенгидрамин, более известный как димедрол). У детей однократная доза кодеина составляет 0,5–1 мг/кг (но не более 60 мг), у взрослых 15–60 мг. При необходимости препарат вводится через каждые 4–6 ч. Препараты кодеина доступны в виде таблеток, растворов для перорального приема и растворов для инъекций (выполняют подкожные и внутримышечные инъекции; внутривенные не выполняют изза развития тяжелой гипотензии).
В дополнение к обезболивающим эффектам кодеин применяют как противокашлевое и противодиарейное средство.
Проблемы клинической эффективности комбинированных препаратов кодеина
Среди комбинированных препаратов кодеина наиболее часто используют ацетаминофен с кодеином. Однако чтобы судить о том, насколько целесообразно применение подобной комбинации, необходимо оценить, насколько ацетаминофен/кодеин будет эффективнее монотерапии ацетаминофеном.
Противоречивые клинические данные в исследованиях у детей
В целом в литературе опубликовано мало контролируемых клинических исследований у детей, в которых бы сравнивали комбинацию ацетаминофен/кодеин с ацетаминофеном. Видимо, по этой причине нам не удалось найти и соответствующих систематических обзоров. В том же небольшом количестве исследований, которые были выполнены, получены противоречивые результаты [3]. Ниже мы приводим примеры двух таких исследований.
Tobias и соавт. [4] включили в проспективное рандомизированное исследование 50 детей в возрасте от 7 месяцев до 4 лет, которые получали однократно ацетаминофен (10 мг/кг)с кодеином (1 мг/кг) либо только ацетаминофен (15 мг/кг) до выполнения билатеральной миринготомии (рассечение барабанной перепонки) и размещения трубочки для выравнивания давления между средним и наружным ухом (такая операция может понадобиться, например, при скоплении гноя в среднем ухе, когда необходимо обеспечить отток гнойного содержимого и тем самым снизить давление в среднем ухе). По результатам исследования авторы заключили, что обезболивающий эффект комбинации ацетаминофена с кодеином был более выраженным, чем при назначении монотерапии ацетаминофеном.
Moir и соавт. [5] в проспективное рандомизированное двойное слепое исследование включили 51 ребенка в возрасте от 3 до 12 лет, которым давали каждые 4 ч (до тех пор, пока это было необходимо) либо ацетаминофен (10 мг/кг) с кодеином (1 мг/кг), либо только ацетаминофен (15 мг/кг) после выполнения тонзиллэктомии или аденоидэктомии. По результатам исследования авторы сделали вывод об отсутствии различий в уровне контроля боли, обеспечиваемом комбинацией ацетаминофена с кодеином или только ацетаминофеном.
Малая добавочная эффективность в клинических исследованиях у взрослых
В отличие от исследований у детей было выполнено большое количество исследований у взрослых, в которых сравнивали комбинацию ацетаминофен/кодеин с ацетаминофеном. Результаты этих исследований были обобщены в двух выявленных нами систематических обзорах, приведенных ниже. Выводы, которые позволяют сделать результаты этих систематических обзоров, можно сформулировать следующим образом: комбинация ацетаминофен/кодеин более эффективно устраняет боль, чем монотерапия ацетаминофеном. Однако прирост эффекта, обусловленный добавлением к ацетаминофену кодеина, был малым.
В систематический обзор, выполненный de Craen и соавт. [6], были включены 24 рандомизированных и/или контролируемых исследования, которые соответствовали намеченным критериям включения исследований в обзор. Среди изученных видов боли была послеоперационная боль (21 исследование), послеродовая боль (1), боль при остеоартрозе (1) и экспериментально индуцированная боль (1). Дозы варьировали от 400 до 1000 мг для парацетамола и от 10 до 60 мг для кодеина. Из 24 исследований в анализ эффективности было включено 19 исследований (18 однодозовых и 1 многодозовое; из последнего брали только первую точку оценивания, поэтому в ходе анализа оно шло как однодозовое). Длительность наблюдения за пациентами варьировала от 2 до 12 ч. В результате выполнения систематического обзора авторы пришли к выводу, что различия в обезболивающем эффекте между комбинацией ацетаминофена и кодеина и монотерапией ацетаминофеном были статистически достоверными, но малыми. Величина прироста обезболивающего эффекта за счет добавления в комбинацию кодеина составила всего 5 %.
Moore и соавт. [7] выполнили систематический обзор, в который включили 31 рандомизированное контролируемое исследование. Во всех исследованиях обезболивающие средства (ацетаминофен/кодеин или только ацетаминофен) назначали однократно для борьбы с послеоперационной болью. Из общего количества исследований в 13 исследованиях (874 пациента) изучали эффективность комбинации ацетаминофена и кодеина по сравнению с монотерапией ацетаминофеном. В ходе выполнения систематического обзора было показано, что при прямых сравнениях ацетаминофена/кодеина с монотерапией ацетаминофеном прирост обезболивающего эффекта в связи с добавлением 60 мг кодеина к ацетаминофену составлял 12 дополнительных пациентов на каждые 100 пролеченных пациентов, у которых наблюдалось по крайней мере 50% ослабление боли.
Интересно отметить, что в систематическом обзоре, выполненном сотрудничеством Cochrane [8], было показано, что назначение кодеина в дополнение к ацетаминофену продлевает действие последнего на 1 ч. Однако значимость этой находки в контексте малой добавочной эффективности кодеина и возможного риска развития побочных эффектов проанализирована не была.
Проблемы безопасности комбинированных препаратов кодеина
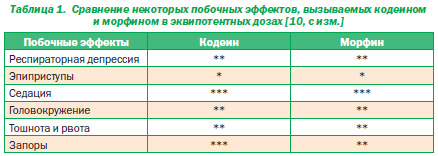
Кодеин вызывает такое же количество побочных эффектов и с той же степенью тяжести, как и другие опиоиды в эквипотентных дозах
Побочные эффекты, вызываемые кодеином, делят на более тяжелые и менее тяжелые [3, 9]. К более тяжелым побочным эффектам относят развитие тяжелой респираторной депрессии, замедление частоты сердечных сокращений, слабый пульс, гипотензию, помрачение сознания, галлюцинации, эпиприступы и затруднение мочеиспускания. К менее тяжелым побочным эффектам относят седацию, головокружение, миоз, сухость во рту, тошноту, рвоту, боль в животе, запоры, потливость и необильные высыпания на коже.
Кодеин стал широко использоваться в качестве обезболивающего средства, особенно у детей, в связи с тем, что, как полагали, он вызывает меньшее количество побочных эффектов или меньшую их тяжесть по сравнению с другими опиоидами. Однако выполненные исследования такое мнение не подтверждают. В частности, было показано, что в эквипотентных дозах кодеин и морфин вызывают одинаковое количество побочных эффектов с одинаковой степенью тяжести. Примеры некоторых из них приведены в табл. 1 [2, 10].
Низкая эффективность кодеина у детей может быть связана с незрелостью ферментных систем, в то время как побочные эффекты могут продолжать выявляться
Выше мы упоминали, что цитохром CYP2D6 осуществляет Одеметилирование кодеина до действующего вещества морфин. Этот процесс не протекает во внутриутробном периоде развития плода, у новорожденных он также отсутствует или его выраженность составляет менее 1 % активности у взрослых. Вскоре после рождения активность цитохрома CYP2D6 начинает расти, хотя к 5летнему возрасту ребенка она все еще может не превышать 25 % от уровня активности у взрослых. Приведенные данные свидетельствуют о том, что в связи с незрелостью ферментных систем активность кодеина у детей является низкой. Повидимому, именно этим можно объяснить противоречивость результатов, получаемых в клинических исследованиях у детей [2].
Несмотря на отсутствие или снижение клинической эффективности в отношении устранения боли, побочные эффекты, связанные с введением кодеина, могут продолжать выявляться. Это может быть связано, например, с тем, что, даже не превращаясь в морфин, молекулы кодеина сами по себе могут быть источником побочных эффектов.
Генетический полиморфизм цитохрома CYP2D6 является причиной вариабельности клинических эффектов кодеина: от полного отсутствия эффекта до его чрезмерной выраженности, с возможным летальным исходом
Учитывая генетический полиморфизм цитохрома CYP2D6, пациентов обычно делят на плохих метаболизаторов (ПМ) и хороших метаболизаторов (ХМ). Частота встречаемости ПМ варьирует от 1 % в арабских странах до 9 % в Великобритании и 30 % в Гонконге (специальный административный район Китая). У ПМ активность цитохрома CYP2D6 снижена, вследствие чего кодеин практически не превращается в морфин. Как следствие, у детей старшего возраста и взрослых даже после созревания ферментных систем кодеин не будет проявлять своих эффектов [2].
У большинства ХМ кодеин обычным образом превращается в морфин, что приводит к развитию клинических эффектов. Выше мы рассматривали, что добавление кодеина к ацетаминофену увеличивает обезболивающую активность последнего, хотя и в малой степени. Однако среди ХМ выделяют особую подгруппу пациентов, называемую ультрабыстрыми метаболизаторами. У этой подгруппы активность цитохрома CYP2D6 сильно завышена, что ведет к быстрому и существенному увеличению концентрации морфина в плазме крови. Как следствие, у детей разного возраста и взрослых развиваются тяжелые побочные эффекты, например тяжелая респираторная депрессия, а также летальные исходы. Подобные клинические примеры были описаны в статье, которую мы выбрали в качестве преамбулы к нашему обзору [1]. Встречаемость ультрабыстрых метаболизаторов среди населения также варьирует: от 29 % в Эфиопии до 1 % в Швеции, Германии и Китае [2].
Идеальным вариантом при назначении кодеина было бы проводить генетическое тестирование пациентов, чтобы исключить назначение данного препарата ПМ и ультрабыстрым метаболизаторам. Однако по состоянию на сегодняшний день такие тесты доступны только для научных учреждений [11].
Учитывая вышеописанное, исследователи приходят к выводу, что введение кодеина должно расцениваться как осложненный и ненадежный путь доставки морфина в организм пациентов. Учитывая тот факт, что в эквипотентных дозах кодеин и морфин вызывают одни и те же побочные эффекты (т.е. у кодеина нет преимуществ перед морфином в отношении профиля безопасности, см. выше), можно воспользоваться советом, данным еще в 1964 г. Lasagna: необходимо избегать применения кодеина путем использования вместо него дозы морфина менее 10 мг [2].
Взаимодействие с другими препаратами может снижать или повышать активность кодеина
Было показано, что ряд лекарственных веществ являются ингибиторами цитохрома CYP2D6. К ним относят хинин, метоклопрамид, некоторые нейролептики, антидепрессанты, противоаритмические средства. При одновременном назначении этих препаратов с кодеином снижается его превращение в морфин и, как следствие, клиническая эффективность уменьшается [2, 11].
Напротив, ряд лекарственных средств являются индукторами цитохрома CYP2D6 (некоторые противосудорожные средства), что может усиливать превращение кодеина в морфин и приводить к росту побочных и токсических эффектов [11].
Даже в обычных дозах кодеин способен к кумуляции
В ходе исследований было выяснено, что повторное назначение кодеина приводит к кумуляции морфина в организме. С одной стороны, это может приводить к росту клинических эффектов препарата, с другой — к увеличению количества побочных эффектов [2].
Зависимость, вызываемая кодеином, может приводить к развитию токсических эффектов изза избыточного потребления тех лекарственных средств, с которыми он комбинируется
Кодеин, подобно другим опиатам, вызывает привыкание и физическую зависимость. При формировании зависимости пациент начинает активно искать возможные способы приобретения кодеина, и, как правило, его источником становятся комбинированные препараты кодеина. В данном случае употребление больших доз кодеина сочетается с употреблением больших количеств того препарата, с которым он комбинируется (например, ацетаминофена или других веществ, см. выше).
В статье, опубликованной в Новой Зеландии [12], описаны 7 пациентов, у которых сформировалась зависимость от комбинированных препаратов кодеина и ибупрофена. Несмотря на то, что у ряда пациентов были выявлены дополнительные осложняющие факторы (например, 4 пациента страдали от активного алкоголизма), авторы заключили, что употребление ибупрофена в больших дозах вносило вклад в формирование язвы желудка, резистентной к ингибиторам протонной помпы (4 пациента), гепатотоксичности (1 пациент) и воспаление кишечника (2 пациента).
В этой же статье приводится ссылка на отчет, в котором были описаны 77 пациентов с зависимостью от кодеина, входящего в состав комбинированных препаратов. В течение 2,5 года среднее количество употребляемых ежедневно таблеток достигло 50 шт. Из 77 пациентов у 39 наблюдались желудочнокишечные кровотечения или перфорация, у 7 — почечная недостаточность и у 5 — тяжелая гипокалиемия.
У пациентов с заболеваниями почек и печени доза кодеина должна быть снижена
Имеются сообщения о том, что у пациентов с умеренной почечной дисфункцией доза кодеина должна быть снижена на 25 %, у пациентов с тяжелой почечной дисфункцией — на 50 %. Подобные меры позволяют предотвратить развитие тяжелой опиоидной интоксикации [3].
Какиелибо специфические рекомендации по дозированию кодеина у пациентов с печеночной дисфункцией отсутствуют, однако исследователи отмечают, что доза препарата и кратность его приема все же должны быть снижены [3].
Кодеин постепенно выводят из клинического использования
В 2010 г. Всемирная организация здравоохранения (ВОЗ) сохранила кодеин в перечне эссенциальных препаратов для детей, используемых для борьбы с болью (2010 WHO Model List of Essential Medicines for Children, 2010 WHO Model Formulary for Children). Однако в последующем рабочая группа Всемирной организации здравоохранения, разрабатывавшая Руководство по фармакологической терапии персистирующей боли у детей (WHO Guidelines on Pharmacological Treatment of Persisting Pain in Children with Medical Illnesses), изучив всю доступную информацию о кодеине, исключила этот препарат из алгоритмов лечения. В настоящее время этот документ проходит процедуру одобрения. Разработка подобного руководства послужила основанием для поднятия вопроса о том, чтобы исключить кодеин из вышеупомянутого списка эссенциальных лекарственных средств Всемирной организации здравоохранения. Этот вопрос также находится в стадии рассмотрения.
Существуют ли альтернативы комбинированным препаратам кодеина?
В 1996 г. Всемирная организация здравоохранения опубликовала так называемую «трехступенчатую лестницу», предлагающую трехшаговый подход к борьбе с раковой болью [14]. В последующем этот подход стали применять ко всем видам боли (рис. 1). На первой ступеньке лестницы назначают ненаркотические анальгетики или НПВС, на второй добавляют слабый опиод (например, кодеин), на третьей вместо слабого опиоида используют сильный опиоид (например, морфин).
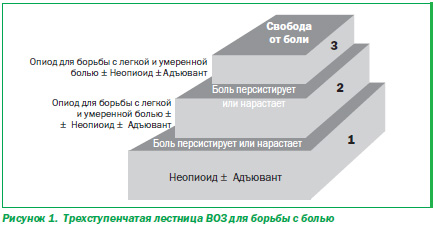
Поскольку наблюдается тенденция к исключению кодеина из современных алгоритмов лечения, то вышеупомянутая лестница станет фактически двухступенчатой (вторая, средняя ступенька выпадет). С этих позиций на первой ступеньке лестницы необходимо использовать те ненаркотические анальгетики или НПВС, эффективность которых сравнима с таковой комбинированных препаратов кодеина. А на последней ступеньке вместо кодеина использовать сильные опиоиды в малых дозах, например морфин. Именно этого подхода мы и будем придерживаться при последующем изложении результатов современных исследований.
В подавляющем количестве исследований показано, что эффективность ибупрофена сравнима с таковой комбинированных препаратов кодеина, а побочные эффекты возникают реже
В клинических исследованиях у детей и взрослых было показано, что эффективность ибупрофена не уступает таковой комбинированных препаратов кодеина. При этом переносимость у ибупрофена была значительно лучше. В связи с этим большинство исследователей рекомендуют использовать ибупрофен вместо комбинированных препаратов кодеина (например, ацетаминофена с кодеином).
В исследованиях у детей было показано, что ибупрофен по крайней мере не уступает по эффективности и лучше переносится по сравнению с комбинацией ацетаминофена с кодеином при устранении болевого синдрома после тонзиллэктомии [3], переломов рук [15], при разнообразных травматических повреждениях конечностей [16] и вообще любых видов мышечноскелетной боли [17].
Представляет особый интерес тот факт, что по результатам 1 длительного и 2 кратковременных рандомизированных контролируемых исследований было вынесено решение о том, что ибупрофен должен использоваться вместо ацетаминофена с кодеином у детей с переломами рук. Ибупрофен снижает боль по крайней мере в той же степени, что и ацетаминофен/кодеин, и переносится лучше (сила рекомендаций: А) [18].
У взрослых тот факт, что ибупрофен не уступает по эффективности ацетаминофену и кодеину, был продемонстрирован при устранении перинеальной боли после рождения ребенка [19]. Кроме того, аналогичные результаты в отношении НПВС по сравнению с ацетаминофеном/кодеином были показаны для послеоперационной боли в результате лапаротомии [20] и устранения различных видов боли в стоматологии [21].
Подбирая дозу ибупрофена, необходимо помнить о дозозависимом характере его эффектов. Если выбранная доза оказалась недостаточно эффективной, ее можно увеличить для достижения приемлемой анальгезии. Примером могут служить результаты метаанализа, посвященного применению обезболивающих средств для устранения послеоперационной зубной боли. Было показано, что ибупрофен в дозе 200 мг был настолько же эффективен, как и комбинация ацетаминофена 600 или 650 мг и кодеина 60 мг, при выполнении оценки по четырем шкалам: PPID, SPID, PPAR и TOTPAR. В то же время увеличение дозы ибупрофена до 400 мг делало его достоверно более эффективным по сравнению с той же самой комбинацией ацетаминофена и кодеина по двум шкалам — PPAR и TOTPAR; по остальным двум шкалам эффективность достоверно не различалась [22].
Какой наркотический анальгетик использовать вместо кодеина?
Если устранить боль с помощью таких НПВС, как ибупрофен, не удается, вместо кодеина рекомендуется добавлять сильные опиоиды, но в малых дозах (например, морфин) [11].
Выводы
В большом количестве исследований была продемонстрирована малая добавочная эффективность кодеина по сравнению с теми препаратами, к которым он добавлялся. Кроме того, клинический эффект комбинированных препаратов кодеина часто был непредсказуем (мог варьировать от полного отсутствия эффекта до развития летального исхода). Вместе с тем назначение кодеина приводило к развитию дополнительных побочных эффектов, кумуляции, привыканию, зависимости, взаимодействию с другими лекарственными средствами.
Данные, накопленные в последние годы, позволяют на первом этапе для борьбы с болевым синдромом вместо комбинированных препаратов, содержащих кодеин, назначать НПВС, такие как ибупрофен. Если развиваемый анальгетический эффект недостаточен, тогда в дополнение к НПВС необходимо назначать сильные опиоиды (такие как морфин), но в малых дозах.
Список литературы находится в редакции

