Газета «Новости медицины и фармации» 5 (449) 2013
Вернуться к номеру
Эпидемиология искусственных эпидемических процессов как третий раздел эпидемиологии
Авторы: Супотницкий М.В., к.б.н., микробиолог, Федеральное государственное бюджетное учреждение «Научный центр экспертизы средств медицинского применения» Министерства здравоохранения Российской Федерации, г. Москва
Рубрики: Инфекционные заболевания, Эпидемиология
Разделы: Справочник специалиста
Версия для печати
 Окончание. Начало в № 4, 2013
Окончание. Начало в № 4, 2013
Реакции иммунной памяти у мышей, ранее иммунизированных против вируса эктромелии, также ингибировались IL4, синтезированным вирусом эктромелии. Во внутренних органах иммунных мышей развивалась неконтролируемая репликация модифицированного вируса, и, как следствие, у них появлялись классические симптомы острой мышиной оспы. Предыдущие исследования с использованием близкородственного осповируса — вируса осповакцины показали, что и у него коэкспрессия IL4 ассоциируется с задержкой выведения вируса из основных органовмишеней и повышением вирулентности для мышей [15].
При описании экспериментов по созданию гибридных и модифицированных бактериальных токсинов исследователи единодушно проявляют скромность в отношении публикации данных по их поражающему действию, когда оно оценивается на лабораторных животных. В то же время этими данными они обстоятельно делятся в тех случаях, когда такие токсины создаются для более эффективного истребления насекомых. Так как инсектицидные токсины отличаются от токсинов, поражающих млекопитающих, только иной специфичностью действия, то будем рассматривать их как модели, на которых отрабатываются технологии модификации токсинов, опасных для млекопитающих.
Наиболее изучены порообразующие токсины семейства Cry (Btтоксины, dэндотоксины). Cryтоксины продуцируются B.thuringiensis (Bt) и представляют собой семейство глобулярных белков, включающее три домена, объединенных через простой линкер. Их организация типична для бинарной АВструктуры бактериальных токсинов. По механизму действия на клетки они схожи с порообразующими токсинами стафилококков [24].
Первичными рецепторами для Cry1Aтоксина являются белки, сходные с кадхеринами (cadherins, CADR) — трансмембранными кальцийзависимыми гликопротеинами, осуществляющими адгезивные межклеточные контакты. Взаимодействие Cryтоксинов с кадхерином осуществляется через комплекс связывающих сайтов: CADR7, CADR11 и CADR12 [52]. Вторичными рецепторами для Cry1Aтоксина являются два протеина, «заякоренных» через мостик в мембране клеткимишени: гликозилфосфатидилинозитол (glycosylphosphatidylinositol, GPI) и либо аминопептидаза N (aminopeptidase N, APN), либо щелочная фосфатаза (alkaline phosphatase, FAL) [19].
Отдельные насекомые имеют видовую устойчивость к Cryтоксинам либо приобретают ее в результате систематического применения таких токсинов для регуляции их численности. В этом случае в популяциях насекомых накапливаются особи с мутировавшими кадхериновыми рецепторами, не взаимодействующими с токсином. Разработчики инсектицидных токсинов вынуждены решать две технические задачи: расширять спектр поражающего действия Cryтоксинов и увеличивать их токсичность в отношении конкретных видов насекомых. Методические подходы, использованные для вмешательства в структуру молекул токсинов семейства Cry, включают сайтнаправленный мутагенез отдельных доменов токсина, конструирование гибридных токсинов, внедрение в молекулу токсина сайтов для расщепления протеазами, делеции его отдельных регионов и др. (рис. 9).
Изменение специфичности Cryтоксинов достигается посредством замены домена III на такой же домен из токсина, обладающего нужной исследователям специфичностью (рис. 9А). Cry1токсины с низкой специфичностью по отношению к Spodoptera exigua, включая Cry1Ab, Cry1Ao, Cry1Ba и Cry1Ea, становятся для них токсичными, если домен III будет заменен аналогичным доменом из Cry1Ca. Например, Cry1Abтоксин не токсичен для S.exigua, но замена его IIIдомена на IIIдомен Cry1C приводит почти к десятикратному росту его токсичности для S.еxigua. Замена участка молекулы Cry1Aaтоксина в пределах аминокислотных остатков 450612 (домен III) на такие же из Cry1Acтоксина ведет к 300кратному увеличению токсичности Cry1Aa в отношении табачной огневки Heliothis virescens.
Активация токсина в новом для него хозяине может быть достигнута внедрением в его молекулу сайта для расщепления протеазами. Вставка в петлю Cry3Aтоксина между спиралью альфа3 и спиралью альфа4 сайта для хемотрипсина/катепсина (chymotrypsin/cathepsin Gсайта) позволило в три раза увеличить его токсичность для личинок D.virgifera (рис. 9Б).
Делеция в аминотерминальном регионе, включающая спираль альфа1 Cry1Aтоксинa, делает возможной олигомеризацию токсина в отсутствие кадхеринового рецептора. Такие модифицированные токсины (Cry1AMod) убивают насекомых, у которых развилась резистентность к Cry1Aтоксинaм, вызванная мутациями в гене кадхерина. Олигомерные структуры, формируемые Cry1AModтоксинaми, обладают пороформирующей активностью, сходной с таковой у природного («дикого») токсина (рис. 9А).
Токсичность Cry2токсинa была повышена для египетской хлопковой совки (Spodoptera littoralis) и совки ипсилон (Agrotis ipsilon) не менее чем в четыре раза делецией 42 аминокислот из Nконцевого региона молекулы, предшествующих аминокислотным последовательностям, формирующим альфа1спираль. Этот участок молекулы прототоксина в кишечнике насекомого отщепляется трипсином, после чего «обнажается» прежде закрытый регион токсина, соответствующий связывающему региону Cry2токсинa (рис. 9В).
Как частный случай гибридного токсина могут рассматриваться иммунотоксины — химерные белки, включающие два домена, один из которых обладает свойствами антитела, а другой — свойствами ферментативной субъединицы токсина (как правило, цитотоксина). Первый домен обеспечивает связывание химерного белка со специфической молекулой или клеткой, второй инактивирует молекулумишень или убивает клетку.
Конструирование иммунотоксинов, используемых в медицинских целях, предполагает повышение их специфичности к опухолевым клеткам. При более высокой дозе иммунотоксина у пациента может развиться синдром пропускания сосудов (vascular leak syndrome, VLS), вызванный высвобождением цитокинов после гибели в коже периваскулярных Тклеток. Количество иммунотоксинов, вызывающих VLS, находится в пределах десятков мкг/кг веса пациента [44].
Для врачейинфекционистов возможности технологий селекции и генной инженерии микроорганизмов означают, что они могут оказаться в ситуации, когда: 1) будет невозможно установить этиологию инфекционной болезни; 2) типовые схемы профилактики и лечения поражений, вызванных микроорганизмами и токсинами, окажутся неэффективными. И сегодня уже есть печальный опыт лечения пораженных такими агентами. Полученный классической селекцией по признакам антибиотикорезистентности и вирулентности природный штамм возбудителя сибирской язвы Ames, будучи примененным для осуществления теракта в 2001 г. в США, вызвал болезнь, не поддававшуюся лечению антибиотиками беталактамного ряда [41, 56].
При расследовании искусственно вызванных эпидемий (вспышек) инфекционных болезней идентификация этиологического агента проводится не только для того, чтобы установить этиологию болезни, но и для определения масштабов теракта (диверсии) и для представления в суде доказательств причастности отдельных лиц к его организации [20]. Отсюда следуют более высокие требования к точности межштаммовой дифференциации возбудителей инфекционных болезней. Для идентификации возбудителя сибирской язвы, выделенного в очагах болезни от заболевших людей и животных, достаточно традиционных биологических и иммунологических методов исследования. Но установить масштабы биотеррористического акта 2001 г. в США и сузить круг подозреваемых в его совершении стало возможным благодаря субтипированию B.anthracis по его ДНК с помощью MLVA13 [38].
Клинические проявления искусственных эпидемий (вспышек)
Роль возбудителя инфекционной болезни в развитии клиники болезни при естественных и искусственных эпидемиях (вспышках) также различна. Для эпидемий, возникающих естественным путем в природных очагах, механизм инфицирования и доминирующая клиника болезни обычно хорошо известны. Например, инфицирование возбудителем чумы в природных очагах этой болезни происходит через кожу посредством укуса блохи. Возбудитель чумы лимфогенным путем достигает регионарных лимфатических узлов, где задерживается и интенсивно размножается. В лимфатическом узле развивается воспалительный процесс, внешне это проявляется первичным бубоном. Большинство случаев чумы в ее природном очаге регистрируются как бубонные.
При эпидемиях, вызванных искусственно, клиника болезни будет зависеть от способа введения возбудителя инфекции в организм человека, выбранного террористами. В этом случае врач столкнется с клинической формой болезни, ранее ему неизвестной, т.е. с невозможной клинической формой болезни. Невозможная она в том смысле, что никогда не встречается при естественном заражении данным возбудителем. Например, кожная форма сибирской язвы хорошо известна инфекционистам. Она наблюдается среди людей, контактирующих с мясом и шкурами болевших сибирской язвой животных. Ее характерное проявление — сибиреязвенный карбункул, обычно появляющийся на открытых частях тела. Однако при подкожном и внутримышечном введении B.anthracis человеку развивается незнакомая инфекционистам локальная форма сибирской язвы, протекающая без развития карбункула, но с обширными некрозами и отеками в участке инъекции (рис. 10).
При внутривенном введении B.anthracis смерть человека клинически напоминает апоплексический удар. При вскрытии — никакой специфики. Выявляются только признаки серозного или серозногеморрагического полиаденита, полнокровие и дистрофические изменения в паренхиматозных органах и кровоизлияния в легких. Такие случаи сибирской язвы зарегистрированы в 2009 г. в Шотландии у наркоманов, купивших афганский героин одной партии, к которому были подмешаны споры возбудителя сибирской язвы турецкого происхождения [11, 37, 55].
Частным случаем невозможных клинических форм болезни является патология мелкодисперсного аэрозоля, т.е. патология, развивающаяся у человека при инфицировании его аэрозолем возбудителя инфекционной болезни с размером дисперсной фазы менее 5 мкм. Например, в природных очагах чумы первичная легочная чума распространяется воздушнокапельным путем (Маньчжурия, 1910 г.). Воротами инфекции являются миндалины и лимфатическая ткань глотки. Поэтому инфекционный процесс клинически проявляет себя нисходящей бронхопневмонией с поражением верхних долей легких. При поражении мелкодисперсным аэрозолем развивается катаральная узелковая пневмония [10].
Поражение человека, вызванное вдыханием аэрозоля спор B.anthracis с размером частиц биологической рецептуры, приближающихся к размеру споры (1,2 мкм), клинически проявляется системной болезнью с вовлечением в инфекционный процесс паренхимы легких и лимфатических узлов средостения. Вдыхание такого же аэрозоля, но с размером частиц 12 мкм и более, приводит к развитию локализованной инфекции с выраженным отеком лица [41, 46].
При инфицировании обезьян Macacca mulatta аэрозолем с жидкой фазой возбудителя туляремии штамма ShuS4 с дисперсностью частиц 1–8 мкм первичный патологический процесс и размножение агента начинаются в области респираторных бронхиол, где развивается специфический бронхиолит, распространяющийся в прилежащую легочную ткань и захватывающий альвеолярные пространства, вызывая развитие мелкоочаговой пневмонии. Ингаляция животных монодисперсным туляремийным аэрозолем с размером дисперсной фазы 18 мкм ни у одной из обезьян не вызвало поражения со стороны легких. Воротами инфекции служили носоглотка с поражением регионарных лимфоузлов, откуда возбудитель попадал в кровоток, вызывая гематогенную диссеминацию и гибель животного [69]. Ангинознобубонная форма туляремии может возникнуть при ингаляционном инфицировании аэрозолем с размером частичек более 5–10 мкм, задерживающихся в носоглотке и инфицирующих миндалины. Глазобубонная форма туляремии развивается при импакции на конъюнктиву относительно крупных частиц аэрозоля (более 25 мкм) [6].
Клиника ингаляционной формы сибирской язвы, вызванной мелкодисперсными аэрозолями разного происхождения, но одинаковой дисперсности, также может не совпадать. За много лет наблюдений над вспышками ингаляционной сибирской язвы естественного происхождения ни разу не было обнаружено патологических процессов в паренхиме легких. До биотеррористического акта 2001 г. в США считалось, что первичнолегочной сибирской язвы не существует. На рентгенограмме грудной клетки пациента может быть обнаружено только выраженное расширение медиастинальных узлов при отсутствии признаков первичной пневмонии [1, 18]. Но изучение в США в 2001 г. последствий ингаляционного поражения людей сухой рецептурой сибирской язвы показало, что в их легких образуются еще и легочные инфильтраты (отмечены у семи пациентов из 12). При этом клиническое течение болезни было очень тяжелым.
К свойствам биологической рецептуры, определяющим полиморфизм клинической картины в очаге искусственно вызванной болезни, может быть отнесено ее качество в момент применения. Во время искусственной вспышки сибирской язвы в США в 2001 г. все пострадавшие контактировали с одним и тем же белым порошком. Но случаи сибирской язвы в НьюЙорке и НьюДжерси были представлены кожной формой болезни, а случаи, выявленные в Вашингтоне, представлены ее ингаляционной формой. Последнее связано с лучшим качеством рецептуры, помещенной в конверт, предназначавшийся для сенатора Томаса Дашли (Thomas A. Daschle), чем рецептуры, содержавшейся в конвертах, направленных в редакции СМИ НьюЙорка. В конвертах, полученных редакциями «ЭнБиСи» и «НьюЙоркПост», следователями ФБР обнаружена увлажненная, образовавшая агломераты рецептура. Она оказалась неспособной проникать в глубокие отделы легких людей и вызывала только кожную форму болезни у лиц, имевших небольшие повреждения кожных покровов [59].
Место аппликации возбудителя болезни меняет не только ее патогенез, но, соответственно, патанатомию. Поэтому во время искусственно вызванных эпидемий (вспышек) патологоанатомические и патоморфологические исследования используются не только для посмертной диагностики инфекционной болезни, но и для расследования обстоятельств и масштабов теракта, выявления технического уровня, достигнутого террористами в разработке средств биологического поражения. Также они могут позволить отличить непосредственных жертв биологической атаки от людей, заразившихся от них «по цепочке». Например, при искусственно вызванных вспышках легочной чумы для первых будут характерны поражения мелкодисперсным аэрозолем (катаральная узелковая пневмония), для вторых — проявления воздушнокапельной инфекции (чумная бронхопневмония).
Искусственные генетические конструкции
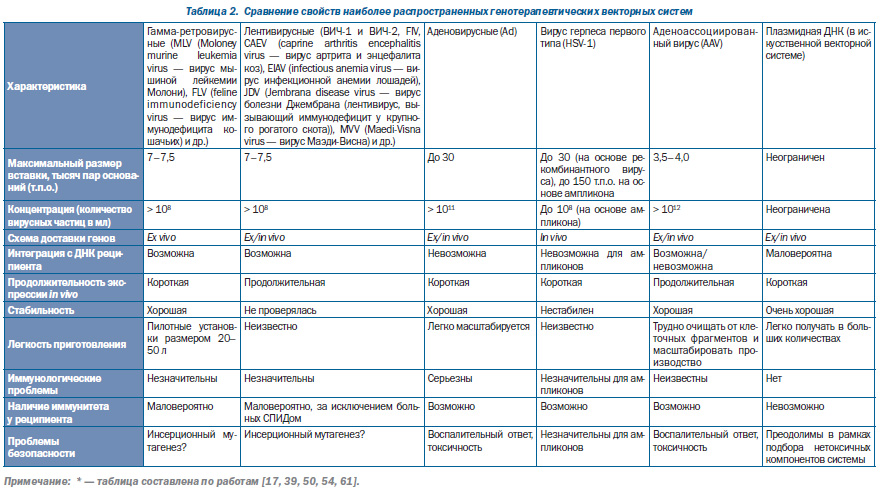
Генная терапия наследственных и инфекционных болезней предполагает доставку генов в клеткимишени. Но ни ДНК, ни РНК не могут быть использованы в «голом виде» для достижения этой цели. Сахарофосфатный остов обоих типов молекул нуклеиновых кислот располагается по их периферии полярными группами наружу и придает им анионные свойства. При физиологическом значении рН нуклеиновая кислота несет отрицательный заряд и не способна непосредственно взаимодействовать с отрицательно заряженными наружными поверхностями клеточных мембран. Изза высокой гидрофильности нуклеиновой кислоты все гидрофобные основания «повернуты» вовнутрь ее молекулы, поэтому она не может проникнуть через гидрофобный барьер клеткимишени. В сыворотке крови нуклеиновая кислота быстро деградирует под воздействием нуклеаз. Период полужизни немодифицированной интерферирующей РНК в сыворотке крови укладывается в 5–60 мин, для ДНК он составляет не более 10 мин. Кроме того, нуклеиновые кислоты не способны специфически узнавать клеткимишени [62]. Поэтому для доставки генов в эукариотические клетки с начала 1980х гг. разрабатываются искусственные генетические конструкции. В настоящее время сформировалось два альтернативных направления их создания — на основе вирусов и на основе искусственных векторных систем (табл. 2).
Искусственные генетические конструкции на основе вирусов в организме человека имитируют поведение вирусной частицы, но не вызывают инфекционный процесс. В их состав входят: белки вируса, формирующие оболочку частицы, способную к узнаванию клетокмишеней и к интернализации в цитоплазму; и трансгенэкспрессирующая кассета, осуществляющая после доставки в клетку длительную экспрессию одного или нескольких генов.
Наибольшее распространение в практике генной терапии наследственных и инфекционных болезней приобрели векторные системы на основе лентивирусов, аденовирусов, аденоассоциированных вирусов, ортопоксвирусов, герпесвирусов и отдельных РНКвирусов, не относящихся к ретровирусам.
Достигнутый сегодня уровень соматической генной инженерии позволяет создавать векторные системы, нацеленные на разные типы клеток и участки генома человека (векторы на основе ВИЧ). Векторные системы, полученные на основе лентивирусов и аденоассоциированных вирусов, способны интегрировать трансгенэкспрессирующую кассету с геномом клетокмишеней.
Ретровирусные (лентивирусные) векторы могут быть перенацелены на разные типы клеток и разные участки генома человека. Первая задача решается благодаря псевдотипированию вируса. Смысл этого методического приема в следующем. Так как из лентивирусной векторной системы удален ген оболочки (env) ВИЧ, то оболочечный вектор может содержать ген, направляющий синтез гетерологичного гликопротеина. Такие вирусы называют псевдотипированными (pseudotyping) или вирусамиобманщиками. В зависимости от используемого в пакующей системе гликопротеина формируются различные псевдотипы вируса [54].
Например, лентивирусные векторы, псевдотипированные с гликопротеинами оболочки вируса бешенства (PVштамм), приобретают тропность к нейрональной ткани и способность к ретроградному транспорту в условиях in vivo. Введенный в периферическом участке нервной системы псевдотипированный лентивирусный вектор по нейрональным аксонам доставил трансгены в центральной нервной системе (ЦНС) [29]. Подробно стратегия использования таких векторов для целей генотерапии описана в работах [22, 30, 54, 68].
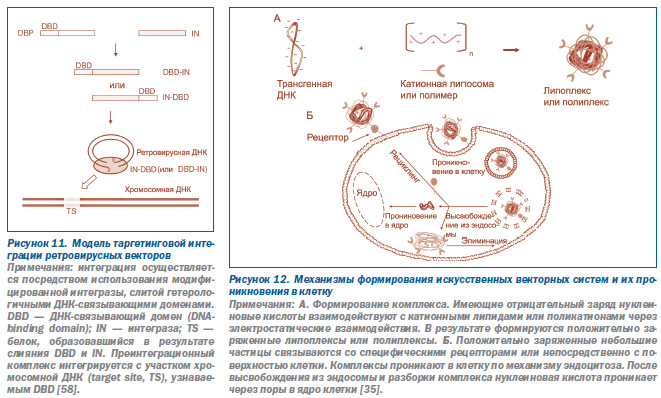
В первом десятилетии текущего века наиболее распространенным подходом к нацеливанию ретровирусного вектора на конкретные участки в геноме человека было использование в составе вирусной частицы слитых белков, образующих вирусный преинтеграционный комплекс, импортирующийся вовнутрь нуклеуса. Такие белки обычно включают INбелок (вирусная интеграза), полученный из ВИЧ1 или ASV, и ДНКсвязывающие последовательности клеточных и бактериальных белков, слитых с N или Cконцом IN. Чтобы вирус не утратил инфекционности, слитые белки вводят в вирион ВИЧ1 вместе с исходным IN (wildtype IN). Одна из используемых моделей нацеливания ретровирусных векторов на конкретные участки ДНК в геноме человека (таргетинговой интеграции) показана на рис. 11.
О том, какое значение имеет участок интеграции провируса в развитии неинфекционной патологии, говорит накопленный опыт применения ретровирусных векторов для лечения детей с Хсвязанным тяжелым комбинированным иммунодефицитом (Xlinked severe combined immunodeficiency, SCIDX1). Например, у 4 детей из 11, которым в терапевтических целях вводили вектор на основе MLV, развилась Тклеточная лейкемия. В последующем было установлено, что по крайней мере у двух детей клональная экспансия Тклеток была вызвана вставкой вектора в Lin1, Isl1, Mec3(LIM)домены протоонкогена only2 (LMO2) и его активацией через энхансеры вектора, содержащиеся в LTR [34].
Для изменения тропизма векторных систем исследователями используются также физический таргетинг, заключающийся в покрытии вирусной частицы специальной оболочкой, изменяющей ее природный тропизм и делающей ее неузнаваемой для иммунной системы человека [63]. Повышение эффективности транскрипции трансгена в клеткемишени достигается путем транскрипционального таргетинга, предполагающего введение в трансгенэкспрессирующую кассету специфических для данных тканей промоторных последовательностей [54].
Искусственные векторные системы разрабатываются по трем направлениям: комплексы, образованные нуклеиновыми кислотами и катионными полимерами (полиплексы); комплексы, образованные нуклеиновыми кислотами и липидами (липоплексы), и использование для комплексообразования наночастиц двуокиси кремния. На рис. 12 показаны механизмы формирования первых двух комплексов и их проникновения в клетку.
Третьим направлением получения искусственных векторных систем, развитие которого по открытой литературе прослеживается только с 2012 г., стало использование наночастиц двуокиси кремния в качестве носителя терапевтических генов. Их основными преимуществами перед липо и полиплексами разработчики считают низкую токсичность, контролируемость размеров и простоту приготовления векторной системы [21].
Наиболее распространенным вариантом конструирования искусственных векторных систем является создание комплексов наноразмеров, подвергающихся декомплексации в эндосомах и высвобождающих ДНК трансгена в цитоплазму. Нанополиплексы размером меньше 25 нм эффективно трансфецируют неделящиеся клетки, так как они меньше, чем размер пор в мембране ядра. Нанополиплексы стабильны в солевых растворах. Конденсированный пептид, содержащий в своей структуре тридцатимерный полилизин с цистеином на Nконце, к которому «пришито» 10 кДа полиэтиленгликоля (ПЭГ), при температуре 4 °C стабилен в солевом растворе более трех лет, 9 месяцев он сохраняет свои основные свойства при комнатной температуре и один месяц при температуре 37 °C [23].
Перечисленные подходы к конструированию искусственных векторных систем позволяют разрабатывать векторы с тонко управляемой специфичностью для направленной доставки трансгенов в целевые клетки (в печень, надпочечники, глубокие отделы мозга, медуллярные двигательные нейроны, костные ткани, гладкую мускулатуру кровеносных сосудов, легочную ткань, опухоли эндотелия и др.).
Исследователями предпочтение отдается использованию неинвазивных технологий, предполагающих ингаляционное или энтеральное введение в организм человека генотерапевтических векторных систем. Полимерные композиции для ингаляционного введения генов конструируют таким образом, чтобы их размер не превышал 5 мкм и они были устойчивы к физическому воздействию, возникающему во время их диспергирования, и стабильными в аэрозолированном состоянии. Стабилизация полиплекса достигается формированием глютаральдегидом или карбодиимидами поперечных сшивок между образовавшими полиплекс катионными макромолекулами (обычно это ветвящиеся производные PEI). Чем больше таких сшивок, тем прочнее носитель, тем менее он подвержен деградации в растворе и тем прочнее в него «упакована» экспрессирующая кассета. Весовое содержание нуклеиновой кислоты в таких носителях достигает 30 % (W/W (weight/weight — вес на вес)). Уменьшение агрегации полиплексов в растворе достигают путем увеличения количества поперечных сшивок между катионными макромолекулами либо их конъюгированием с ПЭГ 5000. Лиофилизованные сшитые полиплексы в водном растворе обычно сами дезагрегируют до исходного размера частиц [60].
По данным F. Thierry [65], субмикронные липосомы выдерживают перевод в аэрозоль. Их устойчивость в таком состоянии достаточна по крайней мере для терапевтических целей. Более тонко аэродинамический размер частиц образуемого аэрозоля липо и полиплексов с жидкой дисперсной фазой регулируется с помощью диспергирующего устройства [47].
Полимерные композиции для энтерального введения в основном предназначаются для введения генов в стволовые клетки кишечного эпителия и предполагают одновременное введение факторов пролиферации стволовых клеток [36, 70].
По мнению J.L. Black [16], возможны два типа нападений с применением таких поражающих агентов, а именно нападение с кратковременным или продолжительным латентным периодом. В первом случае гены могут доставляться при помощи вектора, который инфицирует хозяина и вызывает быструю экспрессию трансгена, оказывающего вредное для здоровья действие (векторы на основе аденовирусов или AAV, искусственные векторные системы). Этот вид нападения похож на использование традиционных агентов БО. Наиболее вероятно, что он будет осуществлен с помощью аэрозолей. Продолжительность латентного периода может зависеть от того, насколько скоро начнет экспрессироваться ген, вызывающий патологический процесс, а сама экспрессия определяется типом используемого вектора и используемой дозой.
Еще больший интерес представляет сценарий J.L. Black [16], предполагающий длительный латентный период после нападения, поскольку он означает возможность ведения скрытой масштабной биологической войны, осуществляемой диверсионными способами. При реализации такого сценария население подвергается нападению посредством искусственных генетических конструкций через продукты (энтерально), лекарственные и иммунобиологические препараты (парентерально, например, под предлогом массовой вакцинации). Наиболее вероятно применение векторов на основе лентивируса. Его осуществление приведет к инкорпорированию трансгена в геном подвергшихся такому нападению людей и, как следствие, к появлению обширных популяций людей с психическими изменениями, онкологическими и неврологическими болезнями, генетическими поражениями и даже наследственно передаваемыми дефектами генов.
Наночастицы
К ним относятся объекты размером от 1 до 100 нм. По характеру поражающего действия они не имеют аналогов ни среди боевых отравляющих веществ (ОВ), ни среди традиционных агентов БО или искусственных генетических конструкций.
К особенностям наночастиц, обусловливающим их поражающее действие, прежде всего следует отнести химическую и каталитическую активности их поверхности, отсутствующие у этого же вещества при более крупной дисперсности частиц. Второй особенностью наночастиц, проявляющейся их токсичностью, является их высокая концентрация в воздухе при незначительном количестве самого распыленного вещества. Например, 10 мкг/м3 вещества образует более чем 1 ´ 106 частиц/см3 при их размере в 20 нм. И третья особенность наночастиц, проявляющаяся их токсическими свойствами, — это их способность к ингаляционному, трансдермальному, транснейральному и энтеральному проникновению в любые органы и ткани человека, включая ЦНС. Физические свойства наночастиц, определяющие их распространение в организме человека, и их поражающее действие приведены в табл. 3.
В патологических эффектах нанообъектов, проявившихся в уcловиях in vivo при одном способе введения, прослеживается определенная специфичность, обусловленная их структурой и химическим строением. Например, агрегированные одностеночные углеродные нанотрубки в легочной ткани мышей индуцируют образование гранулем, главным образом связанных гипертрофией эпителиальных клеток. Эти же трубки, но в диспергированном состоянии, вызывают развитие диффузного интерстициального фиброза с утолщением стенок альвеол [64].
Внутренний объем нанотрубок может быть заполнен токсическими соединениями биологической и химической природы. Стенки нанотрубок исключают взаимодействие биологических компонентов с клетками иммунной системы и последующие иммунные ответы. Благодаря достижениям в конструировании таких структур стала возможной доставка биологически активных веществ и генов в клетки, очень трудные для трансфекции, включая Вклетки и первичные нейроны [31, 41].
Своеобразной «новинкой» для токсикологов, характерной именно для частиц нанодиапазона, является возможность их проникновения в ЦНС по нервным волокнам, идущим от обонятельного эпителия и сетчатки глаза [42, 51].
Нанотехнологии обладают большим потенциалом для создания средств массового поражения, серьезно отличающихся по механизмам поражения, путям проникновения в организм человека, способам применения и целям ведения войны от тех, что разрабатывались в ХХ в. применительно к микроорганизмам, токсинам и ОВ. Наибольшую опасность в настоящее время представляют нанообъекты, имеющие размер менее 50 нм, формирующие инкапсулирующие структуры и подвергнутые биофункционализации. Их применение для поражения людей, возможно, будет осуществляться по тем же сценариям, что разработал J.L. Black [16] для искусственных генетических конструкций. Уже в настоящее время грань между наночастицами и искусственными генетическими конструкциями становится все более условной. По сути, они позволяют вести новый вид биологической войны, когда невозможно не только установить ее организаторов, но и даже ответить на вопрос: война это или не война? Игнорировать такую угрозу, не создавая долговременной и прочной научнометодической базы для противодействия, означает создание преступникам оптимальных условий для их деятельности — сон разума рождает чудовищ.
Терминологическое определение неправильной эпидемиологии
Приведенные данные показывают, что эпидемиология, этиология и клиника естественных и искусственно вызванных эпидемий (вспышек) и других массовых искусственных поражений населения, имеющих биологическую природу, имеют принципиальные отличия и могут рассматриваться как самостоятельные объекты эпидемиологического исследования. Неправильная эпидемиология — самостоятельный раздел в эпидемиологии инфекционных болезней, представляющий собой систему научных знаний, обосновывающих распознание искусственно вызванных вспышек (эпидемий) инфекционных болезней, поражений биологическими токсинами, искусственными генетическими конструкциями и наночастицами, а также устранение (минимизацию) их последствий и оказание содействия правоохранительным органам в выявлении организаций и преступников, осуществивших применение биологических агентов для поражения людей.
Общая эпидемиология инфекционных болезней и общая неправильная эпидемиология используют метод эпидемиологического анализа, т.е. специфическую совокупность приемов изучения закономерностей появления множества событий (заболеваний, смертей и др.), позволяющих установить причины возникновения и распространения патологических состояний любой природы в популяции людей. Эпидемиологический анализ в неправильной эпидемиологии основывается на знании характерных особенностей эпидемиологии искусственных эпидемических процессов и других массовых поражений населения, имеющих биологическую природу.
Подобно классической эпидемиологии инфекционных болезней, неправильная эпидемиология может быть разделена на два подраздела, логически следующих из сути рассматриваемого материала, — общий и частный. Как и любая другая наука, неправильная эпидемиология должна иметь объект исследования, цель и задачи.
Объектом исследования неправильной эпидемиологии являются искусственно вызванные эпидемии (вспышки) инфекционных болезней и другие массовые поражения населения, имеющие биологическую природу.
Цель неправильной эпидемиологии как самостоятельного раздела в эпидемиологии инфекционных болезней — установление искусственного характера вспышки (эпидемии) инфекционной болезни, поражений биологическими токсинами, искусственными генетическими конструкциями и наночастицами.
Основные задачи неправильной эпидемиологии:
- выявление новых биологических угроз и биологических агентов, которые могут быть использованы для преднамеренного поражения людей;
- изучение общих закономерностей развития искусственных эпидемических процессов, поражений биологическими токсинами, искусственными генетическими конструкциями и наночастицами;
- изучение потенциальной опасности и условий, реализующих потенциальную опасность биологических агентов при их преднамеренном применении для поражения людей;
- разработка подходов к эпидемиологическому расследованию искусственных эпидемических процессов, поражений биологическими токсинами, искусственными генетическими конструкциями и наночастицами;
- выявление эпидемиологических последствий преступления, совершенного с помощью биологических агентов;
- разработка критериев для установления деятельности биотеррористических организаций (совместно с правоохранительными органами);
- систематизация специальных знаний, необходимых для проведения экспертиз по уголовным делам, возбужденным в связи с расследованием преступлений, совершенных с помощью биологических агентов.
Неправильная эпидемиология как раздел в эпидемиологии инфекционных болезней находится в тесной методической связи с клинической медициной (инфекционные и соматические болезни), микробиологией, общей и частной эпидемиологией, токсикологией, молекулярной биологией, аэробиологией, соматической генной терапией, наноматериаловедением, судебной медициной, оперативнорозыскной деятельностью и криминалистикой.
В отличие от общей и частной эпидемиологии в компетенцию неправильной эпидемиологии не входит предотвращение вспышек (эпидемий) инфекционных болезней и поражений другими биологическими агентами. Их предотвращение является задачей правоохранительных органов.
Список литературы находится в редакции