Газета «Новости медицины и фармации» Гастроэнтерология (451) 2013 (тематический номер)
Вернуться к номеру
Ерозивно-виразкові ураження гастродуоденальної локалізації: діагностична тактика і лікувальні підходи
Авторы: Дорофєєв А.Е., Томаш О.В., Руденко М.М., Сібільов А.В., Донецький національний медичний університет ім. М. Горького
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
Епідеміологія. За останнє десятиріччя кількість хворих із ерозивновиразковими ушкодженнями верхніх відділів шлунковокишкового тракту (ШКТ) в Україні збільшилась. Так, наприклад, тільки кількість хворих із пептичними виразками шлунка і дванадцятипалої кишки (ДПК) зросла на 38 %, а поширеність цих захворювань досягла 150 випадків на 100 тис. населення. Спостерігається і збільшення кількості їх ускладнень. Кількість виразкових кровотеч зросла за цей час удвічі. Це пов’язано зі збільшенням поширеності не тільки пептичних, а й симптоматичних виразок, особливо викликаних прийомом нестероїдних протизапальних препаратів (НПЗП).
Традиційний термін «виразкова хвороба» (ВХ), що донині широко використовується в національній медицині, слід визнати застарілим. Формулювання діагнозу як ВХ лише констатує наявність морфологічного субстрату (виразки) слизової оболонки шлунка (СОШ) і/або ДПК, не відбиваючи при цьому етіопатогенетичних механізмів розвитку патології та, відповідно, не націлюючи на адекватну тактику її ведення. У світовій медицині стандартним діагностичним терміном є «пептична виразка» (peptic ulcer, peptic ulcer disease), що підкреслює етіопатогенетичну роль саме кислотнопептичного фактора. Виразки, що виникають на фоні прийому НПЗП, слід трактувати як НПЗПгастро(дуодено)патію, що зновтаки визначає тактику ведення цих хворих.
Патофізіологічні основи пептичних гастродуоденальних уражень
Для кращого розуміння патогенезу кислотозалежних захворювань необхідно згадати фізіологічні основи солянокислої секреції. В її регуляції бере участь ціла низка взаємопов’язаних нервових, ендокринних і паракринних механізмів (рис. 1).
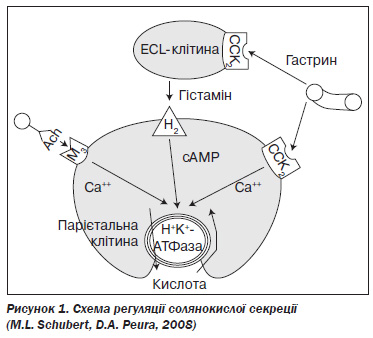
На поверхні обкладинкових (парієтальних) клітин є три види рецепторів, стимуляція яких призводить до збільшення викиду HCl у просвіт шлунка. Ацетилхолін, який виділяється із закінчень n.vagus, стимулює М3холінорецептори, що запускають фосфоліпазнокальцієвий шлях секреції. Гістамін продукується ECLклітинами (еnterochromaffinlike cell — ентерохромафіноподібна клітина) слизової оболонки шлунка й паракринним шляхом впливає на H2рецептори парієтальних клітин. Гастрин — гормон, що виділяється Gклітинами антрального відділу шлунка, кишечника та підшлункової залози. Впливаючи на CCK2рецептори (сholecystokinin; холецистокінінові рецептори 2го типу), він стимулює обкладинкові й ECLклітини. Таким чином, гастрин збільшує викид HCl як за рахунок безпосередньої активації кислотопродукції (менш значущий шлях), так і опосередковано, підвищуючи синтез гістаміну ECLклітинами (провідний механізм впливу). Будучи гормоном, гастрин впливає на росткову зону шлункових залоз. Він стимулює проліферацію обкладинкових і ECLклітин і тим самим підвищує потенціал кислотоутворення в шлунку. Основним інгібітором продукції HCl є соматостатин — гормон, що виділяється в шлунку, кишечнику, підшлунковій залозі. Він впливає на парієтальні клітини ендокринним і паракринним шляхом, стимулюючи соматостатинові SS2рецептори, а також пригнічує надлишковий синтез гістаміну ECLклітинами та гастрину Gклітинами. Кінцевою ланкою секреції HCl за наявності будьякого виду стимуляції виступає H+K+АТФаза, що відповідає за виділення водневих іонів у просвіт шлунка.
Таким чином, секреція соляної кислоти в шлунку стимулюється як у разі активації парієтальних клітин (вплив на М3холінергічні, H2гістамінові та CCK2гастринові рецептори), так і в разі гальмування виділення соматостатину (холінергічна та H3гістамінова стимуляція).
Такий агресивний вміст не ушкоджує сам шлунок, оскільки існує ціла група факторів резистентності. У першу чергу це слизовобікарбонатний бар’єр на поверхні шлункового епітелію (преепітеліальний рівень), нормальна регенерація слизової оболонки (епітеліальний рівень) і адекватна мікро та макроциркуляція в шлунковій стінці (постепітеліальний рівень). У разі надлишкового кислотоутворення і/або недостатності факторів захисту розвиваються кислотозалежні захворювання.
Розумінню сутності проблеми цієї патології сприяє таке. За складом слизу (наявністю тільки нейтральних глікопротеїнів) людина близька до травоїдних тварин, у яких рівень солянокислої секреції відносно низький. Проте характер секреції НСl у людини нагадує її в хижаків, що мають потужніший захисний бар’єр за рахунок наявності не тільки нейтральних, а й кислих глікопротеїнів. Здатність їх синтезувати людина втратила в процесі філогенезу, зберігши при цьому такі ж протеолітичні властивості шлункового соку (ШС), як і в хижаків. У звичайних фізіологічних умовах нейтральних глікопротеїнів достатньо для забезпечення домінування захисних факторів. У разі їх ослаблення і/або посилення ушкоджуючих факторів: ендогенних — НСl, пепсинів, жовчних кислот, екзогенних — пілоричного хелікобактера (Helicobacter pylori — Hр), нестероїдних протизапальних препаратів, алкоголю — чаша терезів схиляється в бік ушкодження слизової оболонки. Таким чином, сам собою рівень як базальної, так і стимульованої солянокислої секреції не є фактором, достатнім для індукції патології СОШ.
Слизова оболонка дванадцятипалої кишки, що примикає до шлунка, не має такого досконалого захисту. Регулярний контакт з НСl, що є потужним агресивним фактором, закономірно призводить до її ушкодження. При цьому початково в патогенезі більше значення має не кислотність ШС як така, а порушення антродуоденального «гальма» (воно перешкоджає потраплянню недостатньо залужненого бікарбонатами шлунка харчового субстрату в цибулину ДПК). У цьому випадку йдеться про ефекти НСl, патологічні вже не за силою, а за місцем дії.
Таким чином, усе розмаїття ерозивновиразкової патології СОШ і ДПК принципово пов’язане з двома етіопатогенетичними механізмами: впливом агресивних факторів і/або зниженням резистентності СО. Фактори агресії можуть бути ендогенними (гіперсекреція НСl, жовчний рефлюкс) і екзогенними (пілоричний хелікобактер, НПЗП, алкоголь). Саме домінування тих чи інших факторів обумовлює диференційований підхід до ведення ерозивновиразкової патології.
Класифікація. Ерозивновиразкові ушкодження ШКТ зазвичай класифікуються за етіологією на інфекційні (насамперед Нрасоційовані, набагато рідші при туберкульозі, сифілісі), медикаментозні (частіше за все НПЗПасоційовані, а також пов’язані з прийомом глюкокортикоїдів, цитостатиків), гемодинамічні (за наявності будьякого шоку, васкулітів), ендокринні (гастринома, гіперпаратиреоз, феохромоцитома, цукровий діабет), неопластичні (рак і лімфома шлунка), інші (гранулематозні ураження при хворобі Крона, саркоїдозі). За глибиною ураження виділяють ерозії (поверхневі, повні) та виразки, за поширеністю — одиничні та множинні, за локалізацією — шлункові (кардіальні, тіла, антральної частини, пілоричного каналу), дуоденальні (цибулинні, зацибулинні) й ерозії та виразки гастроентероанастомозу (післяопераційні). До найбільш частих ускладнень ерозій та виразок належать кровотечі, перфорація, пенетрація, стеноз. Малігнізація, що традиційно згадується, стосується практично виключно виразки шлунка й виникає досить рідко (1–2 % первинно доброякісних виразок). Вона пов’язана не стільки з ульцерацією СОШ як такою, скільки з загальнобіологічними механізмами, частіше за все асоційованими з тривалим персистуванням Нрінфекції.
Клінічні прояви. Синдром диспепсії при ерозивновиразкових процесах, як і за іншої патології, малоспецифічний. Його основним проявом може бути біль у верхній частині живота. Він локалізується в епігастрії або пілородуоденальній зоні, значно рідше — у лівому або правому підребер’ї. За характером біль може бути різноманітним — пекучим, ниючим тощо. Іноді пацієнта турбує тільки відчуття голоду. Болі частіше за все періодичні, вони зазвичай тривають декілька тижнів, зникають самостійно або після прийому антацидів чи антисекреторних препаратів. Рецидиви можуть бути пов’язані зі стресами або зміною пори року (весна, осінь). Традиційно вважається, що біль при виразках ДПК частіше за все виникає натщесерце й купірується прийомом їжі. При цьому чим вище виразка, тим скоріше після їди поновлюється біль. Так, у разі локалізації патології в шлунку болі виникають одразу після їди, а при дуоденальній виразці характерними є болі через 3–4 години після їди та вночі. Проте в реальній практиці такої строгої залежності немає. При цьому, з одного боку, «голодні» й нічні болі не завжди означають наявність ерозій і/або виразок і можуть виникати як симптоми функціональної диспепсії. З іншого боку, при верифікованих виразках диспепсія часто не має чіткої залежності від прийому їжі.
Виразки пілоричного каналу можуть супроводжуватися неспецифічними симптомами минущого порушення евакуації зі шлунка: тяжкістю в епігастрії, швидким насиченням, відрижкою, блюванням.
У разі локалізації виразки в кардіальному відділі шлунка хворого можуть турбувати загрудинні болі, які посилюються в горизонтальному положенні, що часто вимагає проведення диференціальної діагностики із захворюваннями серця.
У багатьох пацієнтів болі бувають неінтенсивними або взагалі відсутні. При цьому на перший план можуть виходити інші прояви синдрому диспепсії — тяжкість і відчуття переповнення в епігастрії, раннє насичення. Можливими є нудота й блювання. На жаль, у частини пацієнтів, особливо з симптоматичними виразками, захворювання може проявитися тільки своїми ускладненнями — перфорацією або кровотечею. У той же час неускладнений перебіг ерозивновиразкової патології ШКТ нерідко є клінічно абсолютно безсимптомним.
Діагностика. За наявності підозри на ерозії і виразки верхніх відділів ШКТ для підтвердження діагнозу показане проведення ендоскопічного дослідження (фіброезофагогастродуоденоскопія — ФЕГДС). Якщо процес локалізується в шлунку, необхідною є біопсія з подальшим морфологічним дослідженням гастробіоптата для виключення злоякісного характеру ураження. Згідно з міжнародними рекомендаціями та національним протоколом, таким пацієнтам також необхідно проводити ФЕГДС і після лікування для підтвердження рубцювання виразки та повторної біопсії із зони рубця. За наявності виразки у ДПК контрольна ФЕГДС після лікування не є доцільною у зв’язку з тим, що ця локалізація практично на 100 % виключає злоякісний характер ураження. Рентгенологічні методи діагностики, що раніше широко використовувалися, виявилися малоінформативними, особливо за наявності ерозій і гострих виразок. Останні, будучи поверхневими, не дають характерного для виразки симптому «ніші». Нині рентгенологічне дослідження проводиться за неможливості ендоскопії та за необхідності оцінки евакуаторної функції шлунка. Більш інформативними є сучасні методики візуалізації – томографія і/або інтрагастральна (ендоскопічна) сонографія. Виявлення ерозій і виразок у шлунку чи ДПК потребує подальшого уточнення етіологічних причин захворювання.
Нр-асоційовані пептичні гастродуоденальні виразки
Найчастішою причиною ерозій і виразок шлунка і ДПК є хелікобактерна інфекція. Як показали широкомасштабні дослідження, проведені в багатьох країнах світу, із цією інфекцією пов’язано 70–80 % дуоденальних виразок і до 50–60 % виразок шлунка. Нр — унікальний мікроорганізм, який пристосувався до життя у високоагресивному кислому середовищі шлунка. Він використовує для захисту від соляної кислоти здатність розщеплювати сечовину з утворенням аміаку — речовини, що має лужне середовище. Нр може викликати різні варіанти ураження шлунка й ДПК: гострий і хронічний гастрити, виразку, МАLTлімфому (МucosaAssociated Lymphoid Tissue lymphoma) й аденокарциному. Останнім часом було доведено роль хелікобактера не тільки у формуванні гастродуоденальної патології, а й у порушенні гемопоезу, що проявляється ідіопатичними залізодефіцитною анемією й тромбоцитопенією. Хелікобактерна інфекція передається фекальнооральним і орооральним шляхом. Тому легше за всіх зараженню піддаються діти, які живуть у великих сім’ях, особливо в разі поганих побутових умов. Це більш характерне для країн, що розвиваються, до яких певною мірою можна віднести й Україну. В Україні в багатьох людей зараження Нр відбувається ще в дитинстві, а в дорослих досягає 70–90 %. У промислово розвинених країнах частота інфікування Нр значно нижча — 0,3–1 % на рік; поширеність інфекції в загальній популяції становить всього 5–30 %. Тому в цих країнах питома вага Нрасоційованої гастродуоденальної патології відносно невелика.
Механізми ушкодження СОШ і ДПК при хелікобактерній інфекції включають як зниження резистентності, так і підвищення агресивності. Нр після адгезії до епітеліоцитів негайно викликає збільшення синтезу прозапальних інтерлейкінів і притягнення лейкоцитів із кров’яного русла. Виникає типова запальна реакція, що призводить до ушкодження СО різного ступеня вираженості. Токсини, що виробляє Нр, і аміак також ушкоджують слизову оболонку, активують запалення та погіршують мікроциркуляцію, внаслідок чого зміни, що виникли, посилюються. У хворих із хелікобактеріозом шлункова секреція спочатку наростає, тобто збільшується агресивність шлункового соку. Це обумовлено переважним ураженням D(дельта)клітин, що виробляють соматостатин (антагоніст гістаміну). Це приводить до зростання гістамінопосередкованої шлункової секреції. Надалі з розвитком і прогресуванням атрофічного гастриту спостерігається зниження секреції НСl. Тільки в 10 % людей, інфікованих Нр, розвиваються ерозивновиразкові ушкодження, а в решти інших — хронічний неерозивний гастрит. До ерозій і виразок частіше за все призводять штами, що виробляють вакуолізуючий токсин і цитотоксичний білок. Важливе значення мають особливості імунної відповіді людини, спадково обумовлені маса залоз тіла шлунка і наявність на епітеліоцитах рецепторів до адгезинів Нр (останні сприяють фіксації бактерій на поверхні СО).
Діагностика Нрінфекції проводиться з допомогою різноманітних тестів. Серологічна діагностика передбачає визначення антитіл до Нр (Ig G) у сироватці крові та в калі (stool antigen test). Можливим є проведення полімеразної ланцюгової реакції для визначення фрагментів генома Нр у гастробіоптаті або в калі. Уреазні тести: дихальний або з гастробіоптатом — ґрунтуються на виявленні ключового ферменту життєдіяльності Нр уреази. Морфологічне дослідження гастробіоптату також дозволяє не тільки верифікувати ураження СО, а й візуалізувати обсіменіння Нр. Найскладнішим і найбільш трудомістким є бактеріологічний метод — виділення культури Нр із подальшим типуванням і визначенням чутливості до антибіотиків.
Зазвичай першим діагностичним тестом на Нр у нашій країні є визначення уреазної активності і/або мікроскопічна ідентифікація в біоптаті СО шлунка, взятому під час ендоскопічного дослідження. Неінвазивні методи діагностики частіше за все застосовуються для оцінки повноти ерадикації Нр, причому робити це необхідно не раніше ніж через 4 тижні після завершення антихелікобактерної терапії.
Визначення сироваткових антитіл до Нр є припустимим тільки як первинна, зокрема, скринінгова діагностика інфекції. Воно не повинне використовуватися для контролю після лікування, оскільки навіть у разі ефективної терапії антитіла зберігаються від декількох місяців до декількох років. Цей метод більш переважний на фоні вже розпочатого прийому антисекреторних і антихелікобактерних препаратів, оскільки уреазні тести при цьому можуть бути псевдонегативними.
У світовій практиці стандартним діагностичним тестом, як первинним, так і після лікування, є неінвазивний уреазний дихальний тест.
Гастродуоденопатії, асоційовані з прийомом НПЗП
Другою за частотою причиною ерозивновиразкової патології СОШ і ДПК (як за відсутності, так і за наявності Нрінфекції) є прийом НПЗП із розвитком НПЗПгастро(дуодено)патії. Як відомо, протизапальний ефект НПЗП обумовлений інгібіцією ферменту циклооксигенази2 (ЦОГ2). Однак неселективність більшості представників НПЗП призводить до одночасного пригнічення активності й ЦОГ1, що є в усіх тканинах організму, зокрема в СО ШКТ. Тут вона стимулює вироблення простагландинів Е2, I2, F2. Саме ці простагландини підвищують резистентність СО до ушкоджень шляхом стимуляції секреції гідрокарбонатів слизовобікарбонатного бар’єра, посилення кровотоку та проліферації клітин, стабілізації клітинних лізосом і мембран.
Таким чином, чим менш селективним є НПЗП, тим вищим є ризик розвитку НПЗПгастропатії. І основний, протизапальний, і побічні (у цьому випадку ульцерогенний) ефекти НПЗП реалізуються на системному рівні, тобто після проникнення препарату в кров. Тому, незважаючи на поширену серед лікарів хибну думку, шлях введення НПЗП (прийом всередину звичайних або кишковорозчинних форм, ін’єкції, свічки) не є принциповим з точки зору профілактики гастропатій. Деякі НПЗП, наприклад ацетилсаліцилова кислота, причому дозою від 10 мг, здатні ушкоджувати СОШ не тільки шляхом ЦОГопосередкованих механізмів. Під час безпосереднього контакту зі слизовою оболонкою відбувається порушення контактів між клітинами, клітинна дезінтеграція. Такий варіант ушкодження дійсно можна зменшити, застосовуючи кишковорозчинні форми (вони підвищують ризик НПЗПентеро та колопатій) або обираючи парентеральний шлях введення.
Залежно від хімічної будови НПЗП ризик розвитку гастропатії коливається від 4 % (диклофенак) до 74 % (кетопрофен). Ультраструктурні зміни в СО можуть розвинутися вже через декілька хвилин після прийому НПЗП, макроскопічні — через декілька днів.
Менший ушкоджуючий ефект мають більш селективні інгібітори ЦОГ2 — німесулід, мелоксикам, набуметон, етодолак і коксиби (целекоксиб, парекоксиб, люміракоксиб тощо). Проте слід враховувати, що коксиби, будучи найменш небезпечними з точки зору гастропатій, підвищують ризик тромбоутворення, що є клінічно значущим для пацієнтів із церебро та кардіоваскулярною патологією.
До факторів, що збільшують ризик ушкодження СОШ і ДПК після прийому НПЗП, належать:
— вік старше 65 років — саме літні пацієнти є основними споживачами НПЗП із приводу ІХС, суглобового синдрому, болю в нижній частині спини;
— наявність пептичної виразки, зокрема в анамнезі (особливо ускладненої кровотечею або перфорацією);
— великі дози і/або одночасний прийом декількох НПЗП, зокрема аспірину дозою 50–325 мг;
— одночасний прийом глюкокортикоїдів (перорально, парентерально);
— одночасний прийом прямих і непрямих антикоагулянтів;
— тривалий прийом (хоча ризик зростає пропорційно тривалості лікування НПЗП, його максимальний приріст відзначається в перші 4 тижні терапії. Таким чином, навіть короткі — до 1 місяця — курси лікування НПЗП не можуть вважатися абсолютно безпечними й потребують відповідної супровідної терапії);
— жіноча стать (існує точка зору, що жінки просто частіше приймають НПЗП);
— паління;
— прийом алкоголю;
— наявність Нр.
НПЗПгастропатія часто не супроводжується жодною клінічною симптоматикою. Її першими симптомами можуть бути ознаки кровотечі або перфорації. Тому для діагностики НПЗПгастропатії показана ЕФГДС. Її необхідно проводити всім хворим, які приймають ці препарати та мають підвищений ризик ускладнень, незалежно від наявності будьяких скарг. Повторні ендоскопічні дослідження проводяться кожні 6 місяців. На відміну від пептичної виразки, у хворих із НПЗПгастропатією виразки частіше множинні, з маловираженим періульцерозним запаленням, локалізовані в тілі шлунка.
Симптоматичні нехелікобактерні ураження
Виявлення множинних ерозивновиразкових ушкоджень слизової оболонки шлунка дуже часто є проявом симптоматичних нехелікобактерних уражень. У цій ситуації необхідно думати про так звані рідкісні захворювання: синдром Золлінгера — Еллісона (СЗЕ, або гастринома), гіперпаратиреоз, системні васкуліти.
СЗЕ — нозологічна одиниця. Сутність патології полягає в наявності гастринпродукуючої пухлини, що частіше за все (60–90 %) локалізується в підшлунковій залозі, стінці ДПК або воротах печінки (так званий трикутник гастрином). Гіперпродукція гастрину призводить до вираженої гіпергастринемії та, як наслідок, до стабільно високої солянокислої секреції. При цьому немає інгібуючого впливу HCl на синтез гастрину через порушений фізіологічний зворотний зв’язок. Хронічна гіперсекреція HCl не компенсується шлунковою секрецією бікарбонатів. У результаті агресивний шлунковий вміст, що має низький (кислий) рівень рН, не тільки ушкоджує СОШ, а й, потрапляючи в просвіт ДПК, викликає її ульцерацію. Ці виразки частіше множинні, резистентні до стандартної антисекреторної терапії; вони рецидивують, незважаючи на відсутність Нрінфекції. Досить часто в пацієнтів із СЗЕ наявна не характерна для пептичної виразки діарея внаслідок інактивації шлунковим соком панкреатичних ферментів у просвіті ДПК. Діагноз підтверджується визначенням рівня сироваткового гастрину, що підвищується більш ніж у 2,5 раза. Візуалізація пухлини за допомогою УЗД, КТ, МРТ на ранніх стадіях може бути утруднена через її малі розміри. У цьому випадку більш інформативною є сцинтиграфія.
Ерозивновиразкове ушкодження може бути пов’язане із системним або локальним порушенням кровообігу (стресові виразки). Класичним прикладом такої патології є виразки Кушинга та Курлінга у хворих з опіками, гострим порушенням мозкового кровообігу, шоком при інфаркті міокарда або гострій крововтраті. Шокові виразки зазвичай тяжкі для діагностики, оскільки практично відсутні симптоми диспепсії, а на перший план виходять ознаки шоку та проявів патології, що його викликала. Дуже часто першим і єдиним проявом таких виразок є симптоми ускладнень — кровотечі або перфорації.
У хворих із виразками шлунка, що тривало не рубцюються (незалежно від Нрстатусу), необхідно виключати первинновиразкову форму пухлини шлунка.
Лікування ерозивно-виразкових ушкоджень
Різноманітність причин і механізмів ерозій і виразок СОШ і ДПК потребує диференційованого підходу до їх лікування та профілактики.
За останні десятиріччя радикально змінилися підходи до лікування пептичної виразки. На зміну запропонованому майже 100 років тому принципу «без кислоти немає виразки» прийшов принцип «без хелікобактера й кислоти немає виразки». Розроблення ефективних методів усунення Нрінфекції та поява нових антисекреторних препаратів призвели до того, що «виразкова хвороба», яку раніше вважали хронічною, тобто невиліковною, нині може й повинна бути повністю вилікувана.
Сучасні антисекреторні препарати є основою лікування Нрнегативної пептичної виразки шлунка та ДПК.
Для успішного рубцювання виразки необхідно підвищити інтрагастральний рівень рН до 3 і вище та підтримувати його не менше 18 годин на добу. Тому практично повністю втратили своє значення антациди, оскільки, як виявилось, вони не здатні адекватно знизити шлункову секрецію навіть при дуже частому застосуванні великими дозами. Як неселективні (атропін, метацин, платифілін), так і селективні (піренцепін) Мхоліноблокатори, що прийшли їм на зміну, виявилися недостатньо ефективними; нині їх розглядають як спазмолітики. У сучасній гастроентерології існують тільки 2 класи антисекреторних препаратів: блокатори гістамінових рецепторів 2го типу (Н2блокатори) та інгібітори протонної помпи (ІПП) (рис. 2). Н2блокатори (ранітидин, фамотидин) через меншу, порівняно з ІПП, антисекреторну активність не рекомендуються як препарати першого ряду для лікування пептичної виразки. Зі значно більшим ефектом вони застосовуються у хворих із функціональною диспепсією.
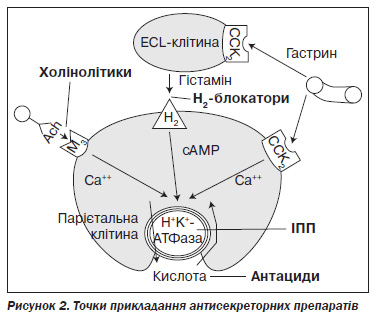
ІПП діють на кінцеву ланку шлункової секреції (іонообмінний фермент Н+К+АТФазу, вона ж — протонна помпа), максимально пригнічуючи виділення соляної кислоти незалежно від шляхів її стимуляції — гістамінового, ацетилхолінового, гастринового. Тому нині вони є основною групою антисекреторних препаратів. Існує декілька поколінь цих препаратів, однак до найбільш поширених у нашій країні належать омепразол (1го покоління) і лансопразол (2го покоління). Рабепразол, пантопразол, езомепразол, що належать до наступних поколінь, а також не зареєстрований в Україні тенатопразол мають ефективність, у цілому зіставну з такою в попередників. В Україні вони застосовуються рідше через свою вищу вартість.
Метаболізм ІПП здійснюється системою печінкових ферментів цитохрому Р450. Їх генетичний поліморфізм може істотно впливати на фармакокінетику й, відповідно, на клінічну ефективність ІПП.
Основним компонентом лікування Нрпозитивної пептичної виразки, спрямованого не тільки на рубцювання виразкового дефекту, а й на усунення рецидивів виразки в подальшому, тобто виліковування, повинна бути антихелікобактерна терапія, спрямована на ерадикацію — повне усунення Нрінфекції.
Перші міжнародні рекомендації з діагностики й лікування Нрасоційованої патології (Маастрихтський консенсус) було опубліковано в 1996 р. У 2010 р. було прийнято останню, четверту, Маастрихтську угоду (Маастрихтський консенсус IV). Згідно і з цим документом, і з національними рекомендаціями передбачається обов’язкова антихелікобактерна терапія пептичної виразки шлунка і/або ДПК, зокрема ускладненої. Такого лікування потребують і всі Нрпозитивні пацієнти з пептичною виразкою в анамнезі («виразкова хвороба в неактивній фазі», за попередніми уявленнями).
Згідно з Маастрихтським консенсусом, існує терапія першої лінії (стартова, потрійна) і терапія другої лінії (квадротерапія). При цьому рекомендовані схеми повинні забезпечувати рівень ерадикації не менше 80–85 % при частоті побічних ефектів менше 5 %.
До терапії першої лінії належить комбінація ІПП з двома антибактеріальними препаратами: кларитроміцином і амоксициліном або кларитроміцином і метронідазолом. Необхідність використання як антисекреторних препаратів саме ІПП пов’язана з тим, що, поперше, ІПП забезпечують максимальний кислотосупресивний ефект, що само собою оптимізує загоювання виразки. Подруге, ця кислотосупресія необхідна для захисту кислотонестійких антибіотиків кларитроміцину та амоксициліну від інактивації в шлунку. Потретє, самі ІПП мають інгібуючий вплив на хелікобактерну уреазу.
У разі неефективності ерадикації є необхідним проведення терапії другої лінії, що передбачає призначення ІПП у сполученні з препаратом вісмуту, метронідазолом і тетрацикліном. Рекомендована тривалість лікування — 7–14 днів. Збільшення тривалості терапії з одного тижня до двох може підвищити її ефективність у середньому на 5 %.
У країнах Західної Європи та Північної Америки, що активно застосовують ерадикаційну терапію протягом 15 років, виникла проблема резистентності Нр до стандартних схем. Для її вирішення запропоновано модифіковані схеми: послідовну (sequential therapy) і супутню терапію (concomitant therapy). Проте жодна модифікована схема в нашій країні поки не рекомендована офіційно. Як терапія третьої лінії застосовуються (у тому числі й в Україні) варіанти так званої терапії порятунку (rescue therapy), що включає альтернативні препарати — найчастіше нітрофуранові, фторхінолонові антибіотики, рифаксимін, рифабутин.
Але досвід провідних українських гастроентерологів (В.Г. Передерій, Ткач, 2012) свідчить про те, що сьогодні в Україні досить високого рівня ерадикації (більше 90 %) так само можна досягти за 7–10 днів стандартної потрійної терапії. Це збігається і з нашими власними даними щодо ефективності фіксованих комбінацій, що відповідають рекомендованим схемам стартової терапії. У проведеному нами порівняльному дослідженні пілобакту нео, бетаклатинолу і орністату (за участю 150 пацієнтів) саме пілобакт нео продемонстрував найвищий рівень антихелікобактерної дії — 91,7 % (проти 73,3 і 61,7 % у орністату і бетаклатинолу відповідно).
Отже, будьякі рекомендації з антибактеріальної терапії повинні ґрунтуватися на регіональних даних щодо резистентності мікрофлори до антибіотиків, а тому не можуть бути абсолютно універсальними.
Широке застосування антибактеріальних препаратів призвело до появи штамів Нр, резистентних до метронідазолу і кларитроміцину. Істинна поширеність таких штамів в Україні невідома, однак орієнтовно резистентні до метронідазолу штами Нр зустрічаються в 4 рази частіше, ніж резистентні до кларитроміцину (26 і 6,7 % відповідно). В окремих регіонах стійкими до метронідазолу виявилися до 70 % мікроорганізмів. Через це в нашій країні недоцільно використовувати як стартову терапію схему, що містить метронідазол. Резистентність же до амоксициліну має спорадичний характер. Тому в Україні перевагу слід віддавати саме комбінації «ІПП + кларитроміцин + амоксицилін», а не метронідазолкомпонентним схемам. Ця позиція чітко обговорена у Наказі МОЗ України № 600 від 3 серпня 2012 року «Про затвердження та впровадження медикотехнологічних документів зі стандартизації медичної допомоги при диспепсії». До речі, Маастрихт IV не розглядає заміну ані кларитроміцину на інші макроліди, ані метронідазолу на інші нітроімідазоли як засіб подолання резистентності.
У країнах із широкою розповсюдженістю кларитроміцин і метронідазолрезистентних штамів Нр як стартова може застосовуватися квадротерапія. В Україні ж ці рекомендації поки не є актуальними.
Ціла низка досліджень (і наші власні дані) продемонстрували доцільність одночасного призначення пробіотиків, що містять деякі штами біфідо й лактобактерій і сахароміцети. Це підвищує ефективність антихелікобактерної терапії та зменшує її побічні ефекти, насамперед антибіотикоасоційовану діарею.
Після кожного курсу терапії обов’язковим є контроль ефективності ерадикації, що дозволяє визначити тактику подальшого ведення пацієнта.
Якщо квадротерапія не дозволила досягти ерадикації, Маастрихтський консенсус пропонує два варіанти. Перший — виділення культури Нр з визначенням його чутливості до антибактеріальних препаратів — в Україні в рутинній практиці не використовується. Другий варіант передбачає проведення вже згаданої терапії порятунку. В України слід призначати ІПП з амоксициліном та левофлоксацином або рифабутином протягом 10–14 днів.
Маастрихтський консенсус передбачає проведення ерадикаційної терапії не тільки пацієнтам із пептичною Нрпозитивною виразкою. Антихелікобактерного лікування потребують Нрпозитивні пацієнти з ФД; атрофічним гастритом, доведеним морфологічно; MALToмою; ті, хто переніс резекцію шлунка з приводу раку шлунка (РШ) та їх родичі у зв’язку з генетичною схильністю до РШ і можливістю інфікування тими ж канцерогенними штамами Нр у разі сумісного проживання. Ця терапія може бути корисною хворим з ідіопатичними залізодефіцитною анемією та тромбоцитопенією. Доцільність ерадикації Нр за іншими показаннями, наприклад за наявності алергічних і шкірних захворювань, на сьогодні не доведена.
Частота реінфікування, принаймні у дорослих, які дотримуються елементарних правил особистої гігієни, становить менше 1 % на рік. Це ще один доказ доцільності проведення антихелікобактерної терапії.
Інші методи лікування пептичних виразок: дієтотерапія, фізіотерапія, санаторнокурортне лікування — втратили своє значення як недостатньо ефективні. У численних дослідженнях було показано, що в разі адекватної медикаментозної терапії відсутня вірогідна відмінність у строках рубцювання виразки залежно від дотримання чи недотримання хворими суворої дієти. Доцільним вважається лише усунення алкоголю, кофеїнвмісних напоїв та індивідуально непереносимих продуктів, а також відмова від паління. Більшість пацієнтів з неускладненою пептичною виразкою не потребують госпіталізації. Планове хірургічне лікування цих хворих також визнано помилковим.
Профілактика й лікування НПЗПгастропатій. З профілактичною метою перевагу по можливості слід віддавати більш селективним інгібіторам ЦОГ2 з урахуванням того, що їх застосування супроводжується меншою частотою пошкодження СО шлунка й ДПК. Курс лікування НПЗП повинен бути максимально коротким і має проводитися з мінімальними, але ефективними дозуваннями. Необхідно уникати одночасного прийому НПЗП із антикоагулянтами і глюкокортикоїдами.
Згідно з Маастрихтським консенсусом, НПЗП і Нр є незалежними факторами ризику ерозій і виразок. Тому за необхідності тривалого або регулярного прийому НПЗП доцільно тестувати пацієнта на наявність Нрінфекції, а в разі позитивності — проводити попередню ерадикаційну терапію за загальними принципами.
У численних дослідженнях було показано ефективність антацидів, Н2блокаторів, ІПП і синтетичного аналога простагландину Е2 мізопростолу як засобів профілактики НПЗПгастропатії. Також довів свою ефективність ребаміпід — мукопротектор, що посилює слизоутворення в шлунку. Найефективнішими з цієї групи традиційно вважаються ІПП. Їх паралельний профілактичний прийом, як правило, половинною дозою є доцільним у хворих із високим ризиком розвитку ерозій і виразок на фоні лікування НПЗП.
ІПП виявилися «конкурентами» антитромбоцитарним препаратам, зокрема клопідогрелю, за біотрансформацією одними й тими ж печінковими ферментами системи цитохрому Р450. У ряді досліджень продемонстровано можливість зниження ефективності терапії клопідогрелем або подвійної антитромбоцитарної терапії (аспірин + клопідогрель) за одночасного прийому практично всіх ІПП. У зв’язку з цим ефективною та безпечною альтернативною для профілактики гастропатій на фоні прийому аспірину та клопідогрелю може бути Н2блокатор фамотидин.
Лікування гастродуоденопатії в ідеалі передбачає скасування «причинного» НПЗП, за неможливості — зменшення його дози або перехід на більш селективний препарат, а також призначення ІПП або Н2блокатора стандартним дозуванням. Можливим також є застосування ребаміпіду. Доцільними є відмова від алкоголю, паління та ерадикація Нр, якщо її не було проведено раніше.
Профілактика й лікування стресових виразок принципово не відрізняються від таких при НПЗПгастропатії та доповнюються лікуванням основної патології.
Терапія СЗЕ зводиться до радикального лікування пухлини та призначення високих і надвисоких доз ІПП, а за наявності діареї — до додаткового призначення кислоторезистентних форм травних ферментів.