Газета «Новости медицины и фармации» Гастроэнтерология (451) 2013 (тематический номер)
Вернуться к номеру
Сучасні аспекти ендоскопічної та морфологічної діагностики неспецифічного виразкового коліту
Авторы: Бойко Т.Й., Сімонова О.В., ДУ «Інститут гастроентерології АМН України», м. Дніпропетровськ
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
У статті наведено огляд сучасної літератури, що стосується критеріїв ендоскопічного та морфологічного методів діагностики неспецифічного виразкового коліту, оцінки ендоскопічної активності і принципів проведення онкоскринінгу при цьому захворюванні.
неспецифічний виразковий коліт, ендоскопічна діагностика, морфологічна діагностика.
За останні роки в усьому світі спостерігається зростання захворюваності на неспецифічний виразковий коліт (НВК).
НВК характеризується хронічним безперервним запаленням слизової оболонки (СО) товстої кишки (ТК) різної протяжності, з обов’язковим залученням прямої кишки, рецидивуючим перебігом і можливістю розвитку місцевих і системних ускладнень. Захворювання уражає людей різної вікової категорії, значно впливає на якість життя, призводить до зниження працездатності та інвалідизації осіб молодого віку [3, 5, 30].
Різноманітність клінічних ознак, наявність позакишкових проявів нерідко викликають труднощі при постановці діагнозу. Діагноз НВК ґрунтується на ретельно зібраних анамнестичних даних, аналізі клінічної симптоматики та результатах допоміжних об’єктивних методів дослідження (ендоскопічного, морфологічного, рентгенологічного, сонографічного та ін.) [26, 32].
Провідну роль у діагностиці НВК відіграє ендоскопічне дослідження товстої кишки, що дозволяє як верифікувати діагноз, так і визначити активність та протяжність запалення в товстій кишці [26, 30, 33].
Однією з основних ендоскопічних ознак НВК є початок ураження з аноректального переходу і безперервне поширення уверх (аборально). Верхня межа ураженої ділянки СО може знаходитися на будьякому рівні: від прямої кишки до ілеоцекального клапана.
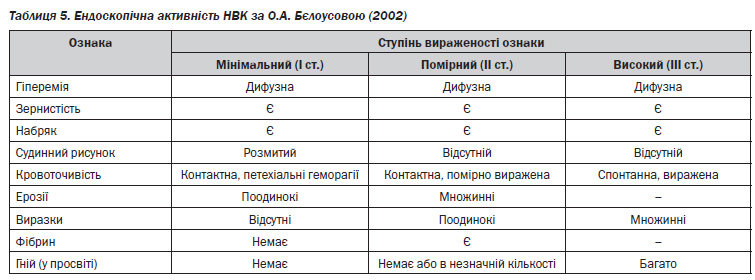
При ендоскопічному дослідженні виявляються: еритема СО, набряк, згладженість складок, стертість судинного рисунка, ерозії, виразки, геморагії, кровоточивість СО, псевдополіпи, наявність чіткої межі між запально зміненою і нормальною СО. Відсутність макроскопічних змін СО прямої кишки при ендоскопічному дослідженні практично виключає діагноз «виразковий коліт», окрім тих випадків, коли нещодавно проводилось місцеве лікування [1–3, 6–9, 11, 25, 30].
Макроскопічні зміни при НВК залежать від фази захворювання, тяжкості процесу, тривалості хвороби [1, 5, 7, 11, 22, 28].
Найбільш типовими ознаками НВК у фазі загострення є дифузна еритема, пухкість СО (слизова оксамитоподібна), петехії (геморагії), стертість нормального судинного рисунка, поверхневі дефекти різної протяжності і форми (полігональні, павутиноподібні) на великій площі, аж до десквамації СО (зливні виразки), контактна або спонтанна кровоточивість різного ступеня вираженості, гнійні й фібринозні накладення. Характерним для виразкового коліту є те, що ерозії і виразки розташовані тільки в ділянках запально зміненої СО. При НВК, на відміну від хвороби Крона, ніколи не зустрічаються афтоїдні виразки. Зернистість СО може спостерігатися у фазі загоєння виразок і ерозій і в неактивній фазі НВК [2, 5, 7–9, 11].
При прогресуванні захворювання гаустри згладжуються, кишка набуває вигляду вузької трубки, яка позбавлена складок; може зустрічатися нерізке звуження просвіту ТК. Стриктури для цього захворювання не є характерними, і якщо спостерігається локальне звуження просвіту кишки, то це повинно викликати підозру на рак, хворобу Крона або ішемічне ураження [1, 7, 30].
У фазі ремісії може відбутися повна репарація СО, але залишаються ознаки, за якими можна ретроспективно встановити перенесений НВК: СО тьмяна, світла, здається ніби натягнутою на підслизовий шар, поверхня її мозаїчна або дрібнозерниста, судинний рисунок може відновитися, але не повністю, як правило, він перебудований, атиповий (судини можуть бути примхливо покручені, з додатковим петлеутворенням), можуть визначатися псевдополіпи, при тривалому НВК зникає складчастість [7, 20, 22, 28].
Проведення колоноскопії дозволяє визначити протяжність ураження ТК, що впливає на вибір терапії, шлях уведення препарату (оральний, топічний). Відповідно до Монреальської класифікації НВК (Montreal world congress of Gastroenterology, 2005 р.), що узгоджується з консенсусом ECCO (Європейське товариство з вивчення хвороби Крона та виразкового коліту) (2006 р.), за протяжністю ураження товстої кишки НВК розподіляється на виразковий проктит (ізольоване ураження прямої кишки), лівобічний НВК (ураження до селезінкового кута), протяжний НВК (ураження вище селезінкового кута, включаючи панколіт) [27]. За даними літератури, ураження прямої та сигмоподібної кишки зустрічаються в 46–70 % випадків, у 15–28 % запальні зміни поширюються до селезінкового згину, а у 15–37 % пацієнтів вони охоплюють всю товсту кишку (субтотальний і тотальний коліти) [26, 32].
При панколіті може спостерігатись залучення апендикса (до 75 % випадків), у ряді випадків — ураження ілеоцекального клапана, що призводить до ригідності й дилатації його отвору. У 2 % хворих на панколіт спостерігається залучення термінального відділу здухвинної кишки — ретроградний (термінальний) ілеїт (backwash ileitis), при якому визначають дифузний набряк, гіперемію СО тонкої кишки, можуть зустрічатись невеликі виразки, зернистість. Зміни рідко поширюються більше ніж на 12–15 см тонкої кишки [30].
Ендоскопічне дослідження дозволяє виявити запалення резервуарновихідникового анастомозу у хворих, які перенесли проктоколектомію з приводу НВК, так званий паучит (pouchitis). Паучит трапляється у 50 % таких пацієнтів і частіше спостерігається у хворих із первинним склерозуючим холангітом або іншими позакишковими проявами НВК. До найбільш характерних ендоскопічних ознак паучиту належать: еритема, набряк, пухкість, зернистість, контактна кровоточивість СО, фібринозний наліт, ерозії й невеликі виразки [30].
Для вибору тактики лікування й прогнозування перебігу виразкового коліту важливим є визначення активності захворювання як за клініколабораторними, так і за ендоскопічними параметрами. Для визначення ендоскопічної активності НВК запропоновано кілька індексів: J.H. Baron (1962 г.) [10, 20, 31], D. Rachmіlewіtz (1989 р.) [24], S. Truelove и L. Witts [17, 30], R. Modigliani (1993 г.) [9], Mayo Score Assignment (1987) та інші [6, 12, 13, 16, 31]. Ступінь активності запалення СО визначається на підставі бальної оцінки основних ендоскопічних ознак НВК: вираженості судинного рисунка, наявності гіперемії, набряку, зернистості СО, контактної або спонтанної кровоточивості, ерозій, виразок, гнійного нальоту. Найбільш часто в клінічних дослідженнях використовуються класифікації J.H. Baron, D. Rachmilewitz, Mayo Score Assignment і R. Modigliani (табл. 1–4).
Бальна система оцінки тяжкості та активності НВК за Рахмілевичем (1989 р.) передбачає визначення індексу клінічної активності (CAI) та ендоскопічного індексу (EI) [24]. Кількісне визначення клінічної активності захворювання з урахуванням клінічних і ендоскопічних ознак є найбільш точним в оцінці стану хворого, однак у цій системі надається увага як об’єктивним (ендоскопічна картина, показники аналізу крові, температура тіла, частота випорожнень та ін.), так і суб’єктивним параметрам (загальне самопочуття хворого, біль у животі).
Російськими вченими запропоновано визначення ендоскопічної активності НВК, що наведене в табл. 5 [2].
Як правило, при виразковому коліті відмічається чітка кореляція між клінічною й ендоскопічною активністю захворювання. Але в деяких випадках спостерігаються розбіжності між цими параметрами. Виражені клінічні прояви НВК за наявності помірних і мінімальних ендоскопічних змін СО ТК можуть бути обумовлені значною протяжністю процесу, на той час як виражена ендоскопічна активність виразкового коліту з помірними клінічними проявами означає залучення тільки дистального відділу кишечника, тобто малу протяжність [23, 29].
Важливе значення при виразковому коліті має методологія ендоскопічного дослідження. Згідно з консенсусом ECCO, при підозрі на НВК для встановлення діагнозу і визначення протяжності ураження рекомендується колоноскопія, бажано з ілеоскопією, і сегментарна біопсія. При тяжкому перебігу захворювання у зв’язку з можливістю перфорації кишки як процедура першої лінії призначається сигмоїдоскопія або рентгенографія черевної порожнини [7, 11, 14, 18, 21, 22, 28, 30].
Ендоскопічне дослідження ТК в активній фазі НВК повинно проводитися з особливою обережністю з метою уникнення ускладнень. При необхідності може бути використаний ендоскоп малого діаметра (дитячий езофагогастродуоденоскоп). При тяжкому ураженні не можна ставити завдання повного огляду ТК для визначення протяжності процесу. При ендоскопічному дослідженні ТК у хворих на виразковий коліт використання зусиль при проведенні ендоскопу категорично протипоказане. Основною причиною ускладнень при колоноскопії у хворих на НВК є недостатній досвід роботи і завищена самооцінка лікаряендоскопіста [7, 18, 28].
Важливе місце в діагностиці виразкового коліту займає морфологічне дослідження.
Для вірогідної діагностики НВК необхідне взяття біопсій із 5 різних відділів ТК, включаючи пряму кишку і здухвинну кишку; мінімальна кількість біоптатів — 2. Біопсійний матеріал з різних ділянок ТК слід класти в різні контейнери і чітко вказувати місце взяття біоптату. Слід враховувати, що біопсії, отримані з нижнього відділу прямої кишки, можуть не містити всі морфологічні ознаки НВК [18, 30].
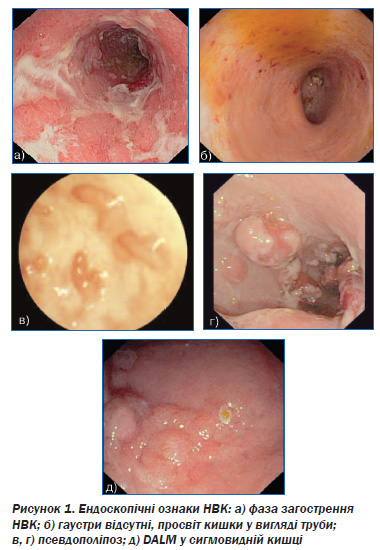
У цілому макроскопічні та мікроскопічні зміни при НВК умовно поділяють на такі, які дозволяють обґрунтувати діагноз, критерії загострення і ступеня активності процесу, ознаки хронізації. До ознак загострення НВК належать поява ерозій і виразок як на макроскопічному, так і мікроскопічному рівнях, виражена запальна інфільтрація з наявністю поліморфноядерних лейкоцитів, часто з глікогеном у цитоплазмі, наявністю міжепітеліальних клітин і часто — криптабсцесів, зменшення кількості бокалоподібних клітин, пригнічення секреції слизу. До критеріїв хронізації НВК автор відносить такі морфологічні ознаки, як порушення архітектоніки крипт, наявність вогнищ склерозу у власній пластинці [4].
Згідно з консенсусом ECCO, серед сукупності морфологічних ознак НВК виділяються: зміни архітектоніки, зміни епітелію, запальні ознаки [15, 30].
Зміни архітектоніки. Класичною гістологічною ознакою НВК є викривлення архітектоніки крипт і фактичне зникнення залоз.
Гілкування крипт (crypt branching) — дві гілки або більше, які добре орієнтовані в одній площині (горизонтальній або вертикальній). Зміни тільки однієї крипти є менш специфічними. Вважають, що розвиток цих змін обумовлений регенерацією після попереднього ушкодження або деструкції (cryptolysis).
Викривлення крипт (mucosal crypt distortion) — зміни розміру крипт (тобто різний діаметр), розташування, орієнтації (втрата паралелізму), форми (в тому числі гілкування з утворенням кіст).
Біопсії, які отримані з нижнього відділу прямої кишки, вважаються не інформативними для виявлення гілкування та викривлення крипт.
Атрофічні зміни — mucosal (crypt) atrophy and crypt density — комбінація виснаження крипт (витончення крипт визначається за збільшенням відстані між криптами, що перевищує діаметр однієї крипти) та збільшенням відстані між м’язовим шаром (muscularis mucosae) та основою крипт.
Деякі автори вважають достатньою присутність хоча б однієї з цих ознак. Слід зауважити, що збільшення міжкриптального простору, проміжку між криптами та м’язовим шаром СО може бути в нормі у дистальному відділі прямої кишки та сліпій кишці. Відстань між muscularis mucosae та основою крипт також не слід оцінювати поблизу лімфоїдних фолікулів.
Surface irregularity (villous surface, villous mucosa) — ворсинчаста поверхня — наявність широкого отвору в крипт, що надає поверхні слизової оболонки пальцеподібного вигляду.
Зміни епітеліальних клітин. Панетівська метаплазія. У нормі клітини Панета в дистальному відділі товстої кишки зустрічаються вкрай рідко — до селезінкового згину (0–1,9 %). Присутність клітин Панета в цьому відділі має назву «панетівська метаплазія». Її патогенез пов’язаний із регенерацією та відновленням епітелію. Наявність панетівської метаплазії є підтвердженням НВК при вже встановленому діагнозі.
Порушення слизопродукції (mucin depletion) визначається зменшенням числа келихоподібних клітин або кількості слизу всередині цих клітин. Значне, поширене зниження слизопродукції спостерігається в активній фазі НВК та допомагає в установленні діагнозу.
Запальні зміни. Базальний плазмоцитоз (basal plasmocytosis) визначається за наявністю плазмоцитів навколо (на глибину 1/5 власної пластинки) або під криптами, уздовж або з пенетрацією в muscularis mucosae. До базального плазмоцитозу також відносять акумуляцію плазматичних клітин між основою крипт та м’язовим шаром. Зміни можуть бути фокальними або дифузними, субкриптальна наявність клітин не завжди присутня.
Базальний плазмоцитоз має високу прогностичну цінність на ранніх стадіях ЗЗК. Повторні біопсії через певний час допомагають у вирішенні диференціальнодіагностичної проблеми та встановленні правильного діагнозу.
Насиченість клітинами власної пластини (Lamina propria cellularity) визначається за щільністю, складом та поширенням клітин. Збільшення загальної кількості плазматичних клітин, лімфоцитів, гістіоцитів та еозинофілів є ознакою будьякого типу колоректального запалення, однак при НВК клітинний інфільтрат дифузний, охоплює всю слизову оболонку (transmucosal). Клітинна інфільтрація власної пластини може бути відсутня у стадії ремісії, її наявність у біоптатах зі сліпої кишки є варіантом норми.
Діагностична значущість нейтрофілів при НВК дискутується. На думку деяких авторів, патологічною ознакою вважається більше ніж 3 нейтрофіли у власній пластинці поза капілярами. Нейтрофіли є ознакою криптиту, ушкодження крипт та формування криптабсцесів супроводжується міграцією нейтрофілів через епітелій крипт. Однак діагностична цінність наявності нейтрофілів при НВК обмежена тим, що вони також присутні при інфекційному та інших формах коліту, на відміну від еозинофілів, збільшення кількості яких вважається специфічним для НВК.
Basal lymphoid aggregates — нодулярне скупчення лімфоцитів між основою крипт та м’язовим шаром слизової оболонки, без зони росту в центрі. Наявність щонайменше двох скупчень лімфоцитів вважається патологічною ознакою.
Стромальні зміни — витончення м’язового шару або його фрагментація — інколи спостерігаються при довготривалому перебігу хвороби.
При ретроградному ілеїті (backwash ileitis), який є подовженням запалення товстої кишки при тотальному НВК, ступінь активності запальних змін у сліпій кишці такий же або більший, ніж в ободовій. Ушкодження клубової кишки при ретроградному ілеїті характеризується активним запаленням у зоні ворсин та власної пластини поряд із укороченням та притупленням ворсин.
Наявність фокальних, ізольованих ерозій клубової кишки, метаплазії слизових залоз, вогнищевого набряку на фоні активного запалення мінімального ступеня потребує виключення хвороби Крона.
При отриманні та аналізі біопсійного матеріалу необхідно враховувати фазу захворювання у конкретного хворого, а також брати до уваги, проводилось лікування чи ні. Розрізняють:
— біоптати, отримані в початковій фазі захворювання (протягом 2 тижнів від початку симптомів, лікування не проводилось);
— біоптати, отримані від пацієнтів з встановленим діагнозом до початку лікування (симптоми понад 4–6 тижнів);
— біоптати, отримані від пацієнтів із встановленим діагнозом після лікування (бажана оцінка попередніх біопсій) [30].
Природна еволюція від активної форми хвороби до фази ремісії, а також вплив лікування відбиваються на морфологічній картині. На початкових стадіях хвороби виявляються окремі морфологічні ознаки НВК, або ж вони можуть не виявлятися зовсім. При загостренні хвороби з хронічним перебігом основними морфологічними ознаками є базальний плазмоцитоз, порушення архітектоніки крипт, дифузна запальна інфільтрація та ворсинчаста поверхня слизової оболонки. При НВК поза загостренням деякі морфологічні ознаки можуть персистувати, нейтрофіли зникають, і біопсії мають вигляд норми [15, 25, 30].
Відомо, що виразковий коліт асоціюється з підвищеним ризиком колоректального раку (КРР). Визначено, що у хворих на НВК він у 7–8 разів вищий, ніж у загальній популяції [7, 18, 19, 21, 30]. На сьогодні найбільш значущими факторами ризику колоректальної карциноми при НВК є тривалість захворювання, протяжність ураження ТК і наявність первинного склерозуючого холангіту. До додаткових факторів відносять: початок захворювання у молодому віці, наявність раку ТК в сімейному анамнезі, дефіцит фолієвої кислоти [30].
Найбільш часто рак ТК розвивається при тривалості анамнезу НВК понад 8–10 років. При більшій тривалості захворювання ризик раку зростає багаторазово. Безумовно, вірогідність злоякісної трансформації найбільш високою є у хворих із тотальним ураженням ТК. Якщо в цілому у хворих на виразковий коліт ризик розвитку колоректального раку у 8 разів підвищує популяційний показник, то при тотальному ураженні він вищий у 19 разів [18, 19, 21, 29, 30].
Отже, при тривалості хвороби понад 8 років і при протяжному ураженні ТК з метою скринінгу КРР показане проведення щорічної колоноскопії, навіть при ремісії НВК [30].
Основна мета скринінгової колоноскопії — виявлення дисплазії, що є найбільш важливим і загальновідомим морфологічним фактором ризику й маркером раку ТК. Відомо, що рак виникає з передракових змін, які складаються зі структурних і клітинних відхилень, об’єднаних поняттям «дисплазія». Виявити дисплазію в умовах хронічного запалення при активному НВК і за наявності запальних поліпів (псевдополіпів) вкрай тяжко.
У зв’язку з труднощами діагностики дисплазії при НВК потрібна велика кількість біопсійного матеріалу. Для вірогідної діагностики дисплазії фахівці рекомендують взяття кількох біоптатів (по 3–4 біоптата) через кожні 10 см по всій довжині ТК та з візуально змінених ділянок. Покращанню якості діагностики дисплазії і зменшенню кількості біоптатів сприяє застосування сучасних допоміжних ендоскопічних методів (хромоендоскопія з індігокарміном, люмінесцентна ендоскопія та ін.) [19, 30].
Розрізняють дисплазію в пласкій слизовій (dysplasia in flat mucosa) і в піднятих новоутвореннях (raised lesion with dysplasia). Підняті новоутворення на фоні НВК відносять до асоційованих з дисплазією новоутворень — displasia associated lesion or mass (DALM). Останні можуть бути видалені ендоскопічно. Для вірогідної діагностики дисплазії спеціалісти рекомендують взяття множинних біоптатів (по 3–4 біоптати) через кожні 10 см по всій довжині ТК [18, 19, 21, 30].
Новоутворення при виразковому коліті ранжируються за значимістю від запальних псевдополіпів до карциноми. При наявності типових псевдополіпів невеликих розмірів немає необхідності в проведенні біопсії, вона є необхідною, коли поліп перевищує 1 см у діаметрі, вкритий спонтанно кровоточивою СО, має нерівну поверхню, неправильну форму, відрізняється за кольором від інших поліпів.
Карциноми при НВК частіше підняті над рівнем СО (поліпоподібні карциноми), але можуть бути представлені бляшкою з потовщенням відповідної ділянки СО, екзофітною пухлиною (має вигляд цвітної капусти) або звуженням просвіту кишки, що може бути схожим на доброякісні стриктури. Майже у чверті пацієнтів із НВК, що ускладнений малігнізацією, діагностуються множинні (мультифокальні) пухлини [18, 19, 30].
Отже, ендоскопічне і морфологічне дослідження дозволяє не тільки встановити діагноз, а й відрізнити фазу ремісії захворювання від загострення, визначити ступінь активності запального процесу, оцінити ефективність лікування, зменшити ризик колоректального раку.
1. Адлер Г. Болезнь Крона и язвенный колит. — М.: ГЭОТАРМЕД, 2001. — 500 с.
2. Белоусова Е.А. Язвенный колит и болезнь Крона. — Тверь: ООО «Издательство «Триада», 2002. — 128 с.
3. Бойко Т.Й., Сімонова О.В. Неспецифічний виразковий коліт: стандарти діагностики та лікування: Метод. рекомендації. — Київ, 2009. — 43 с.
4. Василенко И.В. Морфологическая диагностика неспецифического язвенного колита // Новости медицины и фармации. — 2010. — № 313. — С. 711.
5. Дорофеев А.Э, Звягинцева Т.Д., Харченко Н.В. Заболевания кишечника: Руководство для врачей. — Горловка: ЧП «Видавництво «Ліхтар», 2010. — 532 с.
6. Сімонова О.В., Бойко Т.Й. Критерії ендоскопічної діагностики і визначення ендоскопічної активності неспецифічного виразкового коліту // Український журнал малоінвазивної та ендоскопічної хірургії. — 2009. — № 3(13). — С. 3536.
7. Сотников В.Н., Разживина А.А., Веселов В.В. Колоноскопия в диагностике заболеваний толстой кишки. — М., 2006. — 272 с.
8. Халиф И.Л., Лоранская И.Д. Воспалительные заболевания кишечника (неспецифический язвенный колит и болезнь Крона). Клиника, диагностика и лечение. — М.: Миклош, 2004. — 88 с.
9. Agnostotides A.A., Hodgson H.J.F., Kirsner J.B. Inflammatory bowel diseases. — London: Chapman and Hall, 1991. — 342 р.
10. Baron J.H., Connell A.M., LenardJones J.E. Variation between observers in describing mucosal appearances in proctocolitis // Br. Med. J. — 1964. — № 1(5375). — P. 8992.
11. Chutkan R.K., Waye J.D. Endoscopy in inflammatory bowel disease // Kirsner J.D., ed. Inflammatory bowel disease. — Philadelphia: W.B. Saunders Company, 2000. — Р. 453479.
12. D’Haens G., Sandborn W.J., Feagan B.G. A review of activity indices and efficacy and points for clinical trials of medical therapy in adults with ulcerative colitis // Gastroenterology. — 2007. — Vol. 132. — P. 763786.
13. De Lange T., Larsen S., Aabakken L. Interobserver agreement in the assessment of endoscopic findings in ulcerative colitis // BMC Gastroenterol. — 2004. — Vol. 4. — Р. 919.
14. Fefferman D.S., Farrell R.J. Endoscopy in inflammatory bowel disease: indications, surveillance, and use in clinical practice // Clin. Gastroenterol. Hepatol. — 2005. — Vol. 3. — P. 124.
15. Geboes K., Riddell R., Ost A. A reproducible grading scale for histological assessment of inflammation in ulcerative colitis // Gut. — 2000. — Vol. 47. — P. 404409.
16. Higgins P.D., Schwartz M., Mapili J. Is endoscopy necessary for the measurement of disease activity in ulcerative colitis? // Am. J. Gastroenterol. — 2005. — Vol. 100. — P. 355361.
17. Jarnerot G., LennardJones J., Truelove S. Inflammatory bowel Disease. — Sweden: Corona/Astra, 1992. — 593 p.
18. Kornbluth A., Sachar D.B. Ulcerative colitis practice guidelines in adults (update): American College of Gastroenterology Practice and Parameters committee // Am. J. Gastroenterol. — 2004. — Vol. 99. — P. 13711385.
19. Katsanos K.H., Vermeire S., Christodoulou D.K. Dysplasia and cancer in inflammatory bowel disease 10 years after diagnosis: results of a populationbased European collaborative followup study // Digestion. — 2007. — Vol. 75. — P. 113121.
20. Kuntz H.D., May B. Inflammatory Bowel Diseases. Endoscopic Diagnostics. — Freiburg: Falk Foundation e.V., 1998. — 38 p.
21. Leighton J.A., Shen B., Baron T.H. ASGE guideline: endoscopy and treatment of inflammatory bowel disease // Gastrointest. Endoscopy. — 2006. — Vol. 63(4). — Р. 558565.
22. Messmann H. Atlas of colonoscopy. — New York: Thieme, 2006. — 250 p.
23. Mirpour S., Rabie R., Gholamrezanezhad A. Evaluation of relationship between clinical and colonoscopic feature in patients with active ulcerative colitis // Indian. J. Gastroenterol. — 2007. — Vol. 26(2). — P. 7476.
24. Rachmilewitz D. Prostaglandins, leukotrienes, platelet activating factor and nitric oxide // Inflammatory bowel disease: From Bench to Bedside. International Symposium on IBD., 1996. — P. 133138.
25. Robert M.E., Skacel M., Ullman T. Patterns of colonic involvement at initial presentation in ulcerative colitis: a retrospective study of 46 newly diagnosed cases // Am. J. Clin. Pathol. — 2004. — Vol.122. — P. 9499.
26. Roth M., Bernhardt V. Inflammatory Bowel Diseases (revised 3rd edition). — Freiburg: Dr. Falk Pharma GmbH., 2001. — 77 p.
27. Shatsangi J., Silverberg M.S., Vermeire S., Colombel J.F. The Montreal classification of inflammatory bowel disease: controversies, consensus and implications // Gut. — 2006. — Vol. 55. — Р. 749753.
28. Schiller K.F.R., Cockel R. Atlas of Gastrointestinal Endoscopy and Related Pathology. — Blackwell: Science, 2004. — 551 p.
29. Seo M., Okada M., Yao T. et al. Evaluation of the clinical course of acute attacks in patients with ulcerative colitis through the use of an activity index // J. Gastroenterol. — 2002. — Vol. 37. — P. 2934.
30. Stange E.F. European evidencebased Consensus on the diagnosis and management of Ulcerative colitis: Definition and diagnosis / E.F. Stange, S.P.I. Travis, S. Vermeire et al. for the ECCO // Journal of Crohn’s & Colitis. — 2008. — Vol. 2(1). — P. 123.
31. Travis S.P.L., Schnell D., Krzeski P. et al. Developing an instrument to assess the endoscopic severity of ulcerative colitis: The Ulcerative Colitis Endoscopic Index of Severity (UCEIS) // Gut. — 2012. — Vol. 61(4). — P. 535542.
32. Tromm A., May B. Inflammatory bowel diseases. Endoscopic diagnostics — Freiburg: Falk Foundation e.V., 2004. — 36 p.
33. Vucelic B. Inflammatory bowel diseases: controversies in the use of diagnostic procedures // Dig. Dis. — 2009. — Vol. 27. — Р. 269277.