Газета «Новости медицины и фармации» Гастроэнтерология (451) 2013 (тематический номер)
Вернуться к номеру
Прямокишечные свищи как перианальные проявления болезни Крона: клиника, диагностика, лечение, хирургическая тактика
Авторы: Элин А.Ф., к.м.н., Центральная городская клиническая больница № 16, г. Донецк
Донецкий городской «Центр колопроктологии»
Рубрики: Гастроэнтерология, Хирургия
Разделы: Справочник специалиста
Версия для печати
В статье представлены актуальные вопросы диагностики и лечения прямокишечных свищей при болезни Крона. Освещены особенности клинических проявлений данной патологии, возможности инструментальных методов обследования. Представлен обзор как терапевтических возможностей, так и хирургических пособий при болезни Крона, осложненной прямокишечным свищом.
свищ, болезнь Крона, прямая кишка.
Введение
Поражение аноректальной зоны при болезни Крона (БК) — серьезная проблема современной колопроктологии [7]. Одним из характерных перианальных проявлений БК являются прямокишечные свищи. Несмотря на то, что данная патология редко угрожает жизни пациента, она значительно снижает качество жизни больных. Поэтому в настоящее время перианальные поражения рассматриваются как инвалидизирующие проявления БК. Они наблюдаются у 25–80 % пациентов и могут на несколько лет предшествовать абдоминальным симптомам [21].
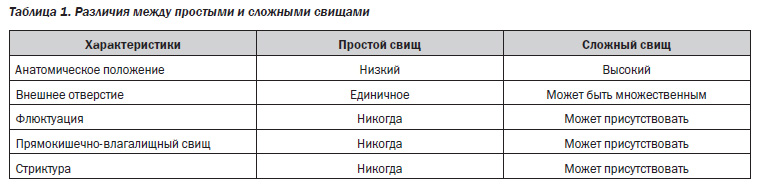
Классификация. Согласно классификации, предложенной Американской ассоциацией гастроэнтерологов [21], выделяют простые и сложные свищи при БК. К простым перианальным свищам относят неректовагинальные поверхностные, низкие интра и транссфинктерные свищи, имеющие единственное наружное отверстие, без клинических признаков абсцедирования и острого воспалительного процесса при отсутствии стриктуры анального канала. В то же время к сложным относят любые формы (по отношению к анальному сфинктеру) высоких свищей с множественными наружными отверстиями, с признаками абсцедирования, ректовагинальные свищи, а также свищи со стриктурой анального канала. Кроме того, если при эндоскопической верификации диагноза выявлен выраженный специфический проктит Крона, то данный свищ относится к категории сложного (табл. 1).
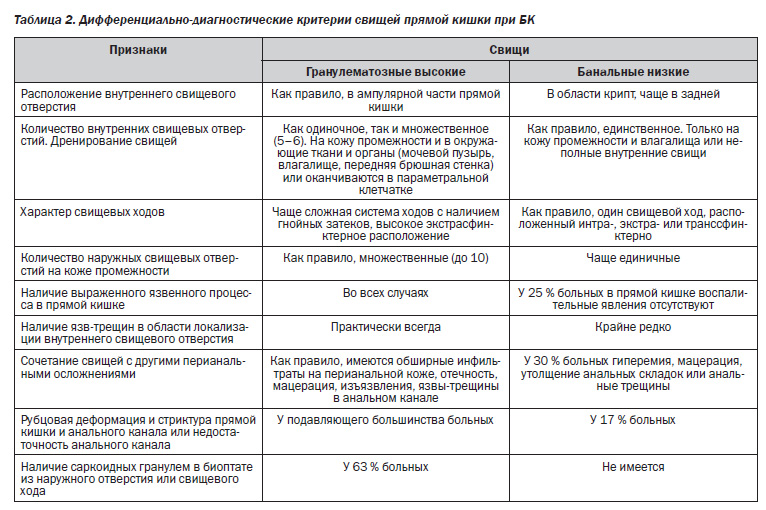
Государственным научным центром колопроктологии (ГНЦК, г. Москва) разработаны дифференциальнодиагностические критерии свищей прямой кишки при БК (табл. 2).
Согласно рекомендациям ГНЦК, целесообразно выделять два типа свищей прямой кишки, обусловленных особенностями этиопатогенеза БК.
1. Высокие (реже — низкие) свищи, причиннообусловленные гранулематозным процессом, когда внутреннее отверстие возникает на фоне активного неспецифического деструктивного воспаления из язвтрещин.
2. Низкие (банальные) свищи, исходящие из области крипт Морганьи, развитие которых связано с инфицированием анальных желез через крипты или поврежденную кожу анального канала на фоне БК.
Низкие (банальные) свищи возникают так же, как и вульгарный хронический парапроктит, и классифицируются по принятой схеме в зависимости от расположения основного гнойного хода по отношению к сфинктеру (интра, транс и экстрасфинктерные).
Для активной формы БК более характерны свищи, исходящие из язвтрещин (внутреннее отверстие), которые локализуются в прямой кишке (нижнеампулярный отдел) и носят название «высокие». Реже внутреннее отверстие свища, т.е. язватрещина, располагается в анальном канале, и тогда свищи обозначаются как «низкие», хотя варианты топики гнойных ходов аналогичны вульгарному хроническому парапроктиту.
Диагностика. Главенствующая роль при определении стратегии лечения перианальных свищей при БК уделяется диагностическим методам. Ведущие жалобы у больных с БК и прямокишечными свищами — наличие солитарного или множественных свищевых отверстий на коже в области заднего прохода с отделяемым из них. Характер последнего варьирует от серозного до гнойного и зависит от степени выраженности воспалительных явлений и адекватности дренирования затеков и полостей. В некоторых случаях при наружном осмотре можно выявить выделение каловых масс из наружного свищевого отверстия. Данный клинический признак характерен для свищей со значительным дефектом (внутренним отверстием) в анальном канале, а также при высоких свищах, когда внутреннее отверстие находится в ампулярной части прямой кишки. Вокруг свищевого хода зачастую можно увидеть мацерацию кожных покровов, мокнутие и экскориации. Если свищ неполный внутренний, то больные, как правило, жалуются на выделения из заднего прохода [1, 8, 12, 13, 35].
Болевой симптом — редкое явление при адекватно функционирующем и дренирующемся свище. Упорный болевой симптом характерен для неполного внутреннего свища, а также в случае выраженного перифокального воспаления с участием волокон внутреннего анального сфинктера, провоцирующего его спазм. При наличии жалоб у больного на прогрессирующую боль необходим тщательный осмотр с целью определения адекватности дренирования свища и исключения гнойных затеков. Обычно боль усиливается в момент дефекации и постепенно стихает, поскольку при растяжении анального канала в момент прохождения калового комка неполный внутренний свищ лучше дренируется [11, 44].
Заболевание носит волнообразный характер с периодами обострения и ремиссии. Обострение процесса возникает при самопроизвольной обтурации свищевого хода каловыми массами, некротическими тканями или грануляциями. Восстановление проходимости по свищу приводит к стиханию воспалительной реакции, уменьшению или исчезновению боли, улучшению соматического статуса. Если проходимость не восстановлена, то прогрессирование инфекционного компонента и отсутствие адекватного дренажа приводят к абсцедированию, а данную клиническую ситуацию необходимо рассматривать как ургентную и проводить мероприятия по вскрытию и дренированию гнойных полостей. В некоторых случаях происходит самостоятельное опорожнение полости гнойника через наружное отверстие или в просвет прямой кишки (через внутреннее отверстие). Такое «самоизлечение» не должно успокаивать ни больного, ни лечащего врача. Только тщательный осмотр и ревизия свищевого хода, зачастую под анестезией, позволит определить адекватность дренирования и укажет на необходимость выполнения экстренной или плановой хирургической коррекции. Периоды ремиссии протекают без видимой активной симптоматики и ухудшения общего состояния [5, 16, 52, 55].
Свищи при БК, как правило, множественные, сложные и имеют рецидивирующее течение. Формирование перианальных абсцессов и впоследствии свищей происходит изза трансмурального проникновения глубокой анальной язвы в параректальную клетчатку. Отличие от криптогенных параректальных свищей — при БК имеют место характерное поражение слизистой прямой кишки, язвы, трещины, а при вульгарных параректальных свищах воспалительные явления в слизистой прямой кишки минимальны либо отсутствуют [32, 37, 53].
Для большинства больных как с низким, так и высоким свищом характерно острое начало парапроктита с резким быстро нарастающим по интенсивности болевым синдромом, повышением температуры, недомоганием и формированием болезненных инфильтратов в перианальной области. Однако в отличие от банального парапроктита у больных на фоне тяжелого течения БК клинические проявления воспалительного процесса в параректальной клетчатке могут нивелироваться. Клиника рецидивов хронического парапроктита в значительной степени зависит от характера течения гранулематозного процесса в толстой кишке [17, 38].
Вместе с тем следует отметить, что при БК существуют некоторые клинические отличия между высокими и низкими свищами, которые, в конечном счете, и определяют выбор лечебной тактики. При высоких свищах прямой кишки парапроктит часто является первым симптомом БК. При высоком расположении внутреннего свищевого отверстия, в отличие от больных с низкими свищами, характерно отхождение кишечного содержимого и гноя из наружного свищевого отверстия. Высокие свищи при БК могут дренироваться во влагалище и мочевой пузырь, что также сопровождается отхождением гноя, газов и кишечного содержимого. Частота обострения воспалительного процесса в параректальной клетчатке в этом случае зависит, как правило, от активности гранулематозного воспаления в прямой кишке. При низких свищах у больных БК с хроническим непрерывным течением анальные симптомы практически исчезают на фоне терапии основного заболевания. После прекращения консервативного лечения симптомы парапроктита быстро возобновляются, особенно при неадекватном дренировании. Аналогичные формы свищей у больных с хроническим рецидивирующим течением БК на фоне медикаментозного лечения и в ремиссии заболевания малосимптомны, выделения скудны, боли практически отсутствуют, и только при обострении заболевания может появиться симптоматика со стороны промежности. Для высоких свищей при БК характерно наличие множественных наружных свищевых отверстий на коже промежности, мошонке, ягодицах. У большинства таких больных в области свищевых отверстий имеются обширные инфильтраты, эрозии, мацерация кожи с нерезко выраженными явлениями воспаления, встречаются изменения по типу кандиломатоза. В период ремиссии или минимальной активности основного процесса участки кожи сморщиваются, снижается ее тургор. Вокруг заднего прохода появляются обширные деформирующие рубцы, анус зияет. Нередко анальный канал представлен в виде деформированной трубки с плотными, неподвижными, рубцовоизмененными стенками. Волевые сокращения анального жома у этих больных снижены или вообще не определяются. Наружные отверстия низких банальных свищей при БК, как правило, одиночные или открываются в преддверии влагалища точечным отверстием.
Высокие свищи прямой кишки в большинстве случаев множественные, со сложной системой ходов и затеков. Гнойные полости в параректальной клетчатке, как правило, обширны, имеют многокамерные свищевые ходы, широкие, в ряде случаев достигающие диаметра более 1 см. Свищевые ходы и затеки располагаются на различных уровнях, но чаще всего в ишио, пельвио и ретроректальном пространстве.
Для больных с высокими свищами характерно наличие множественных внутренних отверстий в ампулярной части прямой кишки, которые располагаются на разных уровнях. Даже если имеется единичное свищевое отверстие, оно обычно достигает больших размеров. У больных данной группы рентгенологическая и эндоскопическая картина указывает на выраженность воспалительных изменений со стороны слизистой и глубоких слоев стенки прямой кишки. Возможны значительные рубцовые изменения в виде деформации и стриктуры. В то же время следует помнить, что у 30 % больных с низкими свищами в прямой кишке не выявляются рентгенологические и эндоскопические признаки, характерные для БК [30].
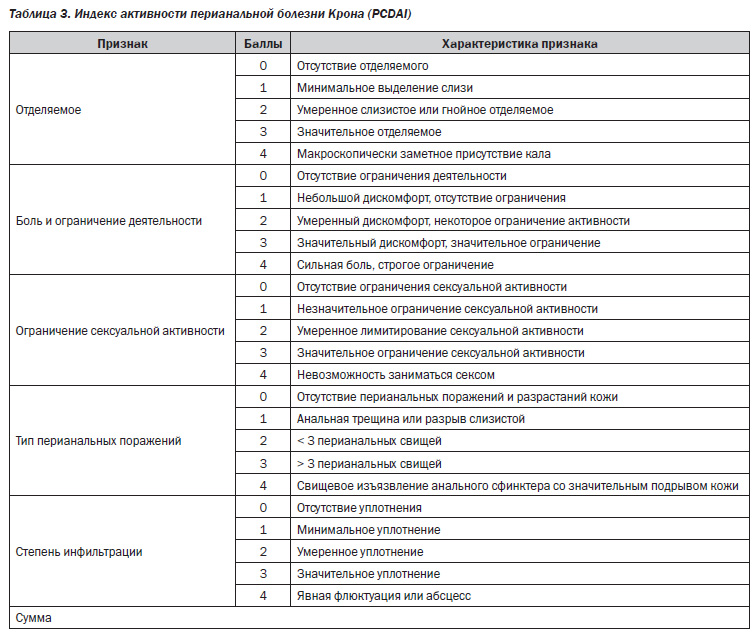
В 1995 г. для подсчета активности перианальных свищей был разработан индекс активности перианальной болезни Крона (Perianal Crohn’s Disease Activity Index — PCDAI) (табл. 3) [29].
В связи с широким внедрением в клиническую практику биологической терапии в последнее время стал использоваться такой критерий активности, как «ответ на терапию». Клиническим ответом считается уменьшение на 50 % или более количества отделяемого из свища при двух последовательных визитах пациента, а клинической ремиссией — полное прекращение отделяемого, также при двух последовательных визитах [43]. Однако исследования В. Van Beers, С. Grandin, А. Kartheuser et al. (1994) показали, что разработанные клинические критерии ответа на лечение, особенно от биологической терапии, зачастую оказываются неточными. Несмотря на положительную клиническую динамику, а в некоторых случаях даже клиническое выздоровление, проявляющееся закрытием наружного отверстия свища, остаточные внутренние полости и ходы сохраняются намного дольше и могут визуализироваться только с помощью дополнительных методов.
Основными методами диагностики при наличии свища прямой кишки являются: наружный осмотр, пальпация, пальцевое исследование анального канала и прямой кишки, проба с красителем, зондирование хода, аноскопия и ректороманоскопия, фистулография при высоких свищах, обильных выделениях и баллотировании зонда [13, 39, 45].
Ано и ректороманоскопия проводится всем пациентам со свищами прямой кишки. Она позволяет врачу наглядно увидеть и оценить состояние слизистой прямой кишки, в некоторых случаях визуализировать внутреннее отверстие свищевого хода, а также выявить другие сопутствующие заболевания. Особую актуальность данный метод приобретает у пациентов с предполагаемой БК [19, 32].
Для получения более четкого представления о сложности хода, наличии карманов и гнойных затеков выполняется фистулография с введением рентгенконтрастного вещества непосредственно в свищевой ход и последующим выполнением рентгенографии. При необходимости прямая кишка дополнительно наполняется бариевой взвесью.
Недостаток данного метода — лучевая нагрузка на пациента и исследователя, а также не всегда полная информация о расположении свищевого хода по отношению к мышцам анального жома. При этом важно отметить, что мышечный аппарат анального канала на рентгенограммах не дифференцируется. Вид свища прямой кишки определяется на рентгеновских снимках по приблизительной высоте внутреннего отверстия [9, 12, 55].
Особую актуальность приобретает фистулография при изучении архитектоники прямокишечных свищей при БК как отправная точка для определения тактических подходов в их хирургической коррекции. Рентгенологическая картина низких свищей обычно аналогична банальным свищам: свищевые ходы могут быть расположены подкожноподслизисто, транс или экстрасфинктерно. В двух первых локализациях свищевые ходы в большинстве случаев короткие и прямые, затеки выявляются редко, при экстрасфинктерном расположении они более сложные, часто выявляются разветвленность и затеки в параректальной клетчатке [9, 20].
При длительном существовании свища и повторных операциях по поводу него возникает необходимость оценки функции анального сфинктера. При этом наиболее информативными методами исследования являются сфинктерометрия, ректоанальная электроманометрия и миография.
Значительную помощь в топической диагностике свищевого хода оказывает ультрасонография. Сонография позволяет идентифицировать ход свища по отношению к внутреннему и наружному сфинктерам прямой кишки, сложность хода, локализацию первичного внутреннего отверстия и наличие гнойных полостей в параректальных клетчаточных пространствах. По возможности предпочтение следует отдавать трансанальному ультразвуковому исследованию с трехмернопространственной реконструкцией. Значительно улучшить визуализацию свищевого хода позволяет введение перекиси водорода, что делает его гиперэхогенным [10, 26, 42]. Это позволяет проследить весь ход свища — от наружного отверстия до внутреннего — и получить полное представление о его пространственном расположении.
В некоторых случаях необходимо проводить микробиологическое изучение отделяемого из свищей с целью подбора антибактериальных средств при проведении санации гнойных затеков и полостей [44].
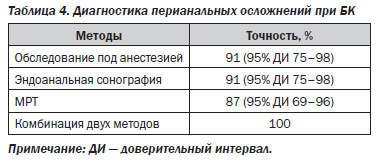
Пальцевое исследование прямой кишки и зондирование не обеспечивают высокой точности при определении анатомических особенностей свища и имеют диагностическую ценность только в 62 % случаев [27], а по некоторым данным фистулографию для оценки перианальной БК проводить не рекомендуется в связи с возможным обострением процесса, абсцедированием и вовлечением смежных клетчаточных пространств [19, 51]. Аноректальное ультразвуковое исследование требует опыта, имеет технические ограничения и может быть трудновыполнимо или невозможно изза местных осложнений БК (абсцесса или стеноза). Обследование под анестезией считается золотым стандартом и является самым чувствительным методом с точностью до 90 % [16, 47]. Для полного описания свищей и оценки свищевых ходов, помимо квалифицированного обследования под анестезией, часто необходима дополнительная визуализация (МРТ) или эндоанальное ультразвуковое исследование (УЗИ). При сравнении методов диагностики в проспективном слепом исследовании [47] точность всех трех методик превышала 85 % (табл. 4), а при объединении любых двух исследований точность достигала даже 100 %.
Ошибочная диагностика, недостаточная оценка сложности свища и не выявленная в процессе диагностики сопутствующая патология приводят к плохим результатам лечения: рецидивированию свища, абсцедированию или прогрессированию простого свища в сложный [32, 38, 48, 53].
Дополнительным дифференциальнодиагностическим тестом при подозрении на БК является биопсия [2, 12, 29]. В ряде случаев удается выявить характерные для БК саркоидные гранулемы, поэтому следует считать обязательным гистологическое исследование участков стенки свищевого хода и цитологического изучения отделяемого из свищей, в котором также иногда удается обнаружить гигантские многоядерные клетки. Обнаружение гранулем саркоидного типа характерно исключительно для высоких свищей [32].
Лечение. Лечебная тактика зависит от локализации свищей, тяжести и их сложности, а также от наличия или отсутствия активного воспаления в дистальном отделе толстой кишки (ампулярный отдел прямой кишки). Кроме того, должны быть приняты во внимание функция сфинктера, сопутствующая патология и активность абдоминальных проявлений. Важно, что медикаментозная или хирургическая стратегия лечения не должна влиять на диагностический подход: технические приемы, разработанные для определения анатомического расположения свищей, считаются обязательными [44].
Медикаментозная терапия аноректальных поражений при БК аналогична лечению других кишечных поражений при данной патологии. Антибиотики, такие как ципрофлоксацин и метронидазол, часто используются как средства первой линии [7]. Стероиды, аминосалицилаты и иммуносупрессивные препараты 6меркаптопурин (6МП) и имуран более безопасны и просты в использовании. По данным А. Ouraghi, S. Nieuviarts, J.L. Mougenel et al. (2001), иммуномодуляторы, такие как моноклональные антиTNFантитела и азатиоприн, позволили в 71 % случаев добиться заживления перианальных свищей и в 79 % — язв и трещин у больных с БК. Продолжает расширяться применение и других биологических методов лечения, таких как TNFсвязанные нейтрализующие белки, интерлейкины и другие иммуномодуляторы, такие как талидомид, такролимус и микофенолат мофетил. Независимо от того, какую медицинскую терапию эти пациенты получают, отличительной особенностью хирургического лечения перианальных проявлений у пациентов с БК является необходимость ее применения вне зависимости от наличия или отсутствия клинических симптомов. Поскольку этот процесс характеризуется рецидивным и агрессивным поражением, пациенты без клинической симптоматики не гарантированы от потенциальной опасности их развития [53].
Средняя рекомендуемая доза метронидазола составляет 750–1500 мг/сут в течение 3–4 месяцев. Прием препарата должен быть прекращен при любых проявлениях нейропатии. Средняя рекомендуемая доза ципрофлоксацина — 500–1000 мг/сут. Сроки лечения обычно идентичны таковым при применении метронидазола. Антибиотики эффективно купируют симптомы болезни, но редко приводят к полному заживлению. Как правило, после отмены препаратов наступает обострение [55]. Однако метронидазол и ципрофлоксацин являются препаратами выбора при лечении перианальной БК согласно Консенсусу ECCO с длительным их приемом — до 6 месяцев. Орнидазол, как препарат из группы нитроимидазолов, может составить альтернативу метронидазолу, однако имеются данные о большем количестве побочных эффектов. Альтернативой ципрофлоксацину при назначении антибактериальной терапии является рифаксимин — полусинтетическое производное рифампицина. M. Perencevich и соавт. (1996) получены оптимистические результаты. Назначение рифаксимина в дозе 1,8 г/сут с параллельным использованием пробиотиков (смесь VSL3) в течение 9 месяцев сравнима по результату с приемом месалазина в дозе 4 г/сут на протяжении 12 месяцев. Кроме того, рифаксимин рассматривается как препарат выбора при лечении резервуарита после тотальной колопроктэктомии с илеоанальным анастомозом.
По данным D. Pearson, G. May, G. Fick et al. (1995), применение азатиоприна в дозе 2,0–3,0 мг/кг/сут или 6меркаптопурина в дозе 1,5 мг/кг/сут при перианальных трещинах и свищах оказалось эффективным у 54 % больных.
Литературные данные свидетельствуют, что циклоспорин способен выборочно блокировать Tхелперы и цитотоксичные лимфоциты через подавление транскрипции интерлейкина2, что позволяет использовать его в лечении БК, в частности перианальных его проявлений. Доза при внутривенном введении циклоспорина составляет 4–8 мг/кг/сут. Если ответ достигнут в течение недели, пациентов переводят на пероральный прием препарата. Эффективность циклоспорина при лечении анальных трещин у пациентов с БК, согласно исследованиям S.R. Gurudu, L.H. Griffel, R.J. Gialanella et al. (1999), составила 83 %, однако после отмены препарата у большинства пациентов наблюдалось обострение процесса.
Убедительных данных, свидетельствующих об эффективности метотрексата у больных с перианальными проявлениями, у пациентов с БК нет. Описано единственное исследование U. Mahadevan и соавт. (2003) об эффективности использования метотрексата, заключающейся в полном закрытии свища в 25 % случаев.
Результаты исследования ACCENT II, проведенного B.E. Sands, F.H. Anderson, C.N. Bernstein et al. (2003), по применению химерных моноклональных антител к ФНО показали его эффективность, а именно — полное заживление трещин и свищей у 69 % пациентов. Препарат вводили в дозе 5 мг/кг на 0, 2 и 6й неделях лечения.
К низкому уровню доказательности относят такие методы консервативной терапии, как талидомид, переход на полное парентеральное питание, диетотерапия, гипербарическая оксигенация, микофенолат мофетил, колониестимулирующий фактор гранулоцитов и т.д.
А. Lapidus и соавт. (1996) отметили, что у пациентов с БК, осложненной образованием свищей, увеличение продолжительности и качества жизни возможно при выполнении хирургической коррекции. Изучению данной тенденции, продолжающейся в эру моноклональных антиФНОантител, было посвящено исследование L.S. Portiz и соавт. (2002). В анализе лечения 26 пациентов, получающих инфликсимаб для лечения свищевой формы болезни Крона (перианальной, кишечнокожной, ректовагинальной, парастомической и интраабдоминальной), у 6 пациентов (23 %) была полная реакция на инфликсимаб, у 12 пациентов (46%) — частичная реакция и у 8 пациентов (31 %) не было никакой реакции на лечение. Четырнадцать (54 %) пациентов все же потребовали хирургического лечения (10 резекций кишки и 4 перианальных вмешательства), а 6 больных отказались от вмешательства. Из 6 пациентов, у которых отмечено закрытие свища после инфликсимаба, 5 имели перианальный или ректовагинальный, не интраабдоминальный свищ. Почти 75 % пациентов все же нуждались в хирургическом лечении, однако продолжили жить с открытыми свищами.
При лечении перианальных свищей долгое время придерживались догмы Alexander Williams: «Каловое недержание — результат агрессивности хирурга, а не прогрессирования болезни», что в течение долгих лет приводило к излишним страданиям пациентов. Сегодня тактика лечения перианальных свищей пересмотрена. Простые перианальные свищи — свищи у пациентов без БК или при этой болезни, но без поражения прямой кишки, могут быть иссечены, если при этом вынуждено травмируется не более 1/3 удерживающей мускулатуры [41, 48, 56]. Williams (2007) сообщает о 55 пациентах, подвергшихся иссечению свища, с частотой положительных результатов 93 %. Эти числа подтверждаются Fry (2001) и Levien (2005) с частотой положительных результатов 100 и 85 % соответственно. При заинтересованности большей доли удерживающей мускулатуры от фистулэктомии следует воздержаться. К качестве альтернативы при высоких свищах и отсутствии поражения прямой кишки может быть полезна пластика перемещенным лоскутом. Формирование отводящей колостомы необязательно. Однако при тяжелом поражении прямой кишки при БК надежды на эффективность такого подхода нет [30].
К местным вмешательствам, направленным на попытку закрытия свищей, относят операции по перемещению эндоректального лоскута, использование фибринового клея и постановку свищевого обтуратора [14, 15, 33, 34]. У ряда пациентов с высокими свищами или при тяжелых абсцессах применяют постоянную силиконовую петлю (seton) с целью адекватного дренирования полостных структур, купирования воспалительных явлений и минимизации возникновения септического процесса. Постановка дренирующей лигатуры рассматривается некоторыми авторами как подготовительный этап для последующих манипуляций, позволяющий сформировать солитарный ход свища [27, 50].
Перемещение эндоректального лоскута нужно применять избирательно у пациентов с БК. Критерием или показанием к данной операции считается отсутствие или незначительные признаки проктита. Так, В. Joo и соавт. (1998) в своем исследовании у 26 пациентов отметили успех вмешательства по перемещению лоскута лишь у 71 % больных. Даже дополнительное применение фибринового клея было неспособно улучшить результаты лечения. По данным L. O’Connor, B.J. Champagne, M.A. Ferguson et al. (2006), эффективность применения свищевого обтуратора Surgisis, который применили у 20 пациентов с единственным свищевым ходом, оказалась равна 80 %. Несмотря на достаточно высокий процент хороших результатов, ряд авторов относится к нему настороженно [48].
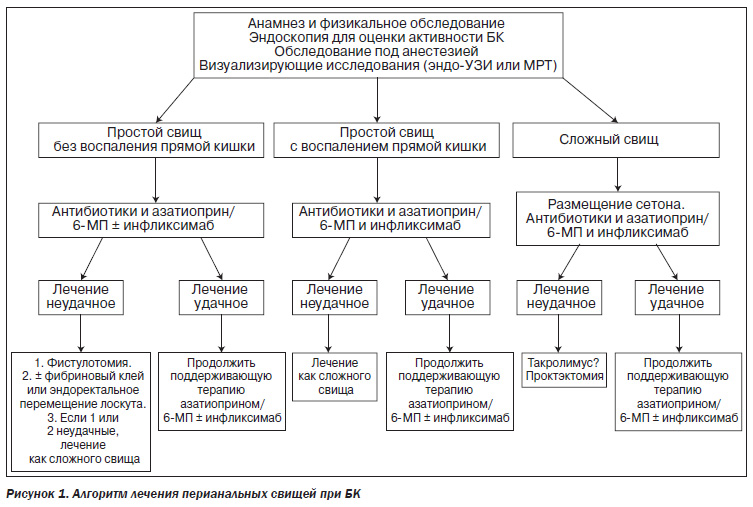
В 2008 г. О.Б. Щукиной и Е.А. Марковой предложен алгоритм лечения перианальных свищей при БК, направленный на дифференцированный подход при определении терапевтических и хирургических подходов при лечении данной категории пациентов (рис. 1).
Попытка максимального сохранение длины кишки с целью поддержания ее нормальной функции является главным в лечении пациентов с тяжелыми (инвалидизирующими) перианальными свищами [54]. Расширение границ резекции зависит от многих факторов: распространенность и глубина поражения, невозможность исключить малигнизацию, состояние сфинктера и предшествующие резекции. Сегментарная резекция с тонкотолстокишечным или толстотолстокишечным анастомозом является наиболее безопасным и приемлемым способом хирургического лечения [24]. У пациентов с панколитом обычно выполняется тотальная колэктомия с илеоректальным анастомозом или проктоколэктомия с концевой илеостомией. Тотальная проктоколэктомия с илеоанальным анастомозом редко выполняется при БК, но наиболее характерна при хирургическом лечении неспецифического язвенного колита (НЯК). Резекция прямой кишки при БК чаще выполняется вторично при длительно существующих симптомах, таких как тазовый сепсис, нарушение функции кишки или реже — кровотечение. Выполняя резекцию прямой кишки при БК, важно прогнозировать возможность формирования длительно незаживающей промежностной раны.
Окончательное удаление толстой кишки, включая и прямую кишку, — колэктомия в интерсфинктерной технике с сохранением наружного сфинктера и пластины леваторов показана, когда при массивном поражении перианальной области, собственно прямой кишки, значительном функциональном нарушении держания нет возможности сохранить толстую кишку. Заживление перианальных ран при этом часто бывает нарушенным [31]. Corman (1997) описывает эту проблему в 34,4 % случаев, Scammell и Keighley (2002) — в 18,7 % в первый послеоперационный год. При этом у 10 % не отмечалось заживления и в последующие года. Goligher (2005) описывает запоздалое заживление (т.е. отсутствие такового) перианальных ран у 28 %.
Межсфинктерный доступ максимизирует количество здоровой мышечной ткани и ткани для закрытия дефекта и уменьшает риск возникновения параректального свища. У тех пациентов, у которых все же сформировался хронический перианальный свищ или полость, данная тактика гарантирует отсутствие рецидива заболевания и лучше поддается дальнейшему лечению при использовании консервативной терапии с местным лечением раны. Однако зачастую многие из этих пациентов требуют более обширных хирургических вмешательств с хирургической обработкой раны и широким ее закрытием мышцей или другой хорошо васкуляризированной тканью [34, 46].
В настоящее время с целью радикальной хирургической коррекции НЯК как операция выбора рассматривается колопроктэктомия и создание тазового кишечного резервуара с илеоанальным анастомозом. Предложено несколько видов тазовых резервуаров типа J, S и W. Изучение функциональных результатов илеоанальных анастомозов с формированием тазового резервуара и без создания резервуара из подвздошной кишки показало, что частота стула у больных со сформированным тазовым резервуаром значительно меньше, чем у пациентов без него [4, 5, 19]. Выполнение этого хирургического вмешательства по строгим показаниям — главное условие получения хороших послеоперационных результатов. БК является противопоказанием для этого хирургического вмешательства. Для удержания полуоформленного кала больные должны иметь хорошую функцию анального сфинктера, которую необходимо до операции оценить при помощи аноректальной манометрии.
Нет единства взглядов при определении объема вмешательства у больных со сформированной так называемой прямокишечной недостаточностью (rectal sparing), характерной для БК с перианальными проявлениями. Продолжает оставаться спорным вопрос о выполнении сегментарной резекции или TACIRA (колэктомия с илеоректальным анастомозом) у пациента с БК. В отличие от БК, при НЯК тотальная колопроктэктомия с илеоанальным анастомозом рассматривается как наиболее адекватная. Обязательное условие выбора объема операции — всесторонняя оценка функции прямой кишки и сфинктерного аппарата с целью минимизации фекального недержания после операции, о чем говорилось выше. О. Bernell и соавт. (2001) проанализировали группу из 833 пациентов с БК и выявили более высокий риск рецидива заболевания в течение 10 лет у больных, которым выполнили TACIRA (58 %), против тех, которым произвели сегментарную резекцию (47 %). Р. Andersson и соавт. (2002) подтвердили эти данные в исследовании 57 пациентов, у которых частота ререзекций была подобной, хотя те больные, которые перенесли сегментарную резекцию, имели меньше симптомных рецидивов заболевания, абсолютное улучшение функции кишки и уменьшение частоты развития перианальных осложнений. В отличие от вышеупомянутых результатов, Р. Tekkis (2006) провел метаанализ всех исследований 1998–2002 гг. по результатам лечения 488 пациентов и не выявил значимых различий в частоте возникновения рецидивов, осложнений или необходимости в длительно существующей стомы. Однако время до рецидива был более длинным в группе TACIRA на 4,4 года (P < 0,001). Автор пришел к выводу, что субтотальная колэктомия у пациентов с БК более приемлема для пациентов, у которых есть поражение двух и больше сегментов, однако все же проблема остается нерешенной. Значительно осложняет вопрос ситуация, когда у пациента с БК имеется диффузное поражение, включая проктит. Как показали исследования, у больных после перенесенной тотальной колопроктэктомии с илеостомией и поддерживающей этиотропной медикаментозной поддержкой частота рецидива заболевания меньше, чем при субтотальной или сегментарной резекции [31].
В исследовании 127 пациентов с перианальным поражением при БК R.F. McKee, R.A. Keenan (1996) выявили, что лечение и его исход в значительной степени зависели от распространенности и тяжести поражения проксимального отрезка кишки. В мультицентровом исследовании шести баз данных из Соединенных Штатов и Европы Р. Sachar оценил 1686 случаев изолированного илеита Крона и 1655 случаев колита Крона, чтобы определить, была ли корреляция между абдоминальными и перианальными свищами. Не было отмечено четкой связи между перианальным поражением и илеитом, хотя у колита Крона и перианального поражения отмечалась четкая корреляция. Таким образом, контроль над проксимальным отделом кишки, весьма вероятно, оказывает влияние на уменьшение перианальных проявлений.
У 25–50 % пациентов с БК толстой кишки имеется тяжелое поражение прямой кишки [56]. При таких показаниях колэктомия с илеоректальной реконструкцией может быть многообещающей, если не имеется перианальных осложнений, функция сфинктеров достаточная, изменения в прямой кишке незначительны, достаточна растяжимость прямой кишки как резервуара, отсутствуют признаки ректальной дисплазии [41, 53]. Частота «хирургического рецидива» при поздних проктэктомиях с наложением илеостомы высока. В литературе указываются данные между 40 [34] и 50 % [24]. Обнадеживающие данные приводятся Longo (1999) о 61 % хорошо функционирующих илеоректальных соустий по прошествии среднего срока наблюдения в 9,5 года.
В современной литературе продолжается дискуссия о месте и роли изолированного выключения ободочной (прямой) кишки из пассажа путем наложения илеостомы или двуствольной колостомы при лечении перианальных проявлений БК. Показания к выключающей стоме в настоящее время ограничены. Она показана пациентам, у которых имеется тяжелое прямокишечное и перианальное поражение, для купирования активного воспаления, для максимизации медикаментозной терапии. Хотя болезнь часто рецидивирует после восстановления кишечной непрерывности, выключение кишки остается ценным инструментом для пациентов, у которых есть тяжелая фистулизирующая форма болезни, или у больных, переносящих попытку восстановления (эндоректальный скользящий лоскут), а также больным с сопутствующей патологией или перед хирургической коррекцией перианальных поражений. Риск для постоянной илеостомы продолжает оставаться высоким, исследование 507 пациентов показало ее 25% вероятность в ближайшие 10 лет [37].
Одна из основных причин для выключения кишки — перианальный сепсис. Хотя выключение кишки может быть успешным в избавлении от симптомов в 80 % случаев, рецидив встречается у большинства этих пациентов, и, к несчастью, восстановление кишечной непрерывности редко выполняется [55]. S. Galandiuk (2001) исследовал 86 пациентов с БК, подвергнувшихся 344 оперативным вмешательствам, из них 49 % в конечном счете потребовали постоянного выключения кишки, показаниями к которому были активное воспаление в ободочной кишке и стриктура анального канала.
По мнению О.Б. Щукиной и Е.А. Марковой (2008), современная медикаментозная терапия располагает достаточной доказательной базой ее эффективности при перианальной БК. Не прекращаются споры о главенствующей роли гастроэнтерологических (терапевтических) или хирургических подходов в коррекции данной патологии. Однако, на наш взгляд, если исходить с позиции больного, лучший результат лечения обеспечивает совместное наблюдение пациентов и принятие решения гастроэнтерологом и хирургомпроктологом.
Таким образом, перианальные свищи являются одним из наиболее тяжелых осложнений у пациентов с БК. В связи с тем, что заболевание характеризуется упорным рецидивирующим воспалительным процессом, перианальные свищи часто глубокие, экстрасфинктерные и сопровождаются обширным рубцеванием. Для них характерны высоко распространяющиеся слепые карманы, располагающиеся выше зубчатой линии, часто сочетающиеся с проктитом. Так же, как при лечении свищей у больных, у которых нет БК, хирургическая коррекция непосредственно связана с анатомией расположения свища и степенью участия сфинктера. При определении хирургической тактики у больных с БК хирург должен также принять во внимание ректальную состоятельность, сопутствующий проктит и возможность хронического поноса. Любые вмешательства, которые могут привести к анальному недержанию, такие как агрессивное иссечение свища, или прогнозируемая возможность развития длительно незаживающей раны, должны исключаться. Только в случаях абсцесса, вызванного парапроктитом с низким свищевым ходом и минимальным поражением сфинктера, можно безопасно выполнить иссечение свища. Когда свищи более высокие или сложные, необходимо выполнять дооперационные исследования, такие как МРТ или эндоректальное УЗИ, для идентификации не только анатомии свища, но и связанного с ним недренируемого затека или гнойника. Хирургические вмешательства при свищах включают установку сетона, перемещение внутрианального лоскута и введение свищевого обтуратора. Многие пациенты, у которых есть свищевая болезнь, требуют длительного стояния сетона. Пациенты должны периодически осматриваться, чтобы гарантировать адекватное дренирование и выявить в редких случаях развитие озлокачествления. Наложение выключающей стомы показано при угрозе развития септических осложнений, а также с целью повышения эффективности закрытия перианальных свищей методом перемещенного лоскута или введения свищевого обтуратора. Однако, по мнению S.A. Hyder, S.P. Travis, D.P. Jewell et al. (2006), даже в эру применения моноклональных антител против TNF и других возможностей консервативной терапии тяжелые анальные свищи могут все еще потребовать наложения постоянной выключающей стомы или резекции прямой кишки.
1. Аминев А.М. Руководство по проктологии. — Т. 1–4. — Куйбышев, 1965–1979.
2. Балтайтис Ю.В. Хирургия неспецифического язвенного колита. — Киев, 1989. — 140 с.
3. Бородкин А.С. Сегментарная проктопластика в лечении экстрасфинктерных свищей прямой кишки: Дис... канд. мед. наук. — М., 2006.
4. Ганичкин А.М., Яицкий Н.А., Васильев С.В. и др. Реконструктивновосстановительные операции у больных с различными видами колостом // Вести хир. — 1988. — № 4. — С. 3641.
5. Генри М., Свош М. (ред.). Колопроктология и тазовое дно: Пер. с англ. — М.: Медицина, 1988. — 459 с.
6. Даценко Б.М., Кристаллов Г.И. Хирургическое лечение острого парапроктита // Вести хир. — 1988. — № 11. — С. 3640.
7. Дорофеев А.Э., Звягинцева Т.Д., Харченко Н.В. Заболевания кишечника: Руководство для врачей. — Горловка, 2010. — 532 с.
8. Дульцев Ю.В., Саламов К.Н. Острый и хронический парапроктит // Проктология / Федоров В.Д., Дульцев Ю.В. — М.: Медицина, 1984. — С. 66107.
9. Заремба А.А. Клиническая проктология. — Рига: Звайгзне, 1987. — 350 с.
10. Канделаки С.М., Гаджиев Г.И., Богомазов Ю.К. и др. Трансректальные ультразвуковые исследования с контрастным усилением в диагностике свищевой формы парапроктитов // Амбулаторная хирургия. Стационарзамещающие технологии. — 2003. — № 2. — С. 4952.
11. Канделис Б.Л. Неотложная проктология. — Л.: Медицина, 1980. — 227 с.
12. Кондратенко П.Г., Губергриц Н.Б., Элин Ф.Э., Смирнов Н.Л. Клиническая колопроктология / Руководство для врачей. — Донецк, 2006. — 406 с.
13. Кондратенко П.Г., Элин Ф.Э., Авраимов С.Л. Анализ лечения прямокишечных свищей по материалам клиники // Хирургия Украины. — 2005. — № 3(15). — С. 104106.
14. Кузьминов А.М., Бородкин А.С., Волков М.В. и др. Результаты хирургического лечения свищей прямой кишки методом низведения полнослойного лоскута ее стенки // Колпроктология. — 1998. — С. 5964.
15. Лурін І.А., Цема Є.В. Віддалені результати лікування хворих з екстрасфінктерними норицями прямої кишки за допомогою методу «пломбування» їх просвіту аутотромбіновим клеєм // Укр. мед. часопис. — 2006. — № 3(53). — С. 99101.
16. Мамчич В.І., Бондаренко М.Д., Пироговський В.Ю. та ін. Ультразвукова діагностика хронічних парапроктитів // Збірник наукових праць співробітників КМАПО ім. П.Л. Шупика. — Київ, 2001. — С. 750753.
17. Наврузов С.Н., Дульцев Ю.В., Саламов К.Н. Причины и профилактика рецидивов свищей прямой кишки // Вестн. хирургии. — 1981. — № 7. — С. 4349.
18. Проценко В.М., Мурадов Б.Х., Максимова Л.В. и др. Лечение ран анального канала и промежности // Хирургия. — 1998. — № 8. — С. 2022.
19. Щукина О.Б., Маркова Е.А. Перианальная болезнь Крона: диагностика и медикаментозная терапия // Фарматека. — 2008. — № 13. — С. 2229.
20. Федоров В.Д., Воробьев Г.И., Ривкин В.Л. Клиническая оперативная колопроктология: Руководство для врачей. — М.: ГНЦ проктологии, 1994. — 432 с.
21. American Gastroenterological Association Medical Position Statement: perianal Crohn’s disease // Gastroenterology. — 2003. — 125. — 150307.
22. Aitola P., Hiltunen K.M., Matikainen M. Fibrin glue in perianal fistulae — a pilot study // Ann. Chir. Gynaecol. — 1999. — 88. — 136138.
23. Ayala M., Jimenez R., GarciaOsogobio S., Mass W., Gomez F. еt al. Surgical treatment of anorectal fistulas // Rev. Gastroenterol. Mex. — 1999, OctDec. — 64 (4). — Р. 1548.
24. Bernell O., Lapidus A., Hellers G. Recurrence after colectomy in Crohn’s colitis // Dis. Colon. Rectum. — 2001. — 44(5). — 64754 [discussion: 654].
25. Champagne B.J., O’Connor L.M., Ferguson M. et al. Efficacy of anal fistula plug in closure of cryptoglandular fistulae: Longterm followup // Dis. Colon. Rectum. — 2006. — 49. — 18171821.
26. Deen K.I., Williams J.G., Hutchinson R., Keighley M.R., Kumar D. Fistulas in ano: endoanal ultrasonographic assessment assists decision making for surgery // Gut. — 1994. — 35(3). — 391394.
27. Durgan V., Perek A., Kapan M. et al. Partial fistulotomy and modified cutting seton procedure in the treatment of high extrasphincteric perianal fistulae // Dig. Surg. — 2002. — 19. — 5658.
28. Hanley P.H. Anorectal abscess fistula // Surg. Clin. North. Am. — 1978. — 58. — 487503.
29. Irvine E.J. Usual therapy improves perianal Crohn’s disease as measured by a new disease activity index. McMaster IBD Study Group // J. Clin. Gastroenterol. — 1995. — 20. — 2732.
30. Joy H.A.,Williams J.G. The outcome of surgery for complex anal fistulae // Colorectal. Dis. — 2002. — 4. — 254261.
31. Fichera A., McCormack R., Rubin M.A. et al. Longterm outcome of surgically treated Crohn’s colitis: a prospective study // Dis. Colon. Rectum. — 2005. — 48(5). — 9639.
32. Fuhrman G.M., Larach S.W. Experience with perirectal fistulas in patients with Crohn’s disease // Dis. Colon. Rectum. — 1989. — 32. — 84748.
33. Hedelin H., Nilson A.E., Teger Nilsson A.C. et al. Fibrin occlusion of fistulae postoperatively // Surg. Gynecol. Obstet. — 1982. — 154. — 366368.
34. Hurst R.D., Gottlieb L.J., Crucitti P. et al. Primary closure of complicated perineal wounds with myocutaneous and fasciocutaneous flaps after proctectomy for Crohn’s disease // Surgery. — 2001. — 130(4). — 76772 [discussion: 7723].
35. Keigley M.R., Williams N.S. Anorectal fistula: surgery of the anus, rectum and colon. — Philadelphia: WB Saunders, 1993. — P. 418466.
36. Ky A.J., Sylla P., Steinhagen R. et al. Collagen fistula plug for the treatment of anal fistulas // Dis. Colon. Rectum. — 2008. — 51. — 838843.
37. Lapidus A., Bernell O., Hellers G. et al. Clinical course of colorectal Crohn’s disease: a 35year followup study of 507 patients // Gastroenterology. — 1998. — 114(6). — 115160.
38. Makowiec F., Jehle E.C., Becker H.D. et al. Perianal abscess in Crohn’s disease // Dis. Colon. Rectum. — 1997. — 40. — 44350.
39. McLeod R.S. Management of fistulainano: 1990 Roussel Lecture // Can. J. Surg. — 1991. — Vol. 34. — P. 581585.
40. Ortiz H., Marzo J. Endorectal flap advancement repair and fistulectomy for high transsphincteric and suprasphincteric fistulae // Br. J. Surg. — 2000. — 87. — 16801683.
41. Ozuner G., Hull T.L., Cartmill J. et al. Longterm analysis of the use of transanal rectal advancement flaps for complicated anorectal/vaginal fistulae // Dis. Colon. Rectum. — 1996. — 39. — 1014.
42. Роеn А.С., FeltBersma R.J.F. Hydrogen PeroxideEnhanced Transanal Ultrasound in the Assessment of FistulaInAno // Dis. Colon. Rectum. — September, 1998.
43. Present D.H., Rutgeerts P., Targan S. et al. Infliximab for the treatment of fistulas in patients with Crohn’s disease // N. Engl. J. Med. — 1999. — 340. — 1398405.
44. Ramanujam P.S., Prasad M.L., Abcarian H. et al. Perianal abscesses and fistulae. Astudy of 1023 patients // Dis. Colon. Rectum. — 1984. — 27. — 593597.
45. Saino P., Husa A. A prospective manometric study of defective anal fistula surgery on anorectal function // Acta Chir. Scand. — 1985. — 151. — 279288.
46. Scammell B.E., Keighley M.R. Delayed perineal wound healing after proctectomy for Crohn’s colitis // Br. J. Surg. — 1986. — 73(2). — 1502.
47. Schwartz D.A., Wiersema M.J., Dudiak K.M. et al. A comparison of endoscopic ultrasound, magnetic resonance imaging, and exam under anesthesia for evaluation of Crohn’s perianal fistulas // Gastroenterology. — 2001. — 121. — 106472.
48. Sohn N., Korelitz B.I., Weinstein M.A. Anorectal Crohn's disease: definitive surgery for fistulas and recurrent abscesses // Am. J. Surg. — 1980. — 139. — 39497.
49. Sonoda T., Hull T., Piedmonte M.R. et al. Outcomes of primary repair of anorectal and rectovaginal fistulae using the endorectal advancement flap // Dis. Colon. Rectum. — 2002. — 45. — 16221628.
50. Theerapol A., So B.Y., Ngoi S.S. Routine use of setons for the treatment of anal fistulae // Singapore Med. J. — 2002. — 43. — 305307.
51. Van Beers B., Grandin C., Kartheuser A. et al. MRI of complicated anal fistulae: comparison with digital examination // J. Comput. Assist. Tomogr. — 1994. — 18. — 8790.
52. Wiliams J.G., Farrands P.A., Williams A.B. et al. The treatment of anal fistula: ACPGBI Position Statement // Color. Dis. — 2007. — 9(suppl. 4). — 1850.
53. Williamson P.R., Hollinger M.D., Larch S.W. et al. Twentyyear review of the surgical management of perianal Crohn’s disease // Dis. Colon. Rectum. — 1995. — 38. — 38992.
54. Wolff B.G. Resection margins in Crohn’s disease // Br. J. Surg. — 2001. — 88(6). — 7712.
55. Wolff B.G., Fleshman J.W., Beck D.E. et al. The ASCRS Textbook of Colon and Rectal Surgery. — 1st ed. — Springer: London, 2006. — 192214.
56. Yamamoto T., Allan R.N., Keighley M.R. Effect of fecal diversion alone on perianal Crohn’s disease // World J. Surg. — 2000. — 24(10). — 125862 [discussion: 12623]