Газета «Новости медицины и фармации» Гастроэнтерология (457) 2013 (тематический номер)
Вернуться к номеру
Патогенетические подходы к антигипертензивной терапии на фоне патологии печени
Авторы: Дорофеев А.Э., Нечипуренко Т.Б. - Донецкий национальный медицинский университет им. М. Горького
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
Патогенетически течение гипертонической болезни можно разделить на две фазы. Для первой характерна активация симпатической нервной и ренин-ангиотензиновой систем, обусловливающая развитие вазоконстрикции. Этой фазе свойственны резистентность к хлориду натрия и зависимость от ренина. Чувствительность к хлориду натрия и объему жидкости характерна для второй фазы гипертонической болезни, развивающейся вследствие прогрессирования артериолосклероза и тубулоинтерстициального воспаления, сопровождающего артериолосклероз сосудов почек [1] . Ремоделирование сосудов имеет стадию нейрогуморальных, вазоконстрикторных реакций неизмененных артерий и стадию морфологических изменений, когда происходят утолщение медиального слоя сосудов и сужение их просвета.
Клинические и экспериментальные данные свидетельствуют о защитных функциях иммунной системы против действия «агрессивных» молекул белковой, липопротеиновой природы, гормонов, олигопептидов, цитокинов. У больных гипертонической болезнью образование этих «агрессивных» молекул на уровне мембран кардиомиоцитов, эндотелиоцитов, нейронов, клеток эндокринной системы и почек усиливается [9, 10]. Связь высокого артериального давления и хронического воспаления доказана [3]. У больных гипертонической болезнью показано наличие повышенного уровня провоспалительных цитокинов [4], в частности интерлейкина (ИЛ)-6, ИЛ-8, фактора некроза опухоли a (ФНО), С-реактивного белка (СРБ), адгезивных молекул. Установлено влияние этих факторов на периферическую и каротидную гемодинамику, состояние микроциркуляции, развитие атеросклероза [3].
Особенное значение придают повышению уровня СРБ у больных гипертонической болезнью [7], как маркеру сосудистого воспаления, фактору риска развития атеросклероза, повышения сопротивления артерий и аорты [10], концентрического ремоделирования левого желудочка [4, 6], увеличения пульсового [5] и диастолического артериального давления [6]. Показано, что повышенный уровень ИЛ-6, ФНО потенцирует эффекты СРБ на состояние сосудистой стенки и миокард левого желудочка [10].
Повышенная продукция ИЛ-1b мононуклеарами больных гипертонической болезнью свидетельствует о повышении уровня воспалительных процессов сосудов, повышении риска развития атеросклероза, ишемической болезни сердца [7]. Повышенные уровни СРБ, ФНО и лейкоцитов способствуют переходу предгипертензивных состояний в гипертоническую болезнь [6]. Вазоконстрикторные реакции у больных гипертонической болезнью зависят от входящего в миоциты сосудистой стенки кальциевого тока. ИЛ и адгезивные молекулы модифицируют этот процесс, повышая чувствительность клеточных мембран к кальцию. Иммунная система влияет на сосудистую реактивность посредством простагландинов и оксида азота [6, 7]. Уровень внутриклеточного кальция полиморфноядерных лейкоцитов, инсулина плазмы крови — определяющий фактор оксидативного и воспалительного процессов у больных гипертонической болезнью. Обнаружена корреляция между уровнем артериального давления, инсулина и содержанием кальция внутри полиморфноядерных лейкоцитов [5]. Определено, что оксидативный стресс через цитокины обусловливает связь между гипертонической болезнью и дисфункцией иммунной системы [4, 5], поражением эндотелиоцитов сосудов и кардиомиоцитов [5, 6]. Маркерами генной чувствительности к оксидативному стрессу при гипертонической болезни являются полиморфизм гена р22phox и активация генов — стимуляторов сосудистой НАДФ-оксидазы [5]. Гипертоническая болезнь характеризуется активацией генов, контролирующих выраженность воспалительных процессов, снижение чувствительности рецепторов к интерлейкинам, экспрессию ангиотензина II типа 1, эндотелина-2, -3, серотонин-рецепторную активность [5, 6]. Воспалительные процессы при гипертонической болезни способствуют поражению органов-мишеней [10].
Теломеразная активность у больных гипертонической болезнью приводит к лейкоцитозу [7]. Гиперкатехоламинемия приводит к повышению уровня моноцитов, лимфоцитов периферической крови, в частности CD3+, CD8+. Об этом свидетельствуют результаты изменения уровня иммунных клеток при проведении пробы с изопротеренолом, который активирует b-адренергические рецепторы лейкоцитов у пациентов с гипертонической болезнью [10]. Гиперкатехоламинемия, изменения уровня ренина, ангиотензинпревращающего фермента, глюкокортикоидов, альдостерона приводят к развитию ремоделирования сердца и сосудов, а воспалительный процесс это ремоделирование усиливает [2, 6]. Выявлена положительная корреляция между высоким уровнем иммуноглобулина G и аутоантител у больных гипертонической болезнью и повышением артериального давления [4].
Идея первичного вовлечения в процесс лейкоцитов при гипертонической болезни противопоставляется вторичному. Первичная роль иммунной системы у пациентов с гипертонической болезнью обусловлена активацией лейкоцитов нервно-вегетативными, нейроэндокринными механизмами [2, 3]. Вторичным изменениям лейкоциты подвергаются в результате образования ангиотензина II, который способствует активации макрофагов, лейкоцитарной инфильтрации органов-мишеней, повреждению их цитокинами, свободными радикалами, адгезивными молекулами [9, 10].
В последнее время значительное внимание уделяется проблеме течения гипертонической болезни на фоне различных факторов риска, среди которых важное место занимают хронические воспалительные заболевания внутренних органов [4, 6]. Считают, что воспалительные процессы внутренних органов, хронические очаги воспаления способны потенцировать изменения системы провоспалительных цитокинов, липидного обмена, стимулировать развитие атеросклероза [4, 10]. Результатом такого объединения патологических процессов являются повреждение эндотелия, утрата им противовоспалительных, антиоксидантных, антитромбогенных свойств, что приводит к нарушению перфузии тканей и развитию гипоксии [2, 4], в частности снижению коронарного резерва миокарда.
По данным исследований больных гипертонической болезнью в сочетании с воспалительной патологией внутренних органов выявлена связь между иммунной реактивностью Т-лимфоцитов, уровнем В-лимфоцитов, иммуноглобулина G и характером ремоделирования миокарда, причем патогномоничной реакцией нейтрофилов оказалось повышение фагоцитарного индекса [1].
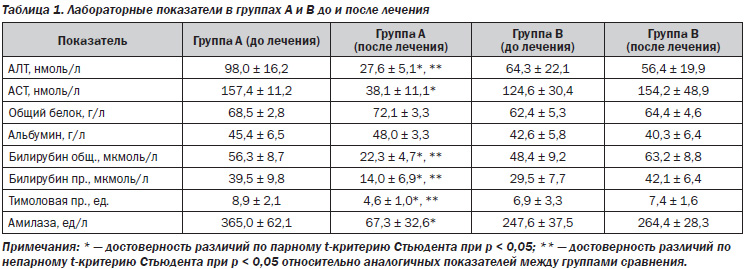
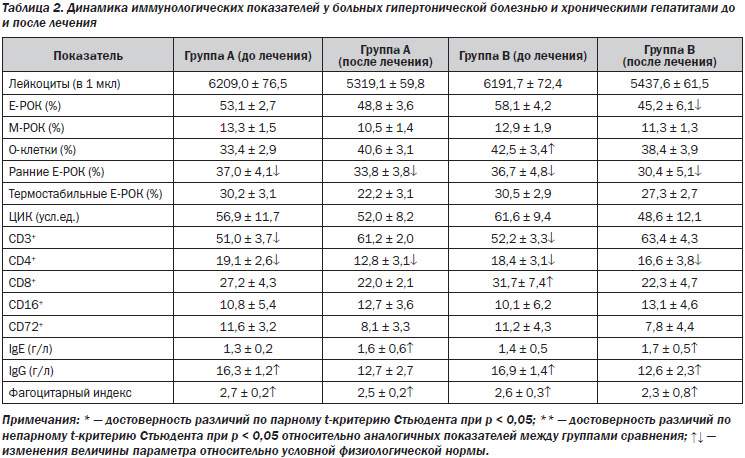
Хроническим гепатитом страдает около 5 % взрослого населения в мире [5]. Распространенность заболеваний печени среди жителей Украины в 1997 году составляла 14 тысяч на 100 тысяч населения по данным официальной статистики, гораздо выше — по мнению специалистов [2]. В последние десять лет заболеваемость хроническим гепатитом выросла на 76,6 %, а его распространенность — в 2,2 раза [2]. Существенно выросло и число пациентов с сочетанной патологией – поражение гепатобилиарной системы выявляется у 28 % больных гипертонической болезнью [3]. Возможные взаимные влияния патогенетических звеньев, необходимость длительного приема лекарственных препаратов, контролирующих гипертензию, обусловливают интерес к изучению сочетанной патологии [4]. Нарушение иммунного статуса — важнейшее патогенетическое звено хронических гепатитов различной этиологии, во многом определяющее прогрессирование этого заболевания [3], изменение иммунного и/или воспалительного ответа при гипертонической болезни в последние годы исследуется все более активно. Снижение функции Т-супрессоров при хроническом гепатите ведет к высокой сенсибилизации Т-лимфоцитов к вирусным антигенам, антигенам мембраны печени и печеночному специфическому липопротеину, повышенной функциональной активности Т-киллеров, что обусловливает развитие выраженного синдрома цитолиза [3]. У больных хроническим гепатитом вирусной этиологии наблюдается повышение CD21+ и О-лимфоцитов, снижение CD3+ и CD8+, что способствует большей интенсивности гуморальных реакций [3, 8]. Развитию осложнений при хронических вирусных гепатитах В и С (ХГВ, ХГС) способствует повышение в сыворотке крови фактора некроза опухоли альфа, являющегося индуктором программированной гибели клеток (апоптоза) [6, 7, 9]. Увеличение содержания ФНО отмечено и при гипертонической болезни [4]. Известны два направления Т-лимфоцитарной индукции апоптоза гепатоцитов. Первое реализуется за счет выброса из Т-клеток гранул перфорина, который, как свидетельствует его название, образует поры в плазматической мембране печеночной клетки. Через них в клетки проникают гранзимы, содержащие протеазы [9], которые являются одним из важных проапоптозных факторов. Второй путь образования апоптоза реализуется с участием Т-лимфоцитов и их действием на Fas-антигены, экспрессия которых происходит на поверхности инфицированных гепатоцитов. Fas-антиген принадлежит к большому семейству рецепторов факторов роста и фактора некроза опухоли [7]. В печени он служит рецептором для Fas-лигандов, вырабатываемых, в свою очередь, активированными Т-клетками [7]. Присоединение Fas-лиганда к Fas-рецептору на гепатоцитах и служит причиной апоптоза клетки-мишени [8]. Отмечено повышение в сыворотке крови больных хроническим гепатитом В и С индуцирующих апоптоз CD95+-клеток [1, 3]. Изменения в балансе иммунорегуляторных медиаторов в пользу цитокинов Тх2-типа (ИЛ-4) при хронических формах гепатита С, а также при микст-формах (В и С) свидетельствуют о преобладании гуморального звена иммунитета [1, 3]. Таким образом, изучение вклада элементов иммунной агрессии в развитие патогенеза гепатитов и гипертонической болезни может быть полезным для разработки принципов подавления патологических механизмов [4–6]. Основной целью проведенных клинических исследований являлась оценка особенностей клинико-иммунологического статуса больных гипертонической болезнью в сочетании с поражениями печени. Исследовано 56 больных гипертонической болезнью и хроническими гепатитами, вызванными вирусными этиологическими факторами и неалкогольными стеатогепатитами (НАСГ), в возрасте 38–69 лет. У 32 был диагностирован хронический гепатит в результате инвазии вируса В и/или С, у 14 — НАСГ, у 3 — аутоиммунный, у 7 — неясной этиологии. Всем больным проводились клиническое, лабораторное, инструментальное обследования, включающие иммунограмму, исследование уровней провоспалительных цитокинов, иммуноглобулинов, маркеров синдрома цитолиза, холестаза, показателей гемодинамики портальной системы, определение степени и морфологического типа гипертрофии левого желудочка (ГЛЖ), толерантности к физической нагрузке, активности симпатической или парасимпатической систем до начала и через 3, 6 и 12 месяцев антигипертензивной терапии. Больные рандомизированы в две группы: больные группы А получали в качестве антигипертензивного препарата b-адреноблокатор небиволол, группы В — ингибитор ангиотензинпревращающего фермента фозиноприл (табл. 1, 2).
При анализе иммунограммы выявлена картина вторичного иммунодефицитного состояния, характерного для хронического воспалительного процесса. Так, по отношению к условной физиологической норме общим для обеих групп сравнения являлось снижение общего количества Т-лимфоцитов (CD3+ и Е-РОК) с нарушением их функциональных свойств и субпопуляционного состава, что проявлялось сниженным содержанием ранних и теофиллинрезистентных Е-РОК, CD4+ Т-лимфоцитов. Несмотря на высокий уровень сывороточного IgG, число В-лимфоцитов с рецепторами для эритроцитов мыши (М-РОК) было сниженным, а количество CD72+-клеток не отличалось от нормальных значений.
В группе пациентов с паренхиматозными поражениями печени и концентрическим типом ГЛЖ исходно отмечались более высокая активность симпатической нервной системы, повышение уровней интерлейкина-1 и -8, фактора некроза опухоли a, позже достигались целевые цифры артериального давления, улучшение показателей кровотока в портальной системе. В группе пациентов с эксцентрическим типом ГЛЖ превалировали парасимпатикотоническая зависимость, часто в сочетании с дискинезиями желчевыводящих путей, более высокие уровни фактора некроза опухоли a. Диастолическая функция левого желудочка в этой группе нормализовалась к 6-му месяцу при лечении небивололом и к 12-му — фозиноприлом. Содеpжание ИЛ пpи хpонических виpусных гепатитах опpеделялось этиологическим фактоpом (ХГС, ХГВ), активностью (высокая, умеpенная, низкая). Наиболее значительно повышалось содержание ИЛ при ХГС, в меньшей степени — при ХГВ. Наиболее часто (до 43 %) и значительно (до 315 пг/мл) повышалось содержание ФНО-a и ИЛ-4, менее существенно — ИЛ-6, ИЛ-1b (до 34 %, 256 пг/мл).
Таким образом, изменения иммунологического статуса и более выраженная активность провоспалительных интерлейкинов, особенно фактора некроза опухоли a, способствуют уменьшению курабельности артериальной гипертензии и замедляют достижение целевых цифр артериального давления у пациентов с гипертонической болезнью на фоне поражения печени. Дифференцированный подход к назначению b-адреноблокаторов или ингибиторов ангиотензинпревращающего фермента в зависимости от этиологии, активности и изменения иммунологических показателей позволит оптимизировать и индивидуализировать комплексную терапию таких пациентов. Объединение провоспалительных, проремоделирующих факторов осложняет течение гипертонической болезни, способствует поражению органов-мишеней и является предпосылкой для алгоритмизации диагностики индивидуальных патогенетических механизмов и выбора клинической тактики.
1. Ивашкин В.Т., Мамаев С.Н., Лукина Е.А., Шульпекова Ю.О., Левина А.А. Система цитокинов у больных хроническими диффузными заболеваниями печени // Иммунология. — 2010. — № 1. — С. 46-49.
2. Ивашкин В.Т., Мамаев С.Н., Лукина Е.А., Шульпекова Ю.О., Левина А.А. Система цитокинов у больных хроническими диффузными заболеваниями печени // Иммунология. — 2006. — № 1. — С. 46-49.
3. Сєркова В.К., Майко О.В. Динаміка сироваткового рівня цитокінів і С-реактивного білка у хворих з хронічною серцевою недостатністю під впливом терапії інгібіторів ангіотензинперетворювального ферменту і b-адреноблокаторами // Серце і судини. — 2007. — № 1. — С. 81-86.
4. Соломатина Л.В. Iмунологiчний статус та ремоделювання серця у хворих на артерiальну гiпертензiю у поєднаннi з запальною патологiєю внутрiшнiх органів // Вiсник проблем бiологiї i медицини. — 2005. — № 4. — С. 98-104.
5. Amar J., Ruidavets J.B., Peyrieux J.C. et al. C-reactive protein elevation predicts pulse pressure reduction in hypertensive subjects // Hypertension. — 2005. — 46(1). — P. 151.
6. Buemi M., Marino D., Floccari F. et al. Effect of interleukin 8 and ICAM-1 on calcium-dependent outflow of K+ in erythrocytes from subjects with essential hypertension // Curr. Med. Res. Opin. — 2004. — 20(1). — P. 19-24.
7. Chon H., Gaillard C.A., Van der Meijden B.B. et al. Broadly altered gene expression in blood leukocytes in essential hypertension is absent during treatment // Hypertension. — 2004. — 43(5). — P. 947-951.
8. Chrysohoou C., Pitsavos C., Panagiotakos D.B. et al. Association between prehypertension status and inflammatory markers related to atherosclerotic disease: The ATTICA Study // Am. J. Hypertens. — 2004. — 17(7). — P. 568-573.
9. Hilgers K.F. Monocytes/macrophages in hypertension // J. Hypertens. — 2002. — 20(4). — P. 593-596.
10. Johnson R.S., Rodriguez-Iturbe B., Kang D.H. et al. A unifying pathway for essential hypertension // Am. J. Hypertens. — 2005. — 18(3). — P. 431-440.
11. Lakoski S.G., Cushman M., Palmas W. et al. The relations between blood pressure and C-reactive protein in the Multi-Ethnic Study of Atherosclerosis (MESA) // J. Am. Coll. Cardiol. — 2005. — 46(10). — P. 1869-1874.
12. Mahmud A., Feely J. Arterial stiffness is related to systemic іflammation in essential hypertension // Hypertension. — 2005. — 46(5). — P. 1118.