Газета «Новости медицины и фармации» Гастроэнтерология (457) 2013 (тематический номер)
Вернуться к номеру
Лікування порушень системи гемостазу та протеолізу у хворих на пептичну виразку шлунка та дванадцятипалої кишки, поєднану з цукровим діабетом
Авторы: Федів О.І., Оліник О.Ю., Гараздюк О.І., Телекі Я.М. - Буковинський державний медичний університет, кафедра внутрішньої медицини, м. Чернівці
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
Вступ
Цукровий діабет (ЦД) характеризується тривалим, постійно прогресуючим перебігом та поєднанням із захворюваннями інших органів та систем, що, у свою чергу, утруднює досягнення компенсації ЦД та значно погіршує якість життя пацієнтів. У 70 % випадків ЦД супроводжується захворюваннями органів травлення [1]. Від пептичної виразки (ПВ) страждає близько 10–15 % дорослого населення, тому поєднання цих захворювань викликає інтерес науковців та клініцистів. Якщо ПВ небезпечна перш за все гострими ускладненнями, то ЦД — поліорганністю ураження та хронічними ускладненнями [1, 2]. Вивчення патогенезу поєднаного перебігу цих захворювань має важливе значення у встановленні нових механізмів розвитку поєднаної патології та удосконалення існуючих методів лікування.
Метою нашого дослідження стало вивчення змін морфофункціональних властивостей еритроцитів (Ер), стану системи гемостазу та протеолізу для з’ясування їх можливого взаємозв’язку та корекції виявлених змін.
Матеріал і методи дослідження
Обстежено 115 хворих, які перебували на стаціонарному лікуванні в обласному ендокринологічному диспансері та гастроентерологічному відділенні обласної клінічної лікарні м. Чернівці. Діагноз пептичної виразки встановлювали згідно з наказом МОЗ України № 271 від 13.06.2005 р., діагноз цукрового діабету — згідно з наказом МОЗ України № 356 від 22.05.2009 р. Усім пацієнтам проводили обстеження, що включало збір анамнезу, оцінку клінічних симптомів, лабораторно-інструментальне обстеження з обов’язковим визначення глюкози плазми натще, глікозильованого гемоглобіну, проведенням перорального тесту на толерантність до глюкози, УЗД внутрішніх органів, фіброгастродуоденоскопії з прицільною біопсією та подальшим визначенням Н. pylori гістологічним методом і за допомогою імунохроматографічної тест-системи для виявлення антигенів Н. pylori у фекаліях (CerTest Biotec, S.L., Pharmasco, Іспанія) [3]. На основі вищезазначених обстежень усі хворі були розподілені на три групи: група І складалась із 39 хворих на Нр-асоційовану ПВ шлунка та дванадцятипалої кишки (ДПК); до групи ІІ увійшли 39 хворих на ЦД; групу ІІІ становили 37 хворих на Нр-асоційовану ПВ шлунка та ДПК, поєднану з ЦД. Контрольна група складалась із 20 практично здорових осіб (ПЗО).
Основну групу залежно від проведеного лікування розподілили на три підгрупи: ІІІа — хворі отримували базисну терапію (рабепразол — 20 мг двічі на день, амоксицилін — 1000 мг двічі на день, кларитроміцин — 500 мг двічі на день упродовж 7 днів та пероральні цукрознижуючі препарати або інсулін в адекватній дозі); ІІІб — на тлі базисного лікування хворим було призначено інгібітор ангіотензинперетворюючого ферменту (ІАПФ) квінаприл у дозі 2,5 мг 1 раз на добу вранці під контролем гемодинамічних показників упродовж 1 тижня, з переходом на 5 мг 1 раз на добу вранці впродовж 3 тижнів; ІІІв — додатково до базисної терапії пацієнти отримували препарат плацента-композитум у дозі 2,2 мл внутрішньом’язово 1 раз на три дні протягом місяця.
Морфофункціональні властивості Ер визначали за допомогою фільтраційних методів: індекс деформації Ер (ІДЕ) — за методом З.Д. Федорової, М.О. Котовщикової у модифікації М.Ю. Коломойця, В.М. Ходоровського; відносну в’язкість Ер суспензії (ВВЕС) — за методом О.Ф. Пирогової, В.Д. Джорджикія у модифікації З.Д. Федорової, М.О. Котовщикової.
Стан системи гемостазу вивчали за допомогою розгорнутої гемостазіограми: коагуляційний гемостаз (уміст фібриногену), антизгортальний потенціал крові (активність антитромбіну ІІІ), фібринолітичний потенціал крові (активність Хагеман-залежного фібринолізу (ХЗФ), потенційна активність плазміногену (ПАП), сумарна (СФА), ферментативна (ФФА) та неферментативна (НФА) фібринолітична активність (СФА) плазми), посткоагуляційна фаза (активність ХІІІ фактора). Крім того, визначали інтенсивність лізису азоальбуміну (АА), азоказеїну (АК) та азоколу (АКл) у крові. Для досліджень використовували набори реактивів фірми «Даниш Ltd» (Львів) за методиками Н. Тіца [4].
Статистична обробка результатів дослідження проводилась за допомогою програми Statistica 6.0. Підраховували середнє (M), стандартну похибку середнього (m) та показник вірогідності відмінності (р).
Результати й обговорення
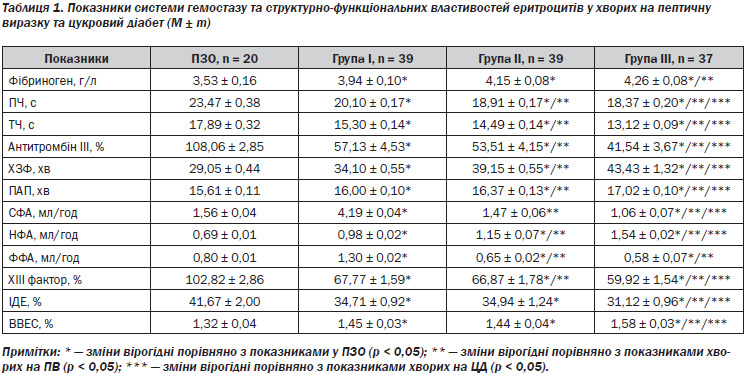
Аналіз результатів дослідження показав (табл. 1), що у хворих на ПВ шлунка та ДПК, поєднану з ЦД, спостерігається активація коагуляційного гемостазу. Зокрема, вміст фібриногену вірогідно (р < 0,05) вищий від такого у ПЗО та у хворих на ПВ, проте не виявлено істотної різниці з групою ІІ. Відмічено вкорочення часових характеристик (ПЧ та ТЧ) у всіх обстежених, проте найнижчими є показники у хворих групи ІІІ (р < 0,05).
Активність АТ ІІІ значно знижена в усіх групах: в 1,9 раза — в групі І, у 2 рази — у групі ІІ та в 2,5 раза — у групі ІІІ порівняно з ПЗО (р < 0,05), а також різниця вірогідна (р < 0,05) в групі ІІІ порівняно з групами І та ІІ. Фібринолітичний потенціал крові у відповідь на виражену гіперкоагуляцію зростає у хворих групи І, зменшується у хворих групи ІІ та є вірогідно меншим у хворих основної групи. Наступне підтверджується показниками фібринолітичної активності: СФА та ФФА у хворих групи І підвищується (у 2,68 раза та в 1,63 раза відповідно), а у хворих групи ІІ знижується (в 1,06 раза та у 1,23 раза відповідно) порівняно з ПЗО (р < 0,05), проте найбільш виражене зниження спостерігається за поєднаного перебігу ПВ та ЦД (в 1,47 раза та в 1,38 раза відповідно).
Показник НФА підвищується у хворих усіх груп, з найвищими показниками у пацієнтів групи ІІІ (р < 0,05). Потенційна активність плазміногену зменшується в усіх обстежених порівняно з ПЗО (р < 0,05). Аналіз посткоагуляційної фази системи гемостазу вказує на значне (в 1,7 раза) зниження вмісту ХІІІ фактора порівняно з ПЗО та в 1,1 раза порівняно з групою ІІ та ІІІ (р < 0,05).
За поєднання ПВ шлунка та ДПК і ЦД спостерігалися також найістотніші (р < 0,05) зміни морфофункціональних властивостей еритроцитів (зниження ІДЕ на тлі підвищення ВВЕС).
Отже, погіршення морфофункціональних властивостей еритроцитів у хворих на ПВ, поєднану з ЦД, супроводжується розвитком синдрому гіперкоагуляції, що характеризується вкороченням часових характеристик згортання крові на тлі зниження СФА (за рахунок ФФА) та підвищення НФА (ймовірно, внаслідок наявності фібринолітичних властивостей у недоокиснених продуктів, які, як відомо, у великій кількості продукуються за наявності цукрового діабету).
За Нр-асоційованої ПВ шлунка та ДПК, поєднаної з ЦД, спостерігається синдром гіперкоагуляції, що супроводжується вкороченням часових характеристик згортання крові на тлі підвищення рівня фібриногену в плазмі крові, зниження активності антитромбіну ІІІ, ХІІІ фактора, виснаження внутрішнього механізму фібринолізу, зменшення потенційної активності плазміногену та ферментативної фібринолітичної активності крові. Однією з причин виникнення гіперкоагуляційних змін при зазначеній поєднаній патології є погіршення морфофункціональних властивостей еритроцитів, а підсилення неферментативного фібринолізу — одним із механізмів компенсації виявлених порушень.
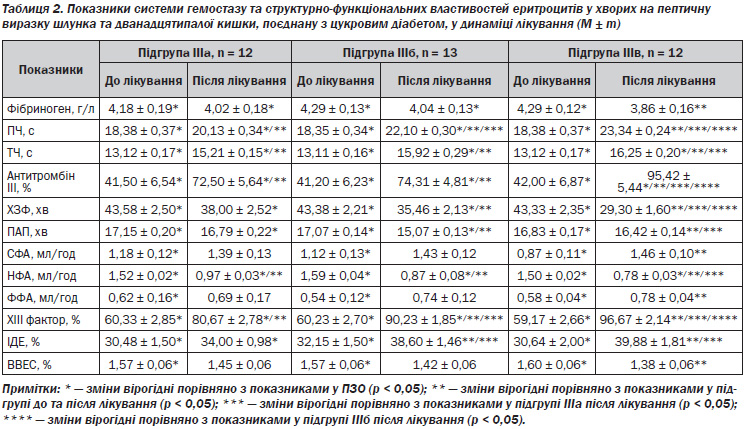
Аналізуючи стан системи гемостазу після лікування (табл. 2), слід відзначити, що у хворих, які отримували лише базисну терапію, спостерігається тенденція до покращення усіх показників, проте вірогідною (р < 0,05) є різниця лише щодо ПЧ, ТЧ, АТ ІІІ, НФА та ХІІІ факторів (на 9, 16, 75, 64 та 34 % відповідно), а також отримані дані після лікування вірогідно різняться з такими у ПЗО (р < 0,05).
У групі ІІІб спостерігалось істотне покращення всіх характеристик системи гемостазу (р < 0,05), окрім умісту фібриногену, СФА, ФФА та ВВЕС, що змінювалися неістотно (р > 0,05). У групі, яка додатково до базисної терапії отримувала комплексний препарат плацента-композитум, відмічено найкращі результати порівняно з такими до лікування, і встановлено істотну різницю з групою ІІІа за всіма показниками (р < 0,05).
Із групою ІІІб вірогідна різниця встановлена лише щодо ПЧ, АТ ІІІ, ХЗФ, ХІІІ фактора (р < 0,05), інші дані після лікування істотно не відрізнялись. У групі ІІІв також не знайдено відмінностей за всіма даними від ПЗО (р < 0,05), окрім ТЧ, АТ ІІІ та НФА.
Отже, призначення інгібітору ангіотензиперетворюючого ферменту квінаприлу призводить до істотного зменшення гемостазіологічних порушень у хворих на Нр-асоційовану ПВ шлунка та ДПК, поєднану з ЦД, імовірно, завдяки позитивному впливу на функціональний стан ендотелію. Застосування ж комплексного антигомотоксичного препарату плацента-композитум сприяє усуненню порушень морфофункціональних властивостей еритроцитів із подальшим покращенням мікроциркуляції у слизовій оболонці та швидшим загоєнням виразкового дефекту.
Висновки
1. При пептичній виразці, поєднаній з цукровим діабетом, спостерігається схильність до гіперкоагуляції, що проявляється підвищенням рівня фібриногену, активності АТ ІІІ, зниженням ХЗФ, підвищенням СФА, НФА, ФФА, зниженням рівня ХІІІ фактора.
2. Реакція системи фібринолізу та протеолізу є неадекватною щодо ступеня активності коагуляційного гемостазу у хворих на пептичну виразку, поєднану з цукровим діабетом, що може бути свідченням зниження компенсаторних сил організму.
3. Застосування на тлі антихелікобактерної терапії ІАПФ квінаприлу та комплексного антигомотоксичного препарату плацента-композитум є патогенетично обґрунтованим та допомагає усунути виявлені порушення.
1. Ткач С.М. Современные подходы к диагностике и лечению пептических язв при сахарном диабете / С.М. Ткач // Сучасна гастроентерологія. — 2010. — № 1(51). — С. 71-77.
2. Konstantinos X. Papamichael, Garyphallia Papaioannou, Helen Karga [et al.]. Helicobacter pylori infection and endocrine disorders: Is there a link? // World J. Gastroenterol. — 2009. — 15(22). — Р. 2701-2707.
3. Joyce Matie Kinoshita da Silva, Aparecida Villares, Maria do Socorro Monteiro [et al.]. Validation of a rapid stool antigen test for diagnosis of Helicobacter pylori infection // Rev. Inst. Med. Trop. Sao. Paolo. — 2010. — 52(3). — P. 125-128.
4. Тиц Н. Энциклопедия клинических лабораторных тестов: Пер. с англ. / Под ред. В.В. Меньшикова. — М.: Лабинформ, 1997. — 960 с.