Газета «Новости медицины и фармации» 9 (460) 2013
Вернуться к номеру
Гипертрофия левого желудочка и артериальная гипертензия: новые патогенетические и терапевтические концепции
Авторы: Головач И.Ю., д.м.н., профессор, Клиническая больница «Феофания» Государственного управления делами, г. Киев
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
 Артериальная гипертензия (АГ) — одна из главных проблем современной медицины, значимая причина инвалидизации и смертности лиц трудоспособного возраста. Это самое распространенное заболевание сердечнососудистой системы и наиболее весомый фактор риска сердечнососудистых осложнений и смертности. Тяжесть клинических проявлений и прогноз больных с АГ определяется не только степенью повышения артериального давления (АД), но и в значительной мере — поражением органовмишеней, в частности формированием гипертрофии левого желудочка (ГЛЖ).
Артериальная гипертензия (АГ) — одна из главных проблем современной медицины, значимая причина инвалидизации и смертности лиц трудоспособного возраста. Это самое распространенное заболевание сердечнососудистой системы и наиболее весомый фактор риска сердечнососудистых осложнений и смертности. Тяжесть клинических проявлений и прогноз больных с АГ определяется не только степенью повышения артериального давления (АД), но и в значительной мере — поражением органовмишеней, в частности формированием гипертрофии левого желудочка (ГЛЖ).
Возрастающий интерес к ГЛЖ и геометрии левого желудочка продиктован прежде всего имеющимися данными о взаимосвязи структурных изменений сердца и сердечнососудистым риском. В настоящее время ремоделирование миокарда, в частности его гипертрофия, рассматривается не как закономерное следствие повышенного АД, а как самостоятельная патология, играющая независимую роль в прогнозе больных с АГ [6].
Гипертоническое ремоделирование сердца, характеризующееся ГЛЖ и нарастающим фиброзом, увеличивает нагрузку на сердце и является важным фактором риска сердечнососудистой заболеваемости и смертности [30]. Существует непрерывная связь между массой левого желудочка и вероятностью сердечнососудистых событий, в том числе инсульта, сердечной недостаточности и ишемической болезни сердца, что приводит к инфаркту миокарда [21]. Также показано, что наличие ГЛЖ способствует возникновению желудочковых нарушений ритма, и это обусловливает повышенный риск внезапной сердечной смерти больных АГ [39]. Формирование гипертрофии левого желудочка сопровождается прогрессивным ухудшением вариабельности сердечного ритма, что также свидетельствует о склонности к аритмогенным осложнениям у таких больных [25].
Исследование M. Muiesan и соавт. [36], впервые осуществивших наблюдение за больными АГ в течение 7–13 лет, продемонстрировало, что изменение массы миокарда во времени (по данным слепого оценивания эхокардиограмм) было более значимым фактором, имеющим отношение к смертности, чем возраст, наличие сахарного диабета, пол, индекс массы тела, уровень липидов плазмы и АД. Еще в одном исследовании, проведенном в Италии [52], при длительном наблюдении за 399 пациентами с эхокардиографическим контролем было выявлено, что среди больных с прогрессированием ГЛЖ смертность была существенно выше, чем у лиц с уменьшением ГЛЖ или ее отсутствием.
Практически все клинические исследования продемонстрировали, что на фоне антигипертензивной терапии возможен регресс ГЛЖ, который достоверно приводит к улучшению течения АГ и уменьшению риска возникновения сердечнососудистых осложнений, независимо от уровня увеличения массы миокарда левого желудочка до лечения [32]. Это поставило новые цели антигипертензивной терапии и одновременно выдвинуло новые требования к антигипертензивным препаратам, что имеет первостепенное значение для снижения кардиоваскулярного риска [36, 37].
Обратное развитие ГЛЖ на фоне антигипертензивной терапии сопровождается целым рядом благоприятных последствий, а именно улучшением коронарного резерва сердца, уменьшением желудочковых нарушений ритма, улучшением диастолической функции, что в конечном итоге приводит к снижению смертности и сердечнососудистых осложнений. В 1990 г. были опубликованы результаты первого исследования, выполненного в США, которое акцентировало внимание на проблеме ГЛЖ и сердечнососудистых осложнений в ходе лечения. Наблюдались 166 пациентов разного пола и расы с АГ в течение 5 и более лет [29]. Вначале больные не имели сердечнососудистых осложнений, принимались во внимание получаемая антигипертензивная терапия, изменение массы тела и АД в момент исследования. При этом среди больных, у которых сохранялась или вновь развилась ГЛЖ, смертность была значительно выше, чем среди тех, у кого ГЛЖ уменьшилась.
В настоящее время в понятие гипертонического сердца уже не вкладывается только представление о банальной ГЛЖ как следствии перегрузки АД. Активно используется термин «ремоделирование сердца», который включает весь комплекс изменений размеров и формы полостей, структуры, биохимических и функциональных свойств миокарда под влиянием различных факторов, но прежде всего АГ.
Установлено, что лишь в начале своего развития ГЛЖ представляет собой компенсаторную реакцию на повышенную нагрузку вследствие высокого АД. Позже она превращается в самостоятельный фактор, оказывающий влияние на течение и прогноз не только АГ, но и других заболеваний [42]. Существование данного варианта субклинического поражения органамишени при АГ ассоциируется с достоверным увеличением числа сердечнососудистых катастроф [27]. У лиц с наличием ГЛЖ общая и сердечнососудистая смертность в несколько раз выше по сравнению с субъектами без признаков ГЛЖ [18]. Все это позволяет предположить, что и особенности течения сердечнососудистых заболеваний на фоне имеющейся ГЛЖ могут во многом определяться характером гипертрофии, а не только заболеванием.
Таким образом, прогностическое значение ГЛЖ при АГ очевидно. Наличие ГЛЖ почти автоматически позволяет отнести пациента к категории так называемого высокого риска кардиоваскулярных осложнений. В течение двухлетнего наблюдения за больными с АГ было установлено, что ГЛЖ повышает риск возникновения ишемической болезни сердца более чем в 2 раза, инсульта — более чем в 3 раза, сердечной недостаточности — почти в 8 раз [2, 51]. Примечательно, что возрастание толщины стенки ЛЖ на 1 мм увеличивает риск смертельных осложнений в 7 раз! Как элемент сердечнососудистого континуума ГЛЖ сопоставима с хронической болезнью почек по предопределению неблагоприятного прогноза в отношении возникновения ишемического инсульта у пациентов с АГ [48].
Сегодня получены убедительные доказательства о роли повышенной активности ренинангиотензинальдостероновой системы (РААС) в реализации неблагоприятного прогноза у больных с АГ [3, 8]. Ангиотензин II (АТ II) является мощным вазоконстриктором и основным элементом РААС, которая играет основную роль в регуляции АД [13], а также является независимым фактором риска развития сердечнососудистых катастроф. Одновременно АТ II играет главную роль в повреждении органовмишеней. Опосредуемые им эффекты вызывают вазоконстрикцию, эндотелиальную дисфункцию, ремоделирование сосудов, в том числе экстра и интракраниальных, способствуют прогрессированию АГ, атеросклероза, апоптозу миоцитов. АТ II принимает участие в развитии гипертрофии миокарда, его фиброза, является фактором риска развития сердечной недостаточности и инфаркта миокарда [40]. Действие АT II реализуется через АТ1 и АТ2рецепторы, влияние которых противоположно. AT1рецепторы оказывают преимущественно отрицательное воздействие — они ответственны за вазоконстрикцию, увеличение реабсорбции натрия, усиление оксидативного стресса, вызывают эндотелиальную дисфункцию, инициируют образование провоспалительных цитокинов, обусловливают клеточную и тканевую гипертрофию. В противоположность AT1рецепторам AT2рецепторы способствуют регенерации тканей, вазодилатации, снижению реабсорбции натрия, уменьшению воспаления, ингибируют пролиферацию (эндотелиальных и гладкомышечных клеток сосудистой стенки, фибробластов и др.) и рост клеток, тормозят гипертрофию кардиомиоцитов [14].
Гиперактивность РААС вносит весомый вклад в развитие ГЛЖ. Считается доказанным, что АТ II не только стимулирует клеточный рост за счет синтеза протеина в кардиомиоцитах, но и посредством активации секреции альдостерона в тканях сердца оказывает влияние на темпы развития интерстициального фиброза. Своеобразной яркой моделью участия РААС в ремоделировании сердца могут быть пациенты с первичным гиперальдостеронизмом. Минералокортикоидный эксцесс у таких больных реализуется формированием ГЛЖ, выраженной в значительно большей мере, чем у пациентов с эссенциальной АГ [1]. Частота возникновения таких кардиоваскулярных осложнений, как инсульт, инфаркт, мерцательная аритмия, у больных с первичным гиперальдостеронизмом соответственно в 4,2; 6,5 и 12,1 раза выше, чем у нормотензивных субъектов с ненарушенным минералокортикоидным обменом [16].
Под влиянием повышенных концентраций АТ II происходит единый процесс сердечнососудистого ремоделирования, отражающий трансформацию функциональных изменений в структурные. В миокарде наблюдается увеличение размеров миоцитов, изменение их изоэнзиматического профиля, повышение содержания субэндокардиального коллагена, что приводит к изменению растяжимости, сократимости, проводимости миокарда, ГЛЖ, его ишемии и развитию сердечной недостаточности в конечном итоге [21].
Считается, что устранение ГЛЖ при эссенциальной гипертензии — это самостоятельная терапевтическая цель и признак эффективной антигипертензивной терапии в целом. Поэтому наиболее эффективные современные подходы, направленные на достижение регресса ГЛЖ, ассоциированы с фармакологической блокадой РААС [2, 6, 41].
Современные требования к антигипертензивной терапии включают в себя не только нормализацию АД, но и обеспечение органопротективного действия за счет влияния на нейрогуморальные системы [7, 8]. По данным многочисленных экспериментальных исследований показано, что только тот препарат, который не вызывает активации симпатической нервной системы и РААС, может вызывать регресс ГЛЖ [24]. Ключевым исследованием в данном направлении явилась работа S. Sen и R. Tarazi [43], в которой было продемонстрировано, что контроль АД не является единственным фактором, способствующим регресу гипертрофии, а имеет значение ингибирование РААС. Способность воздействовать на нейрогуморальное звено патогенеза поражения органовмишеней доказана для ингибиторов АПФ и блокаторов АТ1рецепторов ангиотензина II (БРА II). По последним данным, на первое место уверенно вышли БРА II.
Наиболее значимым исследованием, которое предопределило представления о БРА II как о препаратах выбора при ГЛЖ и является краеугольным в формировании практических рекомендаций для лечения больных с АГ и ГЛЖ, стало исследование LIFE (более 9000 больных), основной целью которого был анализ прогноза пациентов с гипертонической болезнью (ГБ) при терапии лосартаном в сравнении с атенололом [19]. Лосартан достоверно уменьшал ГЛЖ в сравнении с атенололом. Преимущества антагонистов рецепторов к ангиотензину II подкрепляются результатами SILVHIA, где ирбесартан также оказался более эффективным, чем атенолол (на 48 %), в снижении ГЛЖ [31], а также исследованием CATCH, в котором кандесартан по своему эффекту влияния на регресс ГЛЖ был сравним с эналаприлом [17]. Эти исследования убедительно доказали, что БРА II индуцируют регресс гипертрофии миокарда.
Этот эффект достигается не только благодаря собственно антигипертензивному действию БРА II, но и за счет нейтрализации органоповреждающего действия АТ II, то есть в связи с наличием дополнительных (АДнезависимых) органопротективных влияний. Препараты этой группы селективно «выключают» все неблагоприятные эффекты АТ II, реализуемые через АТ1рецепторы. Этим БРА II принципиально отличаются от другого класса ингибиторов РААС — иАПФ. При применении последних, вопервых, имеет место продуцирование АТ II в обход основного пути (химазный и другие альтернативные пути), вовторых, происходит блокада эффектов АТ II, опосредованных через АТ2рецепторы, имеющих положительное значение [5].
Особый интерес в этом отношении вызывает один из новых представителей класса БРА ІІ — олмесартан. Олмесартан характеризуется высоким уровнем тканевой активности, липофильностью, высоким объемом распределения в тканях, а также стойкой блокадой АТ1рецепторов, медленной диссоциацией этих рецепторов, длительным периодом полужизни в плазме, что обусловливает продолжительный и надежный клинический эффект [3, 8, 9].
За 10 лет, прошедшие с момента появления олмесаратана в широкой клинической практике, накоплена большая доказательная база, свидетельствующая о высокой антигипертензивной эффективности и благоприятном профиле безопасности. А в ряде сравнительных рандомизированных контролируемых исследований при сравнении антигипертензивного эффекта различных БРА ІІ были получены сведения об определенных преимуществах олмесартана в лечении больных с АГ как по сравнению с другими БРА ІІ, так и по сравнению с антигипертензивными препаратами других групп первого ряда [13, 45]. В одном из последних метаанализов (2012), посвященных антигипертензивной активности БРА II, отмечен лучший антигипертензивный эффект олмесартана в сравнении с лосартаном, валсартаном, кандесартаном и ирбесартаном, что явилось основой для рекомендации выбора именно олмесартана для лечения АГ у пациентов высокого кардиоваскулярного риска [53].
Олмесартан имеет особый механизм связывания с АТ1рецепторами ангиотензина II — препарат «контактирует» с двумя сайтами рецептора, содержащего ОН и aСООНгруппы (вовлечение домена двойной цепи, double chain domain) [47], в то время как для большинства представителей группы БРА ІІ характерно связывание с доменом рецептора, содержащим ОНгруппу [34, 35]. В связи с этим олмесартан обеспечивает более пролонгированное блокирование эффектов АТ II, а также блокаду РААС в течение 24 ч. Кроме того, олмесартану свойственна стимуляция незаблокированных АТ2рецепторов, что может сыграть дополнительную положительную роль, поскольку происходит увеличение NO как через брадикининзависимый, так и через брадикининнезависимый механизм [15]. Таким образом, теоретически применение олмесартана может иметь двойной положительный эффект — как через блокаду АТ1рецепторов, так и через стимуляцию АТ II незаблокированных АТ2рецепторов.
Эти особенности обеспечивают дополнительные нейрогуморальные эффекты препарата [3], которые выходят за рамки только антигипертензивной активности, прежде всего — влияние на регресс ГЛЖ.
Проведенные экспериментальные исследования продемонстрировали высокую эффективность олмесартана в предупреждении развития и регрессе ГЛЖ. Одним из базовых экспериментальных исследований, целью которого было установить, зависит ли предупреждение ремоделирования миокарда и сосудов при подавлении эффектов АТ II от гипотензивного действия блокады ангиотензиновых рецепторов 1го типа, стало исследование H. Yokoyama с соавт. (2005) [55]. Восьминедельным крысам со спонтанной гипертензией в течение 56 дней назначался олмесартан, атенолол либо плацебо, принимавшиеся вместе с питьевой водой. По окончании каждой фазы лечения измерялись уровни АД, ЧСС, вычислялось отношение массы миокарда к массе тела, оценивалось содержание коллагена в ткани сердца (гистохимический анализ с окрашиванием пикросириус красным), а также определялось отношение толщины сосудистой стенки к диаметру просвета сосудов в изолированных мезентериальных артериях. Через 3 недели от начала терапии у крыс, получавших олмесартан, регистрировались более низкие уровни систолического АД по сравнению с принимавшими атенолол либо плацебо животными. Предотвращение гипертрофии миокарда и отложения коллагена в миокарде наблюдалось лишь у крыс, принимавших олмесартан. Прием как олмесартана, так и атенолола уменьшал отношение толщины сосудистой стенки к диаметру просвета артериол (11,5 ± 0,4 % и 13,3 ± 0,6 % соответственно по сравнению с 18,4 ± 1,1 % в группе плацебо). В то же время этот эффект был более выражен у животных, принимавших БРА II. Таким образом, несмотря на то, что контроль АД играл определенную роль в профилактике гипертрофии миокарда и сосудов, результаты исследования свидетельствуют о не зависящем от снижения АД предупреждении структурных изменений сердца и сосудов при блокаде рецепторов к АТ II.
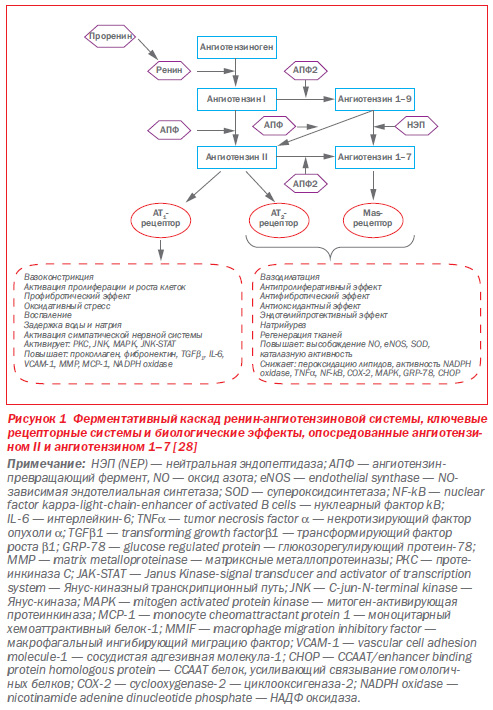
Исследование особенностей влияния олмесартана на РААС позволило раскрыть механизмы его действия и объяснить уникальность его эффектов, прежде всего способность вызывать регрессию ГЛЖ. Хорошо известно, что все БРА II повышают концентрацию АТ II изза отсутствия отрицательной обратной связи в ответ на активность ренина. В недавних экспериментальных исследованиях было продемонcтрировано, что олмесартан является единственным БРА II, который приводит к снижению концентрации АТ II в крови и тканях и, соответственно, к снижению стимуляции АТ2рецепторов [22]. Этот эффект связывают с повышением экспрессии ангиотензинпревращающего фермента 2 (АПФ2) — уникального фермента, идентифицированного в 2000 году [38, 50]. Его функция заключается в конвертации АТ I в ангиотензин 1–9, а AT II — в ангиотензин 1–7 (АТ1–7). Последний метаболит опосредует многие позитивные эффекты, обладает вазодилатирующим действием и натрийуретическими свойствами, также он играет важнейшую роль в предотвращении ГЛЖ (рис. 1) [50]. Считается, что именно новая система АПФ2/АТ1–7/Masрецептор играет важнейшую роль в патогенезе АГ и сердечной недостаточности [22, 28, 38]. В одной недавней обзорной статье две оси ренинангиотензиновой системы — АПФ2/АТ1–7/Masрецептор и АФП/АТ II/АТ1рецептор — противопоставлены друг другу и обозначены как «ангел и демон» [23].
Дальнейшие экспериментальные исследования раскрыли механизмы действия олмесартана. Оказалось, что олмесартан повышает экспрессию АСЕ2 и, соответственно, концентрацию АТ1–7 за счет конвертации АТ II, снижая при этом плазменную концентрацию последнего. Олмесартан также проявляет ингибирующее действие на ангиотензинпревращающий фермент (АПФ) в дополнение к блокирующему влиянию на ангиотензиновые рецепторы 1го типа и таким образом предотвращает увеличение уровня АТ II. Эти эффекты обеспечивают протективное влияние препарата на сердечнососудистое ремоделирование за счет увеличения продукции оксида азота кардиомиоцитами и концентрации АТ1–7 благодаря сверхэкспрессии АПФ2 [11]. Имея эти механизмы действия — блокаду рецепторов АТ ІІ, ингибирование АПФ и повышение экспрессии АПФ2, олмесартан получает дополнительные преимущества в реализации не только антигипертензивного, но и органопротективных эффектов [26]. Еще одно экспериментальное исследование подтвердило высокую эффективность олмесартана в улучшении функции левого желудочка, снижении его гипертрофии благодаря повышению мРНК АПФ2 и снижении уровня АТ II у крыс с ГЛЖ вследствие перегрузки давлением [26].
Клинические исследования подтвердили преимущества снижения уровня АТ II и повышения концентрации АТ1–7 в плане влияния на ГЛЖ. Особенно показательно это было продемонстрировано при переходе с одного БРА ІІ на олмесартан. Так, 50 стабильных амбулаторных пациентов с гипертонической болезнью, которые получали кандесартан более чем 1 год, были рандомизированы на две группы: контрольную группу (n = 25, непрерывное лечение кандесартаном при стабильной дозе) и группу олмесартана (n = 25, терапия кандесартаном 8 мг/сут была изменена на олмесартан в дозе 20 мг/сут). Через 12 мес. наблюдений не было выявлено различий между группами в снижении АТ, однако в группе олмесартана плазменные уровни АТ II достоверно снизились, как и показатель индекса массы миокарда левого желудочка (135 ± 36 г/м2 против 123 ± 29 г/м2; P < 0,01) [49]. В группе кандесартана подобных изменений не было отмечено. Эти данные указывают, что замена кандесартана на олмесартан сопровождается рядом позитивных эффектов: снижением индекса массы миокарда левого желудочка и плазменного уровня АТ II без изменений показателей АТ и альдостерона в течение 12 месяцев.
Похожее по дизайну проспективное слепое исследование было проведено в Японии [44]. 56 пациентов, подвергшихся кардиохирургическим вмешательствам и получавших до этого кандесартан, были переведены на сопоставимые дозы олмесартана (20–40 мг/сут). В ходе наблюдения установлено достоверное снижение плазменных уровней АТ I, альдостерона, натрийуретического гормона и Среактивного белка, что достигло статистически достоверной разницы уже к 6му месяцу терапии. Но наиболее значимой была динамика показателя индекса массы миокарда левого желудочка (ИММЛЖ): с 159,5 ± 5,4 г/м2 до начала терапии до 141,1 ± 4,7 г/м2 через 6 мес. лечения (Р = 0,0158) и до 128,5 ± 4,6 г/м2 через 12 мес. (P < 0,0001). Снижение ИММЛЖ не коррелировало с уровнем АТ II, но достоверно ассоциировалось со снижением концентрации альдостерона. Одновременно у всех пациентов были достигнуты целевые уровни АД через 3 мес. лечения. Таким образом, влияние на ГЛЖ и снижение концентрации натрийуретического гормона обусловливает кардиопротективный эффект олмесартана.
Известно также, что олмесартан позитивно влияет и на сосудистую гипертрофию при АГ, что подтвердили клинические исследования. При оценке процесса ремоделирования сосудов путем миографического исследования подкожных резистивных артерий глютеальной области у пациентов с АГ, получавших олмесартан (20–40 мг/сут) либо атенолол (50–100 мг/сут), через 12 мес. лечения отношение толщины сосудистой стенки к диаметру просвета сосуда достоверно снизилось в группе олмесартана с 14,9 до 11,1 % (Р < 0,01), в то время как на фоне приема атенолола этот показатель существенно не изменился — 16,0 и 15,5 % (нд). Таким образом, прием олмесартана сопровождался обратным развитием гипертрофии стенок резистивных сосудов с достижением показателей, сходных с таковыми у здоровых, нормотензивных лиц. Этот положительный эффект не зависел от степени снижения уровня АД [46].
Безусловно, динамика ИММЛЖ не отражает всего комплекса структурных изменений миокарда под воздействием лекарственной терапии [10]. Большинство препаратов, снижающих массу левого желудочка, не обладают способностью к обратному развитию фиброза, что приводит к относительному увеличению содержания коллагена в сердечной мышце [4, 54]. В этом отношении теоретически преимущества имеют препараты, обладающие антагонистической активностью к факторам фиброза — иАПФ, антагонисты альдостерона и БРА II. Как продемонстрировали экспериментальные и клинические исследования, олмесартан предупреждал отложение коллагена в миокарде [55], а также достоверно снижал концентрацию альдостерона и Среактивного белка при 12месячном наблюдении [44].
Следует также помнить, что контроль АД у больных с поражением органов-мишеней, в частности значимой ГЛЖ, может быть достаточно трудным и предполагает использование комбинированной терапии, что делает актуальным не столько выяснение преимуществ одного препарата в сравнении с другим, сколько выработку оптимальных режимов комбинированной терапии [6]. С точки зрения рациональности, БРА ІI прежде всего комбинируют с тиазидными диуретиками (например, олмесартан + гидрохлортиазид), что с позиций коррекции ГЛЖ является также оправданным, так как диуретики способствуют уменьшению полости ЛЖ, а не только толщины его стенок [33].
Таким образом, гипертрофия левого желудочка — важнейший элемент сердечнососудистого континуума у пациентов с эссенциальной АГ. Роль АТ II в формировании ГЛЖ бесспорна, тогда как блокирование его эффектов сопровождается регрессом ГЛЖ и улучшением функционального состояния сердца. Данные последних исследований и их метаанализов позволяют считать БРА II наиболее эффективным классом антигипертензивных препаратов для лечения ГЛЖ [8, 10, 41, 45, 53]. Эти данные должны ориентировать врача учитывать поражение сердца при назначении антигипертензивной терапии и шире использовать в ее составе БРА II, в частности олмесартан.
Список литературы находится в редакции

