Газета «Новости медицины и фармации» 10 (461) 2013
Вернуться к номеру
Методы рациональной и безопасной фармакотерапии в педиатрии (Викторовские чтения, секция педиатрии)
Рубрики: Кардиология, Неврология, Нефрология, Педиатрия/Неонатология, Эндокринология
Разделы: Медицинские форумы
Версия для печати
17–19 апреля 2013 г. в Киеве в рамках IV Международного медицинского форума состоялись первые Викторовские чтения «Безопасность лекарственных средств и рациональная фармакотерапия», которые проводились в память о выдающемся ученом, клиническом фармакологе профессоре Алексее Павловиче Викторове. Инициаторами их проведения выступили общественная организация «Украинская ассоциация медицинского образования», АМО Украины, зарегистрированная торговая марка «Издательский дом «Заславский», Международный благотворительный фонд «Издательство «Сфера», газета «Новости медицины и фармации».
В рамках Викторовских чтений проводились научно-практические конференции, посвященные проблемам рациональной фармакотерапии в кардиологии, нефрологии, эндокринологии, неврологии и педиатрии.
18 апреля под председательством заведующего кафедрой пропедевтики детских болезней ДонНМУ им. М. Горького, д.м.н., профессора Е.И. Юлиша и заведующего кафедрой факультетской педиатрии и медицинской генетики Днепропетровской медицинской академии МЗ Украины, д.м.н., профессора А.Е. Абатурова состоялось заседание секции педиатрии, на котором рассматривались методы рациональной и безопасной фармакотерапии у детей.

Заседание секции открыл проф. Е.И. Юлиш, он напомнил присутствующим о выдающемся ученом и прекрасном человеке, памяти которого посвящены данные чтения, — А.П. Викторове.
Проф. А.Е. Абатуров в своей первой лекции «Роль бактериальных лизатов в профилактике частой респираторной заболеваемости у детей» отметил, что в связи с увеличением контингента детей, часто болеющих острыми респираторными инфекциями, приобретает особую актуальность понимание клиницистами широкого профиля и пульмонологами механизмов неспецифической защиты респираторного тракта от инфекционных агентов. Остановившись на специфических и неспецифических механизмах, способствующих выздоровлению больного, докладчик сделал акцент на том, что механизмы врожденной неспецифической защиты выполняют первичную и немедленную защиту респираторного тракта от инфекционных агентов и являются основным движущим компонентом выздоровления, в то время как для реализации механизмов специфической защиты (выработки специфических клеток, их клонирования) требуется время, в связи с чем специфические механизмы в большей мере играют протекторную роль.
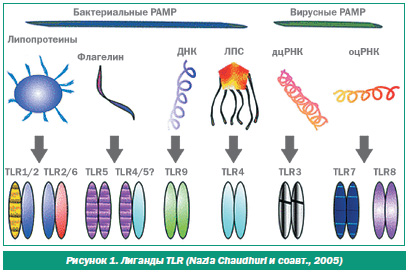
Проф. А.Е. Абатуров рассмотрел центральный компонент неспецифической защиты — так называемые образраспознающие рецепторы (patternreсognition receptors — PRR). Они распознают уникальные для инфекционных агентов, не имеющие аналогов в организме консервативные молекулярные структуры, которые названы патогенассоциированными структурами (patogenassociated molecular patterns — PAMP), и процесс распознавания происходит очень быстро, практически мгновенно. Центральным звеном образраспознающих рецепторов являются Tollподобные рецепторы — Tolllike receptors (TLR), относящиеся к рецепторам семейства интерлейкина1 (рис. 1). Выделено 12 Tollподобных рецепторов, каждый из них распознает свои структуры, бактериальные и вирусные. Возбуждаясь, они активируют большую сеть внутриклеточных молекулярных путей, которые ведут к синтезу различных цитокинов, определяющих процесс воспаления.
Докладчик подробно рассмотрел механизм развития цитокинового ответа в норме. Так, взаимодействие PAMP с ТLR-рецептором приводит к активации нуклеарного фактора NFkB, основного провоспалительного фактора транскрипции. NFkB перемещается в ядро и запускает синтез ИЛ6, ИЛ1, туморнекротизирующего фактора бета, ИЛ12 — основных провоспалительных цитокинов, ведущих к Th1ответу. Но также активируется синтез ИЛ10, который является супрессорным цитокином. Через фактор транскрипции STAT3 он подавляет активность ИЛ12, тем самым снижает воспалительный процесс и ликвидирует воспаление.
Возвращаясь к проблеме часто болеющих детей (ЧБД), А.Е. Абатуров отметил, что у них наблюдается дефицит TLR (недостаточная экспрессия TLR2, TLR4 и, возможно, TLR3, TLR7, TLR9), что обусловливает дефицитарность восприятия PAMP, а значит, и низкий Th1ответ. Такие дети склонны к аллергиям, длительному и малосимптомному течению болезни, к частным заболеваниям.
Докладчик подробно остановился на механизме развития цитокинового ответа на воздействие РАМР у ЧБД, отметив, что недостаточное возбуждение РАМР обусловливает дефицит синтеза ИЛ6, ИЛ1, туморнекротизирующего фактора и ИЛ12, в то время как ИЛ10 синтезируется в достаточном количестве. Это приводит к дефициту Th1ответа.
Докладчик напомнил слушателям о «гигиенической теории» и ее основателе — немецком враче Гансе Бюхнере (Hans Buchner), который предположил, что дефицит возбуждения системы иммунитета приводит к тому, что она не может правильно реагировать на внедрение инфекционных агентов. Hans Buchner разработал «новую гигиену», основанную на введении бактериальных лизатов с целью повышения резистентности организма к инфекционным агентам. Чтобы повысить активность иммунной системы, нужно заставить ее работать, нужно стимулировать ее, но не живыми бактериями, которые вызывают заболевание, а их остатками, лизатами (т.е. патогенассоциированными молекулярными структурами).
Отметив, что сегодня существуют целые наборы бактериальных лизатов, позволяющих модулировать TLRответы, А.Е. Абатуров остановился на препарате бронхомунал как наиболее изученном препарате бактериального происхождения. Он содержит лизаты 8 наиболее часто встречающихся бактерий: Streptococcus pneumoniae, Streptococcus viridans, Streptococcus piogenes, Haemophilus influenzae, Klebsiella pneumoniae, Klebsiella ozaenae, Staphylococcus aureus, Moraxella catarrhalis.
Докладчик познакомил слушателей с результатами проведенного исследования клинической эффективности терапии бронхомуналом П у детей.
В группу наблюдения вошли 278 детей в возрасте от 3 до 17 лет, часто болеющих ОРВИ. Обязательным условием включения в группу наблюдения были результаты объективного осмотра, позволявшие констатировать отсутствие какихлибо клинических признаков ОРЗ или обострения хронического заболевания.
Докладчик отметил, что, как и в ряде других исследований, на терапию бронхомуналом был получен хороший ответ.
Клиническая эффективность терапии бронхомуналом П показана в 67,1 % наблюдений в виде:
- уменьшения длительности острого респираторного эпизода на 1,8 ± 0,2 дня;
- уменьшения кратности ОРИ в течение года в 1,2 ± 0,1 раза;
- уменьшения количества случаев острых респираторных инфекций с осложненным течением на 30 %;
- в 78 % наблюдений в контрольных посевах со слизистых оболочек зева высевалась нормальная микрофлора.
Кроме того, было проведено исследование состояния иммунной системы этих детей. Оно показало, что назначение бронхомунала привело к изменению синтеза иммуноглобулинов, увеличению синтеза ИЛ12 и снижению синтеза ИЛ10. А.Е. Абатуров предположил, что препарат способствует экспрессии TLR (в частности, TLR4, TLR2), их активности, что и ведет к усилению Тh1ответа. А чем выше Тh1ответ, подчеркнул докладчик, тем выше эрадикация возбудителя, чем выше эрадикация возбудителя, тем меньше вероятность развития биопленок и развития последующих заболеваний.
При этом устойчивость компонентов бронхомунала к действию соляной кислоты позволяет им достичь пейеровых бляшек кишечника, которые участвуют в активации Влимфоцитов, их дифференцировке в плазматические клетки, продуцирующие специфические антитела — иммуноглобулины классов А и Е.
В заключение лекции А.Е. Абатуров сделал вывод о том, что бронхомунал, применение которого усиливает неспецифический компонент защиты и развивает специфический ответ на антигены лизатов, является эффективным медикаментозным средством, предупреждающим возникновение острых респираторных инфекций.
Выступление проф. А.Е. Абатурова вызвало большой интерес у аудитории. Отвечая на вопросы слушателей, лектор подробно осветил ряд аспектов применения бактериальных лизатов. В частности, рассматривалась возможность назначения в период болезни, он сделал акцент на том, что основная задача при назначении лизатов — это именно создание протекции; касаясь вопроса о схемах приема лизатов, А.Е. Абатуров напомнил, что сроки максимального антительного ответа у пациентов индивидуальны, и обратил внимание слушателей на то, что при выборе тех или иных бактериальных лизатов нужно с осторожностью относиться к возможности усиливать этот ответ за счет выбора препарата, содержащего адъювант, а также необходимо учитывать, смогут ли родители ребенка при долговременном приеме придерживаться сложных схем применения препарата.
Проф. Е.И. Юлиш в докладе «Рациональный подход к этиотропному лечению ассоциаций вне и внутриклеточных инфекций органов дыхания у детей» обратился к проблеме, которая становится все более актуальной в настоящее время, — проблеме внутриклеточных инфекционных агентов.
Вначале докладчик подчеркнул актуальность проблемы резистентности к антибиотикам, с которой медики столкнулись еще в 70х годах прошлого столетия (в то время начинали терять свою эффективность пенициллины). Одной из причин является нерациональное назначение антибиотиков, в частности, при заболеваниях органов дыхания. Так, по данным General Practice Research Database (оценены исходы 3,36 млн эпизодов инфекций дыхательных путей), общее количество курсов антибактериальной терапии для предотвращения одного случая возникновения осложнений превышает 4000.
Нерациональное использование антибиотиков привело к появлению и широкому распространению антибиотикорезистентных микроорганизмов, устойчивых к нескольким классам антибактериальных препаратов. На данный момент существуют антибиотикорезистентные бактерии, не реагирующие ни на одно противомикробное средство, и этим штаммы распространяются в международных масштабах.
Раскрывая проблему антибиотикорезистентности, профессор Е.И. Юлиш также коснулся вопроса о бактериальных биопленках. Отличительной особенностью бактерий, существующих в составе биопленки, является повышенная в 50–500 раз резистентность к антибактериальным препаратам. Антибактериальные средства оказываются эффективными лишь по отношению к диффузно распределенным микробам, в то время как бактерии внутри биопленки способны размножаться и вновь диссеминировать после завершения курса лечения, приводя к формированию хронических процессов и рецидивов заболевания.
Докладчик обратил внимание аудитории на имеющиеся сегодня данные об участившейся резистентности к цефалоспоринам III и IV поколений у клебсиелл, кишечной палочки и протея. Причем передача резистентности может осуществляться не только в пределах одного вида, но и в пределах рода и семейства. Доказано, в частности, что гены резистентности плазмид передаются между кишечной палочкой и клебсиеллами.
Е.И. Юлиш отметил, что сегодня единственным выходом из создавшейся ситуации является рациональное использование уже имеющихся в нашем арсенале антибиотиков, что позволит не только сдерживать рост резистентности к ним, но и повышать эффективность лечения инфекционных заболеваний.
Далее профессор остановился на бактериальной этиологии внебольничных респираторных заболеваний у детей. Отметив, что среди этиологических факторов первые места занимают, как и прежде, Str.рneumoniae и гемофильная палочка, он обратил внимание присутствующих на появившиеся совсем недавно внутриклеточные формы — Chlamydophila pneumoniae (30–35 %) и микоплазму (табл. 1).

Профессор подчеркнул, что на сегодняшний день хламидиоз действительно является серьезной проблемой. Приблизительно у 50–75 % детей, рожденных от инфицированных хламидиями матерей, развивается поражение одного или нескольких органов, включая легкие, конъюнктиву, носоглотку, прямую кишку и влагалище. Огромная роль отводится хламидиозу в развитии заболеваний органов дыхания, артритов, поражений глаз, в генезе атеросклероза. Конъюнктивиты новорожденного в 70 % случаев обусловлены хламидийной инфекцией. Распространенность хламидиоза в человеческой популяции, влияние инфекции на состояние здоровья человека, частота патологических нарушений, вызываемых хламидиями, определили включение проблемы хламидийной инфекции в программу приоритетных задач ВОЗ.
Далее докладчик познакомил слушателей с данными клиники, база данных которой включает 1500 больных с респираторным хламидиозом. Распространенность хламидийной инфекции у детей с бронхолегочной патологией варьирует от 15 до 40 %. С хламидиозом связано развитие у детей респираторных форм заболеваний (острые респираторные заболевания — ОРЗ, отиты, круп, бронхообструктивный синдром, пневмония и бронхиальная астма (БА)). Хламидии являются возбудителем пневмонии (моно или в ассоциации с другой флорой) у 38 % детей первых лет жизни, в 20 % случаев — в возрасте от 4 до 5 лет, от 7 до 15 лет — в 25–30 % случаев. Пневмония при этом носит интерстициальный характер. У детей в возрасте от 1 до 3 лет с рецидивирующим обструктивным бронхитом в 10 % случаев выявляется Chl.pneumoniae. В случаях резистентности к общепринятой терапии бронхиальной астмы у 35 % больных имеет место течение респираторного хламидиоза.
Профессор коснулся особенностей симптоматики хламидийной пневмонии в отличие от стрептококковой, а затем подробно остановился на проблеме бронхиальной астмы, отметив, что хламидии являются ее триггером в 35 % случаев. И клиническая картина, и течение БА у инфицированных хламидиями детей отличаются от ее атопической формы. У этих детей в 2 раза реже наблюдается наследственность по БА, притом что БА — это наследственно детерминированное заболевание. В результате за одно поколение количество больных БА увеличилось в 200–300 раз (распространенность БА возросла с 0,2 до 10 %).
Далее Е.И. Юлиш рассмотрел показания к терапии при хламидиозах у детей, сделав акцент на том, что для назначения лечения недостаточно выявления у больного антихламидийных иммуноглобулинов. Лечение антибактериальными и интерфероновыми препаратами необходимо начинать только тогда, когда будут обнаружены ДНК в мокроте, слюне больного, и при этом необходимо сочетание их с IgМ. Если же у больного определяются только высокоавидные IgG, количество которых не увеличивается через две недели, то этим больным с латентным течением заболевания лечения не назначают.
Затем докладчик коснулся вопроса антибиотикотерапии при респираторной патологии, констатировав, что в педиатрической практике в качестве препаратов первого выбора чаще всего используются лактамные антибиотики. Однако они не действуют на внутриклеточную флору, а наоборот, могут пролонгировать воспалительный процесс, способствовать его хронизации. Есть три антибиотика, которые действуют одновременно как на внеклеточную, так и на внутриклеточную флору (хламидии, микоплазма) — макролиды, тетрациклины и фторхинолоны. Поскольку тетрациклины и фторхинолоны для педиатров не показаны, препаратами выбора являются макролиды. Из их числа наиболее эффективен азитромицин (препарат создан в 1981 г.), в частности азитро Сандоз, который действует как на внеклеточную флору (Str.рneumoniae, пиогенный стрептококк, гемофильную палочку), так и на внутриклеточную (микоплазма и хламидии), на респираторные, урогенитальные инфекции и даже на хеликобактер. Кроме того, азитромицины имеют не только антибактериальную направленность, они являются препаратами комбинированного действия. В отличие от других макролидов азитро Сандоз очень быстро проникает в лейкоциты, посредством этих лейкоцитов адресно попадает в очаг воспаления и постоянно медленно там выделяется. В фармакокинетических исследованиях было установлено, что концентрация препарата азитро Сандоз в тканях значительно выше (в 50–100 раз), чем в плазме крови. Это уменьшает количество побочных эффектов и увеличивает его эффективность (табл. 2).

Таким образом, резюмировал Е.И. Юлиш, ввиду высокой активности азитромицина, и в частности препарата азитро Сандоз, по отношению к Streptococcus pneumoniae, бетагемолитическому стрептококку, стафилококку, моракселле, Haemophilus influenzaе, Mycoplasma, Chlamydia, то есть практически ко всему спектру этиологических причин, вызывающих внебольничные заболевания респираторного тракта, он является высокоэффективным лечебным средством в терапии ангин, отитов, синуситов, эпиглотита, пневмоний у детей различного возраста.
Отвечая на вопросы слушателей, Е.И. Юлиш, среди прочего, коснулся вопроса о нарушении проводимости вследствие приема макролидов и отметил, что у азитромицина это влияние наименьшее. По опыту работы в клинике, которой руководит профессор, не отмечено ни одного случая нарушения ритма у детей вследствие приема азитромицина.
Далее проф. А.Е. Абатуров представил лекцию «Применение аминокислотных комплексов в терапии острых респираторных заболеваний у детей». Он с сожалением констатировал, что к аминокислотам лечащие врачи относятся как к препаратам, выполняющим одну функцию — строительную, в то время как каждая аминокислота — это активное вещество, которое оказывает свое физиологическое действие, и это было понято в конце 50х годов прошлого века, когда была выяснена роль аминокислот в энергетическом обмене мозга. Было показано, что аминокислоты модулируют ДНКответ, транскрипцию, трансляцию, они изменяют практически все физиологические системы в зависимости от микроокружения, концентрации тех или иных аминокислот. Возникло представление, что каждая группа кислот является активной в определенных регионах, для определенных морфологических структур (рис. 2).
Было показано, что аминокислоты реализуют свое физиологическое действие через множество различных механизмов, основными из которых являются модуляция метаболических процессов, нормализация функционального состояния клеточных мембран, повышение энергетического статуса клеток и усиление адаптационных процессов.
Затем проф. А.Е. Абатуров перешел к рассмотрению оригинального аминокислотновитаминного препарата, который можно применять у детей, — мориамина форте. В производстве мориамина форте использована уникальная технология микрогранулирования, поэтому препарат обладает уникальным усвоением — 98 %.
Докладчик остановился на составе препарата (аминокислоты и витамины), уделив особое внимание рассмотрению входящих в его состав аминокислот (лейцин, лизин, фенилаланин, треонин, валин, триптофан и метионин).
В частности, он отметил, что функциональная активность TLR зависит от обеспеченности лейцином, поскольку в их эктодомене, участвующем в рекогниции PAMP, содержится большое количество лейциновых повторов. Повышение уровня лизина приводит к увеличению синтеза ИЛ10 (тем самым подавляется воспалительный процесс) и к снижению синтеза ИЛ12, ИЛ21, ИЛ23 и ИЛ6 (что способствует снижению воспалительного процесса). Дефицитарность лизина — один из факторов, который предрасполагает к низкоуровневому воспалению. Дефицитарность фенилаланина приводит к дефицитарности нормального стрессорного реагирования, его недостаток всегда ведет к развитию длительных нерегулируемых стрессорных реакций.
Треонин и валин — это две основные аминокислоты, без которых невозможно образование антител. Дефицит валина на 10 % приводит к образованию дефицита синтеза антител на 50 %. Недостаток триптофана грозит развитием функциональных иммунопатологических состояний. Метионин регулирует активность иммунной системы. Эти аминокислоты активно участвуют в эпигенетических воздействиях, особенно влияя на синтез дефензинов — порообразующих белков, обеспечивающих быструю неспецифическую защиту от бактерий.
Отметив, что препарат мориамин назначается при пневмонии, докладчик ознакомил аудиторию с результатами исследования влияния мориамина на течение бронхопневмонии у детей, а также рассмотрел положительное влияние приема препарата мориамин на иммунную систему. Он указал, что после курса препарата мориамин происходит восстановление содержания Т и Влимфоцитов (табл. 3–5).
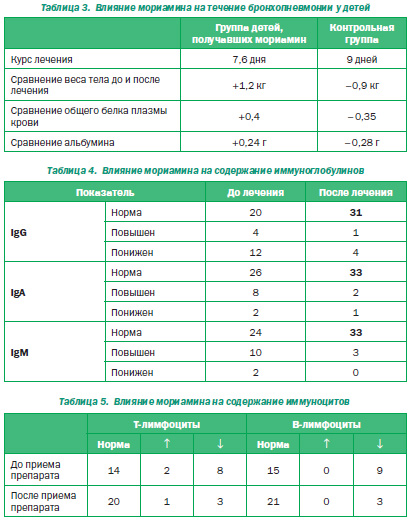
В заключение А.Е. Абатуров подчеркнул, что назначение витаминноаминокислотных комплексов у лиц с респираторной патологией, с частой респираторной патологией, при острых и хронических заболеваниях органов дыхания является необходимым компонентом общей терапии.
Тему острых респираторных заболеваний продолжила ведущий научный сотрудник отдела проблем аллергии и иммунореабилитации детей ГУ «Институт педиатрии, акушерства и гинекологии НАМН Украины», главный внештатный детский аллерголог МЗ Украины, д.м.н. Т.Р. Уманец, выступившая с докладом «Оптимизация лечения детей с ОРЗ». Она напомнила, что заболевания органов дыхания у детей традиционно остаются на первом месте среди всей патологии детского возраста. В Украине ежегодно респираторные инфекции переносят около 4 млн детей, преимущественно раннего возраста, т.е. практически каждый второй ребенок, причем наиболее высокий показатель отмечается у детей дошкольного и младшего школьного возраста. У детей очень часто респираторные реакции могут протекать с осложнениями — это поражения центральной нервной системы, дыхательной системы (бронхит, пневмония), а также осложнения со стороны лорорганов: практически у каждого третьего больного на фоне респираторной инфекции наблюдается клиника среднего отита, синусита. Ежегодно регистрируются случаи смертности от острых респираторных инфекций. По данным МЗ Украины за 2012 год, смертность от ОРИ составила 105 случаев, т.е. 0,22 на тысячу детского населения.
Высокая инфекционная заболеваемость детского населения является важным фактором риска формирования рецидивирующих и хронических заболеваний. Среди этих детей часто формируется группа ЧБД, на долю которых приходится от 15 до 50 % рецидивирующих ОРЗ. Если ребенок болеет больше 6 раз в год, как минимум средней степени тяжести, у него не успевает функционально восстановиться состояние иммунной системы, это приводит к срыву адаптационных механизмов, к снижению местного иммунитета, и формируется фон для повторных инфекций.
Несмотря на большой арсенал лекарственных средств для лечения ОРВИ у детей, отмечается недостаточная эффективность применяемых схем, о чем свидетельствует увеличение частоты повторного инфицирования дыхательных путей с развитием острого воспалительного процесса после окончания терапии, развитие побочных эффектов. Повторные ОРВИ изменяют реактивность детского организма и способствуют формированию хронических очагов инфекции, задержке физического и психомоторного развития, социальной дезадаптации детей. Наиболее частым проявлением респираторных инфекций у детей в пульмонологической практике является бронхит. Он занимает 5е место в структуре обращаемости к педиатрам на амбулаторном этапе.
Среди всех комбинированных препаратов, использующихся в детском возрасте, отдается предпочтение фитопрепаратам, поскольку они обладают низкой токсичностью, воздействуют на различные звенья патогенеза респираторной патологии (сочетают отхаркивающие, муколитические, противовоспалительные, местноанестезирующие, обволакивающие, противомикробные и противовирусные свойства), а также возможно их длительное применение без побочных эффектов.
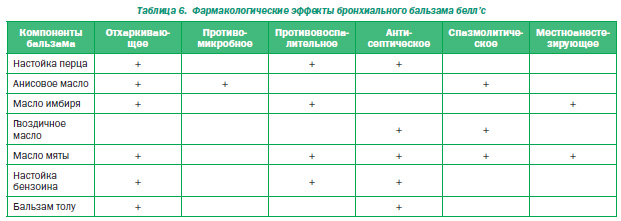
Т.Р. Уманец остановилась на одном таком препарате — бронхиальном бальзаме белл’с, который был создан в Англии еще в 1867 году. Это комбинированный препарат растительного происхождения для лечения кашля, который включает 2 основных и 5 дополнительных компонентов. Одним из основных компонентов является настойка перца, она усиливает регидратацию бронхиальной слизи, способствует отхождению мокроты. Второй компонент — анисовое масло, обладающее отхаркивающим, противомикробным, спазмолитическим действием. Из 5 дополнительных компонентов Р.Т. Уманец обратила особое внимание на бензоин (росный ладан, смола стиракса), оказывающий противовоспалительное, антисептическое, вяжущее, мочегонное, отхаркивающее действие, и бальзам толу (мироксилон, перуанский бальзам), который способствует отхождению мокроты, является антисептическим, отхаркивающим средством, входит в состав лекарств для лечения воспалительных заболеваний легких, гортани.
Препарат активирует секреторную функцию эпителия дыхательных путей; стимулирует функцию ворсинок эпителия, что позитивно влияет на экссудативную и пролиферативную фазы воспаления; разжижает густую мокроту и облегчает выход слизи из дыхательных путей. На слизистые оболочки глотки и бронхов он действует как местный антисептик; снижает тонус гладких мышц бронхиол и трахеи, увеличивает размер бронхиол, уменьшает отек слизистых оболочек (табл. 6).
Р.Т. Уманец познакомила слушателей с результатами исследования терапевтической эффективности и переносимости бронхиального бальзама белл’с у детей с ОРИ. В исследование были включены дети 3–14 лет (35 человек) с наличием катаральных явлений, выраженным кашлем, длительностью симптомов заболевания до постановки диагноза не более 3–4 дней. Критерием эффективности была регрессия основных клинических симптомов, которые регистрировались на 1, 3, 7 и 14й день.
Бальзам назначался: детям 3–6 лет — по 1 чайной ложке (5 мг); 6–12 лет — по 2 чайные ложки, старше 12 лет — по 3 чайные ложки (15 мг) каждые 2 часа 6 раз в сутки.
Такие симптомы, как субфебрилитет, боль в горле, слабость, уменьшались на третий день лечения, к 7му дню значительно уменьшались такие явления, как заложенность носа, кашель и хрипы. Параллельно с клиническими симптомами улучшались показатели клеточного состава мазков — отпечатков слизистой носа. Мониторинг клиникобиохимических показателей в процессе лечения с включением бальзама белл’с не выявил достоверно значимых побочных реакций. Всеми детьми отмечены хорошие вкусовые качества бальзама. У 71,4 % детей было отмечено полное выздоровление, у 22,9 % — улучшение (эпизодический кашель), и только у 5,7 % детей потребовалось усиление муколитической терапии и назначение антибактериальной. Проведенные исследования свидетельствуют о высокой терапевтической эффективности и хорошей переносимости препарата, что позволяет рекомендовать его включение в комплексную терапию острой респираторной патологии у детей.
В процессе обсуждения доклада поднимались проблемы, касающиеся терапии респираторных заболеваний: целесообразность назначения иммуностимуляторов (по мнению Р.Т. Уманец, у детей их нужно назначать с большой осторожностью), связь бронхообструкции с нерациональным использованием антибиотиков при вирусных инфекциях, проблема развития обструктивных бронхитов на фоне приема фитопрепаратов.
Проф. Е.И. Юлиш в докладе «Рациональная антимикробная терапия — профилактика антибиотикоассоциированных диарей у детей» продолжил тему антибиотикотерапии. Отметив, что широкое назначение антибиотиков имеет много побочных реакций, он рассмотрел антибиотикоассоциированную диарею (ААД), на которую приходится треть побочных реакций антибиотикотерапии. Он познакомил аудиторию с данными лаборатории, контролирующей рациональное использование антибиотиков в мире. На материале более 16 тысяч больных, применяющих антибиотики, было отмечено, что ААД наблюдается почти у 10 % детей и 15 % взрослых, причем наиболее уязвимы дети первых лет жизни. Антибиотикоассоциированная диарея вызывается: аминопенициллинами — в 20–30 % случаев, амоксициллином/клавуланатом — в 10–25 %, цефалоспоринами, преимущественно III поколения, — в 15–20 %, макролидами — в 2–5 % случаев. Докладчик сделал акцент на том, что в 1 % случаев антибиотикоассоциированная диарея осложняется развитием псевдомембранозного колита с язвеннонекротическим поражением кишки, что может привести к смертельному исходу.
Проф. Е.И. Юлиш осветил инфекционные и неинфекционные причины ААД. Неинфекционные причины — это мотилиноподобное действие антибиотиков (макролиды, клавулановая кислота) и угнетение нормальной кишечной микрофлоры. Инфекционной причиной является так называемая трудная клостридия, Clostridium difficile, ответственная за развитие 10–30 % случаев заболевания.
Частота носительства клостридий составляет 2–3 %. При госпитализации больных инфицированность возрастает пропорционально длительности пребывания пациентов в стационаре. За каждый день приема антибиотиков количество клостридий увеличивается на 3–5 %. В итоге у 25 % госпитализированных больных наблюдается наличие этого инфекционного агента, который может вызывать ААД и развитие певдомембранозного колита.
Далее Е.И. Юлиш обратился к проблеме лечения детей с внебольничными пневмониями. Остановившись на этиологии этого заболевания, он отметил, что возбудителями таких пневмоний преимущественно являются стрептококк (он наиболее часто вызывает пневмонию), гемофильная палочка, стафилококк, в то время как грамотрицательная флора при внебольничных пневмониях редка. В связи с этим докладчик коснулся вопроса о целесообразности назначения препарата цефтриаксон в качестве стартовой терапии при поступлении больного в стационар. Указав на болезненность инъекций цефтриаксона (его нужно вводить на лидокаине), он также отметил, что цефтриаксон — это цефалоспорин III поколения, к которому более чувствительна грамотрицательная флора, в то время как внебольничные респираторные инфекции вызываются преимущественно грамположительной флорой, на которую направленно действуют цефалоспорины I и особенно II поколения.
Е.И. Юлиш рассказал об опыте лечения внебольничных пневмоний в клинике, которой он руководит (600 больных). Как стартовый антибиотик используются цефалоспорины II поколения, в частности энтеральный пероральный антибиотик цефутил, к которому чувствительны стафилококки, стрептококки и который высокоустойчив к беталактамазам. Докладчик продемонстрировал эффективность препарата при лечении внебольничной пневмонии: на 7й день 95 % больных детей выписывают, потому что у них исчезает даже кашель (табл. 7).
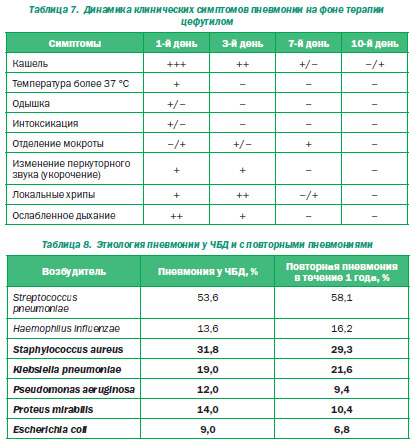
Затем Е.И. Юлиш остановился на категории часто и длительно болеющих детей, которые переносят пневмонии неоднократно. При наблюдении за 350 детьми было выявлено, что они в 3 раза чаще болеют респираторными заболеваниями, у них в 3,4 раза чаще имеют место бактериальные осложнения (синуситы, отиты), в 2,8 раза — пневмонии. Они в 4,2 раза чаще госпитализируются. Часто болеющие дети к 4 годам получают 3,20 ± 0,17 курса антибиотиков, и у них формируется резистентная флора. У часто попадающих в стационары остается немало стрептококка, но при этом увеличивается число стафилококка, а в 50 % случаев обнаруживается грамотрицательная флора: клебсиелла (у каждого пятого), синегнойная палочка, протей и даже Е.coli. И в этом случае цефалоспорины II поколения не срабатывают, необходимо применение препаратов III поколения (табл. 8).
Касаясь назначения цефалоспоринов III поколения, проф. Е.И. Юлиш порекомендовал врачам не назначать их внутримышечно. У препарата III поколения цефодокса биодоступность на уровне 90 %, так что болезненные инъекции цефтриаксона и прием цефодокса внутрь оказывают примерно одинаковый терапевтический эффект.
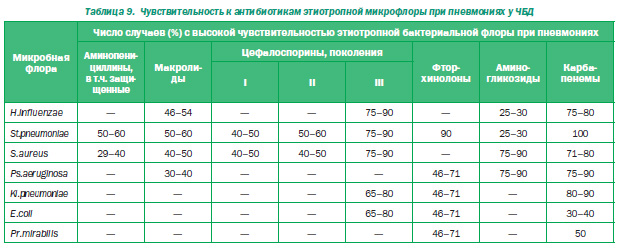
Затем докладчик рассмотрел чувствительность флоры часто болеющих детей к используемым антибиотикам. По данным исследования, проведенного в клинике, резко снижается чувствительность аминопенициллина, макролидов, цефалоспоринов I и II поколений, остается чувствительность к цефалоспоринам III поколения, к карбапенепам и (так как флора грамотрицательная) к аминогликозидам (табл. 9).
Далее проф. Е.И. Юлиш рассказал об опыте применения в терапии часто болеющих детей с бактериальным поражением перорального цефалоспорина ІІІ поколения цефодокса (цефподоксима проксетил). Этот препарат характеризуется минимальным количеством отрицательных побочных реакций. В частности, в отличие от других цефалоспоринов он не вызывает развития антибиотикоассоциированных диарей, связанных с клостридиями, потому что цефодокс — это пролекарство, которое в желудочнокишечном тракте расщепляется на цефподоксим и проксетил. Цефподоксим тут же всасывается, не влияя на флору кишечника, а значит, не способствует развитию клостридий и дисбиоза. Это свойство препарата обусловливает существенное снижение риска развития гастроинтестинальных осложнений и снижает риск развития антибиотикоассоциированной диареи.
Профессор познакомил аудиторию с результатами исследования количества антител к клостридиям при применении различных антибактериальных средств. До начала лечения цефтриаксоном количество антиклостридиальных антител отмечалось у 27 % больных, а после лечения их количество возросло до 45,4 % (в полтора раза), в то время как при применении цефутила, цефодокса и макролидов увеличения количества антител к клостридиям не происходит.
Докладчик отметил отличный эффект препарата при лечении пневмоний легкой и средней степени тяжести. Е.И. Юлиш рассказал о проведенных в 8 городах Украины многоцентровых исследованиях по применению цефодокса, причем во всех случаях отмечался его хороший эффект. На 10й день от начала заболевания прием антибиотика прекращали в связи с выздоровлением больных. Докладчик акцентировал очень хорошую (у 86,7 % детей) и хорошую (у 13,3 % детей) переносимость препарата, отсутствие аллергических реакций и нарушений со стороны желудочнокишечного тракта. Также он отметил позитивную эмоциональную реакцию пациентов и их родителей в связи с применением пероральной формы антибиотика.
Отвечая на вопрос об антибиотикотерапии при пневмонии у детей младшего возраста, проф. Е.И. Юлиш сделал особый акцент на важности хорошо поставленной диагностики на догоспитальном этапе, указав, что серьезные осложнения пневмонии — это зачастую проблема поздней диагностики, а не плохого лечения. В ответ на вопрос о применении пробиотиков (пребиотиков, симбиотиков) при лечении пневмоний он сообщил, что в их клинике при назначении антибиотиков подобные препараты не применяются, как и антигистаминные средства и витамины. Помимо антибиотиков применяются только муколитики, способные облегчить состояние больного.

Доклад «Диагностика и тактика ведения детей с функциональными гастроинтестинальными расстройствами» представила профессор кафедры педиатрии № 1 Донецкого национального медицинского университета им. М. Горького, д.м.н. Т.П. Борисова. Обращаясь к проблеме функциональных гастроинтестинальных расстройств, она сосредоточилась на двух формах — функциональный запор и абдоминальная боль, поскольку, по эпидемиологическим исследованиям, именно они встречаются наиболее часто.
С каждым годом количество больных с запором становится все больше. По исследованиям, проведенным в России, 53 % детей имеют признаки хронического запора. В 95 % случаев запор является функциональным, без органических изменений кишечника.
Т.П. Борисова коснулась вопроса терминологии, обратив внимание присутствующих на то, что в настоящее время изменились диагностические критерии функционального запора. Если в прошлом веке говорили, что запор — это прежде всего увеличение интервалов между актами дефекации, то по современным представлениям следует учитывать не только увеличение этих интервалов, но и недостаточное опорожнение кишечника и изменение формы и характера стула (1й и 2й тип по Бристольской шкале кала).
Докладчик остановилась на причинах возникновения запора у детей, в частности на психофизиологических, таких как подавление позыва на дефекацию вследствие боязни горшка, неврозы (социальная дезадаптация, личностные особенности); депрессивные состояния; отсутствие комфортных условий осуществления акта дефекации (в школе, детском саду). В связи с этим она коснулась вопроса о воспитании гигиенических навыков при естественных отправлениях у детей, напомнив, что родителям важно не переусердствовать в воспитательных действиях.
Гигиенические навыки при естественных отправлениях
- Родители могут начать обучение ребенка тогда, когда он может рассказать о своих нуждах, попросить о помощи, если он обмочился или запачкался, а также разобраться в простой системе поощрений.
- Отказ от памперсов — важный шаг в процессе обучения гигиеническим навыкам.
- Обучение ребенка следует проводить планомерно и целенаправленно на протяжении нескольких недель или месяцев.
- Как бы это ни обескураживало, ни надоедало или раздражало, обучиться этому ребенок может иногда лишь к 3 годам жизни.
- Союз педиатров России рекомендует приучать ребенка к горшку не ранее 18 месяцев.
Затем проф. Т.П. Борисова рассмотрела механизм запора и остановилась на двух проблемах, с которыми сталкивается больной с хроническими запорами, — каломазание и энкопрез (недержание кала).
Профессор изложила общие рекомендации при запоре, касающиеся модификации поведения ребенка (неторопливое посещение туалета, ведение стулового дневника, ведение календаря со стикерами, система награждений для ребенка), а затем коснулась принципов лекарственной терапии. Она отметила эффективность использования слабительных в достижении ремиссии (их применяют до установления регулярного пользования туалетом). Выделяют 4 группы слабительных средств: увеличивающие объем кишечного содержимого; размягчающие каловые массы; раздражающие или контактные; осмотические (соли магния, полиэтиленгликоль, лактулоза). При применении средства трех первых групп возникают побочные эффекты, развивается привыкание к препаратам, атония кишечника. На сегодня, отметила Т.П. Борисова, доказательная база (уровень доказательности А) существует только по осмотическим слабительным, в частности по лактулозе и полиэтиленгликолю.
Далее докладчик остановилась на предпочтительности назначения лактулозы при терапии запоров в связи с двояким эффектом ее применения: слабительным и пребиотическим. В результате того, что лактулоза достигает толстой кишки в неизмененном виде, сахаролитическая флора расщепляет лактулозу на органические кислоты (молочную, пировиноградную и др.). В результате наступает ацидификация содержимого толстой кишки, усиление роста сахаролитической флоры (лактобацилл, бифидобактерий), происходит стимуляция перистальтики толстой кишки. Бифидогенные эффекты лактулозы доказаны многочисленными исследованиями. В рандомизированом исследовании было доказано, что на 28й день после получения препарата лактулозы у пациентов улучшается кишечный биоценоз, а именно увеличивается количество бифидобактерий.
Доза лактулозы у каждого ребенка индивидуальна, ее нужно подбирать, каждые три дня увеличивая дозировку препарата. Как только появился регулярный стул 3го и 4го типа по Бристольской шкале кала, доза считается лечебной, она может быть применена в течение 4 недель, а затем больной переводится на половинную дозу. Препараты осмотического характера можно отменить только после того, как у ребенка появится регулярный стул без трудностей.
Затем проф. Т.П. Борисова приступила к рассмотрению абдоминальной боли. Она подробно остановилась на диагностических критериях синдрома раздраженного кишечника (СРК) и принципах его лечения. Помимо диеты, больным назначаются селективные миотропные спазмолитики, из которых ведущим является мебеверин, не имеющий побочных эффектов и не снижающий тонус кишки; противодиарейные средства при диарее и осмотические слабительные при запоре (рис. 2).
Далее профессор остановилась на критериях диагностики и принципах лечения функциональной диспепсии. Она подчеркнула роль психологический поддержки детей с данным заболеванием. Что касается лекарственной терапии, то к статистически достоверному улучшению симптомов у 92 % больных приводит использование минимикросфер панкреатина.
В заключение Т.П. Борисова сделала акцент на том, что у 25 % тех, кто страдал функциональными запорами в детстве, во взрослом возрасте формируется хроническая органическая патология толстого кишечника, и задача врачей — предотвратить перерастание функциональных расстройств в органические.
Отвечая на вопросы слушателей, Т.П. Борисова осветила синдром циклической рвоты, который на сегодня вынесен в группу функциональных расстройств. В его основе — особенности системы метаболизма у данного ребенка (особая активность ацетилКоА). Такие дети не должны испытывать голод (у них не должна возникать гипогликемия), и у них нужно найти и исключить провоцирующие факторы (например, так называемый синдром дня рождения).
Последним прозвучал доклад профессора кафедры детских и подростковых заболеваний Национальной медицинской академии последипломного образования имени П.Л. Шупика Г.В. Бекетовой «Небулайзерная терапия — современный метод лечения заболевания органов дыхания в детском возрасте». Она рассмотрела ингаляционную терапию как один из основных методов лечения острых респираторных инфекций и их осложнений, в частности, остановилась на таком способе ингаляционной терапии, как использование небулайзеров.
Для небулайзеров характерны эффективное создание высоких концентраций лекарств в дыхательные пути; малая концентрация препарата в крови (а это минимум системных побочных эффектов); быстрое начало действия и возможность коррекции дозы препарата. Золотым стандартом ингаляционной терапии считается применение небулайзеров компрессионного типа, преобразующех жидкие лекарства в сверхмелкодисперсный аэрозоль (с определенными характеристиками) под действием струи воздуха. Для эффективной ингаляционной терапии чрезвычайно важно, чтобы скорость потока частиц аэрозоля оставалась неизменной. Количество вещества, которое распространяется по дыхательным путям, должно оцениваться не в целом, а по отдельным областям — в носоглотке, бронхах, легких.
Докладчик обобщила преимущества ингаляционной терапии через небулайзер:
- простота и удобство применения;
- не нужна координация вдоха и ингаляции;
- легко выполнима для маленьких детей и тяжелобольных (астматический статус);
- отсутствие фреона и других пропеллентов;
- возможность введения высоких доз препарата локально, что значительно уменьшает риск системных побочных эффектов;
- возможность включения в контур подачи О2 или в контур аппарата для искусственной вентиляции легких;
- создание аэрозоля с оптимальным размером частиц бронхолитика.
Затем Г.В. Бекетова акцентировала внимание присутствующих на небулайзере компрессионного типа «Юлайзер» (это отечественный аппарат фирмы «ЮрияФарм»). Докладчик подробно рассмотрела три аппарата фирмы — Ulaizer Pro, Ulaizer First Aid и Ulaizer Home.
Ulaizer Pro — компрессорный небулайзер для профессионального использования в различных отделениях клиники: пульмонологии, терапии, педиатрии, неонатологии, аллергологии, физиотерапии. Он отвечает всем европейским стандартам небулайзерной терапии, универсален, может использоваться для всех возрастных групп.
Ulaizer First Aid — компрессорный небулайзер для бригад скорой медицинской помощи, прежде всего бригад неотложной помощи, неонатологической службы, педиатрической службы, но также может использоваться в домашних условиях.
Ulaizer Home — компрессорный небулайзер для использования: в домашних условиях для всей семьи, может использоваться в путешествиях, командировке, на отдыхе, его особенность — очень широкий спектр набора аксессуаров для проведения процедуры, 5 сменных фильтров. Она отметила также, что существенным преимуществом юлайзеров является доступная цена.
Показаниями для проведения небулайзерной терапии являются практически все заболевания органов дыхания: ОРИ, острый стенозирующий ларингит, бронхообструктивный синдром, ХОЗЛ, обострение и тяжелое течение бронхиальной астмы, бронхоэктатическая болезнь, муковисцидоз, туберкулез легких, бронхит и пневмония.
Проф. Г.В. Бекетова рассмотрела лекарственные средства для небулайзерной терапии: бронхолитики и стабилизаторы мембран тучных клеток (небутамол — первый отечественный сальбутамол для ингаляций в однодозовых контейнерах, фенотерол, ипратропия бромид); муколитики (амброксол, ацетилцистеин, содабуфер); антисептики (в частности, декасан — первый отечественный ингаляционный антисептик в однодозовых контейнерах); антибактериальные средства (ацетилцистеин с тиамфениколом, тобрамицин, пентамидин); противовоспалительные препараты/топические ГКС (будесонид, флютиказон); иммуномодуляторы (интерферон человеческий лейкоцитарный); противовирусные препараты (в частности, отечественный препарат АКК — аминокапроновая кислота); противотуберкулезные препараты.
Далее она отметила преимущества индивидуальных наборов для небулайзерной терапии, которые нивелируют риск контаминации микроорганизмами.
В заключение Г.В. Бекетова еще раз сделала акцент на том, что небулайзеры компрессорного типа производства «ЮрияФарм» обеспечивают безопасное и эффективное ингаляционное лечение острых и хронических заболеваний верхних и нижних дыхательных путей у детей и подростков.
Отвечая на вопросы, Г.В. Бекетова коснулась вопроса о показаниях и противопоказаниях к терапии небулайзерами, а также отличий небулайзеров компрессионного и ультразвукового типа (последние инактивируют действие многих лекарственных средств).

В завершение конференции проф. Е.И. Юлиш предоставил слово организатору Викторовских чтений А.Ю. Заславскому, шефредактору журнала «Здоровье ребенка». А.Ю. Заславский поблагодарил докладчиков и слушателей конференции, а также осветил ряд организационных вопросов, связанных с возможностью участия в программе последипломного дистанционного образования АМО Украины.
Работа конференции прошла в дружественной атмосфере, лекции и доклады ведущих ученых Украины вызывали интерес у слушателей, после их завершения возникало заинтересованное общение докладчиков и слушателей, в процессе которого дополнительно освещались вопросы, касающиеся особенностей применения лекарственных препаратов в практике педиатрии. Следует также отметить, что каждый участник данной конференции получил сертификат участника Викторовских чтений, который принесет ему 0,4 балла для аттестации.
Подготовила Л.В. Карбовская