Газета «Новости медицины и фармации» 14 (465) 2013
Вернуться к номеру
Досвід використання бетаметазону для лікування пацієнтів у критичному стані
Авторы: Павлов О.О., Кабаков Б.О., Тимченко М.Є. - Харківська медична академія післядипломної освіти, кафедра анестезіології, інтенсивної терапії, трансфузіології та гематології
Рубрики: Анестезиология-реаниматология
Разделы: Клинические исследования
Версия для печати
Загальноприйнятою є думка, що неконтрольоване системне запалення є джерелом для прогресування поліорганної дисфункції і смерті [1].
Контроль запалення включає складну взаємодію між нейроендокринною та імунною системами [37]. На клітинному рівні дві біологічно дуже активні системи тісно взаємодіють для підтримки гомеостазу. Система ядерного фактора каппа В (NF-kB) сприяє вивільненню прозапальних медіаторів, тоді як комплекс глюкокортикоїдних рецепторів альфа (G-GRa) інгібує запалення [5]. Ці дві системи знаходяться у всіх клітинах і в стані спокою інактивовані. Поки ці дві системи однаково протидіють одна одній, підтримується гомеостаз. Будь-який дисбаланс на користь NF-kB призведе до неконтрольованого запалення. Існує достатньо доказів того, що такий дисбаланс може виникнути в умовах сталого стресу.
Було показано, що великі хірургічні втручання, такі як торакоабдомінальні операції, призводять до післяопераційної відносної недостатності надниркових залоз, що проявляється високим рівнем циркулюючих прозапальних медіаторів із подальшим розвитком поліорганної дисфункції [17]. Дуже схожі результати були отримані в пацієнтів із політравмою, опіками, після кардіохірургічних або гепатохірургічних втручань [14]. Так звана відносна недостатність надниркових залоз спричиняє прогресування критичних захворювань і в кінцевому підсумку призводить до смерті [24]. Зокрема, у пацієнтів зі стійким респіраторним дистрес-синдромом або септичним шоком. Гіперактивність NF-kB щодо G комплексу G-GRa спричиняє пошкодження клітин, тканин і органів. Механізми, що лежать в основі індукованої надниркової недостатності при критичних станах, були детально розглянуті у світовій літературі [33]. Крім зміни метаболізму кортизолу внаслідок анатомічних ушкоджень гіпоталамо-гіпофізарно-надниркової системи та фармакологічно індукованих змін, існує третій шлях: цитокін-індукована гіперактивність індуцибельної ізоформи синтази оксиду азоту (iNOS) запускає нейроендокринний апоптоз клітин і викликає резистентність до адренокортикотропного гормону (АКТГ) і глюкокортикоїдів (ГК).
Навіть при підвищених концентраціях кортизолу в плазмі може спостерігатися відносна локальна недостатність кортизолу в місцях запалення (синдром кортикостероїдної резистентності) як наслідок: 1) недостатності кортико-стероїд-зв’язуючих глобулінів; 2) активації 11-b-гідроксистероїддегідрогенази (тип 2); 3) депресії глюкокортикоїдних рецепторів; 4) зменшення спорідненості до рецептора кортизолу; 5) підвищення кількості антиглюкокортикоїдних сполук або рецепторів [21].
Дію глюкокортикоїдів пояснюють геномними та негеномними ефектами. Упродовж кількох хвилин після введення спостерігаються негеномні ефекти, що включають зниження агрегації тромбоцитів, клітинної адгезії та рівня внутрішньоклітинних фосфотирозинових кіназ та підвищення екстерналізації алексину-1 [22]. Ці ефекти є наслідком взаємодії глюкокортикоїдів із специфічними ділянками клітинної мембрани [28]. Геномні ефекти поділяють на непрямі та прямі. Непрямі геномні ефекти, які відбуваються в перші декілька годин після впливу глюкокортикостероїдів, призводять до зупинки синтезу майже всіх прозапальних медіаторів. Прямі геномні ефекти розвиваються впродовж декількох днів й полягають у складному процесі активізації ключових протизапальних факторів, таких як фагоцитоз, хемокінез та антиоксидантні реакції. Поширеною є думка, що глюкокортикоїди не стільки пригнічують імунні клітини, скільки репрограмують їх дії [11].
Механізми кардіоваскулярних ефектів глюкокортикоїдів мало вивчені. ГК викликають затримку натрію через глюко- та мінералокортикоїдні рецептори, таким чином сприяючи корекції гіповолемії та низького тонусу периферичних судин [7]. Негеномні ефекти ГК сприяють відновленню чутливості судин до альфа-агоністів, що супроводжується збільшенням артеріального тиску та судинного опору. Відновлення судинної реакції на вазопресори вірогідно корелює з інтенсивністю дисбалансу активності між NF-kB і G-GRa. Кортикостероїди практично не впливають на мале коло кровообігу та на серцевий індекс [17].
Кортикостероїди можуть як запобігти органній дисфункції, так і зменшити її інтенсивність за рахунок зниження запалення тканин, запуску регенеративних процесів і поліпшення тканинної перфузії. Наприклад, у пацієнтів із гострим респіраторним дистрес-синдромом екзогенне введення кортикостероїдів повністю блокувало NF-kB в легенях. У пацієнтів із септичним шоком глюкокортикоїди інгібують вивільнення фактора некрозу пухлини альфа [27], лікування гідрокортизоном повністю інгібує активність NF-kB в периферичних мононуклеарних клітинах. Кортикостероїди зменшують активність ниркової синтази оксиду азоту після ендотоксемії, що запобігає гіпоксичній травмі мозку та відновлює нирковий метаболізм кисню [15]. Крім того, у пацієнтів із септичним шоком кортикостероїди поліпшували проникність клубочкового ендотелію [34]. Позитивний вплив кортикостероїдів на перфузію органів також було показано для серця [13] і мозку [38].
Кортикостероїди та септична летальність
Фундаментальна роль глюкокортикоїдів у стресовій відповіді на інфекцію і збільшення знань про їх протизапальну й імуносупресивну фармакодинамічні дії були обґрунтуванням для їх використання у клінічних випробуваннях із лікування сепсису протягом десятиліть. Терміни, дози і тривалість глюкокортикоїдної терапії були адаптовані до різних захворювань та патофізіологічних моделей, що, імовірно, справляло великий вплив на результати [23]. Кілька рандомізованих контрольованих досліджень однозначно показали, що короткочасне (від 1 до 2 днів) введення високих доз глюкокортикоїдів, еквівалентних 40 г гідрокортизону на добу, на початку септичного шоку не впливало на результат або навіть підвищувало летальність за рахунок імуносупресії і збільшення частоти вторинних інфекцій [40]. Тільки одне дослідження показало початкове поліпшення виживаності та поліпшення клінічної картини шоку при застосуванні високих доз метилпреднізолону, але з урахуванням вторинних ускладнень відмінності більше не були значущими [36].
На відміну від цих старих підходів, останні рандомізовані контрольовані дослідження показали, що тривале (5 днів і більше) введення низьких доз гідрокортизону (240–300 мг на день) у ранній або пізній період септичного шоку покращує клінічний перебіг [8] і зменшує летальність [2]. Ці результати узгоджуються з концепцією порушення функції надниркових залоз під час шоку [23].
Dider Keh et al. доведено, що постійна інфузія низьких доз глюкокортикоїдів відновлює гемодинамічну стабільність та диференційно модулює імунологічну відповідь на стрес, пригнічуючи запальні процеси без істотної імуносупресії [18].
При дослідженні терапевтичного ведення відносної надниркової недостатності або неналежного надниркового резерву вивчалася доцільність застосування малих, або так званих стрес-дозувань, кортизолу як додаткової терапії при септичному шоці й тяжкому сепсисі. Теоретичним обґрунтуванням була здатність кортизолу відновлювати судинні реакції на катехоламіни в дорослих із септичним і геморагічним шоком. Огляд семи таких досліджень у цілому підтверджує перевагу стрес-доз кортизолу в прискоренні досягнення гемодинамічної стабільності в умовах септичного шоку у дорослих [2, 6, 9, 19, 29, 30, 39].
Значуще дослідження низьких доз гідрокортизону та флудрокортизону у дорослих (n = 299) із септичним шоком було проведено у Франції [4]. Ця робота відродила інтерес до ендокринології та обміну речовин в галузі медицини критичних станів. Результати дослідження показали швидшу інволюцію септичного шоку й органної дисфункції в цілому для суб’єктів, які отримують замісну стероїдну терапію. Крім того, значне зниження смертності (~ 20 %) було зареєстроване в пацієнтів, у яких D кортизол < 9 мкг/дл (кортикотропін-стимульований кортизон мінус базальний) при включенні в дослідження. На жаль, результати цього дослідження були визнані невірогідними, бо значна кількість хворих була інтубована за допомогою етомідату [3], який інгібує 11-b-гідроксилазу, що обмежує швидкість синтезу кортизолу. Результатом дискусії стала рекомендація припинити використання етомідату у відділеннях інтенсивної терапії.
Із припущенням, що стрес-дози кортизолу можуть бути доцільними для дорослих із септичним шоком [4], було розроблене міжнародне дослідження CORTICUS. Воно достроково припинене після вивчення близько 500 пацієнтів. Кортизол (без флудрокортизону) або плацебо призначали по 50 мг внутрішньовенно кожні 6 годин протягом 5 днів із наступним швидким припиненням прийому. Хоча інволюція шоку настала скоріше в групі кортикостероїдів (3,1 проти 5,7 дня), користі з точки зору зниження смертності відзначено не було як для загальної когорти, так і для пацієнтів із D кортизолом < 9 мкг/дл. Частота внутрішньолікарняних інфекцій, повторного сепсису або септичного шоку і гіперглікемії була значно більшою в групі гідрокортизону.
За даними метааналізу дослідження 505 дорослих пацієнтів із сепсисом, включених до випробувань із замісної глюкокортикостероїдної терапії до початку CORTICUS, низькі дози кортикостероїдів можуть зменшити дози симпатоміметиків та інотропів і прискорити розрішення шоку.
Інший метааналіз до початку дослідження CORTICUS засвідчив, що: 1) короткострокові курси високих доз глюкокортикоїдів знижують виживання, а отже, не рекомендуються для лікування тяжкого сепсису; 2) 5–7-денний курс низьких доз кортизолу із швидкою відміною покращує виживання і прискорює інволюцію шоку для дорослих із залежним від симпатоміметиків/інотропів септичним шоком; 3) за відсутності потреби в симпатоміметичній підтримці кортикостероїди не повинні використовуватися для лікування сепсису [19].
Неодноразово було показано, що скоріше розрішення септичного шоку пов’язане з поліпшенням результатів лікування [2, 6, 8, 19, 29–31]. Тим не менше швидше розрішення шоку не обов’язково корелює зі зниженням смертності [20].
Дані метааналізу 2009 року [25] оновлюють попередній аналіз вивчення терапії стероїдами при сепсисі. Пошук літератури з 2004 по 2008 рік визначив сім рандомізованих контрольованих досліджень у дорослих пацієнтів, вони були додані до 14 раніше виявлених випробувань. Ефекти стероїдів на смертність сильно варіювали між 21 випробуванням. У дослідженнях, результати яких опубліковані до 1989 року, короткі курси високих доз стероїдів збільшували смертність. Під час випробувань, результати яких опубліковані після 1997 року, більш тривалі курси низьких доз стероїдів призводили до швидшого розрішення шоку, але продемонстрували більш різнорідний вплив на смертність. Обернена лінійна залежність між тяжкістю хвороби й ефектами стероїдів на смертність була визначена у всіх випробуваннях. У підгрупі випробувань, результати яких опубліковані після 1997 року, стероїди були більш шкідливими в менш тяжкохворих і кориснішими в більш тяжкохворих пацієнтів. В останніх не було залежності від впливу АКТГ-стимуляції на частоту виникнення побічних дій глюкокортикостероїдної терапії. Низькі дози стероїдів знижують смертність у пацієнтів із септичним шоком, які мають високий ризик смерті, однак додаткові випробування в цій субпопуляції необхідні, щоб остаточно визначити роль малих доз стероїдів при сепсисі.
За даними Surviving Sepsis Campaign, низькі дози кортикостероїдів були пов’язані із зростанням госпітальної летальності [9]. Проте є деякі сумніви щодо цих висновків [10].
У той час як кортикостероїди незмінно покращують виживання тварин з ендотоксиновим або септичним шоком, клінічні дослідження показали суперечливі результати. Тим не менше недавній аналіз наявних рандомізованих досліджень (із застосуванням частотного та Байесівського аналізів) засвідчив, що низькі дози кортикостероїдів покращували виживання [16].
Таким чином, питання використання терапії ГК у пацієнтів із сепсисом неоднозначне. Поки неясно, чи існує чітке зниження смертності, але скорочення часу розрішення шоку є послідовним результатом [34].
Бетаметазон
Більшість досліджень використовують гідрокортизон як найближчий синтетичний аналог кортизолу. Проте дексаметазон та бетаметазон мають у 30 разів більшу глюкокортикоїдну активність. За даними останніх міжнародних рекомендацій щодо ведення пацієнтів із септичним шоком, хворим із САТ < 90 мм рт.ст. [12] показане внутрішньовенне введення кортикостероїдів, наприклад гідрокортизону в добовій дозі більше ніж 300 мг.
З огляду на значно більшу протизапальну активність та відсутність мінералокортикоїдного ефекту в синтетичних кортикостероїдів, ми вирішили використовувати декса- та бетаметазон з поступовим зменшенням доз, так що загальний курс становив один тиждень. Бетаметазон є правообертальним ізомером дексаметазону та має вищу біодоступність.
Мета дослідження — порівняти ефективність додаткової терапії дексаметазоном та бетаметазоном у пацієнтів із сепсисом при неефективності інфузійної терапії та симпатикоміметичної резистентності. Визначити ефективність малих доз кортикостероїдів для подолання симпатикоміметичної резистентності.
Матеріали та методи дослідження
Із пацієнтів, які перебували у відділеннях нашої клінічної бази з діагнозом септичного шоку ІІ ступеня тяжкості, була сформована вибірка з 30 пацієнтів із сепсисом, розбита на 3 групи. Розподіл пацієнтів в ту чи іншу групу проведений методом рандомізації. Був використаний генератор випадкових чисел для отримання ряду, відповідно до якого кожному пацієнту призначалась одна з доз дексаметазону (4 мг) або Бетаспану (4 мг), третя група — контрольна. Були вивчені вибірки 3 груп:
- 1-ша група (10 хворих) — для підтримки гемодинамічного профілю при неефективності навантажувальної інфузійної терапії та зростанні доз симпатоміметиків внутрішньовенно вводили 4 мг дексаметазону;
- 2-га група (10 осіб) — при аналогічній неефективності терапії внутрішньовенно вводили 4 мг Бетаспану;
- 3-тя група (10 пацієнтів) — контрольна.
Пацієнти, які померли упродовж 7 діб від часу діагностування септичного шоку, були виключені з дослідження.
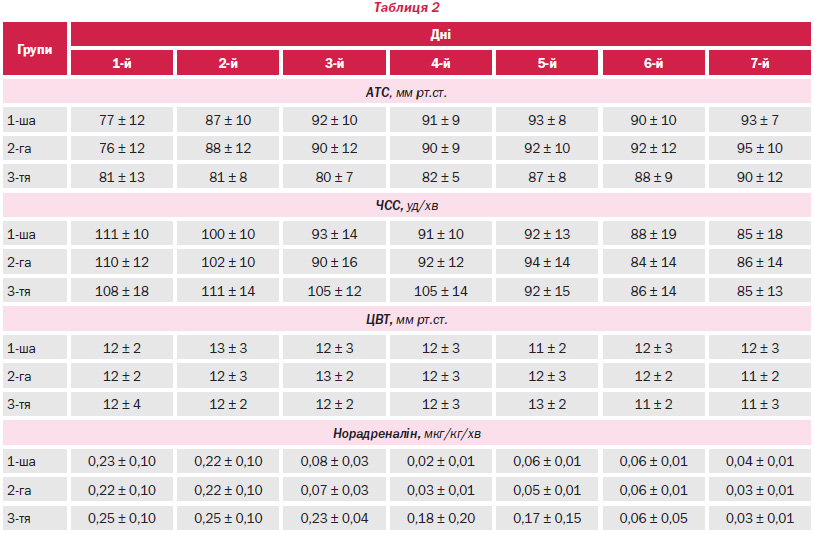
Дослідженню підлягало визначення динаміки артеріального тиску середнього (АТС, мм рт.ст.), числа серцевих скорочень (ЧСС, уд/хв), центрального венозного тиску (ЦВТ, мм рт.ст.) та ефективної дози норадреналіну (мкг/кг/хв).
Статистичний аналіз отриманих даних включав описову статистику за кожним досліджуваним показником, а також перевірку гіпотези про статистичну значущість відмінності середніх значень 2 груп за допомогою критерію Стьюдента при р < 0,05. Для порівняння частот ускладнень були розраховані частотні характеристики вибірок в обох групах, відносний ризик і 95% довірчий інтервал. Уся процедура обробки даних виконана з використанням програмного пакета Microsoft Office Excel 2007.
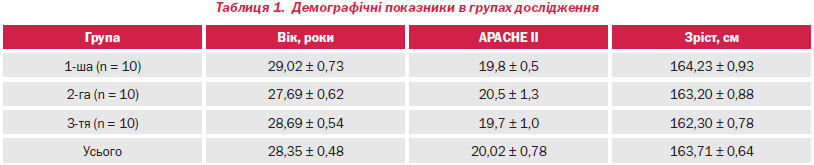
Між групами не було знайдено статистично значимої відмінності середніх значень показника віку, статі, значень за шкалою APACHE ІІ, часу між діагнозом септичного шоку та включенням у дослідження, супутніми хворобами, джерелом інфекції та бактеріологічними результатами. Демографічні показники подані в табл. 1.
Усім пацієнтам проводилась інфузійна терапія згідно з рекомендаціями Surviving Sepsis Campaign 2012 [31]. Додатково в 1-й групі дослідження кожні 6 годин вводили дексаметазон у таких дозах: 8 мг протягом перших 3 діб, 4 мг протягом наступних 2 діб та 2 мг протягом заключних 2 діб. У 2-й групі додатково вводили кожні 6 годин бетаметазон у таких дозах: 4 мг протягом перших 3 діб, 2 мг протягом наступних 2 діб та 1 мг протягом заключних 2 діб. Терапія глюкокортикостероїдами супроводжувалася значною стабілізацією гемодинаміки у вигляді збільшення (р = 0,00424) АТС на 7,5 ± 2,0 % та супутнього зниження (р = 0,00812) частоти серцевих скорочень на 16,6 ± 4,0 % у період із другої по шосту добу (табл. 2).
Починаючи з 3-ї доби в 1-й та 2-й групі потреба в норадреналіні знизилася на 32,4 ± 2,0 % (р = 0,00231), цей ефект зберігався впродовж 3 діб, поки групи не зрівнялися між собою за потребою в норадреналіні на шосту добу. На 7-му добу в 1-й групі 7 із 10 пацієнтів не потребували інфузії норадреналіну, у 2-й групі інфузії норадреналіну не потребували 8 із 10 пацієнтів, а в 3-й — 5 із 10 пацієнтів (p = 0,15).
Висновки
Дослідження показало, що застосування кортикостероїдів у пацієнтів із тяжким септичним шоком у режимі низьких доз упродовж 7 діб із поступовим зменшенням добової дози призводить до більш швидкого його розрішення.
Застосування низьких доз кортикостероїдів сприяє подоланню резистентності до пресорних гормонів та інфузійної терапії, що виникає в пацієнтів із септичним шоком; зменшує потребу у введенні пресорних гормонів, що зумовлено їх властивістю відновлювати чутливість адренорецепторів до катехоламінів.
При порівнянні ефективності двох кортикостероїдних препаратів дексаметазону та його правообертального ізомеру бетаметазону різниці не було виявлено. В обох групах спостерігались однакові ефекти, що описані вище. Виявлена лише різниця в добовій дозі, яка була менша в групі бетаметазону у 2 рази порівняно з дексаметазоном.
Таким чином, пацієнтам із септичним шоком при неефективності інфузійної терапії та розвитку симпатикоміметичної резистентності рекомендується введення бетаметазону кожні 6 годин у таких дозах: 4 мг протягом перших 3 діб, 2 мг протягом наступних 2 діб та 1 мг протягом заключних 2 діб.
Список літератури знаходиться в редакції