Газета «Новости медицины и фармации» Неврология (469) 2013 (тематический номер)
Вернуться к номеру
Простое слепое рандомизированное плацебо-контролируемое исследование эффективности применения тразодона для коррекции аффективных расстройств у больных с алкогольной зависимостью в ремиссии
Авторы: Крупицкий Е.М., Ериш С.М., Рыбакова К.В., Киселев А.С., Бернцев В.А., Торбан М.Н., Ерошин С.П., Ерышев О.Ф. - Санкт-Петербургский научно-исследовательский психоневрологический институт им. В.М. Бехтерева, Россия
Разделы: Клинические исследования
Версия для печати
Алкоголизм является важной медикосоциальной проблемой, актуальность которой обусловлена как стабильно высоким уровнем распространенности этого заболевания [3], так и его негативными социальными последствиями.
Антидепрессанты широко используются в лечении зависимости от алкоголя [5, 11]. Клинические и нейрохимические исследования представляют убедительные свидетельства того, что расстройства тревожнодепрессивного спектра, являясь широко распространенным психопатологическим феноменом при алкоголизме, патогенетически обусловлены и нередко являются одним из проявлений патологического влечения к алкоголю [2, 27].
Полученные в ряде исследований противоречивые данные относительно эффективности селективных ингибиторов обратного захвата серотонина при алкоголизме [4, 18, 22, 24] определили целесообразность изучения эффективности тразодона — антидепрессанта бициклической структуры, представителя группы SARI (ингибитора обратного захвата серотонина и антагониста 2Арецепторов серотонина). Исследований эффективности данного препарата при алкогольной зависимости с коморбидной аффективной патологией, отвечающих критериям доказательной медицины, в литературе мы не нашли. Результаты зарубежных исследований структурно близкого к тразодону и обладающего тем же механизмом действия антидепрессанта нефазодона оказались неоднозначными. C.A. HernandezAvila et al. [17] и E.S. Brown et al. [9] выявили снижение уровня депрессии и тревоги у пациентов, получающих нефазодон, а также сокращение дней потребления алкоголя у зависимых от него пациентов с коморбидной депрессивной патологией.
В исследовании P.P. RoyByrne et al. [26] нефазодон, с одной стороны, проявил себя как безопасный и эффективный антидепрессант, снижающий уровень депрессии у коморбидных больных, однако с другой — не оказывал статистически значимого влияния на потребление алкоголя по сравнению с группой плацебо.
В некоторых других исследованиях эффективность нефазодона при алкоголизме также была поставлена под сомнение [16, 19, 30].
Следует отметить, что негативные результаты были получены в исследованиях нефазодона, для которых больные алкоголизмом были рекрутированы из общей популяции без учета наличия коморбидных аффективных расстройств.
Некупированные коморбидные депрессия и тревога, а также повышенная импульсивность и эмоциональная лабильность, являясь ведущими симптомами периода становления ремиссии, провоцируют наступление рецидива алкогольной зависимости. В связи с этим использование антидепрессантов с седативным компонентом действия, в частности тразодона, представляется перспективным.
Вышесказанное обусловило целесообразность исследования тразодона как средства коррекции аффективных нарушений и профилактики рецидивов алкоголизма.
Материал и методы
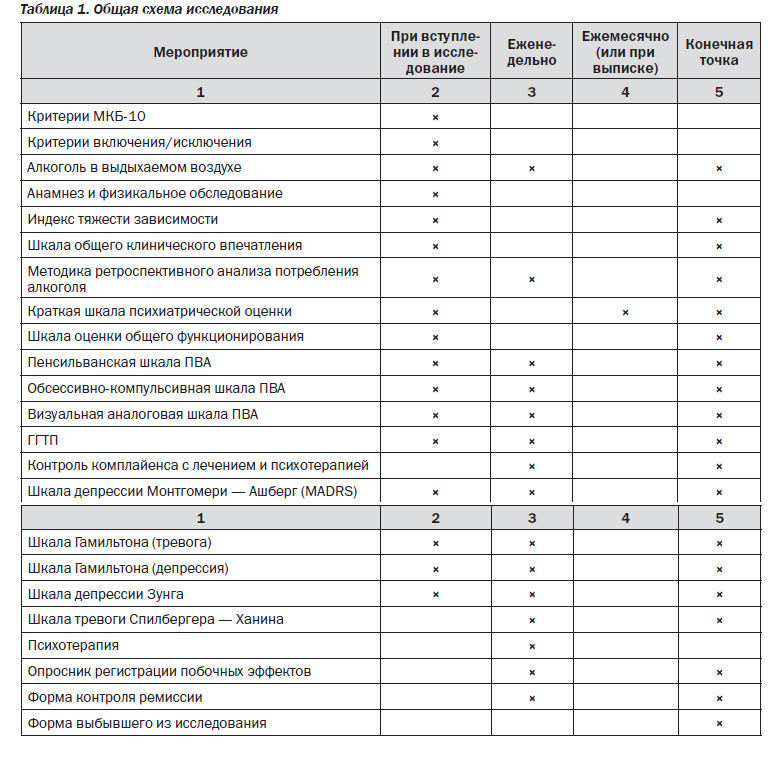
Общий дизайн исследования. В рамках одинарного (простого) плацебо-контролируемого исследования больные с алкогольной зависимостью (61 человек) с коморбидными аффективными расстройствами были в случайном порядке распределены на 2 группы: больные основной группы (30 человек) получали тразодон однократно вечером 150 мг/сут, больные группы сравнения (контрольной группы, 31 человек) получали идентично выглядящее плацебо. Исследуемый препарат назначался на 3 месяца (12 недель), в течение которых испытуемые еженедельно должны были посещать исследовательский центр для конт-роля ремиссии, комплайенса приема препаратов (по подсчету непринятых таблеток), а также для психометрических оценок.
Испытуемые. В исследование включались мужчины и женщины в возрасте от 18 до 50 лет с отрицательным тестом на алкоголь в выдыхаемом воздухе, имевшие диагностированную согласно критериям МКБ-10 алкогольную зависимость в сочетании с аффективными расстройствами — депрессивным эпизодом (F32.0), умеренным депрессивным эпизодом (F32.1) или рекуррентным депрессивным расстройством (F33.x); воздерживавшиеся от употребления алкоголя не менее 7 дней (купированный алкогольный абстинентный синдром). В исследование включались только больные с депрессией легкой или средней степени выраженности (от 8 до 18 баллов по шкале депрессии Гамильтона). Критерием включения для женщин было также отсутствие текущей беременности и согласие использовать адекватные способы конт-рацепции в период участия в исследовании. Все больные включались в исследование при условии наличия контактного номера телефона — для осуществления катамнестического наблюдения (соблюдения еженедельного графика визитов в клинику).
В исследование не включали больных, использующих какие-либо иные психотропные препараты. Кроме того, в исследование не включали больных с выраженным органическим поражением головного мозга, выраженной соматической патологией (патология печени, почек, сердечно-сосудистой, нервной системы), психотическим состоянием или тяжелым психическим заболеванием в анамнезе (шизофрения, эпилепсия, биполярное аффективное расстройство и т.п.), с какой-либо иной химической зависимостью, кроме зависимости от алкоголя и табака, а также получающих какую-либо иную фармако- или психотерапию в связи с зависимостью от алкоголя, в том числе так называемую «плацебо-опосредованную суггестию» («химзащиту»), «кодирование» и т.п.
Набор участников и клиническая база. Исследование проводилось на базе отдела наркологии НИПНИ им. В.М. Бехтерева. После подписания информированного согласия больной включался в исследование.
Методы оценки. Для оценки состояния здоровья больных перед включением в исследование были использованы данные клинического и биохимического анализа крови и общего анализа мочи.
Всем больным проводили физикальный осмотр, определяли концентрацию алкоголя в выдыхаемом воздухе с помощью газоанализатора, осуществляли ретроспективный анализ употребления алкоголя за последние три месяца («Time Line Follow Back») [28] для оценки количества дней пьянства и количества потребленного алкоголя, подтверждали диагнозы алкогольной зависимости и аффективного расстройства по МКБ-10, собирали анамнестические данные с помощью специально разработанного клинического структурированного интервью, а также выполняли психометрические оценки с помощью батареи психометрических инструментов. Использовались следующие инструменты: индекс тяжести зависимости (ИТЗ) [20], шкала оценки общего функционирования (ШООФ) (дополнительная шкала DSM-IV) [12], шкала общего клинического впечатления (ОКВ) [10], краткая шкала психиатрической оценки (КПШ) [23], шкалы тревоги [15] и депрессии [14] Гамильтона, шкала депрессии Монтгомери — Ашберг (MADRS) [21], самооценочные шкалы депрессии Зунга [6, 31] и тревоги Спилбергера — Ханина [7, 29], а также Пенсильванская [13], обсессивно-компульсивная [8] и визуальная аналоговая шкалы оценки патологического влечения к алкоголю (ПВА) (табл. 1). Все вышеприведенные обследования повторялись в течение трех месяцев исследования с периодичностью, указанной в табл. 1.
Кроме того, для объективизации сообщаемых больными данных о потреблении алкоголя еженедельно при каждом визите проводилось определение в крови активности гамма-глутамилтранспептидазы (ГГТП) — фермента, являющегося маркером массивного потребления алкоголя [1].
Для оценки наличия побочных эффектов проводимой терапии на всех больных при каждом из визитов заполнялась специальная регистрационная форма.
Комплайенс с приемом тразодона оценивали методом подсчета непринятых таблеток на каждом визите.
Всем больным (независимо от вида терапии — тразодон или плацебо) на каждом из еженедельных визитов проводился стандартизированный курс рациональной (когнитивно-поведенческой) психотерапии в соответствии с руководством по консультированию больных алкоголизмом [25].
Общая схема проведения исследования, мониторинга состояния больных и оценки клинически значимых параметров приведена в табл. 1.
Рандомизация и ослепление. Рандомизация была проведена при помощи генератора случайных чисел на базе электронных таблиц Exсel. Препараты (тразодон и плацебо) выдавались пациентам с соблюдением принципов одинарного ослепления при каждом визите один раз в неделю на протяжении трех месяцев таким образом, чтобы у них всегда был трехнедельный запас препарата (на случай пропуска 1–2 визитов). Пациенты не знали о своей принадлежности к той или иной группе лечения.
Исключение из исследования. Больные исключались из исследования в случае рецидива алкоголизма, в качестве которого рассматривалось возобновление массивного ежедневного (запойного) пьянства — три и более дня тяжелого пьянства подряд (согласно международным стандартам, тяжелое пьянство — heavy drinking — 5 и более стандартных порций алкоголя в день для мужчин, 4 и более — для женщин), а также в случае пропуска трех и более визитов подряд.
Статистическая обработка. Для ведения базы данных с информацией обо всех пациентах и о каждом их визите использован статистический пакет SPSS. Статистический анализ данных осуществлялся также с помощью статистического пакета SPSS. В целях соблюдения конфиденциальности вся информация о пациентах в базе данных была закодирована и их имена и фамилии нигде не упоминались. Различия рассматривали как статистически значимые при р < 0,05. Статистические характеристики количественных показателей представлены в виде «среднее ± ошибка среднего».
Условно статистический анализ может быть разделен на 3 части: анализ анамнестических данных, анализ показателей, измеренных в динамике, и анализ побочных эффектов.
Анализ анамнестических данных осуществляли для доказательства однородности исследуемых групп. Группа анамнестических показателей состояла из 94 переменных, характеризующих пациента: пол, возраст, биографические данные, показатели, характеризующие его социальное положение, и клинические данные. Для анализа однородности по каждому показателю, в зависимости от его вида (шкала измерения, соответствие нормальному распределению), были использованы: точный критерий Фишера, тесты Колмогорова — Смирнова и Манна — Уитни, а также Т-тест. Анализ показал, что по всем измеренным показателям группы следует считать однородными.
Для анализа показателей, измеренных в динамике, использовался многофакторный дисперсионный (ковариационный) анализ с тестом Бонферрони в качестве апостериорного (post-hoc) теста. В качестве независимых переменных выступали вид терапии (тразодон или плацебо) и время (неделя) с момента включения в исследование, а в качестве зависимых — показатели психометрических шкал и потребления алкоголя. Для сравнения групп по таким показателям, как причина завершения программы, количество дней пьянства, количество употребленного алкоголя (в граммах чистого этанола), наличие и количество срывов и пропусков визитов, были построены таблицы сопряженности и использовался точный критерий Фишера. Для сравнения групп по общей продолжительности ремиссии в исследовании и по времени до первого приема алкоголя применялся тест Манна — Уитни. Также был проведен анализ выживаемости Каплана — Мейера (межгрупповые сравнения по методу хи-квадрат Мантеля — Кокса) по событию выбывания из исследования.
Для анализа побочных эффектов были построены таблицы частот по их наличию и количеству, продолжительности, количеству испытуемых с побочными эффектами и применен точный критерий Фишера для оценки значимости межгрупповых различий.
Этические аспекты. Исследование было одобрено в этическом комитете НИПНИ им. В.М. Бехтерева. Информированное согласие было подписано каждым больным до включения в исследование. Больные, получавшие плацебо, тем не менее не оставались без лечения, так как всем без исключения пациентам проводился стандартизированный курс психотерапии в соответствии с руководством [25].
Конфиденциальность данных об участвовавших в исследовании больных обеспечивалась использованием защищенных кодами компьютеров и баз данных, а также отсутствием фамилий и имен больных на каких-либо документах, кроме информированного согласия.
Результаты
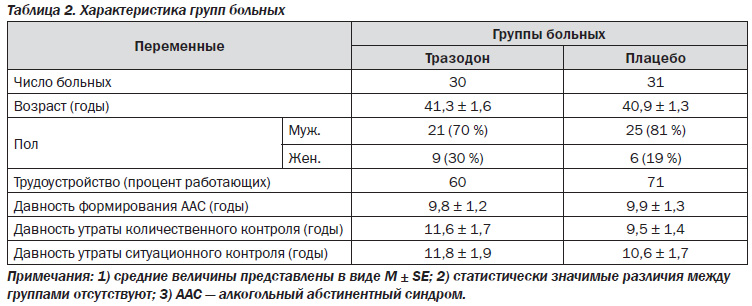
Анамнестические данные. Анамнестические данные (демографические и клинические) приведены в табл. 2. Как видно из таблицы, исследуемые группы больных значимо не различались по основным показателям, таким как возраст, пол, давность формирования зависимости и др. Не отмечалось также статистически значимых различий между группами по другим анамнестическим и клиническим показателям, включая показатели ИТЗ и КПШ.
Динамика психометрических показателей
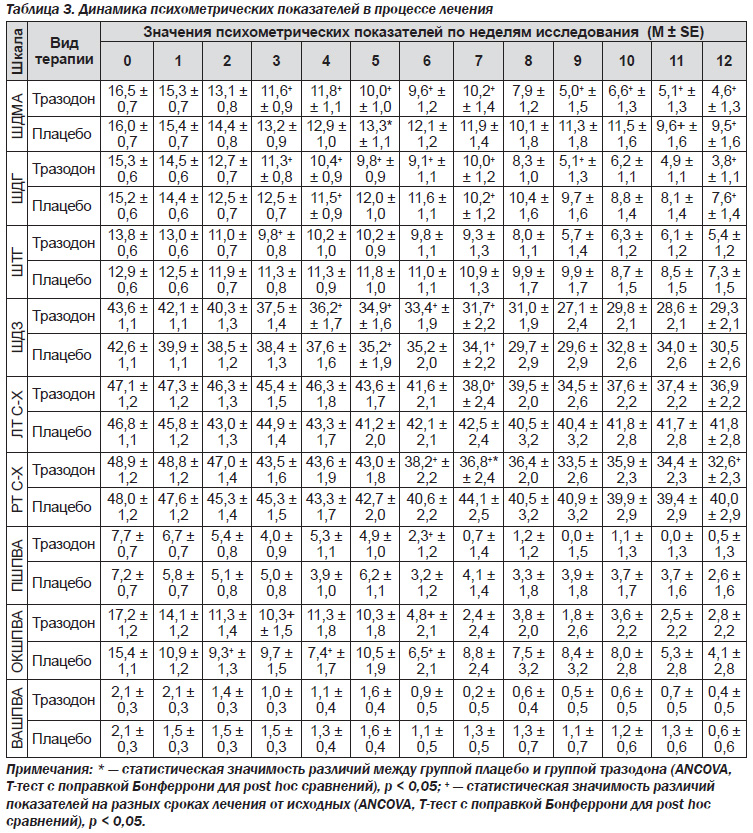
Шкала депресcии Монтгомери — Ашберг (ШДМА). Исходно повышенные показатели депрессии постепенно и значимо снижались в обеих группах больных (табл. 3). По данным дисперсионного анализа, статистически значимое снижение депрессии по ШДМА в основной группе больных произошло уже к 3-й неделе исследования, в то время как в группе сравнения — только к 11-й неделе. Уровень депрессии по ШДМА в основной группе оставался статистически значимо ниже исходных значений с 3-й по 12-ю неделю исследования, в то время как в контрольной группе — только на 11-й и 12-й неделях исследования (табл. 3). Уровень депрессии по данной шкале в основной группе был значимо ниже, чем в группе сравнения: статистически значимые различия между основной и контрольной группами отмечались на 5-й, а также 9–12-й неделях исследования (табл. 3).
Шкала депрессии Гамильтона (ШДГ). Статистически значимое снижение депрессии в основной группе больных по данной шкале произошло к 3-й неделе исследования, и в дальнейшем уровень депрессии оставался значимо ниже на протяжении всего периода исследования (табл. 3). В контрольной группе депрессия по ШДГ статистически значимо снизилась к 4-й неделе, но затем достоверно отличалась от исходных значений только на 7-й и 10–12-й неделях исследования. Статистически значимо более низкий уровень депрессии по ШДГ в основной группе по сравнению с контрольной регистрировался на 9-й и 12-й неделях исследования (табл. 3).
Шкала тревоги Гамильтона (ШТГ). Уровень тревоги в основной группе снижался и статистически значимо отличался от исходных значений на 3-й и 8–12-й неделях исследования, в то время как в контрольной группе — только на 12-й неделе. Статистически значимых межгрупповых различий выявлено не было (табл. 3).
Шкала депрессии Зунга (ШДЗ). Уровень депрессии по самооценочной шкале Зунга снижался и статистически значимо отличался от исходных значений на 4–12-й неделях в основной группе больных и на 5, 7–10 и 12-й неделях — в группе сравнения. Межгрупповые различия не были статистически значимыми (табл. 3).
Шкала реактивной тревоги Спилбергера — Ханина (РТ С-Х). Уровень РТ в основной группе снижался и статистически значимо отличался от исходных значений на 6–12-й неделях лечения. В группе сравнения статистически значимых различий выявлено не было. Уровень тревоги в основной группе больных был статистически значимо ниже, чем в группе сравнения, на 7-й и 12-й неделях исследования (табл. 3).
Шкала личностной тревоги Спилбергера — Ханина (ЛТ С-Х). Статистически значимое снижение ЛТ в основной группе больных по данному тесту выявлено на 7-й и 9–12-й неделях лечения. В контрольной группе статистически значимых различий по отношению к исходному уровню не выявлено. Значимых различий между группами по данным показателям также выявлено не было (табл. 3).
Шкалы оценки патологического влечения к алкоголю (ПВА). По данным Пенсильванской шкалы ПВА (ПШПВА), в основной группе интенсивность ПВА снижалась и статистически значимо отличалась от исходных значений на 6–12-й неделях исследования. В контрольной группе изменения не были статистически значимыми. Достоверных различий в выраженности ПВА между основной и контрольной группами выявлено не было (табл. 3).
В основной группе по обсессивно-компульсивной шкале (ОКШПВА) значимое снижение интенсивности ПВА по сравнению с исходными значениями происходило на 3-й и 6–12-й неделях исследования. В контрольной группе снижение уровня ПВА отмечалось на 2, 4, 6 и 12-й неделях. Статистически значимых межгрупповых различий выявлено не было (табл. 3).
В динамике ПВА по данным визуальной аналоговой шкалы (ВАШПВА) достоверных межгрупповых и внутригрупповых различий выявлено не было.
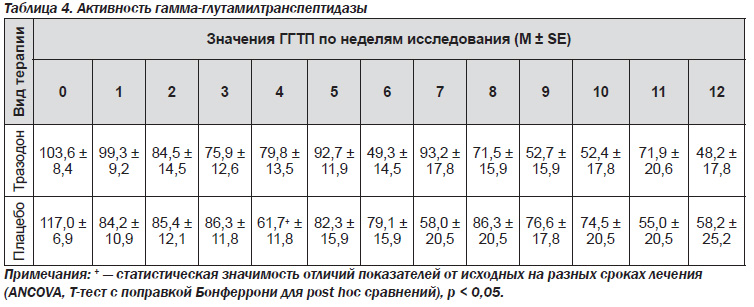
Динамика биохимических показателей. Гамма-глутамилтранспептидаза (ГГТП). Уровень ГГТП в крови больных обеих групп постепенно снижался — практически в 2 раза, однако значимые межгрупповые и внутригрупповые различия отсутствовали из-за большой дисперсии параметров (табл. 4).
Показатели потребления алкоголя и выбывания из исследования. Выбывание из программы исследования. В основной группе больных программу лечения закончили в ремиссии 8 человек (27 %), у 7 больных (23 %) наступил рецидив алкоголизма и еще 15 больных (50 %) выбыли из исследования по другим (не связанным с основным заболеванием) обстоятельствам. В контрольной группе закончили исследование в ремиссии всего 5 человек (16 %), выбыли по рецидиву алкоголизма — 9 (29 %) и 17 больных (54 %) выбыли из исследования по другим обстоятельствам. Статистически значимые различия между группами отсутствуют.
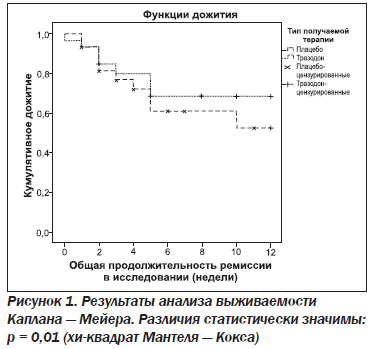
Результаты анализа выживаемости Каплана — Мейера продемонстрировали значимо лучшее удержание в программе лечения в группе больных, получавших тразодон (рис. 1). Различия между основной группой и группой сравнения по критерию хи-квадрат Мантеля — Кокса статистически значимы (р < 0,05).
Показатели ремиссии и употребления алкоголя. Суммарное количество дней употребления алкоголя, верифицированное методом ретроспективного анализа, в основной группе больных (30 дней) было статистически значимо меньше, чем в контрольной группе (46 дней) (р < 0,05; точный критерий Фишера). Относительно небольшое число дней употребления алкоголя в группах обусловлено тем, что при расчете данного показателя учитывались только срывы без рецидивов (то есть больные, у которых наступал рецидив, исключались из исследования в первый день рецидива). Средняя продолжительность ремиссии в основной группе (5,30 ± 0,84 недели) была несколько выше, чем в контрольной (4,74 ± 0,71 недели), однако эти различия не были статистически значимыми. Время до первого употребления алкоголя (срыва ремиссии) между группами достоверно не различалось: 3,43 ± 0,53 недели в основной группе против 4,33 ± 0,99 недели в контрольной.
Общие показатели эффективности терапии
Шкала общего клинического впечатления (ШОКВ). К концу исследования очень значительное или значительное улучшение в основной группе отмечалось у 23,3 % испытуемых, а в контрольной — у 6,4 %. При этом статистически значимых различий выявлено не было (р = 0,364).
Шкала оценки общего функционирования (ШООФ). Исходно группы имели примерно одинаковые оценки по ШООФ (59,23 ± 1,46 в основной группе и 61,38 ± ± 1,08 в контрольной). Через 1,5 месяца (середина исследования) показатели общего функционирования в основной группе были выше, чем в контрольной (70,00 ± ± 2,26 против 62,22 ± 4,34), но статистически значимых различий выявлено не было. Примерно такая же разница между основной и контрольной группами сохранялась к концу лечения (77,78 ± 3,64 в основной группе и 71,67 ± 6,54 в контрольной), однако она также не достигала уровня статистической значимости.
Показатели переносимости терапии. Побочные эффекты. В основной группе больных побочные эффекты отмечались у 16 испытуемых (53 %), в то время как в контрольной группе — у 9 (29 %) (p = 0,071, точный критерий Фишера). Появлявшиеся побочные эффекты были легкой степени выраженности и не требовали какой-либо терапии. Наиболее частыми нежелательными явлениями в основной группе были ощущение заторможенности, вялость, сонливость, усталость, отсутствие энергии, слабость. По причине побочных эффектов в основной группе отказались от участия в исследовании 5 пациентов (16,7 %), а в контрольной — 1 (3,2 %). Серьезных нежелательных явлений зарегистрировано не было.
Обсуждение
Данное исследование является первым одинарным слепым рандомизированным клиническим исследованием эффективности тразодона для купирования аффективных расстройств депрессивного круга и стабилизации ремиссии у больных с алкогольной зависимостью. Общая эффективность 12-недельного курса терапии тразодоном была изучена на выборке из 61 пациента. Первичными показателями эффективности являлись динамика депрессии и тревоги у испытуемых, в то время как выраженность влечения к алкоголю, а также показатели, характеризующие устойчивость ремиссии, рассматривались как вторичные.
Результаты данного исследования свидетельствуют об эффективности тразодона как средства купирования аффективных нарушений начального периода ремиссии у больных алкоголизмом. При этом тразодон продемонстрировал отчетливый антидепрессивный и умеренный анксиолитический эффект. Данные шкалы депрессии Монтгомери — Ашберг выявили статистически значимое снижение уровня депрессии в основной группе больных уже к 3-й неделе исследования. Аналогичная динамика уровней депрессии и тревоги была зарегистрирована по шкалам Гамильтона, снижение показателей по которым оставалось стабильным до 12-й недели исследования. Выраженность реактивной и личностной тревоги, оцениваемая соответствующими шкалами Спилбергера — Ханина, в группе испытуемых, получавших тразодон, значимо снижалась в середине исследования и оставалась статистически значимой до его конца. В контрольной группе по этим шкалам снижение уровня депрессии и тревоги происходило только в конце исследования и не носило устойчивого характера.
Более быстрая и существенная редукция тревоги и депрессии в группе больных, получавших тразодон, сопровождалась достоверной редукцией интенсивности патологического влечения к алкоголю по отношению к исходным показателям, что демонстрирует оценка ПВА по Пенсильванской и обсессивно-компульсивной шкалам. В основной группе интенсивность ПВА по Пенсильванской шкале статистически значимо снижалась начиная с 6-й недели исследования и достоверно отличалась от исходных значений до конца исследования. По данным обсессивно-компульсивной шкалы, в основной группе значимое снижение ПВА происходило уже на 3-й и 6–12-й неделях исследования. При этом достоверные изменения ПВА в контрольной группе практически отсутствовали. Таким образом, тразодон обнаружил также определенное антикрэйвинговое действие у больных с алкогольной зависимостью. Следует отметить, что, несмотря на более частое развитие побочных эффектов у больных основной группы (ощущение заторможенности, вялость, сонливость, усталость, слабость), их выраженность была невысокой и не требовала какой-либо терапии, то есть переносимость тразодона может быть оценена как удовлетворительная. Серьезных побочных эффектов по результатам исследования не было зарегистрировано.
Таким образом, в данном исследовании были получены результаты, свидетельствующие о клинической эффективности и безопасности тразодона, схожие с результатами исследований близкого к нему по механизму действия антидепрессанта нефазодона, полученными C.A. Hernandez-Avila et al. [17] и E.S. Brown et al. [9]. Полученные данные, в частности, продемонстрировали снижение выраженности депрессии и тревоги, а также сокращение дней потребления алкоголя у зависимых от него пациентов. Результаты проведенного нами исследования тразодона хорошо соотносятся также с данными многоцентрового двойного слепого исследования нефазодона, выполненного P.P. Roy-Byrne et al. [26], в котором была показана эффективность данного класса антидепрессантов в отношении купирования депрессии у больных алкоголизмом.
Заключение
Таким образом, проведенное простое слепое рандомизированное плацебо-контролируемое исследование выявило высокую эффективность и хорошую переносимость тразодона в лечении больных, страдающих алкогольной зависимостью, сочетающейся с коморбидными аффективными расстройствами. Препарат способствует редукции депрессии и тревоги, стабилизации ремиссии и профилактике рецидивов.
Продемонстрированная нами в данной работе определенная эффективность тразодона в отношении стабилизации ремиссий при алкоголизме и его умеренное антикрэйвинговое действие, возможно, обусловлены тем, что в настоящее исследование включались только коморбидные больные, у которых зависимость от алкоголя сочеталась с депрессией легкой или средней степени выраженности.
Впервые опубликовано в журнале «Человек и лекарство, Казахстан»
1. Винницкая Е.В. Алкогольная болезнь печени: клиническое течение, терапия // Гастроэнтерология. — 2007. — № 13. — С. 53-58.
2. Иванец Н.Н., Анохина И.П., Коган Б.М. Эффективность и механизмы действия леривона при алкоголизме // Журн. невропатол. и психиатр. им. С.С. Корсакова. — 1996. — Т. 96, № 5. — С. 52-58.
3. Кошкина Е.А., Спектор Ш.И., Сенцов В.Г., Богданов С.И. Медицинские, социальные и экономические последствия наркомании и алкоголизма. — M.: ПЕР СЭ, 2008. — 288 c.
4. Крупицкий Е.М., Илюк Р.Д., Ерышев О.Ф., Цой-Подосенин М.В. Современные фармакологические методы стабилизации ремиссий и профилактики рецидивов в наркологии // Обозрение психиатрии и медицинской психологии им. В.М. Бехтерева. — 2009. — № 1 (Наркология). — С. 12-27.
5. Малин Д.И., Янкин Е.В., Медведев В.М., Ковалев А.В. Депрессии у больных алкоголизмом // Психиатрия и психофармакотерапия. — 2004. — Т. 6, № 5. — С. 243-245.
6. Рыбакова Т.Г., Балашова Т.Н. Клинико-психологическая характеристика и диагностика аффективных расстройств при алкоголизме: Метод. реком. / Сост. Т.Г. Рыбакова, Т.Н. Балашова. — Л.: НИПНИ им. В.М. Бехтерева, 1988. — 27 с.
7. Ханин Ю.Л. Краткое руководство по применению шкалы реактивной и личностной тревожности Ч.Д. Спилбергера / Ю.Л. Ханин. — Л.: ЛНИИФК, 1976. — 18 с.
8. Anton R.F., Moak D.H., Latham P.K. The obsessive compulsive drinking scale // Arch. Gen. Psych. — 1996. — Vol. 53, № 3. — Р. 225-231.
9. Brown E.S., Bobadilla L., Nejtek V.A. Open-label nefazodone in patients with a major depressive episode and alcohol dependence // Prog. Neuropsychopharmacol. Biol. Psychiatry. — 2003. — Vol. 27, № 4. — P. 681-685.
10. Busner J., Targum S.D., Miller D.S. Te Clinical Global Impressions Scale: Errors in understanding and use // Compr. Psychiatry. — 2009. — Vol. 50, № 3. — Р. 257-262.
11. Crocq M.A. Depression and alcohol // Depression and addiction: WPA Bulletin on Depression. — 2001. — Vol. 5, № 23. — P. 1-4.
12. Diagnostic and Statistical Manual of Mental Disorders: Fourth Edition (DSM-IV) / А. Frances, H.A. Pincus, M.B. First (eds.). Substance Related Disorders. — 1994. — P. 325-346.
13. Flannery B.A., Volpicelli J.R., Pettinati H.M. Psychometric properties of the Penn alcohol craving scale // Alc. Clin. Exp. Res. — 1999. — Vol. 23, № 8. — P. 1289-1295.
14. Hamilton M. A rating scale for depression // J. Neurol. Neurosurg. Psychiatry. — 1960. — Vol. 23. — P. 56-62.
15. Hamilton M. Development of a rating scale for primary depressive illness // Br. J. Soc. Clin. Psychol. — 1967. — Vol. 6. — P. 278-296.
16. Hautzinger M., Wetzel H., Szegedi A. et al. Combination treatment with SSRI and cognitive behavior therapy for relapse prevention of alcohol-dependent men. Results of a randomized, controlled multicenter therapeutic study // Nervenarzt. — 2005. — Vol. 76, № 3. — P. 295-307.
17. Hernandez-Avila C.A., Modesto-Lowe V., Feinn R., Kranzler H.R. Nefazodone treatment of comorbid alcohol dependence and major depression // Alcohol. Clin. Exp. Res. — 2004. — Vol. 28, № 3. — P. 433-440.
18. Kranzler H.R., Burleson J.A., Korner P. et al. Placebo-controlled trial of fuoxetine as an adjunct to relapse prevention in alcoholics // American Journal of Psychiatry. — 1995. — Vol. 152. — P. 391-397.
19. Kranzler H.R., Modesto-Lowe V., Van Kirk J. Naltrexone vs. nefazodone for treatment of alcohol dependence. A placebo-controlled trial // Neuropsychopharmacology. — 2000. — Vol. 22, № 5. — P. 493-503.
20. McLellan A.T., Luborsky L., Woody G.E., O’Brien C.P. An improved diagnostic evaluation instrument for substance abuse patients. Te Addiction Severity Index // J. Nerv. Ment. Dis. — 1980. — Vol. 168, № 1. — P. 26-33.
21. Montgomery S.A., Asberg M. A new depression scale designed to be sensitive to change // Br. J. Psychiatry. — 1979. — Vol. 134. — P. 382-389.
22. Naranjo C.A., Bremner K.E. Clinical pharmacology of serotonin-altering medications for decreasing alcohol consumption // Alcohol. Alcohol. — 1993. — Vol. 2. (Suppl.). — P. 221-229.
23. Overall J.E., Gorham D.R. Te brief psychiatric rating scale // Psychological Reports. — 1962. — Vol. 10. — P. 799-812.
24. Pettinati H.M., Volpicelli J.R., Kranzler H.R. et al. Sertraline treatment for alcohol dependence: interactive efects of medication and alcoholic subtype // Alcoholism: Clinical and Experimental Research. — 2000. — Vol. 24. — P. 1041-1049.
25. Pettinati H.M., Weiss R.D., Miller W.R., Dundon W. Medical Management Treatment Manual: A Clinical Research Guide for Medically Trained Clinicians Providing Pharmacotherapy as Part of the Treatment for Alcohol Dependence. Bethesda, MD: US Department of Health and Human Services, 2004. — NIAAA COMBINE Monograph Series, Vol. 2.
26. Roy-Byrne P.P., Pages K.P., Russo J.E. et al. Nefazodone treatment of major depression in alcohol-dependent patients: a double-blind, placebo-controlled trial // J. Clin. Psychopharmacol. — 2000. — Vol. 20, № 2. — P. 129-136.
27. Salloum I.M., Daiey D.C., Tase M.E. Male depression, alcoholism and violence. — UK: Martin Dunitz Ltd., 2000. — 97 p.
28. Sobell M.B., Sobell L.C., Klajner F. et al. The reliability of a timeline method for assessing normal drinker college students' recent drinking history: utility for alcohol research // Addict. Behav. — 1986. — Vol. 11, № 2. — P. 149-161.
29. Spielberger C.D., Gorsuch R.L., Lushene R.E. Manual for the state-trait anxiety inventory. — Palo Alto, CA: Consulting Press, 1970.
30. Wetzel H., Szegedi A., Scheurich A. et al. Combination treatment with nefazodone and cognitive-behavioral therapy for relapse prevention in alcohol-dependent men: a randomized controlled study // J. Clin. Psychiatry. — 2004. — Vol. 65, № 10. — P. 1406-1413.
31. Zung W.W.K. A self-rating depression scale // Arch. Gen. Psych. — 1965. — Vol. 12. — P. 63-70.