Газета «Новости медицины и фармации» Гастроэнтерология (468) 2013 (тематический номер)
Вернуться к номеру
Предпочтительные стратегии эрадикации инфекции Helicobacter pylori в Украине в свете современных международных рекомендаций
Авторы: Ткач С.М. - Национальный медицинский университет имени А.А. Богомольца, г. Киев
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
Хотя эпидемиология инфекции H.pylori за последние годы существенно изменилась и в новых благополучных социально-экономических когортах ее распространенность достаточно низкая, она по-прежнему остается одной из наиболее распространенных в мире инфекций. Средняя распространенность H.pylori по всему миру до сих пор равна приблизительно 50 % с наиболее высоким уровнем в развивающихся странах (80–90 %) и более низким уровнем в Западной Европе (30–50 %), Северной Америке (30–40 %) и Австралии (20 %).
Клиническое значение инфекции H.pylori определяется тем, что она является основным причинным фактором гастродуоденальной патологии (хронические гастриты, пептические язвы, диспепсия, рак желудка, MALT-лимфома желудка) и ряда экстрагастральных расстройств (необъяснимая железодефицитная анемия, В12-дефицитная анемия, иммунная тромбоцитопения).
В связи с этим на основании рекомендаций многочисленных консенсусов установлены соответствующие показания для эрадикации этой инфекции. В частности, показания для эрадикации H.pylori, сформулированные Маастрихтским консенсусом 4-2010, который в настоящее время является основным рекомендательным документом по диагностике и лечению инфекции H.pylori в Европе, представлены ниже.
Современные показания для эрадикации H.pylori:
— дуоденальные язвы;
— язвы желудка;
— атрофия и кишечная метаплазия слизистой желудка;
— MALT-лимфома желудка;
— функциональная диспепсия;
— неисследованная диспепсия (в областях с распространенностью H.pylori в популяции > 20 %);
— предстоящая резекция по поводу рака желудка;
— родственники первой линии с раком желудка;
— длительное применение аспирина/НПВП/коксибов (перед назначением);
— ГЭРБ (при длительном применении ИПП);
— необъяснимая железодефицитная анемия;
— идиопатическая тромбоцитопеническая пурпура.
При последнем пересмотре показаний для эрадикации инфекции H.pylori в итоговых документах Маастрихтского консенсуса 4-2010 оценивались неисследованная диспепсия, функциональная диспепсия, ГЭРБ, НПВП-гастропатии и негастроэнтерологические заболевания.
В частности, при рассмотрении неисследованной диспепсии строго рекомендовано применять стратегию Тest&treat (то есть диагностика H.pylori и проведение эрадикации при положительном результате), но только в тех регионах, где распространенность H.pylori превышает 20 % (степень доказательств А, 1а). В отношении функциональной диспепсии сделан вывод, что эрадикация является наилучшим методом лечения и поэтому может быть рекомендована всем инфицированным больным (А, 1а). В отношении ГЭРБ сделан вывод, что H.pylori-статус не оказывает влияния на тяжесть и рецидивирование симптомов, а также на эффективность лечения. Эрадикация инфекции не обостряет течение ГЭРБ и не ухудшает эффективность лечения (А, 1а). В отношении НПВП-гастропатий сделан вывод, что инфекция H.pylori является практически единственным модифицируемым фактором риска, который снижает вероятность их возникновения. Поэтому всем больным, у которых планируется длительный прием обычных НПВП, коксибов или аспирина, рекомендуется стратегия Тest&treat (А, 1в).
В отношении экстрагастральных расстройств сделан вывод, что имеются убедительные доказательства роли инфекции H.pylori в развитии необъяснимой железодефицитной анемии — до 40 % всех случаев (А, 1а), иммунной тромбоцитопении — до 50 % всех случаев (А, 1в) и дефицита витамина В12 (В, 3в), в связи с чем при этих состояниях она должна быть эрадицирована. Отмечено, однако, что на сегодняшний день нет убедительных доказательств причинной ассоциации инфекции H.pylori с другими экстрагастральными расстройствами, включая кардиоваскулярную и неврологическую (цереброваскулярная болезнь, мигрень, болезнь Паркинсона) патологию, и поэтому необходимы дальнейшие исследования в этой области, включая изучение СаgА-позитивных штаммов инфекции.
При оценке методов диагностики инфекции H.pylori в итоговом документе Маастрихтского консенсуса 4-2010 рассматривались фекальный антигенный тест (ФАТ), серология и определение чувствительности инфекции H.pylori к антибиотикам. В частности, в отношении ФАТ сделан вывод, что его диагностическая точность эквивалентна 13С-мочевинному дыхательному тесту, но только если применяется моноклональный ФАТ (А, 1а). Отмечено также, что в определенных ситуациях для диагностики может применяться серологическое определение IgG-антител. К таким ситуациям, когда 13С-мочевинный дыхательный тест и ФАТ могут дать ложные результаты, относятся недавнее применение антибиотиков или антисекреторных средств, желудочное кровотечение, атрофия и рак желудка (В, 1в). Экспертами также сделан вывод, что перед проведением 13С-мочевинного дыхательного теста или ФАТ прием ингибиторов протонной помпы (ИПП) должен быть приостановлен за 2 недели до исследования (А, 1в). Если это невозможно, должна применяться серология (В, 2в).
Изучение чувствительности инфекции H.pylori к антибиотикам важно проводить в следующих случаях: 1) перед назначением стандартной тройной терапии в регионах с высокой кларитромицин-резистентностью; 2) перед назначением терапии 2-й линии во всех регионах, если эндоскопия проводится по любому поводу; 3) в случаях неудачи 2-й линии терапии (D, 5). Отмечено также, что если стандартное культуральное изучение чувствительности невозможно, для определения кларитромицин- или фторхинолон-резистентности могут применяться молекулярные дисковые методы определения чувствительности непосредственно в биоптатах (А, 1в). Отдельно выделено, что соответственно чувствительности к антибиотикам в разных регионах инфекция H.pylori делится на следующие категории: 1) бактерии обычно чувствительны (менее 10 % резистентных штаммов) — необходимости тестирования нет; 2) бактерии непостоянно чувствительны (10–50 % резистентных штаммов) — тестирование необходимо; 3) бактерии большей частью резистентны (более 50 %).
Следует сказать, что, несмотря на то, что инфекция H.pylori представляет собой весьма распространенную и серьезную проблему, ее терапия мало оптимизирована, в подавляющем большинстве случаев назначается эмпирическим путем и дает худшие результаты по сравнению с терапией других более частых инфекционных заболеваний. Хотя бактерия H.pylori и чувствительна к достаточно большому числу антибиотиков и антимикробных препаратов, в то же время сама инфекция H.pylori трудно поддается лечению. Эффективность многих часто рекомендуемых режимов терапии инфекции H.pylori все чаще и чаще уменьшается в связи с постоянно возрастающей резистентностью бактерии ко многим антимикробным препаратам, особенно метронидазолу, кларитромицину и фторхинолонам. В частности, при рассмотрении лечения в итоговом документе Маастрихтского консенсуса 4-2010 отмечено, что с 1992 по 2010 год в мире проведено 113 метаанализов, посвященных изучению эффективности различных схем лечения инфекции H.pylori. Именно данные этих метаанализов и явились основанием для пересмотра некоторых положений, касающихся схем эрадикации в регионах с различной чувствительностью инфекции к антибиотикам, в первую очередь — к кларитромицину. Кроме того, трудности лечения связаны с очень большим количеством бактерий H.pylori в желудке, создающим «эффект обсемененности», их способностью занимать разные ниши (например, внутриклеточные или в толстом слое слизистого геля желудка), высоким показателем частоты повторного инфицирования в развивающихся странах.
В связи с этим режимы эрадикационного лечения H.рylori постоянно меняются и совершенствуются. Оптимальная схема терапии инфекции H.pylori должна обеспечивать ≥ 95% уровень успешности у пациентов, инфицированных чувствительными штаммами, и достигать высокого показателя эффективности эрадикации (> 85 %) у пациентов, инфицированных резистентными штаммами. Если не имеется схем терапии, способных дать такой результат, клиницист должен использовать наиболее эффективные схемы, доступные в конкретном регионе.
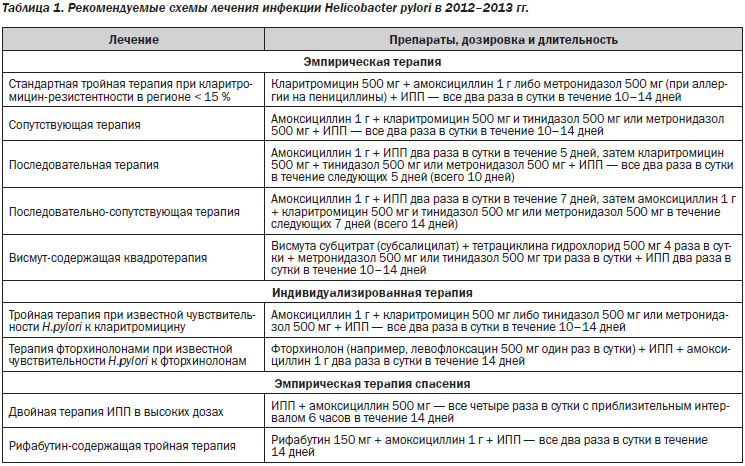
В настоящее время выделяют три основных вида антихеликобактерного лечения — эмпирическую терапию, индивидуализированную терапию и эмпирическую терапию спасения (табл. 1).
Эмпирическая терапия, назначаемая как терапия первой или второй линии без определения чувствительности H.рylori к антибиотикам, включает в себя стандартную тройную терапию, последовательную терапию, сопутствующую терапию, последовательно-сопутствующую терапию и висмут-содержащую квадротерапию. В схемах стандартной тройной, последовательной и сопутствующей терапии препараты висмута не применяются, эти схемы включают четыре препарата: ИПП, кларитромицин, метронидазол (или тинидазол) и амоксициллин.
Стандартная тройная терапия на основе кларитромицина по-прежнему остается наиболее широко применяемой в Европе и США первой линией терапии, хотя ее эффективность во многих странах постоянно снижается. В связи с этим Маастрихтский консенсус 4-2010 настоятельно рекомендует выбор первой линии лечения проводить на основе известной в стране (регионе) кларитромицин-резистентности. В частности, если резистентность к кларитромицину в данном регионе не превышает 15 %, то, как и прежде, в качестве первой линии лечения рекомендуется назначать эмпирическую стандартную кларитромицин-содержащую тройную терапию (ИПП + кларитромицин + амоксициллин или метронидазол в случаях аллергии на пенициллины) даже без предварительного определения чувствительности, при этом дозы для всех препаратов остаются прежними (А, 1а). Важным заключением консенсуса явилось то, что удлинение стандартной тройной терапии до 10–14 дней повышает эффективность эрадикации в среднем на 5 % (А, 1а). Кроме того, отмечено, что применение высоких (двойных) доз ИПП (дважды в день) позволяет дополнительно повышать эффективность эрадикации на 8 % (А, 1в). Еще один вывод касается того, что некоторые пробиотики и пребиотики демонстрируют обнадеживающие результаты в качестве адъювантной терапии для уменьшения побочных эффектов и поэтому могут широко применяться (D, 5).
Если резистентность к кларитромицину в данном регионе превышает 15–20 %, а чувствительность к антибактериальным препаратам у конкретного индивидуума до лечения не определялась, то в таких случаях Маастрихтский консенсус 4-2010 вместо стандартной тройной терапии в качестве первой линии лечения рекомендует либо классическую 4-компонентную висмут-содержащую терапию (в течение 10–14 дней), либо последовательную терапию, либо сопутствующую квадротерапию (А, 1а).
Последовательная терапия состоит из двух периодов: применение ИПП + амоксициллин в течение 5 дней, а затем ИПП + кларитромицин и метронидазол (или тинидазол) в течение последующих 5 дней. При применении сопутствующей терапии все четыре препарата применяют на протяжении всего курса терапии, и поэтому такая схема является более простой, так как она не требует изменения количества или типа препаратов в середине лечения. Обе эти схемы в основном являются эффективными, за исключением некоторых регионов с высокой распространенностью (≥ 20–30 %) резистентности к кларитромицину или двойной резистентности – к кларитромицину и метронидазолу. При применении обеих схем уровень эрадикации достигает 90–94 %, хотя ни одна из этих схем до сих пор не оптимизирована, например, в отношении дозировки или длительности.
Альтернативу сопутствующей терапии представляют собой 4-компонентные висмут-содержащие схемы. Уместно напомнить, что первая успешная схема эрадикации с эффективностью не менее 90 % состояла именно из висмута, тетрациклина и метронидазола, применяемых в течение 14 дней. Усиленной версией этого лечения явилась висмут-содержащая квадротерапия, в которую был добавлен ИПП, а суточная доза метронидазола увеличена до 1500 мг. Именно эта схема позволила в значительной степени преодолеть резистентность к метронидазолу. В США успешность данной схемы терапии при инфицировании штаммами H.pylori, резистентными к метронидазолу, составила 90 %, а в Европе — 90,5 %. Однако эта схема лечения не приобрела широкой популярности в силу того, что требовала приема большого числа таблеток 4 раза в сутки, что резко снижало приверженность больных к лечению, а также из-за недоступности препаратов висмута или тетрациклина в ряде регионов.
Врачам-клиницистам рекомендуется использовать ту схему, которая более всего эффективна в данном регионе, и всегда подтверждать факт излечения неинвазивным методом (13С-мочевинный дыхательный тест или моноклональный фекально-антигенный тест), проведенным не ранее чем через 4 недели после окончания лечения. Мониторинг исхода терапии дает возможность клиницистам достоверно определить эффективность той или иной терапии в данном регионе, а также служит для раннего предупреждения развития резистентности, которая может отрицательно повлиять на эффективность какой-либо схемы лечения. Кроме того, для более эффективного выбора схемы терапии следует учитывать не только информацию о резистентности к лекарственным средствам в данной местности или регионе, но также и предшествующее применение антибиотиков пациентом, что может быть полезным при определении препаратов, к которым, скорее всего, существует резистентность (например, предшествующее применение макролидов, фторхинолонов или метронидазола).
В качестве второй линии лечения Маастрихтский консенсус 4-2010 рекомендует проводить либо классическую квадротерапию (ИПП + метронидазол + тетрациклин + висмут) в течение 10 дней, либо тройную терапию с левофлоксацином в течение 10 дней (А, 1а), при этом необходимо учитывать быстро растущую резистентность к левофлоксацину (В, 2в). После неудачи второй линии дальнейшее лечение рекомендуется проводить только после индивидуального определения чувствительности при любой возможности ее проведения (А, 1с) либо проводить эмпирическую терапию спасения.
Индивидуализированная терапия. Заключается в назначении эрадикационной терапии на основе определения индивидуальной чувствительности H.pylori к антибиотикам — обычно к кларитромицину и левофлоксацину. В подавляющем большинстве случаев это терапия третьей линии, являющаяся разновидностью персонифицированной медицины. В настоящее время выделяют два вида индивидуализированной терапии — тройную терапию при известной чувствительности H.pylori к кларитромицину и терапию фторхинолонами при известной чувствительности H.pylori к фторхинолонам.
Эмпирическая терапия спасения. Терапия спасения — это альтернатива индивидуализированной терапии, применяющаяся после нескольких (минимум двух) неудачных попыток лечения с использованием разных схем. При отсутствии возможности исследования антимикробной чувствительности еще несколько лет назад основным видом терапии спасения была терапия с включением левофлоксацина, рифабутина или фуразолидона. В настоящее время левофлоксацин-содержащая схема уже не рассматривается как терапия спасения, поскольку часто используется как вторая линия терапии. В качестве основных вариантов терапии спасения в настоящее время рассматриваются двойная терапия ИПП в высоких дозах (например, омепразол 40 мг + амоксициллин 500 мг — все четыре раза в сутки с приблизительным интервалом 6 часов в течение 14 дней) и рифабутин-содержащая тройная терапия (рифабутин 150 мг, амоксициллин 1 г и ИПП — все два раза в сутки в течение 14 дней).
Какой же стратегии ведения пациентов, инфицированных H.pylori, которым показано проведение эрадикационной терапии, следует придерживаться украинским врачам, если следовать современным международным рекомендациям? Поскольку Украина является европейским государством, в этом отношении мы, безусловно, должны безоговорочно придерживаться положений Маастрихтского консенсуса 4-2010.
Это означает, что при рассмотрении показаний для эрадикации инфекции H.pylori мы должны более широко, чем ранее, проводить ее при неисследованной и функциональной диспепсии, больным ГЭРБ, длительно получающим антисекреторные препараты, и больным, у которых планируется длительная терапия аспирином, неселективными НПВП или коксибами, с целью профилактики НПВП-гастропатий. Это же касается и таких экстрагастральных показаний, как необъяснимая железодефицитная анемия, недостаточность витамина В12 и иммунная тромбоцитопеническая пурпура.
В области диагностики следует более широко применять общепризнанный неинвазивный золотой стандарт — 13С-мочевинный дыхательный тест, тем более что необходимая аппаратура имеется уже во многих областных центрах Украины. Считаем необходимым напомнить практическим врачам о недопустимости применения невалидизированного дыхательного Хелик-теста, имеющего низкую специфичность и в большинстве случаев дающего неверные результаты. Применение поликлонального ФАТ, особенно офисных экспресс-тестов, следует ограничивать, поскольку их точность существенно ниже.
Как известно, истинной картины в Украине по кларитромицин-резистентности инфекции H.pylori мы не знаем, поскольку специальные масштабные исследования в этом направлении у нас в стране никогда не проводились. Если ориентироваться на наших ближайших соседей — Россию, где кларитромицин-резистентность находится на уровне 8–10 %, то и в Украине ситуация пока выглядит достаточно благоприятно, о чем, кстати, косвенно свидетельствует сохраняющаяся пока высокая эффективность стандартных кларитромицин-содержащих схем тройной терапии. Тем не менее по мере нарастания приема макролидных антибиотиков ситуация будет меняться, и кларитромицин-резистентность однозначно будет возрастать, а эффективность стандартной тройной терапии — снижаться, что мы прогнозируем через 3–5 лет.
Наш собственный опыт применения стандартной тройной терапии на основе кларитромицина и подтверждения эрадикации H.pylori при помощи 13С-мочевинного дыхательного теста, включающий ежегодное лечение 600–800 больных в течение последних 15 лет, свидетельствует о том, что эффективность стандартной тройной терапии пока остается высокой, превышающей 85 %. Чаще всего для проведения стандартной тройной терапии мы применяем комбинированный препарат Пилобакт Нео (производитель «Ранбакси»), важным преимуществом которого является выпуск в специальной форме (одна упаковка препарата содержит 7 комбинированных блистеров, каждый из которых содержит все необходимые компоненты в рекомендуемых дозах), позволяющей существенно повышать приверженность больных к лечению и, соответственно, добиваться более высокого уровня эрадикации. Немаловажно и то, что практическому врачу первичного звена (например, семейному врачу) даже нет необходимости запоминать дозировки и названия отдельных препаратов, поскольку все они специально расфасованы в необходимом составе и дозировках. Стоимость курсового лечения Пилобактом Нео существенно ниже, чем применение трех отдельных препаратов разных фирм-производителей.
На наш взгляд, в плане назначения первой линии эрадикации в Украине вряд ли что-то пока следует менять, за исключением удлинения продолжительности стандартной тройной терапии (назначение препарата Пилобакт Нео по 3 таблетки 2 раза в день в течение 10–14 дней) и ее сочетания с пробиотиками для уменьшения частоты и выраженности побочных эффектов. Таким образом, пока (во всяком случае ближайшие 3 года) однозначным выбором практикующего врача в Украине для эрадикации H.рylori является назначение стандартной 3-компонентной кларитромицин-содержащей терапии, которая доказала свою высокую эффективность и хорошую переносимость. Как известно, в Украине проведение классической висмут-содержащей квадротерапии связано с определенными трудностями, связанными с отсутствием на рынке эффективных дозировок тетрациклина. Поэтому в качестве второй линии лечения можно рекомендовать тройную терапию с левофлоксацином либо последовательную терапию, эффективность которых в таких случаях достаточно высока. Крайне важным считаем необходимость во всех случаях подтверждения эрадикации H.pylori при помощи неинвазивного, безопасного и быстрого 13С-мочевинного дыхательного теста (но не Хелик-теста!), позволяющего определять тактику дальнейшего ведения пациентов.
1. The European Helicobacter Pylori Stude Group: Current European concepts in management of Helicobacter pylori infection. — The Maastricht Consensus Report // Gut. — 1997. — V. 41. — P. 8-13.
2. Malfertheiner P., Megraud F., O’Moran C. et al. Current concepts in the management of Helicobacter pylori infection. The Maastricht 2-2000 Consensus Report, September, Rome, 2000.
3. Malfertheiner P., Megraud F., O’Moran C. et al. Current concepts in the management of Helicobacter pylori infection — The Maastricht III Consensus Report // Gut. — 2007. — 56. — 772-781.
4. Malfertheiner P., Megraud F., O’Moran C.A. et al. Management of Helicobacter pylori infectiondthe Maastricht IV — Florence Consensus Report // Gut. — 2012. — Vol. 61(5). — 646-664.