Газета «Новости медицины и фармации» 15 (466) 2013
Вернуться к номеру
Эффективная антибиотикотерапия рекуррентных бактериальных бронхитов у детей с гипертрофией лимфоглоточного кольца
Авторы: Овчаренко Л.С., Ткаченко В.Ю. - ГУ «Запорожская медицинская академия последипломного образования МЗ Украины»
Рубрики: Семейная медицина/Терапия, Педиатрия/Неонатология, Антибиотикотерапия
Разделы: Клинические исследования
Версия для печати
Использование цефалоспоринов у детей при острых бактериальных заболеваниях респираторного тракта определено Приказом МЗ Украины № 18 от 13.01.05 «Про затвердження Протоколів надання медичної допомоги дітям за спеціальністю «дитяча пульмонологія» [1], в которых в качестве стартового антибактериального средства представлены аминопенициллины, а при острых бактериальных бронхитах — цефалоспорины 1, 2 и 3го поколений.
Одним из наиболее исследованных и эффективных противомикробных средств является пероральный цефалоспорин 3го поколения — цефподоксима проксетил, представленный на рынке Украины препаратом Цефодокс.
Отечественный практический опыт использования данного антибиотика демонстрирует его достаточную клиническую эффективность и обусловливает широкое применение данного препарата в педиатрии для лечения острой бактериальной патологии. Цефподоксима проксетил имеет доказанную эффективность для антимикробного лечения легких пневмоний (при пероральном применении) и в качестве средства ступенчатой терапии внебольничных пневмоний средней степени тяжести [2, 3].
Доказана эффективность применения цефподоксима проксетила в терапии внебольничных пневмоний и рецидивирующих бронхитов у детей. Показано, что данный препарат является эффективным и безопасным лекарственным средством и может использоваться в качестве стартового антибиотика при лечении воспалительных заболеваний респираторного тракта у детей как в стационарных, так и в амбулаторных условиях, а также как второй этап ступенчатой терапии внебольничной пневмонии после парентерального стартового применения цефалоспоринов 3го поколения [4]. Препарат Цефодокс успешно используется для лечения внегоспитальных пневмоний и такого сложного контингента пациентов, как часто болеющие дети раннего возраста [5].
Высокая эффективность и высокий профиль безопасности цефподоксима проксетила подтверждены данными, полученными в ходе проспективного многоцентрового открытого исследования эффективности и переносимости цефподоксима проксетила (Цефодокс) у детей с нетяжелой внегоспитальной пневмонией («ЦефПросто»), проведенного в 2009–2010 гг. в Украине на базе 8 клинических центров (гг. Киев, Харьков, Донецк, Днепропетровск, Полтава, Запорожье, Львов, Симферополь) с участием 225 пациентов в возрасте от 5 месяцев до 18 лет [6].
Также имеется положительный опыт клинического использования цефподоксима проксетила в схемах стартовой антибиотикотерапии риносинуситов у детей [7].
Важной характеристикой данного препарата при его использовании у детей является его хорошая переносимость и безопасность, обусловленная особенностями фармакодинамики и фармакокинетики: препарат поступает в кишечник в неактивной форме в виде пролекарства. Поэтому при лечении острых бактериальных заболеваний органов дыхания у детей младшего возраста использование цефподоксима проксетила (Цефодокса) в виде антибактериальной монотерапии или ступенчатой терапии позволяет избежать развития диспептического, аллергического, гепатотоксического синдромов [8].
Так, динамическое клиникобактериологическое исследование 20 детей в возрасте от 15 месяцев до 5 лет установило отсутствие клинически значимого негативного воздействия цефподоксима проксетила на микробиоценоз кишечника [9].
В то же время в отечественной литературе недостаточно данных в отношении эффективности и безопасности применения цефподоксима проксетила у детей с рекуррентными формами острых бактериальных бронхитов на фоне гипертрофии лимфоглоточного кольца, что обусловливает необходимость клинического исследования по данной проблеме.
Материалы и методы
Название исследования: исследование эффективности и безопасности перорального использования цефподоксима проксетила (Цефодокс) в течение 5дневного периода терапии детей в возрасте 2–10 лет с рекуррентными формами острых бактериальных бронхитов на фоне гипертрофии лимфоглоточного кольца.
Учитывая тот факт, что понятие «рецидивирующий бронхит» («рекуррентный бронхит») согласно национальному протоколу [1] формируется исходя из заболеваемости острыми бронхитами 3 и более раза в год, при выявлении такой частоты бронхиальной патологии она расценивалась как проявление рекуррентной формы.
Под наблюдением находилось 30 детей в возрасте от 2 до 10 лет, болеющих острым бактериальным бронхитом третий раз за последний год на фоне гипертрофии лимфоглоточного кольца, получающих Цефодокс.
Критерии исключения из исследования: наличие врожденных аномалий развития органов дыхания (Q30Q34), муковисцидоз (E84).
Первичные задачи исследования: установить клиническую эффективность 5дневного перорального применения препарата Цефодокс для терапии детей с рекуррентными формами острых бактериальных бронхитов на фоне гипертрофии лимфоглоточного кольца.
Вторичные задачи исследования: установить влияние 5дневного перорального применения препарата Цефодокс на состав микрофлоры респираторного тракта и течение системного бактериального воспалительного процесса, установить безопасность и переносимость препарата.
Первичная переменная эффективности: процентное соотношение изменения исходных (начало исследования), промежуточных (день 3) и конечных (день 5) симптомов рекуррентных форм острых бактериальных бронхитов на фоне гипертрофии лимфоглоточного кольца, общих симптомов основного заболевания, эпизодов развившихся осложнений.
Вторичная переменная эффективности: динамика показателей исследования микрофлоры респираторного тракта — исходных (начало исследования) и конечных (день 5), сывороточного уровня прокальцитонина — исходного (начало исследования) и конечного (день 5).
Переменная безопасности: нежелательные явления и побочные реакции на препарат.
Препарат Цефодокс использовался в форме суспензии, содержащей в 5 мл 50 мг цефподоксима, перорально во время приема пищи в дозе 10 мг/кг массы тела в сутки двукратно с интервалом 12 часов.
Сопутствующая терапия включала применение мукотропных средств (амброксол), антипиретиков (парацетамол — по показаниям) в возрастных дозировках, согласно национальным протоколам [1].
Клинический метод исследования состоял в оценке данных клинической картины заболевания, общеклинических методов исследования (общий анализ крови, общий анализ мочи). Микробиологическое исследование проводилось утром до приема пищи путем взятия стерильным ватным тампоном материала с поверхности слизистой носа и небных миндалин, его посева на кровяной агар с последующей оценкой полученных изолированных колоний.
Сравнительная оценка динамики клинического состояния детей с рекуррентными бронхитами проводилась в условных баллах (на основе адаптированной к детскому возрасту формализованной системы базовых клинических показателей для оценки состояния больных с обструктивными и необструктивными болезнями органов дыхания по В.Н. Савченко, 2001) [10] (табл. 1).
Количественное определение прокальцитонина в сыворотке крови проводилось методом иммуноферментного анализа на фотометреанализаторе Sunrise (TECAN, Австрия).
Полученные результаты обрабатывались посредством критерия U Манна — Уитни и углового критерия Фишера. Исследование было проведено в соответствии с этическими принципами медицинского исследования, проводимого на людях, которые были приняты Хельсинкской декларацией (2008), и качественной клинической практики (GCP).
Результаты и их обсуждение
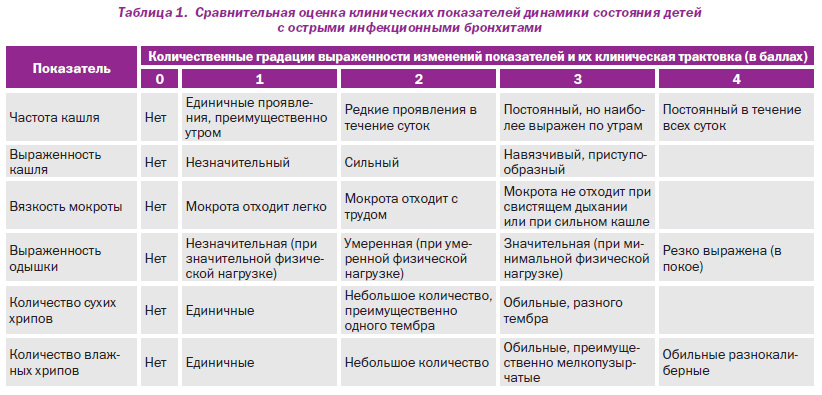
Для объективизации оценки течения острых бронхитов у детей группы наблюдения была использована сравнительная оценка динамики количества детей, достигших целевых значений клинического выздоровления (температура тела –36,5–36,9 °С, отсутствие головной боли, отсутствие гиперемии слизистой оболочки глотки, нормальная дневная активность, нормализация аппетита) (рис. 1), а также клинических проявлений бронхообструктивного синдрома в баллах (рис. 2).
Данные, представленные на рис. 1, указывают на статистически значимое (Р < 0,05) улучшение общей симптоматики при использовании Цефодокса у детей с рекуррентными бронхитами на фоне гипертрофии лимфоглоточного кольца на 3и сутки терапии в отношении купирования головной боли и гиперемии слизистой оболочки глотки.
В целом 72часовой мониторинг состояния пациентов показал его положительную динамику и эффективность проводимых противомикробных мероприятий при отсутствии побочного действия препарата, что обосновывало возможность дальнейшего продолжения терапии Цефодоксом.
При мониторинге состояния пациентов на 5е сутки лечения было зарегистрировано статистически достоверное (Р < 0,05) улучшение всех исследуемых показателей. Это позволило ограничить применение Цефодокса при данной патологии пятью сутками. Только у двух детей сохранялась субфебрильная температура тела, что, учитывая преморбидный фон пациентов (частые эпизоды бронхитов в анамнезе, наличие гипертрофии лимфоидной ткани глотки), потребовало продления антибактериальной терапии до 7 дней. После 7го дня использования Цефодокса излечение было констатировано у всех пациентов.
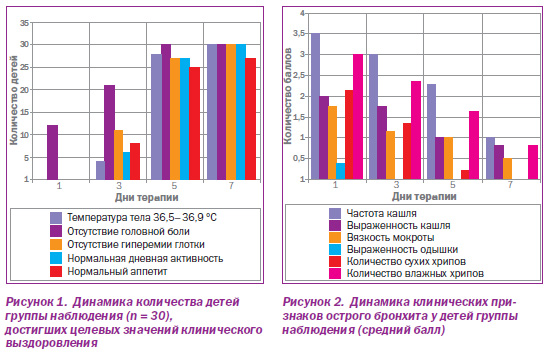
Важно отметить, что улучшение клинических показателей течения рекуррентных бронхитов при применении Цефодокса сопровождалось выраженной положительной динамикой параметров функционирования секреторноэвакуаторных механизмов бронхов как ведущих проявлений бронхообструктивного синдрома при основном заболевании.
Как видно из динамики показателей, приведенных на рис. 2, острый период рекуррентных бактериальных бронхитов у детей, получавших Цефодокс, протекал с выраженной позитивной динамикой не только общеинтоксикационного, но и бронхообструктивного синдрома. Это проявилось как в сумме баллов по каждому дню заболевания в отдельности, так и в общей сумме баллов по симптомам за весь период болезни. Оставшаяся после прекращения приема Цефодокса на 5е и 7е сутки симптоматика купировалась применением мукотропных препаратов согласно национальному протоколу.
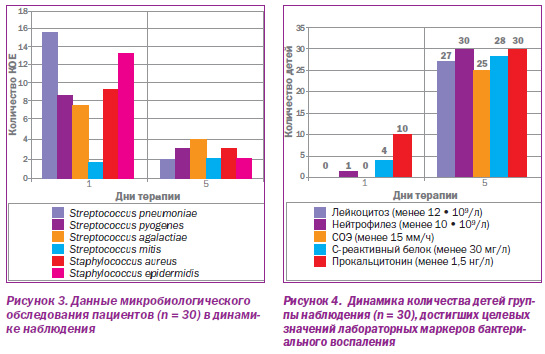
Динамика выраженности воспалительного процесса контролировалась путем мониторинга количества колониеобразующих единиц (КОЕ) патогенной и условнопатогенной микрофлоры на слизистых оболочках ротоглотки пациентов и лабораторных маркеров бактериального воспаления. Оценивалось количество детей, у которых исследуемые показатели достигали установленных целевых значений: лейкоцитоз (менее 12 • 109/л), нейтрофилез (менее 10 • 109/л), СОЭ (менее 15 мм/ч), сывороточные уровни Среактивного белка (менее 30 мг/л), прокальцитонина (менее 1,5 нг/л). Результаты представлены на рис. 3, 4.
Микробиологическое исследование после 5дневной терапии Цефодоксом продемонстрировало статистически значимое (Р < 0,05) снижение числа КОЕ выделенных патогенов, что свидетельствует о достаточном уровне противомикробной активности препарата и возможности его использования у детей при лечении респираторных бактериальных инфекций.
Результаты динамического исследования лабораторных маркеров бактериального воспаления показали, что число детей, достигших целевых значений при терапии Цефодоксом, статистически достоверно увеличилось (Р < 0,05). Это указывает на существенный положительный эффект данного антибиотика в отношении подавления острого бактериального воспалительного процесса.
Терапия препаратом Цефодокс у всех детей переносилась хорошо. Аллергических реакций, случаев нежелательных явлений и побочных действий препарата, описанных в аннотации, не отмечалось.
Выводы
Таким образом, использование Цефодокса у детей на протяжении 5 дней является высокоэффективным методом терапии рекуррентных бактериальных бронхитов у детей на фоне гиперплазии лимфоглоточного кольца, что выражается:
- в быстром клиническом улучшении состояния пациентов;
- эрадикации патогенной и условнопатогенной микрофлоры со слизистых оболочек респираторного тракта;
- подавлении острого бактериального воспалительного процесса.
Список литературы находится в редакции