Газета «Новости медицины и фармации» Гастроэнтерология (473) 2013 (тематический номер)
Вернуться к номеру
Ишемическая панкреатопатия
Авторы: Губергриц Н.Б., Зубов А.Д., Агапова Н.Г., Лукашевич Г.М. - Донецкий национальный медицинский университет им. М. Горького
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
Старенье часто видно по приметам,
Которые грустней седых волос:
Толкает нас к непрошеным советам
Густеющий сосудистый склероз.
Есть надо мало и совсем не пить,
Соленого и сладкого — нельзя,
А женщин — стороною обходить —
Вот старости печальная стезя.
Игорь Губерман
Почему же пожилые люди действительно имеют низкую толерантность к пищевой нагрузке (мало едят), плохо переносят острое, соленое, сладкое, не говоря уже об алкоголе? Одна из причин тому — ишемическая панкреатопатия.
Поджелудочная железа (ПЖ) особенна во всем, в том числе и в кровоснабжении (рис. 1).
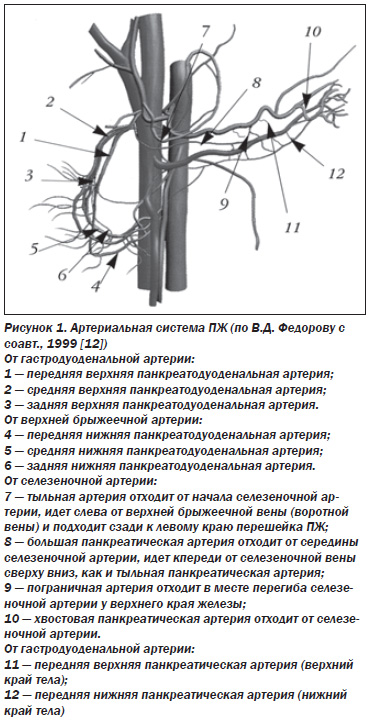
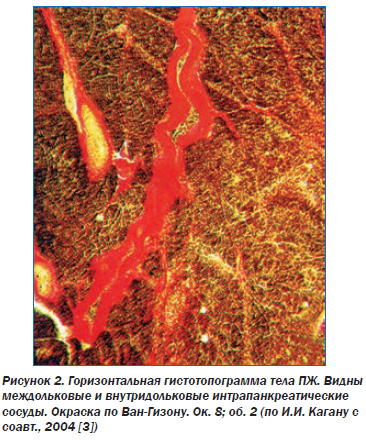
Главной особенностью является отсутствие собственных крупных артерий. ПЖ кровоснабжается из ветвей общей печеночной, верхней брыжеечной и селезеночной артерий. Несмотря на высокую вариабельность, принято выделять 12 артерий ПЖ (6 панкреатодуоденальных, тыльную артерию, большую панкреатическую артерию, пограничную артерию, хвостовую панкреатическую артерию, передние верхнюю и нижнюю панкреатические артерии), а также 5 артериальных дуг, обеспечивающих кровоток органа. Эти артерии и дуги ПЖ образуют замкнутый перипанкреатический артериальный круг, от которого на всем протяжении отходят анастомозирующие между собой ветви по передней и задней поверхности органа. В результате артериальная система ПЖ является трехмерной внутриорганной сетью широко анастомозирующих между собой сосудов (рис. 2) [6, 12].
Перипанкреатический артериальный круг и внутриорганные анастомозы обеспечивают внутрисистемные (бассейн чревного ствола) и межсистемные (бассейны чревного ствола и верхней брыжеечной артерии) артериальные связи. Этим обеспечивается пластичность артериального русла ПЖ за счет быстрого перераспределения крови. Но в то же время вовлечение артерий ПЖ в патологический процесс при абдоминальной ишемии обусловливает столь же быстрое развитие необратимых изменений паренхимы. Особенности кровоснабжения ПЖ объясняют частоту ишемических панкреатопатий при абдоминальном ишемическом синдроме (АИС). Так, ишемические поражения ПЖ занимают второе место после эрозивноязвенных поражений желудка у больных с АИС и встречаются при хронической абдоминальной ишемии в 33,5 % случаев [6].
Венозная система ПЖ не менее сложна, чем артериальная. Отток крови из долек ПЖ осуществляется через 2–3 дольковые вены. Они, сливаясь, формируют междольковые вены. Эти вены соединяются в более крупные и впадают в сагиттальные и фронтальные аркады. Вены головки ПЖ представлены одноименными с артериями панкреатодуоденальными венами, которые образуют 2 венозные дуги, и собственными венами головки. Последние впадают в верхнюю брыжеечную вену и правую ветвь воротной вены. Интересно, что количество вен почти в 2 раза больше, чем число артерий. Таким образом создается мощная система венозных сплетений, которые регулируют кровенаполнение паренхимы. Вены тела и хвоста ПЖ образуют 2 венозные дуги, но венозная система уступает по насыщенности артериальной. Отличием венозной системы ПЖ является меньшее количество межвенозных анастомозов, чем межартериальных, а также отсутствие перипанкреатического венозного круга, который бы затруднял отток крови от ПЖ [12].
Этиология и патогенез ишемической панкреатопатии. Ишемия ПЖ может развиваться по трем принципиальным механизмам (рис. 3).
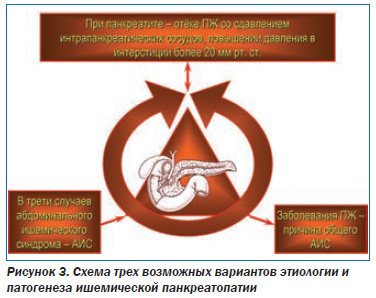
Вопервых, элементы ишемии ПЖ неизбежно возникают при остром панкреатите, обострении хронического панкреатита (ХП), когда вследствие отека органа повышается внутриорганное давление. Если это давление превышает 20 мм рт.ст., то это приводит к сдавлению интрапанкреатических сосудов, усугублению панкреатита и усилению панкреатической боли. То есть ПЖ в этих ситуациях создает ишемию сама себе, ухудшая течение панкреатита. Кроме того, ишемия ПЖ может развиваться изза сдавления питающих ее сосудов (экстравазальные причины) или изза заболевания этих сосудов (интравазальные причины) [5, 6]. Экстравазальный стеноз чревного артериального ствола или его ветвей может иметь место при их сдавлении фиброзноизмененной срединной дугообразной связкой и медиальными ножками диафрагмы, ганглиями чревного сплетения и т.д. Важно, что сама ПЖ при значительном увеличении размеров (опухоли, кисты и др.) вновь может способствовать возникновению АИС и, следовательно, собственной ишемии, оказывая давление на чревный ствол, верхнюю брыжеечную артерию и даже брюшную аорту. Такая возможность обусловлена тесными анатомотопографическими связями ПЖ с крупными сосудами (рис. 4).
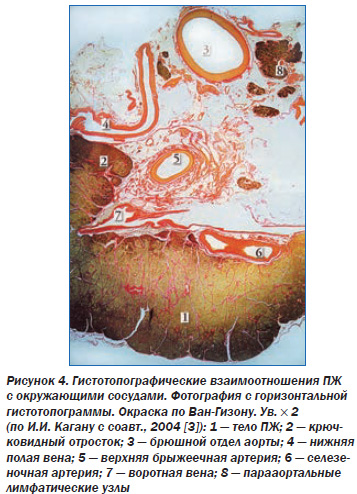
Это второй вариант патогенеза ишемической панкреатопатии. Следует отметить, что ПЖ топографически связана не только с артериями, но и с венами, изза сдавления которых увеличенным органом может развиться подпеченочная портальная гипертензия, спленомегалия, тромбоз селезеночной вены. Давление увеличенной ПЖ на нижнюю полую вену, расположенную между ней и позвоночником, может стать причиной отека нижних конечностей. Интравазальные причины ишемии ПЖ (третий вариант патогенеза ишемической панкреатопатии): атеросклероз брюшной аорты (рис. 5), чревного ствола и их ветвей, тромбангиит, узелковый периартериит, диабетическая ангиопатия, системная красная волчанка, вызванный амфетаминами некротизирующий ангиит, злокачественная гипертензия [2, 17].
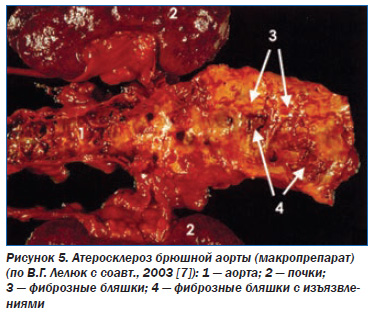
В некоторых случаях идиопатический панкреатит развивается на фоне стенозирующего атероматоза панкреатических сосудов и сопровождается шоком [17]. Причем при постепенном атеросклеротическом сужении сосудов развивается ишемический ХП, а при эмболии из атероматозной бляшки — острая ишемия ПЖ. Последнее состояние, вплоть до инфаркта ПЖ, может развиться и при других заболеваниях, сопровождающихся повышенным тромбообразованием со склонностью к тромбоэмболии (стеноз митрального отверстия, бактериальный эндокардит, тромбоваскулиты и др.). Провоцирующим фактором по отношению к острой ишемии ПЖ может быть аортография. Факторами риска являются также сочетание атеросклероза с артериальной гипертензией, инфаркт миокарда, цирроз печени, почечная недостаточность, аневризма и тромбоз селезеночной вены, рак ПЖ, сыпной тиф и т.д. [1, 5]. В большой части случаев различные факторы, приводящие к ишемии ПЖ, сочетаются с другими этиологическими факторами ХП (алкоголь, билиарная патология и др.), и заболевание не является чисто ишемическим. Диабетическая ангиопатия чаще приводит к хронической ишемии ПЖ вследствие постепенного уменьшения просвета сосудов, особенно при частом сочетании с их атеросклеротическим поражением. Однако изза склонности к тромбообразованию при диабетической ангиопатии возможна и острая ишемия ПЖ по типу очагового панкреонекроза [1]. То есть не только панкреатит приводит к вторичному сахарному диабету, но и наоборот, сахарный диабет, особенно при длительном течении у пожилых больных, может вызывать развитие ишемического панкреатита и экзокринной недостаточности ПЖ.
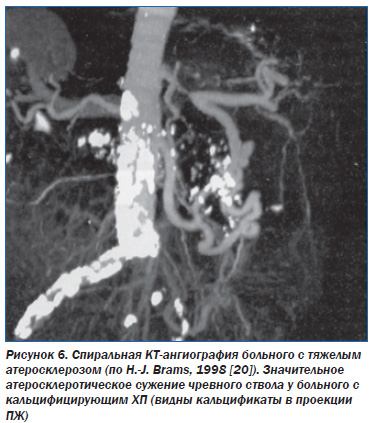
Однако возможны и другие варианты развития ишемии ПЖ. Например, возможно сочетание кальцифицирующего панкреатита с выраженным общим атеросклерозом, в т. ч. с атеросклерозом брюшной аорты и чревного ствола (рис. 6).
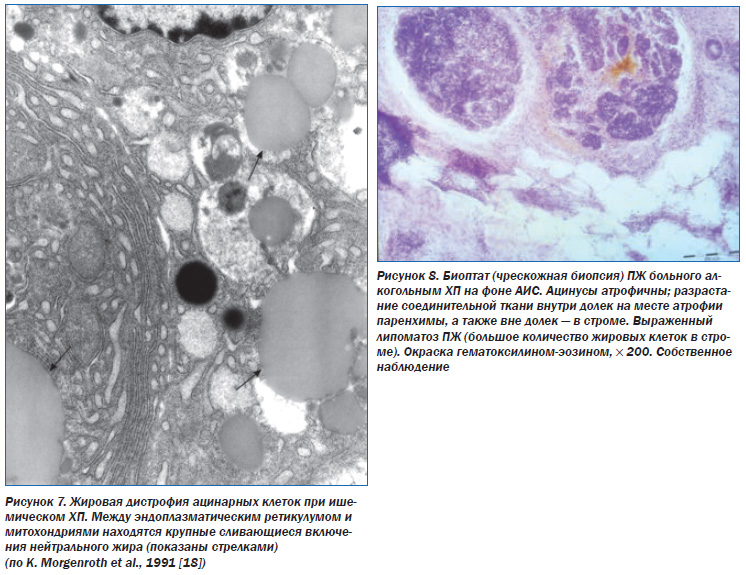
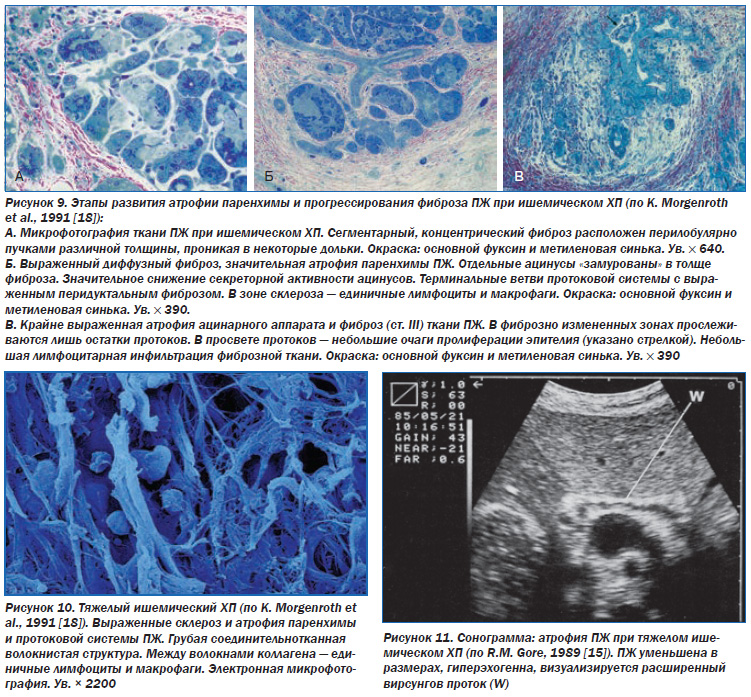
Патоморфология. При хронической ишемии ПЖ происходят постепенная атрофия ацинусов и островков Лангерганса, жировая дистрофия ацинарных клеток (рис. 7), разрастание жировой ткани вокруг ацинусов (липоматоз ПЖ) (рис. 8), замещение участков атрофии соединительной тканью (фиброзирование ПЖ) (рис. 9а, б, в, 10), метаплазия протокового эпителия, кистозное расширение протоков.
В результате выраженной атрофии и фиброза ПЖ может уменьшиться в размерах, что подтверждается результатами сонографии, компьютерной томографии (рис. 11).
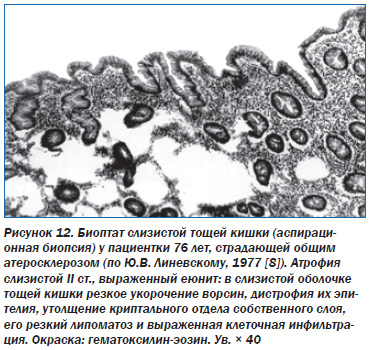
Вследствие этого прогрессирует внешне и внутрисекреторная недостаточность ПЖ. Важно, что ишемический ХП обычно является компонентом АИС. При этом параллельно развивается ишемическая энтеропатия, сущностью которой является атрофия ворсинок тонкой кишки (рис. 12) [8]. То есть сочетание атрофии паренхимы ПЖ, ее фиброза, атрофии кишечных ворсинок составляет морфологическую основу прогрессирующих мальдигестии и мальабсорбции, которые развиваются у пожилых людей вследствие атеросклероза. Это и есть так называемые «стареющие органы пищеварения». При острой ишемии ПЖ имеют место явления очагового геморрагического некроза.
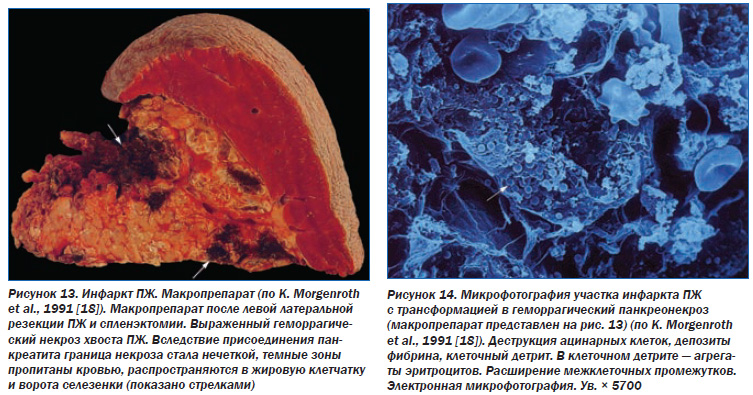
Причем в отличие от острого геморрагического панкреатита при острой ишемии ПЖ некроз ограничен областью нарушения кровообращения, не распространяется на окружающую ткань органа и парапанкреатическую клетчатку. Инфаркт ПЖ быстро вызывает развитие острого геморрагического панкреатита, т.к. из подвергшейся некрозу паренхимы высвобождаются ферменты и запускается аутолиз, т.е. развивается острый панкреатит (рис. 13, 14).
При инфаркте миокарда острый геморрагический панкреатит может развиться и как результат тромбоза панкреатических сосудов, и непосредственно как осложнение самого инфаркта миокарда. Исходом острой ишемии ПЖ может быть рубцевание, образование острой псевдокисты, нередко с нагноением последней.
Клиника. Прежде всего следует учитывать, что ишемия ПЖ крайне редко бывает изолированной, т.е. в клинике, как правило, имеют место явления ишемического поражения других органов брюшной полости (АИС).
Классические клинические проявления АИС складываются из трех симптомов: боли в животе, дисфункции кишечника и похудения [2]. Боли появляются или усиливаются после приема пищи, так как на высоте пищеварения органы брюшной полости нуждаются в большем притоке крови, который не может быть обеспечен при АИС. В связи с этим возникновение боли зависит не от качества, а от количества пищи, принятой пациентом. Этот момент следует учитывать при дифференциальной диагностике ишемического ХП в составе АИС и банального ХП (алкогольного, билиарного и др.). Вообще, самый частый неправильный диагноз, который ставят больным с АИС — это ХП, имея в виду неишемическую этиологию, так как при этом заболевании также развиваются боли после еды, которые плохо купируются. Кроме того, диагноз любого ХП, в т.ч. и ишемического, сложно объективизировать. Следовательно, при наличии болей в животе после еды при отсутствии явной органической причины, выявляемой традиционными методами визуализации, обычно ставят диагноз ХП. В дифференциальной диагностике также важно учитывать, что боли при АИС могут провоцироваться или совпадать с приступами стенокардии, эпизодами подъема или снижения артериального давления. Боли, как правило, не имеют четкой локализации. Их интенсивность может быть различной в зависимости от чувствительности органов пищеварения к ишемии и от степени нарушения кровотока. Нередко боли по интенсивности достигают характера «морфинных», что является еще одной причиной сложности дифференциальной диагностики АИС и изолированных заболеваний ПЖ (например, при банальном ХП и особенно при раке ПЖ также имеют место интенсивные, крайне плохо купирующиеся боли). Характер боли также зависит от выраженности сосудистых нарушений (варьирует от чувства тяжести в эпигастрии до ноющих болей и далее — до жгучих болей) и индивидуальных особенностей висцеральной чувствительности [4]. Ишемическая дисфункция тонкой кишки проявляется неустойчивым стулом или диареей, метеоризмом и прогрессирующей мальабсорбцией, а дисфункция толстой кишки — запорами [11]. Похудание связано с мальабсорбцией, а также с отказом больных от пищи изза боязни появления боли (ситофобии) [9]. Кстати, ситофобия характерна также для банального ХП, что является еще одной причиной постановки этого неправильного диагноза при АИС.
При объективном исследовании симптомом, позволяющим заподозрить АИС, является систолический шум. Если он выслушивается на 2–4 см ниже мечевидного отростка по срединной линии, то речь идет об атеросклерозе брюшной аорты и/или чревного ствола. Если шум выслушивается ниже — чуть выше пупка, то следует думать о стенозе верхней брыжеечной артерии. Однако этот шум появляется лишь при сужении артерии на 80–90 %. При пальпации могут определяться пульсация и болезненность брюшной аорты [6, 10].
Ишемический ХП может протекать в виде двух клинических вариантов. Первый вариант соответствует вышеописанной клинике АИС. По мере прогрессирования атрофии паренхимы ПЖ приступы болей урежаются, а прогрессируют явления функциональной панкреатической недостаточности с учащением стула, похудением, инсулярной недостаточностью. То есть клиника гиперферментного панкреатита трансформируется в гипоферментный панкреатит с соответствующими ему лабораторноинструментальными маркерами. Так, в период болевого приступа повышается содержание ферментов в крови. На ишемический характер болей указывают пожилой возраст больного, систолический шум над брюшной аортой (непостоянный признак), результаты допплеровского исследования сосудов брюшной полости. Второй клинический вариант ишемического ХП характеризуется тем, что без предшествующего выраженного болевого синдрома нарастают симптомы гипоферментии, сахарного диабета. Для диагностики применяются те же методы. Кроме того, при УЗИ ПЖ определяется значительное повышение эхогенности ее ткани, иногда уменьшение размеров органа (рис. 11). Эти же изменения наблюдаются при длительном течении первого варианта ишемического ХП.
Острый ишемический панкреатит и инфаркт ПЖ клинически протекают в виде чрезвычайно интенсивного приступа боли в эпигастрии, левом подреберье с характерной иррадиацией в поясницу. Типичны рвота, коллапс. При пальпации выражены болезненность и резистентность в проекции ПЖ. В отличие от банального острого панкреатита лейкоцитоз, ускорение СОЭ, гиперферментемия не определяются. Диагноз острого ишемического панкреатита и инфаркта ПЖ очень сложен. При УЗИ выявляют отек, неоднородность структуры ПЖ, иногда кальцинаты в ее ткани. При подозрении на острую ишемию ПЖ проводят допплеровское исследование сосудов брюшной полости. Ангиографические исследования опасны изза возможности провокации тромбоэмболии, хотя А.Л. Костюченко с соавт. (2000) [5] советуют применять эти диагностические методы даже при инфаркте ПЖ для определения места окклюзии сосудов.
Осложнениями острой ишемии ПЖ могут быть острые язвы желудка, флегмона его стенки.
Диагностика ишемического ХП в составе АИС не является сложной, особенно после внедрения в клиническую практику ангиографии и допплеровского исследования сосудов. Проблема состоит в недостаточности знаний врачей об АИС и в связи с этим — в редком назначении обследования, подтверждающего наличие ишемического поражения органов брюшной полости.
Выделяют следующие группы диагностических методов в зависимости от их чувствительности при АИС [6]:
1. Анамнез (чувствительность 78 %) — наличие сердечнососудистых заболеваний, облитерирующего эндартериита, метаболического синдрома, сахарного диабета.
2. Пальпация и аускультация брюшной аорты (чувствительность 50–60 %).
3. Инструментальные методы:
— УЗИ (чувствительность 50–75 %);
— допплеровское исследование (чувствительность 80 %);
— КТ (чувствительность 78–82 %);
— ангиография (чувствительность 90–95 %).
Лечение. Прежде всего необходимо проводить лечение основного заболевания, проявлением которого является ишемия ПЖ. При хронической ишемии ПЖ лечение соответствует терапии гипер или гипоферментного панкреатита (в зависимости от клинического варианта). Кроме того, лечение дополняют нитратами, антикоагулянтами, препаратами, улучшающими микроциркуляцию (плавикс и др.), корригирующими липидный спектр крови и обладающими цитопротективными свойствами (препараты, содержащие эссенциальные фосфолипиды).
Принципиальное значение в лечении ишемического ХП, в компенсации нарушений пищеварения при АИС имеют минимикросферические ферментные препараты. Данные препараты являются золотым стандартом в заместительной терапии при панкреатической недостаточности. Эффективность минимикросферических ферментных препаратов для заместительной терапии при внешнесекреторной недостаточности ПЖ соответствует уровню доказательности А [20]. Проведено также множество исследований, соответствующих уровню В. Исследования обоих уровней доказывают бесспорное превосходство минимикросферических ферментных препаратов по сравнению с таблетированными. Эти исследования столь убедительны, что проведение их основной массы завершилось в 80х гг. XX в., так как нет необходимости чтолибо еще доказывать в этом отношении. Лишь единичные исследования, уточняющие некоторые детали фармакокинетических свойств препаратов, проводились в 90е гг. Кратко приведем результаты некоторых из них. I. Ihse et al. (1980) [16] доказали в исследовании, соответствующем уровню В, что при приеме таблетированных ферментных препаратов не происходит увеличения содержания панкреатических ферментов в дуоденальном аспирате в течение 2 часов после приема пробного завтрака. Аналогично этому таблетированные препараты с таниновой оболочкой, то есть защищенные от низкого рН и пепсина, также не способствовали изменению уровня ферментов ПЖ в дуоденальном содержимом. С другой стороны, уменьшение размеров лекарственной формы препаратов даже до размера гранул (гранулы Pankreon) способствовало значительному увеличению содержания в просвете двенадцатиперстной кишки амилазы, липазы, фосфолипазы и трипсина. То есть было доказано, что именно уменьшение частиц ферментного препарата имеет принципиальное значение для обеспечения эвакуации препарата из желудка вместе с химусом, тогда как таблетированные формы задерживаются в желудке (в исследовании и таблетированные, и гранулированные препараты имели кислотоустойчивую оболочку). Аналогичные данные, подтверждающие значение размера лекарственной формы ферментного препарата, проведены J.H. Meyer et al. (1985) [14].
Развитие асинхронизма при пассаже химуса и таблетированных ферментных препаратов и отсутствие этого асинхронизма при приеме микросферических препаратов доказано также исследованиями M.G. Bruno et al. (1995) [13], которые регистрировали динамику пассажа химуса и препарата, их соотношение в пищеварительном тракте путем внесения в них изотопной метки (уровень В).
Подтверждение недостаточной эффективности таблетированных препаратов для заместительной терапии получено S. Mundlos et al. (1991) [19]. С помощью дыхательных тестов показано, что ферментные препараты при диаметре более 2 мм не увеличивают абсорбцию жира. Кроме того, такие средства даже в больших дозах не приводят к полному исчезновению стеатореи изза того же асинхронизма.
Минимикросферические ферментные препараты патогенетически обоснованы в лечении ишемического ХП также благодаря своему свойству купировать панкреатическую боль. Следует напомнить, что ишемия является патогенетическим компонентом болевого синдрома при ХП любой этиологии (см. выше). Ферментные препараты уменьшают болевой синдром по механизму обратной связи, способствуя снижению стимулирующих влияний на секрецию ПЖ. Вследствие этого создается «функциональный покой» органу, уменьшается выраженность отека, инфильтрации, а значит и ишемии ПЖ. Так, результаты рандомизированного исследования указывают на статистически достоверное уменьшение болевого синдрома у больных ХП при приеме двухоболочечного микросферического препарата (уровень В). Следует отметить, что больные сами регулировали дозу препарата, выбирая такую, которая приводила к снижению интенсивности боли [21]. Оказалось, что больные принимали для купирования боли 480–960 ЕД F.I.P. протеаз на прием. Важно отметить, что такое лечение было эффективным у больных с различной степенью панкреатической недостаточности, в т.ч. с тяжелой. И это не случайно. Ведь панкреатическая недостаточность может быть самостоятельной причиной боли при ХП.
Однако радикальным является только хирургическое лечение, характер которого зависит от причины ишемии ПЖ (например, протезирование чревного ствола, трансаортальная эндартэктомия и др.).
При острой ишемии ПЖ проводят консервативное лечение (новокаиновые блокады, ингибиторы протеаз, антикоагулянты), а также хирургическое лечение (например, тромбоэмболэктомия). То есть лечение проводится по принципам ведения больного острым геморрагическим панкреатитом.
Современные лекарственные средства (особенно эффективные минимикросферические ферментные препараты, сосудорасширяющие, гиполипидемические средства), а также хирургические методы лечения позволяют с бóльшим, чем еще лет 10 назад, оптимизмом оценивать прогноз больных с АИС и конкретно с ишемической панкреатопатией. Вполне можно ожидать, что при адекватном лечении «стареющая» ПЖ позволит всетаки и есть побольше, в том числе соленое и сладкое, и даже без особых последствий принять немного алкоголя (см. эпиграф).
1. Гребенев А.Л. Сосудистые поражения поджелудочной железы // Руководство по гастроэнтерологии. — М., 1996. — Т. 3. — С. 117120.
2. Ишемическая болезнь кишок / М.Б. Коломойская, Е.А. Дикштейн, В.А. Михайличенко, Н.М. Ровенская. — Киев: Здоров’я, 1986. — 136 с.
3. Каган И.И., Железнов Л.М. Поджелудочная железа: микрохирургическая и компьютернотомографическая анатомия. — М.: Медицина, 2004. — 152 с.
4. Калинин А.В., Степуро Д.К., Токмулина Г.М. Хронический абдоминальный ишемический синдром. Особенности клиники и диагностики // Рос. журн. гастроэнтерологии, гепатологии, колопроктологии. — 2003. — Прил. № 21. Материалы IX Российской гастроэнтерологической недели. — М., 2003. — С. 52.
5. Костюченко А.Л., Филин В.И. Неотложная панкреатология. — СПб.: Деан, 2000. — 480 с.
6. Лазебник Л.Б., Звенигородская Л.А. Хроническая ишемическая болезнь органов пищеварения. — М.: Анахарсис, 2003. — 136 с.
7. Лелюк В.Г., Лелюк С.Э. Методика ультразвукового исследования сосудистой системы: технология сканирования, нормативные показатели (Метод. пособие). — М., 2002. — 39 с.
8. Линевский Ю.В. Значение функциональной патологии и морфологических изменений тонкой кишки в патогенезе, диагностике хронических энтеритов и их лечение: Дис… дра мед. наук (14.00.05. Внутр. болезни) / Дон. гос. мед. инт. — Донецк, 1977. — 423 с.
9. Ойноткинова О.Ш., Немытин Ю.В. Атеросклероз и абдоминальная ишемическая болезнь. — М.: Медицина, 2001. — 312 с.
10. Парфенов А.И. Энтерология. — М.: ТриадаХ, 2002. — 744 с.
11. Покровский А.В. Заболевания аорты и ее ветвей. — М.: Медицина, 1979. — 324 с.
12. Федоров В.Д., Буриев И.М., Икрамов Р.З. Хирургическая панкреатология. — М.: Медицина, 1999. — 208 с.
13. Bruno M.J. Exocrine pancreatic insufficiency: Efficacy of enzyme replacement therapy. — Amsterdam: Thesis Publishers, 1995. — 167 p.
14. Effect on size and density on canine gastric emptying of nondigestive solids / J.H. Meyer, J. Dressman, A.S. Fink, G. Amidon // Gastroenterol. — 1985. — Vol. 89. — P. 805813.
15. CT of the Intestinal Tract. The radiologic clinics of North America / Ed. R.M. Gore. — Philadelphia: W.B. Saunders Company, 1989. — 838 p.
16. Ihse I., Lilja P., Lundquist I. Intestinal concentrations of pancreatic enzymes following pancreatic replacement therapy // Scand. J. Gastroenterol. — 1980. — Vol. 15. — P. 137144.
17. Lankisch P.G., Banks P.A. Pancreatitis. — Berlin; Heidelberg; New York et al.: SpringerWerlag, 1998. — 377 p.
18. Morgenroth K., Kozuschek W. Pancreatitis. — Berlin; New York: Walter de Gruyter, 1991. — 120 p.
19. Mundlos S., Kuhnelt P., Adler G. Monitoring enzyme replacement treatment in exocrine pancreatic insufficiency using the cholesteryl octanoate breath test // Gut. — 1991. — Vol. 31. — P. 13241328.
20. The Pancreas / Ed. H.G. Beger et al. — Oxford et al.: Blackwell Science Ltd., 1998. — Vol. 1. — 885 p.
21. Selfadministration of enzyme substitution in the treatment of exocrine pancreatic insufficiency / O.J. Ramo, P.A. Puolakkainen, L. Seppala, T.M. Schroder // Scand. J. Gastroenterol. — 1989. — Vol. 24. — P. 688692.