Газета «Новости медицины и фармации» Неврология (474) 2013 (тематический номер)
Вернуться к номеру
Послеоперационная когнитивная дисфункция у женщин среднего возраста: инцидентность и методы профилактики
Авторы: Лесной И.И., Белка К.Ю., Климчук Л.В., Воробьева Л.И., Кабанчук Ю.В., Катриченко М.О.,
Сидоренко К.Д., Балахонов О.И. - Национальный институт рака, отделение анестезиологии и интенсивной терапии, г. Киев
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
Актуальность
Мысль о том, что действие анестетиков не оканчивается с прекращением анестезии, существует давно. Современное состояние демографической ситуации во многих развитых странах, а также ускорение темпа жизни увеличивают требования к качеству анестезии и хирургии в целом. В последние десятилетия стала актуальной проблема влияния анестезии и хирургического вмешательства на когнитивные функции пациентов в раннем и отдаленном послеоперационном периоде. В частности, 10 % судебных исков в сфере медицины связаны именно с этой проблемой [1].
Послеоперационная когнитивная дисфункция (ПОКД) — это когнитивное расстройство, которое развивается в раннем и сохраняется в позднем послеоперационном периоде, клинически проявляется в виде нарушений памяти, затруднения концентрации внимания и нарушений иных высших функций коры головного мозга (мышление, речь и т.п.) [3]. Для диагностики ПОКД стандартно рекомендуют тестирование когнитивных функций по шкале оценки психического статуса Фолстейна (Mini-Mental State Examination, MMSE), о развитии ПОКД свидетельствует снижение предыдущих показателей на 10 % и более [2].
По данным некоторых публикаций, развитие ПОКД ассоциируется с увеличением продолжительности госпитализации, ухудшением качества жизни и удовлетворенности пациентов, а также с повышением летальности у людей пожилого возраста [3]. Тем не менее большое значение имеет риск возникновения ПОКД у людей среднего возраста после проведения плановых оперативных вмешательств, что значительно влияет на их трудоспособность и качество жизни в целом.
Гистерэктомия — вторая по распространенности операция у женщин. Ежегодно выполняется 600 тысяч гистерэктомий, и каждая третья женщина старше 60 лет перенесла такую операцию в США. Среди доступных работ в базах Medline, Pubmed, Cochrane публикаций относительно частоты возникновения ПОКД у пациенток после онкогинекологических операций нет, отсутствуют также отечественные публикации. Поэтому целью нашего исследования было определить актуальность проблемы ПОКД для женщин среднего возраста после гистерэктомий, частоту возникновения ПОКД и возможные факторы ее риска, а также исследовать эффективность профилактики ПОКД путем назначения нейропротекторных препаратов, в частности Глиатилина.
Одними из наиболее эффективных препаратов среди нейропротекторов являются производные экзогенного холина: CDP (цитиколин), GPS (холина альфосцерат (Глиатилин)).
Глиатилин содержит холин и глицерофосфат, который превращается в организме в метаболически активную форму, способен проникать через гематоэнцефалический барьер и активировать биосинтез ацетилхолина в пресинаптических мембранах холинергических нейронов [6].
В исследованиях на животных показано, что Глиатилин предотвращает индуцированный холинергический дефицит, развитие деменции, облегчает процессы обучения и запоминания за счет увеличения синтеза и высвобождения ацетилхолина в мозговых структурах [7].
Другим механизмом действия Глиатилина является анаболический эффект, который проявляется в стимуляции мембранного и глицеролипидного синтеза вследствие образования предшественников фосфолипидов мембран из продуктов его метаболического распада [7, 8].
Таким образом, Глиатилин активирует холинергическую нейротрансмиссию, повышая пластичность тканей мозга, осуществляет мембраностабилизирующее и антиоксидантное действие.
Были проведены многочисленные исследования, которые продемонстрировали эффективность Глиатилина в отношении двигательных нарушений, уровня сознания, когнитивных нарушений у больных в остром периоде мозгового инсульта [9–15]. Продемонстрировано благотворное влияние Глиатилина на психическую деятельность больных, память, восстановление речевых функций [9–12].
Применение препарата Глиатилин ассоциировалось со значительным улучшением когнитивных функций у пациентов с болезнью Альцгеймера [9]. По результатам обзора тринадцати клинических исследований, в которые были включены 4054 пациента с ишемическим инсультом, Глиатилин оказывает положительное влияние на когнитивные функции у обследуемых больных.
Перспективным направлением остается периопе-рационное назначение Глиатилина с целью предот-вращения возникновения ПОКД и послеоперационного делирия у пациентов среднего и пожилого возраста.
Материалы и методы
На базе отделения анестезиологии и интенсивной терапии Национального института рака (г. Киев) проведено проспективное контролируемое исследование.
Целью исследования было определить частоту развития ПОКД у пациенток после плановых онкогинекологических оперативных вмешательств, а также эффективность и безопасность Глиатилина относительно предотвращения развития ПОКД.
В исследование включали пациенток, которые готовились к плановым гистерэктомиям по поводу рака шейки матки или рака тела матки.
Критериями включения в исследование были: согласие пациентки, возраст 60 лет или менее, запланированное оперативное вмешательство под общей анестезией продолжительностью 2 часа или более, анестезиологический риск по ASA ІІ–ІІІ, отсутствие у пациента недостатков слуха, зрения.
Критериями исключения были: отказ пациентки, возраст более 61 года, исходная оценка по шкале MMSE менее 23 баллов, выраженная сопутствующая патология сердечно-сосудистой, дыхательной систем, сахарный диабет, заболевание нервной системы (деменция, дисциркуляторная энцефалопатия, ОНМК в анамнезе и т.п.), психические заболевания, прием антидепрессантов или седативных препаратов, алкоголизм.
Пациентов распределили на 2 группы. Группа 1 — группа исследования: пациентам назначали Глиатилин в дозе 2 г внутривенно за 20 минут до конца операции и 1 г внутривенно через 24 часа после операции. Группа 2 — контрольная группа: без назначений Глиатилина.
После получения информированного согласия пациенток за день до операции проводили тестирование когнитивных функций по шкале оценки психического статуса Фолстейна (MMSE). Повторную оценку когнитивных функций проводили на 3-й и 7-й день после операции. Кроме того, отмечали скорость пробуждения пациенток после проведения общей ингаляционной анестезии и время до экстубации.
Время пробуждения пациентов определяли как время от прекращения ингаляции севофлюрана (с переходом на ингаляцию кислорода) до первого продуктивного контакта с пациентом (выполнение элементарных команд, например открывание глаз).
Время экстубации определяли от прекращения ингаляции севофлюрана до экстубации пациента при адекватном самостоятельном дыхании.
Критерием ПОКД было снижение результата теста оценки психического статуса Фолстейна после операции на 10 % и больше.
Проводили мониторинг периоперационного уровня глюкозы крови как маркера стресса, продолжительности анестезии. Уровень глюкозы крови определяли через 6 и 24 часа после операции.
При анализе полученных данных определяли инцидентность развития ПОКД в послеоперационном периоде, отношение шансов (ОШ) развития ПОКД в контрольной и исследуемой группах, продолжительность времени до пробуждения и экстубации, статистическую достоверность оценивали с помощью критерия Фишера (Statistica 8.0; WinPepi).
Результаты
В исследование включено 40 пациенток (группа 1 и 2 — по 20 пациенток соответственно), средний возраст — 44,2 года (95% доверительный интервал (ДИ): 41,2; 47,3). Группы статистически не отличались по возрасту и отвечали критериям включения в исследование.
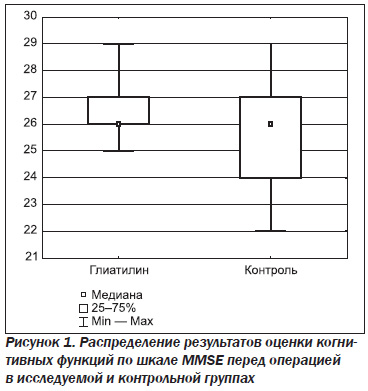
По результатам оценки когнитивных функций перед операцией (шкала MMSE) средний показатель в группе 1 составлял 26,7 (95% ДИ: 26,1; 27,3); в группе 2 — 25,8 (95% ДИ: 24,8; 26,7), что свидетельствует о статистически возможной однородности групп (р = 0,08) (рис. 1).
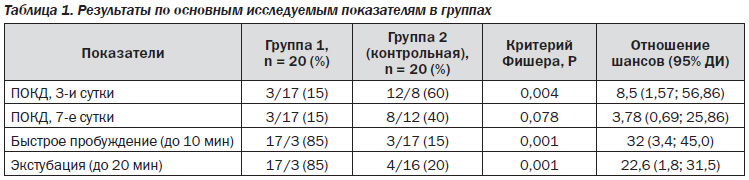
Всем пациенткам была выполненная гистерэктомия по поводу рака тела или шейки матки под общей ингаляционной анестезией севофлюраном, глубина которой контролировалась целевыми показателями МАК (1,5–2) и BIS-мониторинга (40–60). Для послеоперационного обезболивания комбинировали НПВП и опиоидные анальгетики. Время от остановки ингаляции анестетика до пробуждения пациента и до экстубации в группе 1 в среднем составляло 8,2 (95% ДИ: 7,6; 8,8) и 14 (95% ДИ: 13,4; 14,9) минут соответственно. В группе 2 (контрольной) время от остановки ингаляции анестетика до пробуждения пациента и до экстубации в среднем составляло 16,5 (95% ДИ: 14,7; 18,2) и 22,8 (95% ДИ: 21,1; 24,4) минуты соответственно. Установлено возможное отличие между группами по времени пробуждения и времени экстубации (р = 0,0001) (табл. 1).
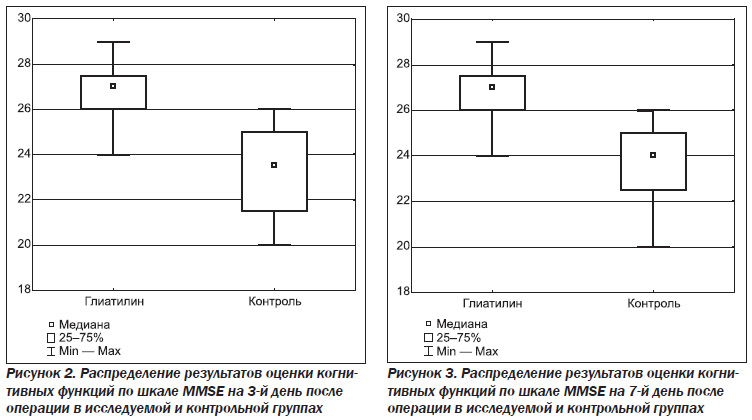
На 3-и сутки после операции всех пациенток повторно тестировали по шкале оценки психического статуса Фолстейна. Результаты приведены в табл. 1. ПОКД диагностировали у 3 (15 %) пациенток из группы 1 и 12 (60 %) пациенток из группы 2, разница между инцидентностью ПОКД в группах была статистически возможной (P = 0,004, ОШ = 8,5 (95% ДИ: 1,57; 56,86)). ОШ свидетельствует о том, что риск возникновения ПОКД в контрольной группе достоверно превышал риск ПОКД в исследуемой группе в 8,5 раза.
На 7-е сутки после операции всех пациенток снова тестировали по шкале оценки психического статуса Фолстейна. ПОКД диагностировали у 3 (15 %) пациенток из группы 1 и 8 (40 %) пациенток из группы 2, разница между инцидентностью ПОКД в группах не была статистически достоверной, тем не менее тенденция к большей инцидентности ПОКД в контрольной группе сохранялась (P = 0,078, ОШ = 3,78 (95% ДИ: 0,69; 25,86)). ОШ свидетельствует о том, что риск возникновения ПОКД в контрольной группе достоверно превышал риск ПОКД в исследуемой группе в 4 раза.
Уровень глюкозы крови статистически не отличался в группах. Через 6 часов после операции среднее значение глюкозы крови в группе 1 составляло 5,5 ммоль/л (95% ДИ: 4,6; 6,8); в группе 2 — 6,2 ммоль/л (95% ДИ: 5,2; 6,9). Через 24 часа после операции средний уровень глюкозы в группе 1 был 5,9 ммоль/л (95% ДИ: 4,68; 6,8); в группе 2 — 6,0 ммоль/л (95% ДИ: 4,9; 6,9), р > 0,05.
Средняя продолжительность оперативного вмешательства также статистически не различалась в группах и составляла в группе 1 — 132 минуты (95% ДИ: 122; 178), в группе 2 — 140 минут (95% ДИ: 125; 180), р > 0,05.
Обсуждение и выводы
Проблема когнитивной дисфункции после плановых онкогинекологических оперативных вмешательств актуальна для женщин среднего возраста. Частота возникновения ПОКД, по результатам нашего исследования, может представлять до 60 % у женщин после онкогинекологических операций. По данным зарубежных авторов, у неонкологических пациентов разного возраста частота возникновения ПОКД равна 31–40 % [2]. У большинства пациентов улучшение когнитивной функции происходит на протяжении следующих трех месяцев [2], тем не менее существует прямая связь между развитием ПОКД и увеличением смертности в первый год после больших некардиологических операций [21]. Кроме того, ПОКД ассоциируется с увеличением продолжительности госпитализации, времени восстановления функциональной активности, реабилитации, отрицательными социальными последствиями с ухудшением качества жизни [21].
Факторами риска ПОКД являются: преклонный возраст, низкий уровень образования, острое нарушение мозгового кровообращения или транзиторная ишемическая атака в анамнезе, повторные операции, интраоперационная гипоксия или большая кровопотеря [2]. Кроме того, в нескольких исследованиях показана взаимосвязь между уровнем секреции кортизола, воспалительных медиаторов, которые являются независимыми факторами стресс-реакции, и частотой возникновения ПОКД [22, 23]. Продолжительные эффекты анестетиков в форме антихолинергической или антикатехоламинергической [24, 25] активности, а также депривация сна [25], связанные с госпитализацией, могут вызвать когнитивные расстройства.
В данном исследовании мы изучали влияние применения препарата Глиатилин на частоту развития ПОКД, исключая факторы, которые могли бы влиять на исследуемый результат. Группы не отличались по возрасту, уровню образования, неврологическому анамнезу, типу операции, анестезии и послеоперационной анальгезии. У всех пациенток была выполнена первичная операция, группы статистически не различались по продолжительности операции, объему кровопотери, с исключением периодов интраоперационной гипоксии. О развитии стресс-реакции можно опосредованно судить по динамике глюкозы крови в обеих группах, основываясь на доказанной корреляции между уровнем глюкозы крови и уровнем стресс-факторов (кортизол, провоспалительные медиаторы) [26]. Динамика глюкозы крови статистически не различалась в исследуемых группах. Ведь пациентки обеих групп находились в относительно одинаковых условиях, тем не менее частота возникновения ПОКД достоверно различается в группах.
Одним из методов предотвращения развития ПОКД является периоперационное назначение нейропротекторов, в частности производных экзогенного холина (Глиатилин). По результатам данного исследования, назначение Глиатилина ассоциировалось с возможным снижением риска возникновения ПОКД, сокращением времени пробуждения и времени до экстубации пациентов. Поэтому периоперационное назначение Глиатилина потенциально может быть профилактикой развития ПОКД. Тем не менее для окончательных выводов необходимо проведение дальнейших исследований на больших выборках пациентов с наличием плацебо-контроля.
1. Postoperative cognition disorders in elderly patients. The results of the «International study of postoperative cognitive dysfunction» / Biedler A., Juckenhцfel S., Larsen R. et al. // Anaesthesist. — 1999. — Vol. 48, № 12. — P. 884-895.
2. Predictors of cognitive dysfunction after major noncardiac surgery / Monk T.G., Weldon B.C., Garvan C.W. et al. // Anesthesiology. — 2008. — Vol. 108. — P. 18-30.
3. Abildstrom H., Rasmussen L.S., Rentowl P. et al. Cognitive dysfunction 1–2 years after non-cardiac surgery in the elderly // Acta Anaesthesiol. Scand. — 2000. — 44. — 1246-51.
4. Johnson T., Monk T., Rasmussen L.S. et al. Postoperative cognitive dysfunction in middle-aged patients // Anesthesiology. — 2002. — 96. — 1351-7.
5. Jevtovic-Todorovic V., Hartman R.E., Izumi Y. et al. Early exposure to common anesthetic agents causes widespread neurodegeneration in the developing rat brain and persistent learning deficits // J. Neuroscience. — 2003. — 23. — 876-82.
6. Lopez C.M., Govoni S., Battaini F. et al. Effect of a new cognition enhancer, alphaglycerylphosphorylcholine, on scopolamine-induced amnesia and brain acetylcholine // Pharmacol. Biochem. Behav. — 1991. — Vol. 39, Issue 4. — P. 835-840.
7. Fallbrook A., Turenne S.D., Mamalias N., Kish S.J., Ross B.M. Phosphatidylcholine and phosphatidylethanolamine metabolites may regulate brain phospholipid catabolism via inhibition of lysophospholipase activity // Brain. Res. — 1999. — Vol. 10. — P. 207-210.
8. Khaselev N., Murphy R.C. Structural characterization of oxidized phospholipid products derived from arachidonate-containing plasmenyl glycerophosphocholine // J. Lipid Res. — 2000. — № 41. — Р. 564-572.
9. Amenta F., Carotenuto A., Fasanaro A.M., Lanari A., Previdi P., Rea R. Analisi comparativa della sicurezza/efficacia degli inibitori delle colinesterasi e del precursore colinergico colina alfoscerato nelle demenze ad esordio nell’eta adulta // G. Gerontol. — 2010. — Vol. 58. — P. 64-68.
10. Lucilla Parnetti, Francesco Amenta, Virgilio Galla. C holine alphoscerate in cognitive decline and in acute cerebrovascular disease: an analysis of published clinical data // Mechanisms of Ageing and Development. — 2001. — Vol. 122, Issue 16. — P. 2041-2055.
11. Голохвастов С.Ю., Цыган Н.В. Многоцентровое (пилотное) исследование эффективности глиатилина при остром ишемическом инсульте // Клиническая неврология. — 2010. — Т. 4, № 1. — С. 20-27.
12. Вознюк И.А., Одинак М.М., Кузнецов А.Н. Применение глиатилина у больных с острым нарушением мозгового кровообращения // Сосудистая патология нервной системы. — СПб., 1998. — С. 167-172.
13. Антонов И.П. Эффективность применения препарата глиатилин у больных с острыми нарушениями мозгового кровообращения в раннем восстановительном периоде. — СПб.: Terra Medica, 1998. — С. 36-44.
14. Черний Т.В., Андронова И.А., Черний В.И. Предикторы и фармакологическая коррекция недостаточности модулирующих систем мозга при мозговом инсульте и тяжелой черепно-мозговой травме // Международный неврологический журнал. — 2011. — № 2. — С. 40.
15. Никонов В.В., Савицкая И.Б. Возможности применения холина альфосцерата для лечения постгипоксической энцефалопатии // Медицина неотложных состояний. — 2011. — № 1–2. — С. 101-106.
16. Borowicz L.M., Goldsborough M.A., Selnes O.A., McKhann G.M. Neuropsychologic change after cardiac surgery: A critical review // J. Cardiothorac. Vasc. Anesth. — 1996. — 10. — 105-12.
17. Arrowsmith J.E., Harrison M.J., Newman S.P., Stygall J., Timberlake N., Pugsley W.B. Neuroprotection of the brain during cardiopulmonary bypass: A randomized trial of remacemide during coronary artery bypass in 171 patients // Stroke. — 1998. — 29. — 2357-62.
18. Nielson W.R., Gelb A.W., Casey J.E., Penny F.J., Merchant R.N., Manninen P.H. Long-term cognitive and social sequelae of general versus regional anesthesia during arthroplasty in the elderly // Anesthesiology. — 1990. — 73. — 1103-9.
19. Casati A., Aldegheri G., Vinciguerra F., Marsan A., Fraschina G., Torri G. Randomized comparison between sevoflurane anaesthesia and unilateral spinal anaesthesia in elderly patients undergoing orthopaedic surgery // Eur. J. Anaesth. — 2003. — 20. — 640-6.
20. Casati A., Fanelli G., Pietropaoli P., Proietti R., Tufano R., Danelli G., Fierro G., DeCosmo G., Serillo G. Continuous monitoring of cerebral oxygen saturation in elderly patients undergoing major abdominal surgery minimizes brain exposure to potential hypoxia // Anesth. Analg. — 2005. — 101. — 740-7.
21. Monk T.G., Weldon B.C., Garvan С.W., Dede D.E., van der Aa М., Heilman К.М. Predictors of cognitive dysfunction after major noncardiac Surgery // Anesthesio-logy. — 2008. — Vol. 108. — P. 18-30.
22. Lupien S.J., de Leon M., de Santi S., Convit A., Tarshish C., Nair N.P., Thakur M., McEwen B.S., Hauger R.L., Meaney M.J. Cortisol levels during human aging predict hippocampal atrophy and memory deficits // Nat. Neurosci. — 1998. — 1. — 69-73.
23. Rasmussen L.S., O’Brien J.T., Silverstein J.H., Johnson T.W., Siersma V.D., Canet J., Jolles J., Hanning C.D., Kuipers H.M., Abildstrom H., Papaioannou A., Rae-der J., Yli-Hankala A., Sneyd J.R., Munoz L., Moller J.R. ISPOCD2 Investigators: Is peri-operative cortisol secretion related to post-operative cognitive dysfunction? // Acta Anaesthesiol. Scand. — 2005. — 49. — 1225-31.
24. Pratico C., Quattrone D., Lucanto T., Amato A., Penna O., Roscitano C., Fodale V. Drugs of anesthesia acting on central cholinergic system may cause postoperative cognitive dysfunction and delirium // Med. Hypotheses. — 2005. — Vol. 65. — P. 972-982.
25. Ancelin M.L., Artero S., Portet F., Dupuy A.M., Touchon J., Ritchie K. Nondegenerative mild cognitive impairment in elderly people and use of anticholinergic drugs: Longitudinal cohort study // BMJ. — 2006. — Vol. 332. — P. 455-459.
26. Лесной И.И. Сравнение эффективности двух подходов к аналгезии у хирургических больных в отделении интенсивной терапии // Український журнал клiнiчної та лабораторної медицини. — 2012. — Т. 7. — С. 71-79.