Газета «Новости медицины и фармации» 18 (472) 2013
Вернуться к номеру
Названы лауреаты Нобелевской премии по физиологии и медицине — 2013
Лауреатами Нобелевской премии по физиологии и медицине за 2013 год стали трое ученых, работающих в США. Это Джеймс Ротман, Рэнди Шекман и Томас Зюдхоф.
Премия вручена за раскрытие механизмов везикулярного транспорта — главной транспортной системы в наших клетках.
Разнообразные молекулы, упакованные в пузырькивезикулы, постоянно пересылаются из одного отдела клетки в другой, а также секретируются наружу. Точная доставка возможна благодаря комплексу белков, которые выступают как в качестве «адреса», так и в качестве «почтового отделения» в каждом клеточном отделе. Работы Нобелевских лауреатов этого года позволили прояснить механизм в деталях: какие гены кодируют компоненты системы везикулярного транспорта, что за белки в этом участвуют и, наконец, как регулируется внутри и межклеточный трафик.
Работа не является результатом одного гениального открытия или научным прорывом. Это результат многолетнего кропотливого труда, благодаря которому удалось в деталях изучить один из базовых процессов в клеточной физиологии — внутриклеточный транспорт. Трое ученых — Рэнди Шекман, Джеймс Ротман и Томас Зюдхоф — внесли свой вклад в эту работу, используя разные подходы — генетический (Шекман), биохимический (Ротман) и физиологический (Зюдхоф).
Джеймс Ротман (James E. Rothman)
родился в 1950 году в штате Массачусетс, США. Получил докторскую степень (PhD) в 1976 году в Гарварде, затем работал в не менее знаменитом Массачусетском технологическом институте, а потом — в Стэнфордском университете, где он и начал исследования в области везикулярного транспорта. В настоящее время является профессором Йельского университета, где возглавляет кафедру клеточной биологии.
Рэнди Шекман (Randy W. Schekman)
родился в 1948 году в штате Миннесота, США. Докторскую степень получил в Стэнфорде под руководством Артура Корнберга — нобелевского лауреата 1959 года, открывшего механизм синтеза нуклеиновых кислот. Затем Шекман перешел в Калифорнийский университет в Беркли, где и работает до сих пор, являясь профессором кафедры молекулярной и клеточной биологии.
Томас Зюдхоф (Thomas C. Südhof)
родился в 1955 году в Геттингене, Германия. В отличие от своих коллег по премии он получил степень доктора медицины (1982), а затем — степень в области нейрохимии. Однако Зюдхоф недолго пробыл немецким ученым: уже в 1983 году он перебрался в Техасский югозападный университет в Далласе (США), где работал вместе с Майклом Брауном и Джозефом Голдстейном — лауреатами Нобелевской премии 1985 года за изучение метаболизма холестерина. В настоящее время является профессором кафедры молекулярной и клеточной физиологии в Стэнфордском университете.
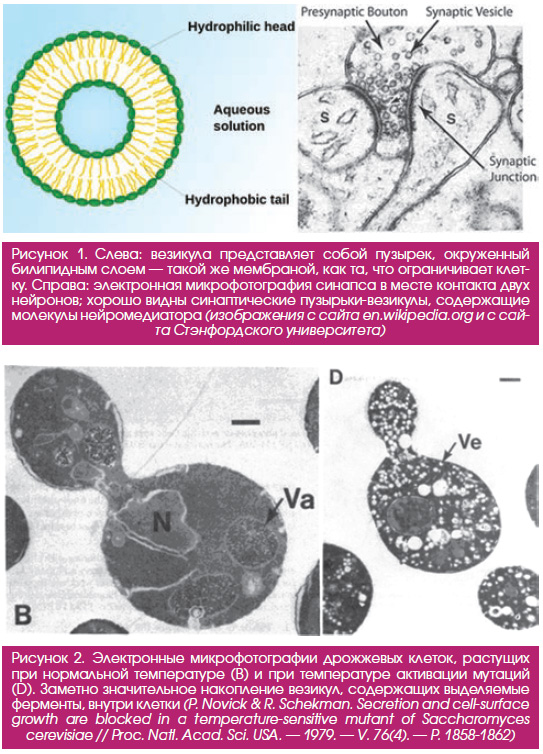
Поскольку эукариотическая клетка — сложноорганизованная структура со множеством «отделов», в процессе ее жизнедеятельности возникает необходимость передавать грузы из одного отдела (компартмента) в другой, а также посылать их за пределы клетки. Такая необходимость обусловлена разделением труда между компартментами: например, белки часто синтезируются на рибосомах, расположенных в эндоплазматическом ретикулуме, а используются в какомнибудь другом отделе или вообще секретируются наружу. Чтобы груз был доставлен по адресу, его нужно упаковать в пузырек — везикулу (рис. 1) и снабдить специальным сигнальным белком. В качестве грузов могут выступать самые разнообразные молекулы: гормоны (в том числе инсулин), ферменты, строительные белки и др. Отдельным немаловажным примером клеточного транспорта является передача сигнала между нейронами — она осуществляется посредством выброса в синаптическую щель нейромедиаторов, упакованных в такие же везикулы.
Изучение везикулярного транспорта имеет не только фундаментальное значение: среди болезней, связанных с нарушением процессов переноски грузов, — диабет второго типа и эпилепсия. Бактерии из рода Clostridium, которые являются возбудителями ботулизма и столбняка, при помощи своих токсинов как раз и портят белки, участвующие в формировании везикул в синаптических щелях. В результате этого блокируется выброс нейромедиаторов между нейронами либо между нейроном и мышцей, что приводит к параличу.
О существовании внутриклеточного транспорта было известно еще с начала ХХ века (везикулы можно разглядеть в обычный световой микроскоп). Однако с молекулярной точки зрения детали этого процесса начали проясняться с выходом в свет в 1979 году работы Шекмана в журнале PNAS. Используя пекарские дрожжи, Шекман вместе со своим коллегой Питером Новиком идентифицировал гены, продукция которых обеспечивает нормальный внутриклеточный транспорт. Ученые проанализировали сотни штаммов мутантных дрожжей и выбрали среди них носителей так называемых термочувствительных мутаций (такие клетки нормально растут при комнатной температуре, но если их содержать при температуре 37 °С, в них начинают накапливаться поломки). Отобранные мутанты были не способны нормально экспортировать наружу ферменты для размещения на клеточной стенке. При повышении температуры в этих клетках начинали накапливаться везикулы, хорошо заметные в микроскоп (рис. 2).
Шекман проанализировал генотип полученных мутантов по везикулярному транспорту и в конечном итоге идентифицировал 23 гена, которые можно было разделить на три группы, в зависимости от того, откуда и куда должны были направляться везикулы, — транспорт, ассоциированный с эндоплазматическим ретикулумом, с комплексом Гольджи или с поверхностью клетки. В своих последующих работах он обнаружил промежуточные стадии в формировании везикул и связал их с мутациями в конкретных генах (гены были обозначены аббревиатурой sec — от secretory).
Джеймс Ротман в своих работах подошел к изучаемому вопросу с другой стороны. В Стэнфордской лаборатории несколькими годами позже он с коллегами восстанавливал процесс транспорта in vitro, то есть в пробирке. Ученые пытались воссоздать процесс транспортировки белка вируса везикулярного стоматита в комплекс Гольджи в клетках млекопитающих (вирусный белок был выбран потому, что при инфекции он накапливается в клетках в больших количествах и с ним удобно работать). В нескольких последовательно вышедших статьях Ротман описал в деталях клеточный транспорт белка и попутно выделил ключевые компоненты, необходимые для формирования и транспорта везикул. Первым найденным белком оказался NSF (Nethylmaleimidesensitive factor), затем был идентифицирован SNAP (soluble NSFattachment protein). В совместной работе с Шекманом они установили, что белки NSF и SNAP соответствуют продуктам ранее идентифицированных Шекманом генов sec17 и sec18. Таким образом, оказалось, что процесс внутриклеточного транспорта универсален среди эукариот и совпадает в деталях как у дрожжей, так и у млекопитающих.
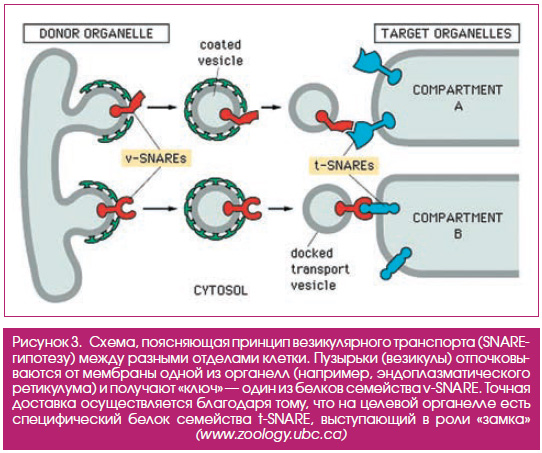
Продолжая работу по выделению ассоциированных с везикулами белков, Ротман обнаружил еще три ключевых белка: синаптобревин, SNAP25 и синтаксин. Эти белки были ранее найдены другими учеными в синапсах (областях контакта между нейронами), однако их функции оставались неизвестными. Ротман объединил их в группу SNARE (soluble NSFattachment protein receptors). Синаптобревин был ассоциирован с везикулами, а SNAP25 и синтаксин — с клеточными мембранами. Это открытие позволило Ротману сформулировать SNAREгипотезу — ключевую гипотезу, объясняющую принцип внутри и межклеточного транспорта. Согласно этой гипотезе, в процессе формирования и доставки везикул участвуют белки, принадлежащие к двум группам — vSNARE (v — от vesicle (везикула)) и tSNARE (t — от target (мишень)), которые специфически узнают друг друга. Благодаря специфическому узнаванию доставка осуществляется точно в нужное место (рис. 3). Гипотеза была подтверждена в дальнейших работах как Ротмана, так и других научных групп (синаптобревин, помимо прочего, является мишенью при развитии ботулизма и столбняка).
Томас Зюдхоф по образованию был нейрофизиологом и изучал, каким образом происходит передача сигнала в синапсах между нейронами. Его заинтересовал процесс выброса нейромедиатора в синаптическую щель. Молекулы нейромедиатора упаковываются в везикулы и точно в определенное время должны выделиться в пространство между мембранами двух нейронов (рис. 1 (справа)). Оказалось, что этот процесс зависит от внутриклеточных колебаний концентрации кальция. Зюдхоф сосредоточил свое внимание на двух белках — комплексине и синаптотагмине. В это время (начало 90х годов) уже получила распространение технология, позволяющая выращивать нокаутных (Нобелевская премия по физиологии и медицине // Элементы. — 12.10.2007) по определенному гену животных. Изучая мышей с нарушенной функцией генов, кодирующих комплексин или синаптотагмин, он определил, что эти два белка реагируют на концентрацию кальция и являются «привратниками», предотвращающими постоянное неконтролируемое образование везикул. Оказалось, что синаптотагмин, с одной стороны, является сенсором кальция, а с другой стороны, взаимодействует с SNAREбелками и запускает механизм формирования везикулы. Зюдхоф также идентифицировал белок Munc18, мутация в котором соответствовала дрожжевому фенотипу sec11, описанному Шекманом. Этот белок и семейство, к которому он принадлежит, получили общее название «SMбелки» (от Sec/Munc). Оказалось, что они вместе со SNAREбелками участвуют в процессе формирования везикул.
Таким образом, работы Шекмана, Ротмана и Зюдхофа стали частями одной мозаики, описывающей транспортную систему клетки с участием пузырьковвезикул. Они во многом определили, как пузырьки формируются, как они находят свое место доставки и каким образом регулируется их образование точно в определенное время. Однако можно заметить, что в мозаике не хватает кусочка: везикулы внутри клетки не плавают сами по себе, а путешествуют по цитоскелету вдоль микротрубочек при помощи специальных моторных белков — динеина и кинезина. За изучение моторных белков и транспорта с их участием в 2012 году три других американских ученых получили престижную премию Ласкера. Эту премию считают предвестницей Нобелевcкой, так что, возможно, недостающее звено в картине внутриклеточного транспорта в ближайшие годы тоже будет удостоено высочайшей награды (надо сказать, что и лауреаты этого года в разное время становились лауреатами премии Ласкера).
Источники: прессрелиз на сайте Нобелевского комитета; Zierath J., Lendahl U. Machinery Regulating Vesicle Traffic, A Major Transport System in our Cells (статья на сайте Нобелевского комитета)